Method Article
다운스트림 단일 세포 분석에 대 한 요로 감염의 Murine 모델에서 생성 된 단일 세포내 세균성 지역 사회의 절연
요약
이 프로토콜에는 요로 감염의 murine 모델에서 단일, 감염 방광 상피 세포를 분리 하는 간단한 방법을 설명 합니다.
초록
이 문서에서는, 우리는 실험적으로 요로 감염 된 마우스에서 개별 세포내 세균성 지역 사회를 분리 하는 데 사용 하는 프로시저 개요. 프로토콜은 광범위 하 게 3 개의 섹션으로 분할 될 수 있다: 감염, 방광 상피 세포를 채취, 그리고 개별 감염 된 상피 세포를 분리 하 입 micropipetting. 격리 된 상피 세포 실행 가능한 박테리아 세포를 포함 하 고 거의 무료 오염 extracellular 박테리아, 다운스트림 단일 세포 분석에 이상적입니다. 감염의 시작에서 단일 세포내 세균성 지역 사회를 얻기에 걸린 시간은 약 8 h입니다. 이 프로토콜 배포 저렴 하 고 널리 사용 가능한 재료를 사용 하 여 우리가 예상 하는 그것은 또한 다른 감염 모델 그 감염 된 세포는 드문 경우에 단일 감염된 세포 세포 혼합물에서 분리에 이용 될 수 있다. 그러나, 입 micropipetting에 잠재적인 위험으로 인해이 절차 매우 전염 성 요원에 대 한 권장 하지 않습니다.
서문
요로 감염 (UTIs) 가장 흔한 세균 감염 중 하나입니다. 여성의 약된 40-50%는 그들의 일생1동안 적어도 하나의 요로 감염 (UTI)를 경험 하는으로 예상 된다. 요로 감염의 주요 에이전트 중 하나 uropathogenic 대장균 (UPEC), 단순한 UTIs2의 70% 이상 차지 하는. 또한, UTI 자들의 약 1/43적절 한 항생제 치료도 불구 하 고 같은 긴장에 의해 발생 하는 재발 감염을 할 것 이다. 요로 감염의 높은 발생률 의료 시스템, 미국4년 이상의 $2 십억을 비용에 상당한 부담을 나타냅니다. 또한, UTIs를 치료 하는 항생제의 사용 또한 이끌어 낸다 상승 항생제 저항 속도 중요 한 공중 위생 관심사5.
따라서, 큰 노력을 UPEC 하는 재발 성 감염6,,78발생 하는 기능 뿐 아니라 요로 감염 하는 메커니즘을 이해에 배치 하고있다. 특히, 감염 마우스 모델 요8에 기여 하는 박테리아 및 호스트 특성 검사 사용 되었습니다. 이 마우스 모델 인간 환자에서 분리 된 수정 되지 않은 임상 계통에 적용 되 고의 이점이 있습니다. 이 모델 또한 잠재적으로 druggable 세균 경로 유형 1 pilus9 와 철 수집 시스템10등 요로 감염의 설립에 대 한 중요 한 발견에 지도 했다.
요로 감염에서 초기 이벤트를 공부 하 고 이러한 성공에 비해, 재발 성 요로 감염을 기본 메커니즘의 지식은 여전히 부족 한11. 한 가설 UPEC 항생제 치료를 evades 방광 상피 세포 내에서 세포내 세균성 지역 사회 (IBCs)를 형성 하 여 방광에 재발 성 감염을 일으키는 것입니다. IBCs 감염의 murine 모델와 인간의 요로 감염 환자12,13에서 확인 되었습니다. 소아 요로 감염 환자 로부터 소변 샘플에 IBCs의 존재는 되풀이14,15의 더 높은 속도와 연결 되었습니다. 그러나, IBCs를 분리 하 고 공부 하는 그들 내의 박테리아; 그들의 진귀 때문에 기술적으로 도전적인 것을 입증 했다 그것은 그 감염된 murine 방광 일반적으로 10-100 IBCs16추정. 또한, 방광 상피 세포는 비교적 큰 (50-120 µ m)17, 형광 배포에 도전 하기가 셀 정렬 (FACS)는 70 µ m 또는 100 µ m의 직경을 가진 전형적인 FACS 노즐 설계 지원. 따라서, 방광 상피 세포로 세포 종종 FACS는 응용 막힘을 방지 하기 전에 여과 의해 제거 됩니다.
연구소는 최근 방광18의 긁힌 것된 상피 세포 같은 혼합물에서 희귀 감염 된 세포를 분리 하 일반 하 고 경제적인 방법 설명. IBCs를 효과적으로 격리 하려면 우리 전통 입 pipetting 사용. 입 micropipetting는 단일 세포 및 배아 다운스트림 분석19,20,,2122,23, micromanipulation에 대 한 오래 사용 하는 기술 24 , 25. 자주의 원인이 되었습니다 (밀리 리터)에 큰 액체 볼륨의 전통적인 입 pipetting 실험실 관련 사고, 그리고 기술은 많은 전통적인 발생 학 외부 연구 커뮤니티에 의해 기피 바르게가 고 단일 셀 응용 프로그램입니다. 우리의 프로토콜은 큰 버퍼를 제공 하 여 위험을 완화 하는이 기술은19,20, 단일 셀 버전에 의해 영감을 (> 2 mL) 연구원과 액체의 볼륨에 비해 샘플 사이의 공기의 양도 (< 1 Μ L)입니다. 이 방법은 또한 활용 미세 제어의 그 입 micropipetting 제공 하는 전송 솔루션 및 고립 된 세포의 고 순도의 낮은 최종 볼륨을 변환. 저렴 한 재료를 사용 하는 기술 (<$ 50), 따라서 모든 실험실에서 구현 하기 위해 실현 되어야 하 고.
이 시각 프로토콜 설명 우리의 IBC 격리 기술을, 다른 연구원은이 기술은 복제 하고자 하는 지원에 대 한 참조를 제공 합니다. 연구원에 대 한 액세스 해 형광 현미경 (또는 유사한 장치) micropipetting에 대 한 개방적이 고 접근 이미징 무대와 라이브 영상 중 개별 상피 세포와 형광 박테리아를 시각화 하는 데 사용할 수 필요 합니다. (현미경 사용의 세부 사항에 대 한 테이블의 자료 를 참조 하지만 다른 동일 악기 모델도 사용할 수 있습니다). 이 프로토콜은 요로 감염의 murine 모델에서 IBCs에 집중할 것 이다, 하는 동안 비슷한 방법 감염의 다른 모델에서 셀 정지에서 감염 된 세포를 분리에 적용 해야 합니다.
프로토콜
여기 동물 취급에 관한 설명 하는 모든 메서드는 과학, 기술 및 연구, 싱가포르에 대 한 기관 동물 관리 및 사용 위원회 (IACUC)의 싱가포르 게놈 연구소 및 기관의 생물 자원 센터에 의해 승인 되었습니다.
1. 마우스 감염
-
유리 모 세관의 준비
- 불 화로 소스 (분 젠 버너 또는 알코올 버너).
- 단단히 양쪽 끝을 곤란 하 게 하 여 유리를 두 손으로 모 세관 누른 다음 유리 부드러운 때까지 튜브의 가운데를 균등 하 게 열. 회전 모 세관 부드럽게 앞뒤로 유리의 난방에 도움을 그것의 축.
- 유리 모 세관 열원에서 제거 하 고 즉시 손을 튜브의 양쪽 끝에 그립을 유지 하면서 떨어져 당겨. 가져온된 모 세관의 이상적인 최종 길이 3-5 cm 이상 되도록 단일 방광 상피 세포를 고립 시키기를 위한 적절 한 내부 직경 unpulled 모 세관.
주의: 튜빙 여전히 남아 매우 뜨거운 시간 동안, 그래서 옆으로 다음 단계로 진행 하기 전에 냉각 몇 분 동안 열 안전한 표면에 모 세관을 설정 합니다. - 확인 유리 모 세관의 중간 되고있다 보고 좁은 (그림 1A)과 튜브의 내부는 여전히 투명 (그림 1B). IBCs의 격리, 200-400 µ m의 구멍 크기는 사용할 수 있습니다.
- 한 손으로 뽑아 모 세관의 한쪽 끝을 선택 합니다. 다른 한편으로는와 함께 집게의 쌍을 보유 하 고 모 세관 그것의 가장 좁은 지점에서 가져온된 유리를 선택 하는 데 사용할. 그것을 분쇄 하지 않고 모 세관을 단단히 그립에 충분 한 힘으로는 겸 자 녀석은 확인 합니다.
- 모 세관 입 micropipetting를 만드는 좁은 지점에서 가져온된 모 세관에는 집게를 들고 손으로 급속 한 트위스트 동작을 사용 합니다.
참고: 유리 파편 으로부터 적절 한 보호 사용 대신에 집게 손가락을 사용 하 여 허용, 됩니다. - 반복 단계 1.1.2-1.1.6 충분 한 예비 micropipetting 모세 혈관 생성 및 IBC 격리에 대 한 직경의 범위를 제공에 더 많은 x 4 이상. 하나 이상의 감염 그룹은 예상 하는 경우 각 추가 감염 그룹 5 추가 micropipetting 모세 혈관을 준비 합니다.
주의: 열린 불꽃을 차단 하는 것을 잊지 마십시오. - 100 mm 페 트리 접시에에서 가져온된 모 세관을 놓고 소독은 모세 혈관을 30 분 동안 UV 방사선에 접시를 노출 합니다.
- UV 살 균 후 페 트리 접시에 뚜껑을 장착 하 고 실내 온도에 모 세관을 샬레를 저장.
-
감염 전에 카 테 터의 준비
- 요도 카 테 터 감염 감염 하기 전에 최소 1 일 웅 외8 및 코노 버는 외.26 에서 설명한 대로 준비 합니다.
-
형광 uropathogenic 대장균 문화의 준비
- 선택한 fluorophore 표현 uropathogenic 세균성 성장 설립된 프로토콜에 따르면 스트레인.
참고: 긴장과 fluorophore의 선택은 크게 현미경 및 개별 실험실에서 사용할 수 있는 긴장에 따라 달라 집니다. 이 예제에서 우리는 원래 재발 성 방광염을 가진 환자에서에서 임상 격리 UTI89에서 파생 된 긴장을 사용 합니다. 이 스트레인, SLC-638, 플라스 미드 (pSLC-77) vsfGFP-9 고 대 저항18를 표현 하는 운반. SLC-638 50 µ g/mL 대 보충 하는 37 ° C에서 파운드 국물에서 성장 된다. - Luria Bertani (파운드)에 스트레인 SLC-638 행진-천 배지 50 µ g/mL 대 보충. 37 ° C에서 접시를 밤새 품 어.
- (선택 사항) 표현의 형광 마커 식민지를 선택 하기 전에 확인을 해 현미경에 접시를 볼.
- 세균 접종 루프를 사용 하 여 선택한 식민지 파운드 국물 50 µ g/mL 대 보충의 10 mL와 125 mL 원뿔 플라스 크 전송. 24 h에 대 한 37 ° C에서 정적으로 플라스 크를 품 어.
- 2 차 배양 플라스 크에서 문화의 10 µ L 파운드 국물의 10 mL에 희석 함으로써이 플라스 크에서 박테리아 신선한 125 mL 플라스 크 (1:1000 희석)에서 50 µ g/mL 대 보충. 또 다른 24 h에 대 한 37 ° C에서 정적으로이 두 번째 플라스 크를 품 어.
- 5000 x g 5 분 및 4 ° c.에 대 한 세균성 문화 아래로 회전
- 가만히 따르다는 상쾌한 고 차가운 PBS 0.5 세600 에 세균성 펠 릿 resuspend.
참고: 그것은 문화에서 문화, 다를 수 있지만 일반적으로 정적 문화의 1 mL 제공 OD600 의 대략 4-5 개 mL = 0.5 세균성 문화. 각 스트레인은 다음과 같이 계산할 수 있다에 필요한 세균성 inoculum의 총 볼륨: 50 µ L 각 마우스에 대 한 필요 하 고 50 µ L 바늘 머리를 채우기 위해 필요 하다. 추가로 10-20% (최소 50 µ L)는 inoculum의 주사기에 죽은 볼륨을 담당 하는 것이 좋습니다. - 웅 외.8에 설명 된 대로 감염 titer를 나머지 세균 혼합을 사용.
참고: 이 단계는 4 ° c.에 세균 혼합 저장 하 여 몇 시간 동안 지연 될 수 있습니다.
- 선택한 fluorophore 표현 uropathogenic 세균성 성장 설립된 프로토콜에 따르면 스트레인.
-
요로 감염의 murine 모델
- 형광 대장균 단면도 1.3에서 경작의 각 변형에 대 한 하나의 실험 그룹과 웅 외.8에 의해 설명 된 대로 쥐를 감염.
참고: 또한 시각적 지원을 위한 Conover 외.26 을 참조 하십시오. - 참고 마우스 또는 감 금 소에 대 한 세균 접종의 시간.
- 전체 실험 그룹에 대 한 감염을 반복 합니다.
참고: 감염 테 같은 그룹에 있는 모든 쥐에 대 한 다시 사용할 수 있습니다. - 각 실험 그룹에 대 한 반복 단계 1.4.1-1.4.3, 신선한 카 테 터와 새로운 윤 활 유 젤 모든 그룹에 대 한 준비는 보장 계획.
참고: 동물의 많은 수로 실험, 동물 5 그룹으로 나누는 것이 좋습니다 및 각 그룹은 그런 감염을 엄청난 감염 떨어져 1 시간 30 분 정도. 이 다음 단계 (섹션 2와 3)에 대 한 충분 한 시간을 제공할 것입니다.
- 형광 대장균 단면도 1.3에서 경작의 각 변형에 대 한 하나의 실험 그룹과 웅 외.8에 의해 설명 된 대로 쥐를 감염.
2. 방광 상피 세포 세포 현 탁 액을 얻기 위해 수확
-
수확 및 반전 murine 방광
- 3 50 mL 원뿔 튜브 수술 장비를 살 균에 대 한 70% 에탄올의 45 mL 가득 준비.
- 2.1.1 단계에서 준비 하는 튜브의 두 가지로 위 고 각 집게의 쌍을 놓습니다. 제 3 관으로 집게 (한 선호 좁고 둥근 팁, 방광의 반전에 대 한)의 두 쌍을 놓습니다.
참고: 첫 번째 관에서 도구를 사용 하는 외부 지역에 하 고 두 번째에서 도구 방광 수확에서 사용 될 것입니다 마지막 관 지에서 집게의 두 쌍 방광 반전에 사용. - 6 h 게시물 감염, 안락사 기관의 설립된 IACUC 프로토콜에 따라 감염 된 쥐.
참고: 우리의 IACUC 프로토콜 마우스 (isoflurane) 취하는 동안 수행 하는 자 궁 경부 전위를 통해 안락사에 대 한 호출 합니다. - 그들의 뒤에는 동물을 사용 하 여 스프레이 병에 70% 에탄올으로 가득 그들의 복 부 지역 소독.
- 한 쌍의 집게와 첫 번째 튜브 (단계 2.1.2에서에서 준비)에서 수술가 위를 사용 하 여 만들 피부 위에 요도 약 1 cm에 작은 가로 절 개 여. 복의 내용을 노출 하는 마우스의 앞쪽 전체에 따라 V 자형 컷을 만드는 마우스의 위 사지 쪽으로 대각선 절 개를 확장 합니다. 이 과정 동안,가 위로 자르지 않는다 마우스 (그림 2A, B)의 내장을 통해 확인 합니다.
- 도구 (단계 2.1.2에서에서 준비)의 두 번째 집합으로 전환 합니다. 사용 하 여가 위의 블레이드 나는 집게의 샤프트, 부드럽게 밀어 지방 패드는 마우스의 골반 지역 근처에.
참고: 이 단계는 방광 밖으로 내 다 원인과 수확에 대 한 가시성을 보장 합니다. - 한 쌍의 집게 (그림 2C) 꼭대기에 노출된 방광을 잡습니다.
- 자르고 (절단 요도 ureters 멀리) 동물의 나머지에서 방광 무료는 집게와 방광 꼭대기에 확고 한 그립을 유지, 수술가 위를 사용 하 여. 아직 방광을 잡고 집게를 해제 하지 않습니다 .
- 3 원뿔에서 좁은 둥근된 포 셉이 위에서 switching (2.1.2 단계)에서 튜브, 어디 그것은 단지 잘 렸 (그림 2D) 이전 단계에서 방광의 오프닝에 둥근된 집게의 한 샤프트 끝을 삽입 합니다. 방광의 개통에 안전 하 게 삽입 하는 둥근된 집게의 팁과 방광의 꼭대기 창과 집게의 쌍 놓고 두 번째 원뿔 튜브에 반환.
- 부드럽게 방광을 "밖으로 안으로", 먼저 둥근된 집게 (그림 2D, 화살표 1)에서 방광의 입의 외부 끝이 겠 지 하 고 주변과의 다른 끝에 그것을 지도 차례 제 3 관에서 집게의 두 번째 쌍을 사용 하 여, 둥근된 집게 (그림 2D, 화살표 2).
참고: 작업 한 발에서 양말을 제거 하 고 다른 그것을 당기 게 비유 될 수 있습니다.- 반전 하는 동안 집게 거의 완전히 폐쇄의 첫 번째 둥근된 쌍을 유지 합니다. 이 해내야 방광 둥근된 집게의 첫 번째 축에서 움직임의 충분 한 자유를 제공 하지만 또한 가까이 둥근된 집게의 두 번째 샤프트 첫 번째 가져오고 방광 쉽게 전송할 수 있습니다. 이 단계의 마지막 결과 반전 되 고 집게 (그림 2E)의 첫 번째 쌍의 두 번째 샤프트 끝에 방광 종료 해야 합니다.
- 차가운 PBS의 1 mL에는 집게의 끝에서 거꾸로 방광 동축 케이블 부드럽게 집게의 두 번째 쌍을 사용 하 여.
참고: (선택 사항) 이것은 전체 반전 있는 경우 일반적인 주파수와 IBCs의 분포를 관찰 하 감염된 방광의 이미지를 데리고 적시.
- (최대 5 동물)에 실험적인 그룹에 있는 각 방광에 대 한 2.1.1-2.1.10 단계를 반복 합니다.
-
방광 상피 세포 근 근
- 2를 사용 하 여 집게의 쌍을 깨끗 한, 부드럽게 (내부 상피 세포 층에는) 거꾸로 방광의 외부를 다쳤어요. 주변 PBS 된다고 수익금으로 흐린 나타납니다 하 고 상피 세포는 PBS 솔루션으로 해제 됩니다.
- (선택 사항) 시각적으로 해 현미경을 사용 하 여 솔루션으로 셀을 발표 했다 방광 된다고 확인 합니다. 그림 3 A, B)입니다. PBS는 육안에 흐림 나타나야 하 고 긁힌 것된 개별 방광 상피 세포는 10 배 확대에서 볼 수 있습니다.
- 2.1 단계에서 각 수확된 방광에 대 한 2.2.1-2.2.2 단계를 반복 합니다.
3. 세포내 세균성 지역 사회 (IBC) 절연: IBCs 입 Pipetting
참고: 이 섹션에 설명 된 모든 방법을 제도적 위험 평가 받은 합니다. 입 pipetting 전송 솔루션의 섭취의 고유 위험을 운반 합니다. 이러한 위험이 크게이 프로토콜 사용 하 여, nanoliter 볼륨에 의해 완화 되 고 프로토콜 지불의 모든 사용자는 예방에 주의 하 고 연습 노트는 토론에 여기 나열 하는 것이 좋습니다.
-
셀 후 입 micropipetting 장치 (그림 3C)를 설정 하는 PBS에 긁어 되어 있다.
- 흡 인기 튜브의 고무 플러그 (백색 끝)에 가져온된 유리 모 세관 (unpulled 끝)의 두꺼운 끝을 삽입 합니다.
- 꽉 맞는 보장 흡 인기 튜브의 다른 오픈 (빨간색) 끝에 1 mL 피 펫 팁의 좁은 끝을 삽입 합니다.
- 2 mL 피 펫 1 mL 피 펫 팁의 오픈, 더 넓은 끝에 발음의 좁은 끝, 맞는 다시 꽉입니다 보장 합니다.
참고: 결과 설정 수 입 피 펫의 연구원 사용 하 여 넓은, 오픈 기구의 다른 쪽 끝에서 모 세관 튜브의 좁은 끝에서 부드러운 흡입 힘을 만드는 aspirating 피 펫의 끝에서. - 신선한 이온된 수를 포함 하는 100 mm 페 트리 접시를 사용 하 여 최종 입 micropipetting 장치를 테스트 합니다. Aspirating 피 펫 (빨 대 통해 음료에 홀 짝과 유사)의 오픈 엔드에 약간의 흡입 액션, 모 세관에서 액체의 수준을 증가 해야 하지만 이온된 물 흡 인기 튜브에 오버플로 발생 하지. 한 손으로 사용 하 여 배양 접시의 위치를 조정 하려면 다른 손을 사용 하는 동안 모 세관 튜브를 제어.
참고: 흡입 입 pipetting 단일 IBC에 필요한 강도 연구자 사이에서 달라질 수 있습니다. 그러나, 각 연구원은이 기술은 시도 약한 흡입을 시작 하 고 천천히 없는 액체는 모 세관을 흐르는 경우 증가 하는 것이 좋습니다. 마시는 빨 대를 빨 아 보다 더 큰 힘에 대 한 필요가 있다. 모 세관 액체 단계 3.1.4에서에서 테스트 하는 동안 데리를 나타나지 않으면, 모 세관 또는 aspirating 튜브가 고 교체 해야 가능 하다. 사용 하 여 입 pipetting 장치에 흡입 제어 모든 새로운 연구원 첫 연습 물 소독 더는 것이 좋습니다. 또한, 연구자의 혀를 통해 입 pipetting 기구에 의해 채택 하는 볼륨의 제어는 note. 혀 수 있습니다 정밀 하 게 적용 하 고, 흡입의 강도 조정 뿐 아니라 비상 정지 역할. - 액체의 성공적인 도입을 달성 한 후 부드럽게 aspirating 피 펫의 오픈 엔드에 불어 모 세관에서 추방 하는 능력을 테스트 합니다. 아니 거품 3.5 단계는 IBCs의 오염을 방지 하기 위하여 액체를 추방 하는 과정에서 만들어집니다 확인 하십시오.
참고: 흡입, IBC 원심 분리기 튜브에 추방에 연구원에 의해 긍정적인 압력의 강도 연구자 마다 다 됩니다. 그것은 연구자이 프로토콜을 새로운 단계로 연습 3.1 몇 일 전에 실제 감염 권장. 연습 입 micropipetting에 대 한 한 가지 제안을 연습 전송 작은 양의 멸 균된 물 몇 방울 입 micropipette 기구를 사용 하 여 (시정)에 대 한 음식 염료의 혼합입니다.
- 해 현미경 긁힌 것된 세포 현 탁 액 놓고 큰 형광 집계 (그림 3A, B)로 IBCs를 식별 합니다. 확대의 이상적인 범위는 20-40 x. 1에 대 한 PBS의 신선한 관으로 유리 모 세관의 좋은 끝을 찍어 모 세관 작용을 통해 원치 않는 볼륨의 통풍 관을 감소 시키는 s.
- 현미경을 통해 찾고, 관심의 IBC 식별 그리고 천천히 IBC로 세관의 오픈 종결. 유리 모 세관의 좋은 끝을 사용 하 여 두 개 이상의 셀에의 열망을 방지 하거나 셀의 떨어져 큰 집계를 각 IBC 근처 여분의 셀을 멀리 공중 소탕.
- 현미경을 통해 보면서, IBC 유리 모 세관으로 안내 입 micropipetting 기구의 맨 끝 (피 펫 발음)에 매우 작은 흡입 힘을 적용 합니다.
- IBC를 따기 후 빈 1.5 mL 원심 분리기 튜브에 모 세관을 이동 하 고 원심 분리기 튜브 (그림 3D)에 작은 물방울 및 IBC를 추방 하기 위해 약간의 긍정적인 압력을 적용 합니다.
- 많은 IBCs 다음 방광에 진행 하기 전에 현재 방광에서 필요한 단계 3.3-3.6에 반복 합니다. 발음 펫과 타 액의 형성을 방지 하기 위해 자주 모세 혈관을 변경 합니다.
주의: 박테리아의 전염 성 (또는 임상) 종자를 사용할 때는 지속적으로 모 세관에서 솔루션의 수준을 모니터링 합니다. 흡 인기 관으로 모 세관의 가장자리에서 pipetted 오버플로 되는 액체의 수준을 하지 마십시오. 이 문제가 발생 하면, 즉시 다른 흡 인기 튜브에 전환 하 고 이전 세트를 삭제 합니다. - 3.2-3.6 모든 수확된 방광, 또는 실험적인 그룹에 대 한 충분 한 수의 생물 학적 샘플이 수집 될 때까지 단계를 반복 합니다.
- (선택 사항) 3.6, 3.7 단계를 반복 하 여 모든 실험 그룹 (또는 마우스) 안락사 되 고 충분 한 생물학적 샘플 각 그룹에서 수확 되어 있다.
결과
해 현미경을 통해 컬렉션 튜브에 단일 격리 된 IBC의 존재의 확인 (그림 3D), 떨어져 고립 된 IBC의 순도 또한 confocal 현미경 검사 법에 의해 확인할 수 있습니다. 그림 4A같이 격리 된 셀 대장균 을 uroplakin, 얼룩 해야 되며 IBCs (50-120 µ m)17에 대 한 예상된 크기. 또한, 대장균 얼룩는 주변 액체에 존재 하지입니다. 우리의 데이터를 바탕으로,이 기법으로 고립 된 세포의 90%는 IBCs18. 절연, 후 존재 하 고 개별 IBC에 세균성 세포의 생존 확인 될 수 있다 콜로 니 형성 단위 (CFU) 열거형 (그림 4B) 또는 게놈 등가물 (정량적 중 합 효소 연쇄 반응 (정량) 그림 4 C). 그림 4C 감염 되지 않은 상피 세포 같은 프로토콜 고립 된 박테리아의 정량 금액 필요가 없습니다 보여 줍니다. 이러한 데이터를 바탕으로, 단일 IBC에서 CFUs의 범위는 요로 감염의 murine 모델에서 102-103 예상. 단일 IBC 격리의 주요 목표 중 하나 RNA 시퀀싱 등 다운스트림 분석을 수행 하는 것입니다. 우리의 절연 방법 분석 IBCs에 박테리아에서 RNA를 얻을 수 있는지 확인에 대 한 3 개의 유전자 (16, cyoB, 및 frdA)의 양이 많은 반전 녹음 방송 중 합 효소 연쇄 반응 (qRT-PCR) 정량화 수행을 개별적으로 분리 되 고 풀링된 IBCs (그림 4D)의 범위. 그림 4 에 표시 된 모든 데이터는 Duraiswamy 외18허가 적응 되었습니다. 그림 5, Duraiswamy 그 외 여러분18에서 재현 되는 우리의 IBC 격리 프로토콜의 개요 구조를 볼 수 있습니다.

그림 1 : 손으로 뽑아 모세 혈관 유지 좁은 구멍. 손으로 뽑아 모 세관 튜브의 (A) 샘플 대 검은 배경에 표시 됩니다. 바닥 위에, unpulled 모 세관, 충분 한 정도로 끌려 하지 모 세관에서 단일 방광 상피 세포 수확에 사용할 수 있는 모 세관 그리고 너무 얇은 (그리고 따라서 두 조각으로 분리) 끌려 모 세관 표시 됩니다. 15 cm 눈금자 눈금에 대 한 이미지의 하단에 배치 됩니다. 사용 가능한 모 세관에서 스냅에 대 한 예상된 포인트 그림에 빨간색 화살표로 표시 됩니다. (B) 이미지 뽑아 모 세관 (아래)의 빈 내부 직경을 확인 해 현미경으로 찍은. Unpulled 모 세관은 두 개의 모세 혈관의 상대적 크기 차이 보여 주기 위해 위에 배치 됩니다. 눈금 막대 = 4.0 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
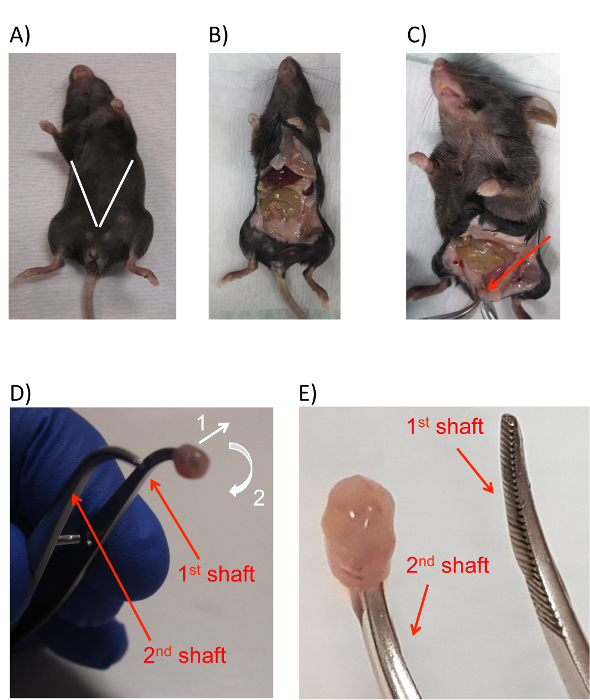
그림 2 : 방광 상피 세포 수확 마우스의 해 부. (A) 백색 라인 예상된 위치와 절 개의 각도 나타내는 추가 마우스의 이미지로 murine 복 막 구멍와 방광. (B)는 노출의 이미지 마우스 복 막 구멍 후 절 개. (C)는 노출의 이미지 방광 (빨간색 화살표) 지방 패드 사이 튀어나온. (D)를 방광을 반전 하는 데 필요한 동작의 방향을 나타내는 화살표와 함께 루멘에 삽입 하는 집게의 팁 murine 방광의 이미지. 방광은 집게의 첫 번째 샤프트 주위 다음 끄고 약간 바깥쪽으로 뽑아 처음입니다. 두 작업에 대 한 동의의 방향은 번호 1과 2는 흰색 화살표로 표시 된 대로. (E)는 집게의 두 번째 샤프트에 삽입 거꾸로 방광의 최종 위치를 보여주는 이미지입니다. 샤프트는 집게의 빨간색 화살표와 텍스트 모두 패널 D와 E에에서 표시 되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
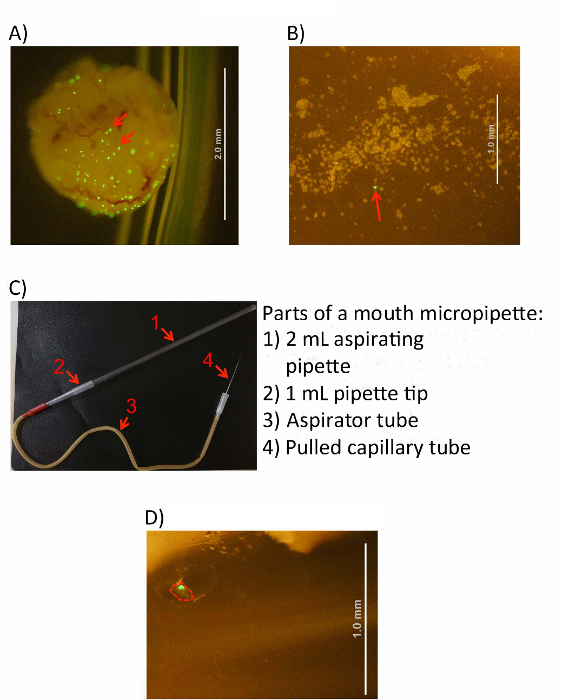
그림 3 : IBC 방광 세포에서 수확. (A) 셀 긁 기 전에 차가운 PBS 솔루션에 감염 하 고 거꾸로 방광. (B)는 이미지 긁어 방광 세포는 현미경 아래에서 본. IBCs (빨간 화살표 참조) 두 이미지에서 큰 녹색 형광 집계로 식별할 수 있습니다. (C)의 완료 이미지 입 micropipetting 기구. 오른쪽에 표시 된 대로 발음 피 펫, 피 펫 팁, 흡 인기 튜브, 그리고 가져온된 세관 번호 화살표로 식별 됩니다. (D) 1.5 mL 컬렉션에서 단일 격리 된 IBC의 이미지 튜브 (빨간색으로 설명 참조). 스케일 바 (로 표시) A, B, 및 d. 패널에 흰색 선으로 표시 됩니다 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
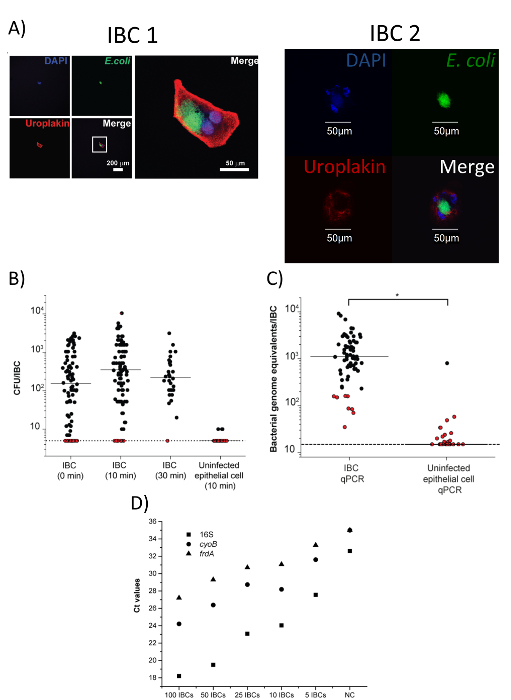
그림 4 : 수확된 IBCs 순수 하 고 다운스트림 분석에 사용할 수 있습니다. 이 그림은 Duraiswamy 외18에서 허가로 수정 되었습니다. (A) 두 개의 고립 된 GFP-긍정적인 셀 안티-uroplakin 및 안티-대장균 항 체로 얼룩진 했다의 이미지. 첫 번째 셀 (IBC 1) 왼쪽 (낮은 배율)에 개별 채널의 이미지 있으며 고배율 병합 된 이미지는 오른쪽에 있습니다. 두 번째 셀 (IBC 2) 병합 및 개별 채널에 높은 확대에 표시 됩니다. 스케일 바는 표시 된 대로. DNA는 4, 6-diamidino-2-phenylindole (DAPI) 물 이며 파랑 채널에 표시. 안티-대장균 fluorescein isothiocyanate (FITC)를 활용 하 고 녹색 채널에 2 차 항 체로 얼룩진입니다. 안티-uroplakin tetramethylrhodamine isothiocyanate (TRITC)를 활용 하 고 빨강 채널에서 이차 항 체와 스테인드입니다. (B)에서 격리 된 IBCs 세균 CFUs. IBCs 즉시 처리 또는 0.1 %10 또는 30 분 풀링된 CFU 건의 개별 IBCs에 대 한 Triton X n에서 고립에서 incubated = 3 별도 실험 같습니다. 탐지의 한계 = 0.7 로그10 CFUs/IBC. 탐지의 한계에서 플롯 하는 빨간 점 아니 식민지 했다 복구 하는 샘플을 나타냅니다. 모든 IBC 포함 된 샘플은 크게 다른 (p > 0.05, 맨-휘트니 테스트); 감염 되지 않은 상피 세포 IBC (10 분) 데이터 (p < 0.001, 맨-휘트니 테스트)에서 크게 다르다. (C) 정량 부 량 개별 IBCs와 감염 되지 않은 상피 세포에 박테리아의 0.1%에 10 분 부 화 후 트리톤-X (*, p < 0.0001, 맨-휘트니 테스트, n = 4). 탐지의 한계 = 1.18 로그10 세균성 게놈 등가물/IBC. 빨간 점 표시 샘플 없는 식민지 패널 B. (D) 정량화 16S rRNA, cyoB, 및 frdA 유전자의 다양 한 수가 개별적으로 분리 되 고 풀링된 IBCs에에서 titering에 복구 되었다 (n = 1 실험, 각 포인트 3 기술 복제의 평균을 나타냅니다). NC = DNA 부정적인 통제. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
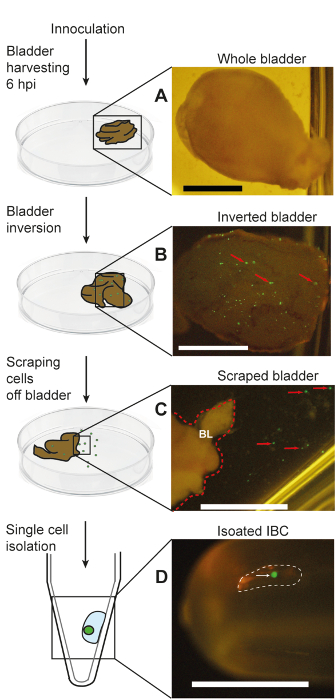
그림 5 : 회로도 및 그것의 관련된 사진에서 입 micropipetting 통해 IBCs의 절연을 나타내는 쥐 방광 감염. 이 그림은 Duraiswamy 외.18에서 재생 된다. (A) A 수확 전체 방광; (B) 거꾸로 전체 방광 IBCs; 표현 GFP를 노출 (C)에 인접 한 버퍼;에서 개별 IBCs를 보여주는 긁힌 것된 방광의 가장자리의 클로즈업 (D) 단일 절연 튜브로 pipetted IBC. 패널 B에에서 빨간색 화살표는 방광의 luminal 표면에 GFP-긍정적인 IBCs의 예를 나타냅니다. 패널 C에서에서 빨간 점선 나타냅니다 ("파"로 표시); 거꾸로 방광의 오른쪽 테두리 패널 C에에서 빨간 화살표 명백한 개별 GFP-긍정적인 상피 세포는 방광 표면에서 긁힌 것을 나타냅니다. 흰색 점선 패널 D micropipetted 하위 microliter 드롭릿을 격리 된 IBC, 흰색 화살표에 의해 표시 됩니다 포함 된 나타냅니다. 스케일 바 = 2 m m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
우리가 설명 하는 프로토콜은 요로 감염의 murine 모델에서 단일 IBCs의 격리에 대 한 수 있습니다. 이 프로토콜 격리 IBCs CFU에 배양 하 여 확인할 수 있습니다 가능한 세포내 박테리아를 포함 합니다. Extracellular 박테리아에 의해 작은 오염 IBCs에서 세포내 박테리아에 대 한 허용 프로토콜 결과 두 박테리아의 특성을 추가 하 고 IBC (그림 4C)에서 세포를 호스트. 우리 또한 표시 단일 IBC에서 박테리아 정량그림 4(C)와 같은 다운스트림 응용 프로그램에 사용할 수 있습니다 제안 하는 다른 체 외 분석에 대 한 우리의 기술은 프로세스 IBCs에 사용할 수 있습니다. 몇 가지 5 IBCs로에서 수확 하는 박테리아를 풀링 하 여 추가 설명 3 세균 유전자에서 qRT-PCR 분석을 수행 하는 능력 좋은 품질 RNA (그림 4D) 우리의 절연된 IBCs에 박테리아에서 수확 수 있습니다 제안 합니다. 결합, 우리 하는 데이터는 단일 IBCs에 (예: RNA 시퀀싱) 게놈 넓은 RNA 분석을 수행 수 있습니다이 격리 기술을 사용 하 여 나타냅니다.
IBC 번호 UTI8927에 의해 감염 하는 검은 6 쥐의 방광에 피크 때가 있기 때문에이 프로토콜에서 우리 6 h 시간 포인트에 집중 했다. 또한, 우리는 또한 사용 정적 세균성 문화 시스템 UTI89에 타입 1 pilus 식의 수준을 향상 시키기 위해. 타입 1 pilus의 식을 연결할 감염 방광 상피 세포28을 대장균 에 대 한 중요 한입니다. 그러나,이 식은 단단히 규제29 이며 환경 단서30변경으로 알려져 있습니다. 일관 된 감염 형 및 IBCs의 충분 한 번호를 유지, 대장균 테스트 이전 작업 (약간 웅 외.8에서 수정) 2 x 24 h 정적 세균성 문화 및 6 h 감염 시간 포인트를 사용 하 여 것이 좋습니다. NU14, UTI89,2829등 긴장. 그러나, 그것은 이러한 변수는 다른 요로 긴장 또는 각 감염에서 IBCs의 이상적인 수를 얻기 위해 다른 쥐 긴장 조정 될 필요가 있을 것 이다.
웅 외.8 에서 프로토콜 여성 마우스만 사용 하 여, 하는 동안 다른 설립된 프로토콜 설정 남성 쥐에 요로 감염 보고31되었습니다. 이 모델에서는 또한 남성 생쥐에서 방광염 IBC 통로를 따 랐 다. 남성 및 여성 쥐의 방광은 크기에서 유사 하다, 우리는 뿐만 아니라 감염 된 남성 쥐에 우리의 IBC 격리 프로토콜을 사용할 수 있는 예상.
이 프로토콜에 활용 하는 비교적 간단한 기술도 대부분 실험실에서 배포할 수 있습니다 보장 합니다. 이 프로토콜에 관련 된 중요 한 단계 중 하나는 관심의 셀 형식을 선택 하기 위한 microcapillaries를 만드는 유리 모 세관의 당기는. 이 단계를 만든 microcapillaries의 직경에 유연성에 대 한 허용 하 고 따라서 메서드는 여러 다른 대상 셀 형식에 확장 될 수 있습니다. 그러나,이 모세 혈관을 만드는 고유한 변이 때문 배려는 최종 직경 가능한 범위에 있는지 확인을 한다. 모 세관 너무 좁은 경우에, 그들은 관심의 셀을 선택 하 실패 하지만 한 시도에서 여러 셀을 선택할 수 있는 그들은 너무 넓은 경우. 또한, 모 세관을 당기기의 과정에서 화기를 사용 하 여 microcapillaries를 만들려고 연구원 발생 등을 방지 하기 위해 처리 해야 하는 그래서 화상 및 화재, 내재 된 위험을 운반 합니다. 가변성으로 오픈 화재 위험을 줄이기 위해 이러한 모세 혈관을 만들기에 참여 연구원 만들 수 전통적인 micropipette electrophysiological 실험 (예를 들어, PC-100, Narishige 그룹)에 대 한 사용과 같은 기계를 당기의 사용. 으로이 기계는 모세 혈관을 중력 또는 로봇 플랫폼의 사용, 그들은 감염 모델의 요구에 맞게 맞춤화 할 수 있습니다. 그러나, micropipette 당기는 기계 사용할 수의 광범위는 개별 연구원이이 프로토콜 사용 하기 위해 적절 한 최종 모 세관의 직경을 결정 하기 위해 몇 가지 시행 착오를 통해 갈 필요가 있을 것 이다 의미 합니다.
제시 프로토콜 IBC를 시각적으로 식별 하는 형광 태그를 표현 하는 박테리아의 사용. 따라서,이 기술은 유전자 감염 유기 체를 수정 하는 연구팀은 능력에 의해 제한 됩니다. 특히 UPEC에 대 한 CFT073 및 NU14 같은 IBC 형성 긴장 성공적으로 변형 되어 GFP 표현 플라스 미드32,,3334;와 이 따라서 같은 프로토콜에 사용 해야 합니다. 에 대해 IBCs의 발생률에 대 한 추정치는 마우스 방광 (70 m m2)35, 개별 상피 세포 (50-120 µ m)17의 길이 그리고 단일 방광16IBCs의 주파수 영역에 따라, 1에서 1000 셀 (또는 0.1%)입니다. 이 견적에는 드문 이벤트를 대상으로 우리의 세포 격리 프로토콜의 유틸리티 진열 장. 우리의 프로토콜을 통해 셀 선택의 정밀도 및 당길 수 있다 모 세관 직경의 광범위가이 프로토콜 세포내 박테리아 감염의 vivo에서 그리고 생체 외에서 다른 모델에서을 사용할 수 있습니다 하는 것이 좋습니다. 사실, 우리 성공적으로 감염 된 교양된 방광 상피 세포 (데이터 표시 되지 않음)을이 기법을 이용 했다.
더 기술적으로 도전적인 단계 프로토콜에의 한 방광 상피 세포 근 근에 대 한 노출 반전 형 이다 이다. 우리는 그것도 방광 근 근에 대 한 그것을 밖으로 넓히다에 절 개를 만들 수 발견 했다. 그러나 때문에 주의 오픈; 절단의 과정에서 방광의 상피 세포에 피해를 줄이기 위해 해야 이상적으로 단일 컷 방광 오픈 퍼짐에 활용 되어야 합니다. 또한, 컷 여야 한다 차가운 PBS에 손실을 방지 하기 위해 실수로 셀 또는 방광 직물의 과정에서.
입이 프로토콜에서 IBCs의 pipetting 뿐만 아니라 셀 함께 전송 솔루션의 최종 볼륨을 제한으로 셀 선택 과정을 더 잘 제어할을 제공 합니다. 정밀한 제어 및 연구원은 입에서 솔루션의 큰 분리 또한 전송 볼륨 microliter 범위를 nanoliter 내에 있다 연구원의 안전을 극대화 합니다. 반면, 우리의 경험과 현대 micropipette 이다 그것은 더 많은 주변 액체와 ibc, extracellular luminal 박테리아와 오염에 잠재적으로 주요 셀 전송 하는 경향이 있다. 우리의 찾는 그 입 pipetting 제공 합니다 높은 성능을 다른 단일 셀 격리 방법 또한 다른 실험실22,,2324에 의해 보고 되었습니다. 단일 셀 격리, 외 입 pipetting도 사용 되었습니다 단일 셀 electroporation에 뉴런25, 추가 유틸리티 및 훈련된 연구원 기술 달성 수 분 제어를 보여줍니다. 그러나, 안전은 기본의 중요성, 그리고 잠재적인 추가 조치 사용 되 고 병원 균에 따라 취할 수 있는 것이 좋습니다: (i) 연구원과 생물 소재, 예를 들어 한 발음을 사용 하 여 사이 공기 버퍼의 확장 추가적인 방 벽 역할을 aspirating 피 펫에 솜 털 같은 물리적 필터를 추가 하는 큰 볼륨 (예: 5 mL), 또는 (ii) 피 펫.
위험 평가 입 pipetting는 여전히 너무 위험한 결론에 이르게 하는 경우에 상용 로봇 설정 (예: nanoinjections 사용) 위한 안전한 방법을 제공 하기 위해 우리의 기술의 다른 섹션으로 결합 될 수 있다 혼합된 인구에서 감염 된 세포를 분리. 그것은 로봇 micromanipulator를 사용 하 여 우리의 경험 IBC 격리에 비해 입 pipetting, 방광 상피 세포 크기에 큰 내부 실험 변화 하기가 어려운 사용자의 감소 속도 증명 하고있다 언급 되어야 단일 IBCs를 선택 하는 데 필요한 힘을 결정 하는 로봇 팔. 그럼에도 불구 하 고, 그 질병의 높게 전염성이 에이전트와 작업에 대 한 비록 costlier, 실행 가능한 옵션이 남아 있다.
공개
저자는 공개 없다.
감사의 말
이 연구는 국립 연구 재단, 총리의 사무실, 싱가포르, 그것의 NRF 연구 장학금 제도 의해 지원 되었다 (NRF 수상 no. NRF-RF2010-10); 싱가포르의 보건의 국립 의학 연구 위원회 (NMRC/CIRG/1358/2013); 그리고 싱가포르 게놈 연구소 (GIS) / 과학, 기술, 및 연구 기관 (A * STAR).
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tube | For static bacterial culture and OD measurement | ||
| 100% ethanol | For Alcohol Burner | ||
| 15 mL conical tube | For static bacterial culture and OD measurement | ||
| 1 mL Tuberculin Syringe | BD Biosciences | 302100 | |
| 3% Bacterial Agar | For static bacterial culture and OD measurement | ||
| 70% ethanol | For static bacterial culture and OD measurement | ||
| Aesculap anatomic forceps | Braun/Kruuse | BD222R | For initial dissection of mouse (skin, fascia) |
| Alcohol Burner | Wheaton | 237070 | |
| Aspirating pipette | BD Biosciences | 357558 | |
| Aspirator tube | Sigma-Aldrich | A5177 | |
| Bacterial loops | For static bacterial culture and OD measurement | ||
| Benchtop centrifuge | Eppendorf | 5424 | Any centrifuge for 1.5ml eppendorf tubes |
| Conical flasks | For static bacterial culture and OD measurement | ||
| Digital camera for microscope | Olympus | DP71 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Glass Capillaries | Kimax | 6148K07 | |
| Iris Scissors STR SS 110MM | Braun | BC110R | |
| Isoflurane (Isothesia) | Henry Schein Animal Health | 29405 | |
| Kanamycin Sulfate | Calbiochem | 420311 | For static bacterial culture and OD measurement |
| LB broth (Miller) | Thermo/Gibco | 10855021 | For static bacterial culture and OD measurement |
| Light source unit for microscope | Olympus | LG-PS2 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Lubricant | KY | Any similar commercial medical lubricant will suffice | |
| Macro fluorescence microscope | Olympus | MVX10 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Micropipette + micropipette tips | For static bacterial culture and OD measurement | ||
| PBS 1x | For static bacterial culture and OD measurement | ||
| Pipette controller + Pipettes | For static bacterial culture and OD measurement | ||
| Polyethylene Tubing | BD Intramedic | 427401 | |
| Precision Glide needle 30 G | BD Biosciences | 305107 | Possibly under new catalogue number (305106) |
| Splinter forceps curved | Braun | BD312R | |
| Spray bottle (for ethanol) | For static bacterial culture and OD measurement | ||
| Square cuvettes | Elkay | 127-1010-400 | For static bacterial culture and OD measurement |
| Sterilgard III Advance Safety Cabinet | Baker | SG403 | Any biosafety cabinet with a UV irridiator |
| Sterilin 90mm Standard Petri Dish | Thermo | 101VR20 | Any sterile petri dish |
| Stevens, vascular and tendon scissors, curved, delicate, 110 mm | Braun | OK366R | Recommended for harvesting of bladder |
| Surgical Scissors STR S/B 105MM | Braun | BC320R | |
| Tabletop Centrifuge | Eppendorf | 5810R | Any refridgerated centrifuge for 15ml conicals |
| WPA C08000 cell density meter | Biowave (Biochrom) | 80-3000-45 | For static bacterial culture and OD measurement |
참고문헌
- Barber, A. E., Norton, P. J., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Flores-Mireles, A. L., Walker, J. N., Caparon, M., Hultgren, S. J. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nature Reviews Microbiology. 13, 269-284 (2015).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80, 331-333 (1990).
- Foxman, B., Barlow, R., D'Arcy, H., Gillespie, B., Sobel, J. D. Urinary tract infection: self-reported incidence and associated costs. Annals of Epidemiology. 10 (8), 509-515 (2000).
- Zowawi, H. M., et al. The emerging threat of multidrug-resistant Gram-negative bacteria in urology. Nature Reviews Urology. 12, 570-584 (2015).
- Silverman, J. A., Schreiber, H. L., Hooton, T. M., Hultgren, S. J. From physiology to pharmacy: developments in the pathogenesis and treatment of recurrent urinary tract infections. Current Urology Reports. 14, 448-456 (2013).
- Sivick, K. E., Mobley, H. L. T. Waging war against uropathogenic Escherichia coli: winning back the urinary tract. Infection and Immunity. 78, 568-585 (2010).
- Hung, C. -. S., Dodson, K. W., Hultgren, S. J. A murine model of urinary tract infection. Nature Protocols. 4, 1230-1243 (2009).
- Cusumano, C. K., et al. Treatment and prevention of urinary tract infection with orally active FimH inhibitors. Science Translational Medicine. , (2011).
- Alteri, C. J., Hagan, E. C., Sivick, K. E., Smith, S. N., Mobley, H. L. T. Mucosal Immunization with Iron Receptor Antigens Protects against Urinary Tract Infection. PLoS Pathogens. , (2009).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. , (2006).
- Hunstad, D. A., Justice, S. S. Intracellular lifestyles and immune evasion strategies of uropathogenic Escherichia coli. Annual Review of Microbiology. 64, 203-221 (2010).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Medicine. , (2007).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- Schwartz, D. J., Chen, S. L., Hultgren, S. J., Seed, P. C. Population dynamics and niche distribution of uropathogenic Escherichia coli during acute and chronic urinary tract infection. Infection and Immunity. 79, 4250-4259 (2011).
- Keshtkar, A., Keshtkar, A., Lawford, P. Cellular morphological parameters of the human urinary bladder (malignant and normal). International Journal of Experimental Pathology. 88, 185-190 (2007).
- Duraiswamy, S., Chee, J. L. Y., Chen, S., Yang, E., Lees, K., Chen, S. L. Purification of Intracellular Bacterial Communities during Experimental Urinary Tract Infection Reveals an Abundant and Viable Bacterial Reservoir. Infection and Immunity. , (2018).
- Kurimoto, K., Yabuta, Y., Ohinata, Y., Saitou, M. Global single-cell cDNA amplification to provide a template for representative high-density oligonucleotide microarray analysis. Nature Protocols. 2, 739-752 (2007).
- Tang, F., et al. Deterministic and stochastic allele specific gene expression in single mouse blastomeres. PLoS One. , (2011).
- Wells, J. M., Melton, D. A. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 127, 1563-1572 (2000).
- Guo, H., et al. Profiling DNA methylome landscapes of mammalian cells with single-cell reduced-representation bisulfite sequencing. Nature Protocols. 10 (5), 645-659 (2015).
- Zhao, R., et al. The establishment of clonally derived chicken embryonic fibroblast cell line (CSC) with high transfection efficiency and ability as a feeder cell. Journal of Cellular Biochemistry. , (2018).
- Tang, F., et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell. Nature Protocols. 5 (3), 516-535 (2010).
- Wiegert, J. S., Gee, C. E., Oertner, T. G. Single-Cell Electroporation of Neurons. Cold Spring Harbor Protocols. , (2017).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), 52892 (2015).
- Justice, S. S., et al. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 101 (5), 1333-1338 (2004).
- Mulvey, M. A., et al. Induction and Evasion of Host Defenses by Type 1-Piliated Uropathogenic Escherichia coli. Science. 282 (5393), 1494-1497 (1998).
- Zhang, H., Susanto, T. T., Wan, Y., Chen, S. L. Comprehensive mutagenesis of the fimS promoter regulatory switch reveals novel regulation of type 1 pili in uropathogenic Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), 4182-4187 (2016).
- Gally, D. L., Bogan, J. A., Eisenstein, B. I., Blomfield, I. C. Environmental regulation of the fim switch controlling type 1 fimbrial phase variation in Escherichia coli K-12: effects of temperature and media. Journal of Bacteriology. 175 (19), 6186-6193 (1993).
- Olson, P. D., Hruska, K. A., Hunstad, D. A. Androgens Enhance Male Urinary Tract Infection Severity in a New Model. Journal of the American Society of Nephrology. 27 (6), 1625-1634 (2016).
- Garofalo, C. K., et al. Escherichia coli from Urine of Female Patients with Urinary Tract Infections Is Competent for Intracellular Bacterial Community Formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Berry, R. E., Klumpp, D. J., Schaeffer, A. J. Urothelial cultures support intracellular bacterial community formation by uropathogenic Escherichia coli. Infection and Immunity. 77 (7), 2762-2772 (2009).
- Holden, N., Totsika, M., Dixon, L., Catherwood, K., Gally, D. L. Regulation of P-fimbrial phase variation frequencies in Escherichia coli CFT073. Infection and Immunity. 75 (7), 3325-3334 (2007).
- Jost, S. P. Postnatal growth of the mouse bladder. Journal of Anatomy. 143, 39-43 (1985).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유