Method Article
Colletotrichum fioriniae Sviluppo in acqua ed estratti floreali basati su cloroformio mirtillo e Cranberry
In questo articolo
Riepilogo
Qui, sono descritte le analisi biologiche progettate per monitorare lo sviluppo di un agente patogeno fungoso, Colletotrichum fioriniae, alla presenza di estratti di mirtillo o mirtillo rosso floreali su vetrini coprioggetti. Acqua-, cloroformio- e acqua piovana campo - base floreale estrazione tecniche sono dettagliate e spaccato di come queste informazioni possono essere applicate.
Abstract
Per monitorare accuratamente la fenologia del periodo della fioritura e la dinamica temporale dei segnali chimici floreale nelle frutta funghi patogeni di decomposizione, metodi di estrazione floreale e coprioggetto analisi biologiche sono state sviluppate utilizzando Colletotrichum fioriniae. Nel mirtillo rosso e mirtillo, questo agente patogeno è controllato in modo ottimale applicando fungicidi durante il periodo di fioritura a causa del gioco di ruolo fiori nelle fasi iniziali dell'infezione. Il protocollo dettagliato qui descrive come floreali estratti (FE) sono state ottenute utilizzando acqua, cloroformio e metodi basati su acqua piovana di campo per un uso successivo nel corrispondente analisi biologiche di vetrino coprioggetti di vetro. Ogni FE è servito a fornire un set di informazioni diverso: risposta di c. fioriniae a chimica floreale mobilitato stecche in acqua (a base di acqua), risposta di agente patogeno al fiore e cere superficie di frutta (a base di cloroformio) e monitoraggio basato sul campo di raccolta acqua piovana floreale, trasferirsi in vitro osservazioni in un ambiente agricolo. Il FE è ampiamente descritto come acqua-cloroformio-basi o, con un'appropriata analisi biologica descritto per compensare le differenze intrinseche tra questi due materiali. L'acqua piovana che ha avuto colare di fiori è stato raccolto in dispositivi unici per ciascuna coltura, alludendo alla flessibilità e alla applicazione di questo approccio per altri sistemi di coltivazione. Le analisi biologiche sono rapido, economico, semplice e forniscono la capacità di generare informazioni spatiotemporal e site-specific sulla presenza di stimolatori floreali composti da varie fonti. Queste informazioni saranno in definitiva informare meglio strategie di gestione della malattia, come FE diminuire il tempo necessario per l'infezione si verifica, fornendo così spaccato cambiando rischi per infezione da agente patogeno nel corso della stagione di crescita.
Introduzione
Colletotrichum fioriniae provoca una putrefazione della frutta del mirtillo gigante americano (Vaccinium corymbosum L.) e il grande mirtillo americano (V. macrocarpon Aiton)1,2. Questo agente patogeno è stata recentemente delineato dal c. acutatum specie complesse3,4,5,6 ed è un agente causale dell'antracnosi del mirtillo e membro della putrefazione della frutta del mirtillo rosso complesso, oltre a causare numerose altre pianta malattie in tutto il mondo7. C. fioriniae ha una latente, stile di vita hemibiotrophic8, con le infezioni che si verificano durante lo sviluppo di bloom e sintomo non diventando evidente fino a quando i frutti sono nelle fasi finali della maturazione9. Nel mirtillo rosso e mirtillo, putrefazione della frutta è solo adeguatamente controllata con applicazioni di fungicida effettuate durante il periodo di fioritura. Il patogeno sverna in mirtillo dormienti gemma floreale scale10 e sporulates durante la fioritura. Conidi vengono spostati in tutto il baldacchino via pioggia-splash dispersione11,12 e accumulo di inoculo è stato fortemente correlato per il periodo di fioritura13. Risposta di Colletotrichum specie a fiori di host non è univoco per Vaccinium, come fiori sono importanti componenti della frutta di agrumi post fioritura drop (PFD)14 così come antracnosi fragola15, in entrambi i casi la causa l'agente patogeno per sporulare. Tutti questi casi evidenziano l'esigenza di metodi efficaci valutare la dinamica temporale dei segnali chimici floreale nelle fioriniae c. e altri agenti patogeni che infettano durante la fioritura. Le intuizioni fornite con i metodi descritti qui stanno diventando sempre più più preziose.
Questo protocollo particolari metodi di approvvigionamento Estratto floreale (FE) e guide per la valutazione delle risposte di c. fioriniae a FE via vetro vetrino coprioggetti analisi biologiche15,16. Le tecniche di estrazione floreale sono suddivisi in due tipi principali; estrazioni a base d'acqua (attivo-FE, passiva (pass -FE) e campo base acqua piovana (rw-FE)) e basato su cloroformio (ch-FE)17 estrazioni. Le estrazioni di acqua-base consentono per l'ispezione di acqua mobilitato floreale segnali chimici. Queste indicazioni di mobilitati sono probabilmente importanti componenti della Corte infezione, poiché FE aumenta notevolmente la velocità di infezione16, oltre a fornire l'umidità necessaria per l'infezione si verifica. Inoltre, essi rappresentano una condizione più naturale come stimolo floreale può essere lavato in tutto il baldacchino durante gli eventi di bagnatura come precedentemente osservato in mirtillo e altri sistemi di coltura14,16. Cloroformio-base floreale estrazioni (ch-FE) anche forniscono preziose informazioni relative alla risposta di agente patogeno a superficie host cere17,18, delucidando le prime fasi di crescita di conidi una volta depositati su suscettibili organi di host (ad esempio fiori, ovaie e frutta in via di sviluppo). Risposta di agente patogeno a cambiamenti stagionali in cere superficie host possa essere monitorato anche utilizzando questo protocollo. Di conseguenza, le analisi biologiche sono su misura per lavorare con FE a base d'acqua o basati su cloroformio FE per mitigare le differenze intrinseche tra questi due materiali.
I dati generati da analisi biologiche ha rivelato che le estrazioni di acqua-basato stimolano livelli elevati di conidiation secondaria che basati su cloroformio estrazioni dove c'era una risposta definitiva appressorial, implicando quindi molteplici composti presenti alla FE. È interessante notare che, entrambe queste risposte di crescita sono state osservate quando utilizzando acqua piovana che aveva scappano di mirtillo rosso e mirtillo fiori, che indica più composti stimolatore può essere lavato dalla superficie dei fiori. Così, monitoraggio per stimolazione floreale fornirà approfondimenti la probabilità di successo di agente patogeno in un sistema agricolo.
L'obiettivo finale di questo protocollo è quello di fornire una metodologia per generare informazioni di base biologica su funghi fitopatogeni in risposta a stimoli chimici floreale, così come le metodologie d'inizio che possono utilizzare queste informazioni floreale per aiutare nella processi di gestione e il processo decisionale di site-specific di malattia.
Protocollo
1. funghi isolati e sospensioni di Spore
- Isolare Colletotrichum fioriniae da un ospite infetto naturalmente19. Quindi, è possibile memorizzare le culture pulite sulla farina di mais agarici (CMA). Inserire la spina della cultura (da slant CMA) su una cella di plastica standard cultura piatto (diametro 9 cm) contenente che sia chiarito agar di succo V8 (cV8A) (modificato dal 1955 Miller), o non-chiarito V8 succo agar (V8A)20. Quando colonie iniziano a sporulare, streak conidi (masse conidial arancione) su un altro cV8A o V8A contenente piastra di coltura delle cellule (con un'ansa sterile standard) per produrre una cultura sporulanti ad alta densità.
Nota: Qualsiasi procedura di protocollo con funghi dovrebbe essere eseguita in una cappa a flusso laminare per ridurre la possibilità di contaminazione colture fungine e/o le analisi biologiche. - Dopo 7 giorni di crescita, con un'ansa sterile standard raccogliere una piccola quantità di conidi dalla cultura ad alta densità (toccando leggermente il ciclo alla massa conidial) e mescolare questo in una provetta da centrifuga da 15 mL contenente 10 mL di acqua deionizzata sterile (SDW). Vortice in questo esempio per 10 s, quindi utilizzando una pipetta standard immergersi su e giù numerose volte per ulteriori mix il campione.
- Quindi, mettere una goccia di campione sull'emocitometro agitati con vortex e stimare le concentrazioni di spore. Campi di conteggio 5-10 sull'emocitometro, ottenere la media e moltiplicare la media per il fattore di diluizione (cioè 10.000), ottenendo così la concentrazione conidial / mL SDW.
- Quindi utilizzando un volume (V) / equazione di concentrazione (C) (V1● [C1] = V2● [C2]) regolare (con SDW) a 1,0 X 105 conidi per mL di SDW con un volume finale di 5 mL. Questo è indicato come la sospensione di spore e fatta solo immediatamente prima dell'uso in entrambi analisi biologica.
2. attivo, basato su acqua floreale estratti (attivo -FE)15,16
Nota: Vedere Supplemental figura 1, supplementare nella figura 2, supplementare nella figura 3e film supplementare 1.
- Accuratamente a mano-raccogliere mirtillo (aprile-maggio) e mirtillo rosso (giugno-luglio) fiori durante le loro fioriture di picco rispettivi nel campo (Supplemental figura 1). Indossare e cambiare i guanti di nitrile tra punti di campionamento (cultivar-varietà/fisiche posizioni) per inibire la contaminazione dell'olio di pelle umana, nonché la contaminazione incrociata tra le varietà floreali. Fiori o mirtillo o mirtillo (da un'unica fonte) posto in sacchetti di plastica (riempite una sacca da 100 x 150 mm) e immediatamente in frigorifero a 4 ° C, una volta che i fiori sono raccolti.
Nota: L'active - estrazione viene modificato da Leandro et al. (2003) 16. - Prima dell'estrazione, rimuovere qualsiasi fiori deteriorati, danneggiati, malati, quindi utilizzando fiori sani rimuovere ovaie, sepali e peduncoli con pinzetta (45 ˚ pinzette) e scartare. Utilizzare solo i restanti organi (corolla, lo stigma, stile e stame) per attivo - estrazioni. Tagliare garza (150 x 150 mm) e posto all'interno di un imbuto di 7 x 7 mm, posto in una provetta da centrifuga 50ml pulito e mettere da parte.
- Unire 1 parte elaborata fiori a 9 parti SDW (1 wt: 9 vol ratio) in un mortaio. Macinare delicatamente con un pestello per 30 s (attenzione non completamente polverizzare i campioni). Ceppo risultante polpa attraverso preparato garza/imbuto e raccogliere in provetta da centrifuga (50 mL). Pulire o utilizzare nuovo mortaio/pestello tra ogni estrazione con 95% EtOH e acqua calda corrente.
- Preparare un apparato di filtrazione a vuoto: raccogliere Imbuto Buchner, matraccio di Erlenmeyer filtro del vuoto (fino a 1.000 mL di capacità), 55 mm cerchio carta da filtro e tubo/fonte di vuoto. Aggiungere carta da filtro ad un imbuto di Buchner dimensione appropriato e posto in cima al pallone, poi collegare l'apparecchiatura ad un'acqua / sorgente tramite tubo di aspirazione di aspirazione e mettere da parte.
- Chiarire ulteriormente gli estratti di mirtillo floreale mediante centrifugazione per 10 min a 8.055 x g. Versare sovranatante apparato preparato filtro vuoto, attivare la fonte del vuoto, filtrare il surnatante, quindi versare il contenuto del pallone in una nuova provetta da centrifuga (50 mL). Pulire tutti i componenti di apparecchi tra ogni filtrazione con 95% EtOH e acqua calda corrente. Ulteriore filtro attraverso una siringa adattato con un 0,22 µm dei pori, acetato di sterilizzazione, filtro in una nuova provetta da centrifuga (50 mL).
- Per gli estratti di mirtillo rosso floreali, vuoto solo filtrare attraverso carta da filtro e versare il contenuto del pallone in una nuova provetta da centrifuga (50 mL).
- Preparazione risultante si riferisce a come attivo- Estratto floreale (active -FE). Conservare tutti gli estratti floreali di base d'acqua (attivo- passivo-, raccolte di acqua piovana) a-20 ° C in aliquote di 5-50 mL fino uso sperimentale. Ripetere le estrazioni con campioni multipli (almeno 3 estrazioni per tipo di campione) per fornire repliche.
3. passivo , basato su acqua floreale estratti ( passare -FE) 16
Nota: Vedere film supplementare 2.
- Raccogliere tutta mirtillo fiori (50 g) come sopra a mano e conservare in frigorifero dopo la raccolta. Prima dell'estrazione, rimuovere qualsiasi fiori deteriorati, danneggiati, malati e rimuovere solo i peduncoli da fiore intatto. Refrigerare i campioni preparati fino a quando il passivo - sistema di estrazione, descritto di seguito, è a posto.
- Sciacquare tutte le parti prima dell'uso con 95% di etanolo (EtOH) e acqua calda corrente per prevenire la contaminazione (foglio di plastica della maglia, due cestelli in rete plastica, recipiente di vetro e bottiglia della foschia pompa). Anche preparare una provetta da centrifuga garza/imbuto/50 mL 4 strati per ogni estrazione come descritto sopra (al punto 2.2) e mettere da parte.
- Preparare il setaccio: inserire un foglio di plastica della maglia (aka chiaro bar stuoia) una maglia di plastica paniere (114 x 102 mm). Posizionare un cestello in rete secondo, identico, capovolta (invertito) in un vetro pane-pan (127 x 229 mm) (per evitare i fiori che si siede in SDW) e mettete la maglia foglio contenente cesto in cima. Aggiungere 50 g di fiori disposti nel setaccio.
Nota: In alternativa, piccola provetta [pulizia] cestini possono essere usati ai panieri di maglia di plastica originalmente usato (cestelli di pinta di vecchio, verde, fragola in rete sono spesso difficili da fonte). - Uniformemente nebbia fiori con 250 mL utilizzando una pompa nebbia bottiglia e catturano il deflusso nel recipiente di vetro. Poi filtrare filtrato attraverso la garza/imbuto preparato in una provetta da centrifuga pulita. Preparazione risultante è indicato come passivo- Estratto floreale (pass -FE); memorizzare come per sopra (punto 2.6).
- Pulire tutti i componenti tra ogni estrazione con 95% EtOH e acqua calda corrente. Ripetere estrazioni con campioni multipli per fornire replica (almeno 3 al tipo di campione).
4. cloroformio-base floreale estratti (ch-FE) 17
- Raccogliere fiori di mirtillo rosso e mirtillo come per sopra (punto 2.1) e preparare i fiori per l'estrazione (punto 2.2, senza preparazione di garza/imbuto). Mantenere i fiori pronti refrigerati fino a prima dell'uso.
- Qualsiasi lavoro eseguito con cloroformio deve essere eseguita in una cappa aspirante per motivi di sicurezza. Questo comprende la preparazione dei materiali / cristalleria, le procedure di estrazione e analisi biologica conduttanza (passaggi utilizzando ch-FE).
- Pulire tutti i componenti con 95% EtOH due volte, poi due volte con cloroformio per prevenire la contaminazione per ogni estrazione: filettato provette di coltura di vetro, 2 bicchieri di vetro, in acciaio inox piccolo schermo e un cilindro di laurea [vetro]. Mettere da parte a secco a testa in giù. Sciacquare tappi di politetrafluoroetilene (PTFE) foderato due volte con 95% EtOH solo (cloroformio danneggia i materiali esterni della PAC) e mettere da parte ad per asciugare.
- Unire 1 parte elaborata fiori a 9 parti cloroformio (1 wt: 9 vol ratio) in un becher (fiori poi cloroformio), delicatamente ricciolo per 30 s e il ceppo attraverso uno schermo di acciaio inossidabile nel bicchiere graduato secondo. Ch-FE dal secondo bicchiere versare il tubo di vetro (10-15 mL) di cultura e apporre il tappo PTFE. Avvolgere il tappo con parafilm per evitare l'evaporazione.
- Questa preparazione è l'Estratto floreale basato su cloroformio (ch-FE). Conservare il campione al buio (per ridurre la degradazione luce) a 4 ° C fino all'utilizzo sperimentale. Ripetere estrazioni con campioni multipli per fornire replica (almeno 3 al tipo di campione).
5. raccolta di acqua piovana da fiori di mirtillo (BB rw-FE)16
Nota: Il dispositivo di raccolta di acqua piovana floreale di mirtillo è costituito da una tazza di spray aria pistola a spruzzo vernice monouso con adattatore di connessione (Coppa: filettatura femmina, adattatore: filettatura maschio), provette da centrifuga 50ml (polipropilene), parafilm e fili ricoperti in plastica ( filo di telefono standard, contenuto filo conduttore interno).
- Selezionare più posizioni all'interno di un cespuglio di mirtilli per catturare scappano di fiori prima di creare dispositivi di raccolta acqua piovana. Questi includono direttamente sotto infiorescenze (fiore) alla base del bush (corona). Record diametro degli steli (che vanno da 1-5 cm) alle posizioni selezionate, come questo determinerà la dimensione dei fori utilizzati per il fissaggio del dispositivo, descritto di seguito.
- Per ogni posizione selezionata creare un dispositivo di raccolta. In primo luogo un foro nella parte inferiore di una tazza di spruzzo (dove la Coppa curve verso l'apertura filettata) per il diametro corrispondente, con un po' di passaggio collegato a una pressa di trivello. Quindi, tagliare una linea retta dalla parte superiore della giorgia_wade alla bocca della tazza dello spruzzo. 4 fori equidistanti (grande abbastanza per filo il legare rivestito di plastica), alla foce della Coppa spray e collegare un'estremità dei fili rivestiti in plastica lasciando un'estremità libera.
- Praticare un foro abbastanza grande da avvitare l'adattatore di Coppa spruzzatore di vernice in un coperchio di protezione 50ml centrifuga. Sigillare le filettature della scheda con parafilm per prevenire le infiltrazioni. Collegare sia il tappo di centrifuga e porzione filettata della Coppa spruzzatore. Collegare il tubo di centrifuga accoppiate 50 mL.
- Ripetere i passaggi da 5.3-5.4 per creare dispositivi multipli secondo percorsi selezionati, un minimo di dispositivi 4 collezione per ogni posizione di campionamento.
- Distribuire i dispositivi alle posizioni selezionate dalla flessione tazze spruzzatore su steli di. Orientare il taglio-lato della tazza spruzzo verso l'alto utilizzando i cavi plastica-rivestito altri steli (per assicurare acqua passando sopra i fiori viene catturato). Apporre il parafilm eventuali aperture che potrebbero verificarsi perdite di acqua piovana. (Supplemental figura 3, supplementare nella figura 4, supplementare figura 5e supplementare nella figura 6).
- Provette per l'etichetta, con la distribuzione di data / ora. Dopo un evento di pioggia, rimuovere e sostituire la parte inferiore (tubo) della provetta da centrifuga (etichetta data / ora di raccolta). Portare le collezioni di deflusso (denominati Estratto floreale di acqua piovana del mirtillo (BB rw-FE)) all'interno e vuoto (filtraggio descritto in passaggi 2.4-2.5). Archivio come sopra (punto 2.6), fino a quando usato in un'analisi biologica basati su acqua.
6. raccolta di acqua piovana da Cranberry fiori (CB rw-FE)
- Il dispositivo di raccolta di acqua piovana floreale in mirtillo rosso è costituito da un imbuto in polipropilene cm 7 X 7, provette da centrifuga 50ml (polipropilene), parafilm, e 4 standard, plastica rivestito legami di torsione (per dispositivo).
- In primo luogo, calore puntura 8 fori equidistanti (diametro di legami torsione) intorno alla bocca dell'imbuto utilizzando una sonda di metallo. Inserire legami torsione nei 4 fori. Attaccate gli altri capi in posizione opposta che fori, formando un reticolo ordinato incrocio. Avvolgere imbuto giù-staminali con parafilm e mettere da parte.
- Praticare un foro abbastanza grande per inserire l'imbuto giù-staminali in un tappo di centrifuga 50 mL con un po' di passaggio. Inserire imbuto preparato nel tappo della centrifuga. Ripetere i passaggi 6.2-6.3 per creare più periferiche, un minimo di dispositivi 4 collezione per ogni posizione di campionamento.
- Distribuire i dispositivi etichettati (data/ora) in torbiere del mirtillo rosso selezionati. Ordinatamente Infilare due fiore cuscinetto infiorescenze (noti come montanti) sotto i legami incrociati plastica torsione. Quindi verticalmente orientare il dispositivo forando la provetta da centrifuga nel baldacchino del mirtillo rosso (Supplemental figure 7-8, Supplemental Movie 3).
- Dopo irrigazione pioggia o sovraccarico rimuovere e sostituire la parte inferiore (tubo) della provetta da centrifuga (etichetta data / ora di raccolta). Portare il deflusso (denominato Estratto floreale (CB rw-FE) di acqua piovana mirtillo rosso) all'interno e vuoto (filtraggio descritto in passaggi 2.4-2.5). Archivio come sopra (punto 2.6), fino a quando usato in un'analisi biologica basati su acqua.
7. analisi biologica utilizzando acqua base floreale estratti15,16 (attivo-FE, passare-FE, rw-FE)
Nota: Vedere la Figura 1.
- Questa analisi biologica viene preparato in una cappa a flusso laminare. Preparare i materiali: lamelle di vetro triplo risciacquo con 95% EtOH e aria secca, quindi mettere da parte. Tagliare dischi di carta asciugamano al diametro interno di piastre di coltura una cella standard in plastica (9 cm). Posto 2 strati di dischi di carta all'interno di piastre di coltura e inzupparlo con 2 mL SDW.
- Preparare almeno 5 mL di un 1.0 X 105 conidi per mL di sospensione di spore SDW (c. fioriniae) come sopra (passo 1.2-1.4), mettere da parte. Successivamente, mescolare volumi uguali di SDW ed Estratto floreale di base d'acqua in 2 mL microcentrifuga. Quindi, aggiungere un volume uguale di sospensione di spore per la microcentrifuga preparato 2 mL (SDW più FE); la preparazione risultante è denominata una miscela acquosa di trattamento. Per il controllo, omettere la porzione di FE e sostituire con SDW, per mantenere le concentrazioni di conidial coerente.
Nota: dimensione della porzione dipende dal numero di repliche e punti di tempo. In genere, le porzioni non superi 500 µ l. Una volta conidi e FE sono combinati ha iniziato l'analisi biologica, post-inoculazione 0 h. - Posto le lamelle di vetro pre-pulito in cima le salviette di carta bagnato all'interno piastra di coltura delle cellule. Posizionare una goccia di 40 µ l di miscela acquosa trattamento al centro di un vetrino coprioggetti. Ripetere per i trattamenti desiderati, compreso il controllo, chiudere la piastra di coltura delle cellule. Ripetere in piastre di coltura cella separata per le repliche (almeno 3) e intervalli di tempo (ogni piatto è per 1 punto di tempo). Una volta che tutti i trattamenti e le repliche sono stati dispensati, inserire tutte le piastre di coltura cellulare replicati in un contenitore di plastica sigillato (30 x 13 x 7 mm) e incubare a 25° C al buio.
- Agli intervalli di tempo predeterminati, aggiungere 10 µ l di un fissativo come lattofenolo cotone-blu (20,0 g di cristalli di fenolo, 20,0 mL 2,5% acido lattico, glicerolo 40,0 mL, blu di cotone 0,05 g) per le goccioline, fermando la crescita e semi-preservare il Monte.
- Aspettare 2 ore per raccogliere il punto di tempo 0 h come questo permette conidial adesione alla superficie del vetro, ma non è abbastanza lungo per la germinazione conidial. Per tutti gli altri punti di tempo, è possibile aggiungere fissativo in fase corrispondente.
- Una volta che è stato aggiunto un fissativo, attentamente invertire i coprioggetti, mettendoli sul lato goccia giù su un vetrino per microscopio per facilitare l'esame al microscopio (1 vetrino coprioggetto per vetrino). Quando tutte le lamelle sono sui vetrini, lasciare loro di stabilirsi e parzialmente asciugare nella cappa flusso per 20 min.
- Conteggio di tutti i conidi (Totale conidi) presentano sul vetrino coprioggetti (primari conidi, germinati conidi e neonate conidi secondari) come pure di appressoria a entrambi 400 X ingrandimento (contando 16 campi) o 200 X (contando 4 campi), per un totale di un'area di 3,808 mm 2. replicare intera analisi biologica per l'analisi statistica. Per i dosaggi usare Idropittura FE, analizzare dati come descritto nella Waller et al. 201716, in genere visualizzati come media count/mm2 (Totale conidi o appressoria).
8. analisi biologica utilizzando basati su cloroformio floreali estratti (ch-FE)17
Nota: Vedere la Figura 2.
- Preparare i materiali e delle cellule di piastre di coltura come per sopra (passi 7,1). Inoltre, sciacquare un numero uguale di Van Tieghem (VanT. cellule) (8mm OD, ID 6 mm) per vetrini coprioggetti, come pure una pipetta di vetro (1 mL con incrementi di 1 µ l) all'interno di una cappa aspirante, (due volte con il 95% EtOH poi due volte con il cloroformio) e mettere da parte.
- In cappa a flusso laminare, utilizzando un tubo del microcentrifuge 2 mL aggiungere due volumi uguali (almeno 500 porzioni µ l) di SDW e 1 volume di sospensione di spore, quindi mettere da parte. Questa è la miscela acquosa trattamento per analisi biologiche ch-FE.
- In una cappa aspirante, posto un VanT. delle cellule sul vetrino coprioggetti all'interno piastra di coltura preparati cella in plastica. Dispensare (con una pipetta di vetro) 33 µ l di desiderato ch-FE in al centro della cellula T. Van (non toccare le pareti del VanT. Cella; per il trattamento di controllo, aggiungere Vergine cloroformio) e lasciare per asciugare. Ripetere in piastre di coltura cella separata per le repliche (almeno 3).
- Una volta ch-FE ha asciugato, dispensare 99 µ l della miscela preparata trattamento acquosa con una pipetta standard nel centro della VanT. cella, poi Chiudi tutto cellula piastre di coltura. Una volta che la miscela acquosa trattamento ha venuto a contatto con i trattamenti secchi ch-FE, ha iniziato l'analisi biologica, post-inoculazione 0 h.
- Una volta che tutti i trattamenti e le repliche sono stati dispensati, inserire tutte le piastre di coltura di cellule (chiuse) in un contenitore di plastica sigillato (30 x 13 x 7 mm) e incubare a 25° C al buio.
- Agli intervalli di tempo predeterminati, aggiungere 15 µ l di un fissativo (lattofenolo cotone-blu) per il VanT. cellulare e lasciare riposare per almeno 5 min assicurare adeguata colorazione fungine. Dopo quel tempo, rimuovere con cautela il VanT. Cellulari e seguire coprioggetto inversione e dati acquisizione passaggi sopra (passi 7,5-7,6). Per l'analisi dei dati, seguire i metodi descritti nel 2015 Gager17, in genere, come formazione di appressorium, visualizzazione dei dati, che è il rapporto tra totale conidi di appressoria contato nella zona osservata (3,808 mm2).
9. mirtillo basati su fenologia estrazioni17
- Mano raccogliere fiori del mirtillo rosso (nel mese di giugno; 100 g), immaturi di frutta (due volte; Luglio e agosto; 200 g) e maturare frutta mirtillo al momento del raccolto (ottobre; 200 g), posto in sacchetti di plastica dimensioni appropriate e conservare in frigorifero a 4 ° C immediatamente dopo la raccolta. Utilizzare le precauzioni di contaminazione descritte sopra (punto 2.1).
Nota: Ci sarà materiale supplementare pianta raccolti in ogni momento, ma questi importi guardia contro l'estrazione ovviamente fungine ovaie infette e frutta (da sintomi e segni di malattia). - Prima dell'estrazione, rimuovere qualsiasi fiori deteriorati, danneggiati, malati, quindi utilizzando solo sani fiori, rimuovere i sepali, peduncoli, corolle, stigmi, stili e stami con pinzetta (pinzetta 45 °) ed eliminare tutti, ma le ovaie. Una volta che le ovaie sono raccolti, eseguire l'estrazione basata su cloroformio a 1 wt: 9 rapporto di vol (dettagliato in passi 4.2-4.4, usando solo le ovaie). Conservare i campioni fino a quando tutte le altre estrazioni sono complete, cioè fino a conduttanza di analisi biologica.
- Una volta frutta vengono raccolti, esegue un'estrazione basata su cloroformio (passaggi 4.2-4.4, utilizzando frutta raccolti invece di fiori), ma aggiunga 10 g di frutta a 90 mL di cloroformio e una volta estratte, lasciare che la soluzione di evaporare a 9 mL (con conseguente un wt 9 mL 10 g: : soluzione vol).
- Effettuare estrazioni di frutta immediatamente dopo la raccolta in luglio, agosto e ottobre. Memorizzare come per sopra (punto 4.4) fino a quando tutte le estrazioni vengono raccolti. Dopo l'ultima estrazione di cloroformio-base frutta, sottoporre tutti gli estratti di cloroformio basati su Penalogia raccolti per questa analisi all'analisi biologica basati su cloroformio e analizzare conseguenza (punti 8.1-8.6).
Risultati
I risultati presentati qui sono alcuni esempi dei molti saggi che possono essere eseguiti utilizzando questa metodologia. Figura 1 è una guida illustrata all'analisi biologica FE base d'acqua ed è completata dalla Figura 2 che segue all'analisi biologica basati su cloroformio FE. Figura 3 fornisce una guida visiva per quello che può essere previsto sulla valutazione microscopica di c. fioriniae a 24 h, in entrambe le analisi biologiche (controlli rispetto SDW) basati su acqua e cloroformio. Figura 4 dettagli uno studio di corso di tempo di 24 h con c. fioriniae in presenza del mirtillo rosso varietà 'Stevens' ch-FE e dà un riferimento visivo per un risultato di importazione di questa ricerca: FE è diminuito il tempo necessario per formare strutture di infezione rispetto al SDW. Figura 5 fornisce un esempio di dati raccolti da una vetrino coprioggetti analisi biologica utilizzando il deflusso di acqua piovana floreale del mirtillo rosso (CB "Fiore" rw-FE). Figura 6 rappresenta un altro importante risultato: floreale ovaia ch-FE era molto più stimolante di frutta ch-FE, che indica l'importanza di fioritura del ciclo di vita di c. fioriniae. Le foto supplementari e filmati forniscono importanti elementi visivi dei fiori utilizzati nelle floreale dell'acqua piovana raccolta dispositivi/distribuzione, oltre ai film che visualizzano l'attivo e passivo - estrazione (le estrazioni processi basati su acqua).
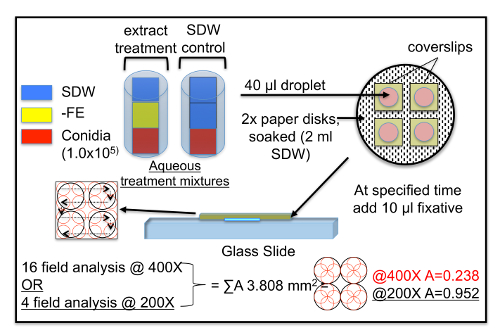
Figura 1 : Panoramica generale della acqua-base floreale estrarre analisi biologica (FE). Questa analisi è stata utilizzata per gli estratti floreali acquatiche con fiori del mirtillo e del mirtillo rosso: active -floreale estratti (attivo-FE), estratti di passivo -floreale (passare-FE) ed il deflusso dell'acqua piovana floreale (rw-FE). Il - FE porzione costituisce in genere il fattore sperimentale/variabile. Al contrario il - FE porzione può rimanere costante e post-inoculazione punti/ore di tempo possa essere valutato. Preferenza è stato fatto verso 4 analisi di campo a 200 ingrandimenti. Abbreviazioni: Acqua deionizzata Sterile, SDW; Superficie per campo di vista, A. Clicca qui per visualizzare una versione più grande di questa figura.
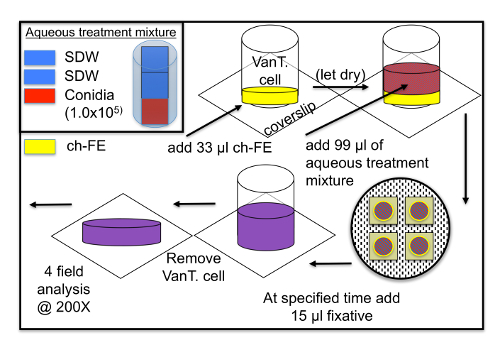
Figura 2 : Panoramica generale di cloroformio-based floreale estrarre analisi biologica (ch-FE). Questa analisi è stata utilizzata per mirtillo e cranberry (fiori, frutta e ovaie). Un solo tipo di miscela acquosa trattamento è stato usato per questo test, sospensione di spore parte 1 di 2 parti SDW (per mantenere la concentrazione conidial coerenti a causa dell'evaporazione ch-FE). Questo test può essere utilizzato per confrontare più ch-FE (cere da varie superfici delle piante), o più tempo punti/ore post-inoculazione utilizzando un singolo ch-FE. Abbreviazioni: Acqua deionizzata Sterile, SDW; Van Tieghem [vetro] cellule, VanT. cella. Clicca qui per visualizzare una versione più grande di questa figura.
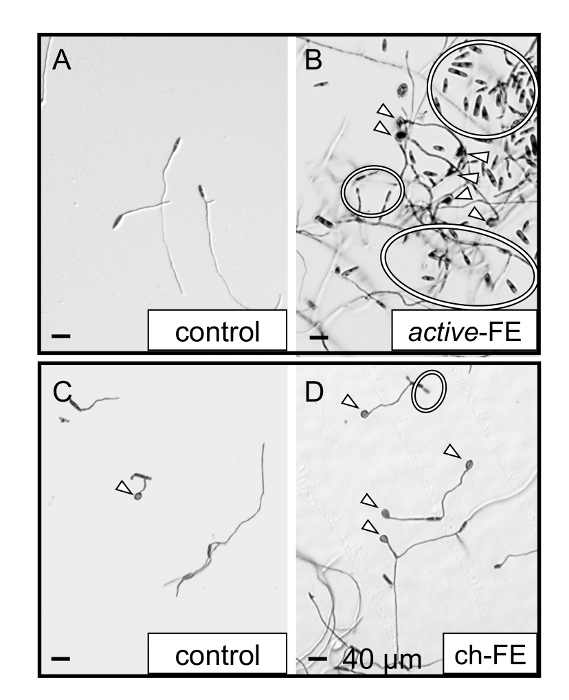
Figura 3 : Confronto visivo del Colletotrichum fioriniae in presenza di acqua-base FE e ch-FE. In questo mirtillo saggio 'Bluecrop' (attivo-FE, base d'acqua) (fungina isolato: BB #10) e mirtillo rosso 'Stevens' basati su cloroformio (ch-FE) (fungina isolato: CB-PMAP182) estratti floreali sono stati confrontati ai comandi SDW. Un drammatico aumento secondario conidiation (anelli) e formazione di appressorium (punte di freccia) sono stati osservati durante il confronto di conidi in presenza di SDW (controllo) (A) per attivo-FE (B) al post-inoculazione 24h. Tuttavia, conidiation secondario non era così evidente quando si confrontano il controllo SDW analisi biologica di cloroformio (C) a ch-FE (D); piuttosto, la crescita di c. fioriniae spostata verso la formazione di appressorial. Mostrato è una risposta comune a ciascun tipo di estrazione acquosa e cloroformio-base, indipendentemente dalla specie ospite/floreale descritta. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 4 : Tempo-corso di studio (24 h) con Colletotrichum fioriniae in presenza di ch-FE. In questo test, un controllo SDW (A-D) e mirtillo rosso 'Stevens' ch-FE (E-F) sono stati ispezionati visivamente a 0, 6, 12 e 24 ore post-inoculazione (un esempio di punti di tempo variabile anziché confrontare più FE). Formazione Appressorium (punte di freccia) ha cominciato a 6 h a ch-FE e costantemente aumentato nel corso di intervalli di tempo successivi. Questo risultati sfugge ad un fattore importante della biologia dell'agente patogeno durante il periodo di fioritura: fiori riducono il tempo necessario per formare strutture di infezione. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 5 : Visualizzazione grafica dei dati raccolti utilizzando rw-FE in un'analisi biologica. Acqua piovana scappano di mirtillo rosso fiori (CB "Fiore" rw-FE) e acqua piovana Vergine che non aveva toccato qualsiasi tessuti di pianta del mirtillo rosso ("Terra" rw-FE) da un singolo evento di bagnatura plus un standard attivo, basato su acqua floreale Estratto di mirtillo rosso (CB attivo -FE) (controllo positivo) e SDW (controllo negativo) sono stati sottoposti ad un'analisi biologica di idropittura vetrino coprioggetti e valutati per la crescita di c. fioriniae . CB "Fiore" rw-FE ha avuto lo stesso livello di formazione secondaria di conidiation e appressorium come la standard CB attivo-FE al post-inoculazione di 24 h, che indica che i dispositivi di raccolta erano efficaci nel catturare floreali stimolanti rilasciati durante un bagnante-evento. Conidi totale è composto di primario (depositato), conidi e neonate conidi secondari. Le lettere indicano differenze significative a p < 0,05 secondo almeno differenza significativa di Fischer prova (LSD); maiuscole, totale conidi; minuscolo, appressoria. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 6 : Analisi biologica di mirtillo fenologia basato ch-FE, ispezione visiva. Gestione della malattia per frutta funghi di decomposizione spesso coinvolge applicazioni fungicida in fase di fioritura. Qui, mirtillo estratti basati su cloroformio (ch-FE) da più fasi di crescita di cranberry ('Stevens') sono stati valutati visivamente per l'effetto delle cere superficiali su c. fioriniae al post-inoculazione 24h. Ovaie raccolti nel mese di giugno (A), frutto immaturo raccolti in luglio e agosto (B, C), la frutta raccolta raccolti nel mese di ottobre (D), e un controllo SDW (E) sono stati ispezionati per la formazione di appressorial (punte di freccia). Ovaia ch-FE aveva la grandezza massima di formazione appressorial, indicando che questa pianta fenologia (bloom) è estremamente importante per il ciclo di vita di c. fioriniae. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare figura 1: infiorescenza mirtillo. Fiori del mirtillo sono stati raccolti per le estrazioni durante la piena fioritura (aprile-maggio in New Jersey, Stati Uniti d'America) (mostrate 'Bluecrop'). Si noti la sovrapposizione delle corolle/ovaie da fiori adiacente e l'architettura complessiva dell'infiorescenza rispetto ai supplementari figura 2 (mirtillo in posizione verticale). Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare nella figura 2: mirtillo rosso montante. Fiori del mirtillo rosso sono stati raccolti per le estrazioni durante la piena fioritura (giugno-luglio nel New Jersey, Stati Uniti d'America) (mostrate 'Stevens'). Nota le fasi del fiore varia su una singola infiorescenza di mirtillo rosso (verticale) e l'uncinato, goccia d'acqua mantenendo la forma della corolla. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare nella figura 3: distribuzione di acqua piovana mirtillo (fiore). Completato il dispositivo di raccolta di acqua piovana floreale mirtillo, posizionato direttamente sotto un cluster delle infiorescenze. Nota il filo rivestito di plastica utilizzato per orientare verticalmente il dispositivo. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare figura 4: distribuzione di acqua piovana mirtillo (stelo). Dispositivo di raccolta acqua piovana floreale completato mirtillo collocato a metà strada verso il basso lo stelo tra un'infiorescenza e la corona del bush. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare nella figura 5: distribuzione di acqua piovana mirtillo (corona). Completato il dispositivo di raccolta di acqua piovana floreale di mirtillo, posizionato alla base del bush (corona). Nota fili ricoperti in plastica possono essere rimosso se non necessario. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare figura 6: distribuzione di acqua piovana mirtillo (terra). Completato il dispositivo di raccolta di acqua piovana Vergine, piazzato accanto a cespugli di mirtilli. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare nella figura 7: distribuzione di acqua piovana del mirtillo rosso (primo piano). Completato dispositivo di raccolta di acqua piovana floreale del mirtillo rosso, con due montanti nascosti sotto i legami di cavo incrociato ordinatamente. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare figura 8: distribuzione di acqua piovana Cranberry. Multiplo completato dispositivi di mirtillo rosso floreale dell'acqua piovana distribuiti in una palude. Clicca qui per visualizzare una versione più grande di questa figura.

Supplementare Movie 1: attivi a base di acqua, estratti floreali (attivo -FE). Supporto video supplementare come segue: 2.3-2.5.1. Fiori di 'Bluecrop' del mirtillo sono stati usati. Per favore clicca qui per vedere questo video. (Tasto destro per scaricare.)

Supplementare Movie 2: passiva, estratti floreali acquatiche (passare-FE). Supporto dei video supplementari seguenti passaggi 3.3-3.4. Fiori di 'Bluecrop' del mirtillo sono stati usati. Per favore clicca qui per vedere questo video. (Tasto destro per scaricare.)

Supplementare Movie 3: distribuzione di dispositivi di raccolta di acqua piovana floreale del mirtillo rosso. Supporto video supplementare seguendo passo 6.4. Per favore clicca qui per vedere questo video. (Tasto destro per scaricare.)
Discussione
Le analisi biologiche rilevare la risposta di c. fioriniae agli estratti floreali (FEs) sono state sviluppate per i frutti di mirtillo e cranberry rot pathosystems ma possono essere facilmente adattate ad altre colture orticole. Il protocollo di cui sopraelencato è stato prezioso nell'acquisizione di molti insiemi di dati importanti tra cui, ma non limitato a: FE effetti su più isolati di numerosi agenti patogeni, corso di tempo informazioni relative alle fasi di crescita fungina in presenza di vari FEs, confronto di tecniche di estrazione, ispezione di singole sostanze chimiche fioriniae c. crescita e differenziamento, valutazione dell'organo di fiori singoli estratti, effetti della temperatura sulla c. fioriniae , mentre in presenza di FE, effetti di estrazioni di cera dipendente fenologia ed effetti floreali dell'acqua piovana. Attraverso l'utilizzo di queste tecniche, dati generati hanno anche fornito una comprensione più chiara della vita di c. fioriniae fasi e delucida parzialmente perché il periodo di fioritura è così importante per il controllo di frutta molti agenti patogeni di decomposizione.
Inizialmente, tutti i fiori sono stati elaborati in modo identico per l' attiva-FE, ma il processo di estrazione è spostata verso l'utilizzo di fiori interi. Dissezione floreale era molto tempo e ha avuto poco effetto sulla bioattività del FEs risultante. Tuttavia, singoli organi floreali possono e sono stati valutati utilizzando questo protocollo, ma grande cura deve essere preso non completamente macerare i tessuti floreali (Supplemental Movie 1, con precauzioni dettagliate al punto 2.3), come questo può provocare rilasciato funghi tossici/statico composti in FE che potrebbe falsare la valutazione microscopica. Meno invasive estrazioni come pass -FE (Supplemental Movie 2) e rw-FE sono ora più favorevole grazie alla loro facilità di acquisizione. Inoltre, queste tecniche di estrazione richiedono solo di filtrazione sotto vuoto per acquisire biologicamente attivi floreale segnali chimici.
I fiori utilizzati in tutte le estrazioni in genere erano refrigerati per 0-3 giorni prima della preparazione di estratto. Una sfida di questo protocollo è la gestione del tempo del fatturato di FE (raccolta di campi attraverso deposito di estratti). Ciò è stata esacerbata da numerosi campioni da più fonti e date. Fiori congelati non sono stati valutati in qualsiasi misura reale, come fiori scongelati appaiono deteriorata e scolorita. Tuttavia, una volta che la FEs a base d'acqua sono stati preparati, ripetuti di congelamento e scongelamento non ha mostrato alcun effetto sulla bioattività del FE, così a lungo come il FE sono ricongelati rapidamente dopo la preparazione di analisi biologica (valida 3 anni FE).
Cloroformio-basato estrazione consente l'indagine delle risposte di agente patogeno per il cere superficie tridimensionale floreale e frutta in un piano bidimensionale tramite evaporazione ch-FE su vetrini coprioggetti. Tuttavia, è improbabile che le strutture cristalline effettive delle cere depositati da ch-FE sono identiche alla superficie da cui sono stati raccolti. Tecniche-significate, supplementare devono essere implementate se fungina risposta a cera specifiche strutture in vivo è l'obiettivo principale di indagine. Basato su cloroformio estratti bisogno più deposito manutenzione rispetto le estrazioni a base d'acqua. Oltre a mantenere il ch-FE estratti nel buio, la coltura delle cellule PTFE rivestito tube tappi e parafilm tenuta involucro c'è bisogno di essere controllato regolarmente per perdite per evaporazione e sostituiti se necessario.
Il concetto di monitoraggio deflusso di acqua piovana floreale è radicato nell'idea di far avanzare gli strumenti di monitoraggio di malattia site-specific. I dispositivi di raccolta dell'acqua piovana possono essere adattati a molte altre architetture di pianta, fintanto che cattura il dispositivo di raccolta dell'acqua piovana che ha eseguito fuori di fiori. Questo approccio fornisce informazioni su o meno stimolazione floreale è presente nel campo in qualsiasi momento e può essere monitorata per tutta la stagione. In alternativa, dispositivi di raccolta possono essere distribuiti su più postazioni di baldacchino per determinare quanto lontano spunti floreali sono stati lavati durante qualsiasi dato bagnante-evento. In futuro gli esperimenti, rw-FE detterà quando applicazioni fungicida devono iniziare e quando possono tranquillamente finire. Inoltre, monitorando le estrazioni di cera dipendente fenologia (protocollo sezione 9), l'importanza del periodo di fioritura alla biologia dell'agente patogeno è diventato ancora più evidente. Tale sezione è stata anche inclusa per dimostrare la flessibilità di queste analisi biologiche, fornendo i metodi che consentono il confronto side-by-side di cere di superficie di host che sono temporaneamente separati. I dati generati utilizzando le tecniche di estrazione floreale e analisi biologiche rappresentano indicatori tangibili di stimolazione dell'agente patogeno, specifiche classi chimiche importante patogeno biologia e strategie di controllo futuro.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il William S. Haines, Sr. dotato Cranberry Research Fund e il New Jersey mirtillo e Cranberry Research Council, Inc., per il supporto. Ringraziamo anche Jennifer Vaiciunas (orientamento e preparazioni floreali), Christine Constantelos (coltura fungosa e preparazioni floreali), David Jones (estrazioni e preparazioni floreali), Langley Oudemans (preparazioni floreali, le riprese e la fotografia), Jesse Lynch (preparazioni floreali), Roxanne Tumnalis (supporto generale) e numerosi studenti/estate stagisti.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm pore size, acetate sterilizing filter | VWR | 101102-280 | Blueberry floral extract (FE) clarification |
| 200-1000 µl pipette with tips | - | - | Equipment, any make within range will be adequate |
| 40-200 µl pipette with tips | - | - | Equipment, any make within range will be adequate |
| 5-40 µl pipette with tips | - | - | Equipment, any make within range will be adequate |
| Air spray gun disposable paint spray cup with connection adapter | Harbor Freight | 97098 | Blueberry rainwater (rw-)FE collection |
| Autoclave | Amsco | 3011 | Equipment, media preparation |
| Bar mesh matting (plastic mesh sheet) | Winco | BL-240 | Passive (pass)-FE collection |
| Benchtop timer | Fisher Scientific | 06-662-47 | Equipment, FE preparation |
| Black pressure/vacuum hose | VWR | 62994-795 | Vacuum filter component |
| Buchner funnel | Coors USA | 60240 | Vacuum filter component, accepts 55 mm filter paper disks |
| Bunsen burner | - | - | Equipment |
| Calcium carbonate | Fisher Scientific | C64-500 | Media component |
| Centrifuge | Sorvall | RC 5B Plus | Equipment |
| Centrifuge tubes (15 ml) | Fisher Scientific | 05-527-90 | Equipment |
| Centrifuge tubes (50 ml) | VWR | 10025-694 | Equipment, rw-FE collection |
| Cheesecloth (grade 50) | Fisher Scientific | AS240 | Equipment, FE preparation |
| Chloroform | VWR | JT9175-3 | Chemical, trichloromethane: assay grade, ≥ 99% pure, for molecular biology, peroxide-free |
| Corn Meal Agar (CMA) | Fisher Scientific | B11132 | Pre-mix media, isolate storage on slants |
| Cotton-blue stain | Sigma-Aldrich | 61335 | Lactophenol cotton-blue stain |
| Difco Agar | VWR | 90004-032 | Media component |
| Drill-press | Delta | - | Equipment, rw-FE collection |
| EASYpure LF Ultrapure water | Barnstead | D738 | Equipment, deionized water source |
| Ethanol (95%) | - | - | Chemical |
| Filter flask (500 ml) | Pyrex | No. 5340 | Vacuum filter component |
| Fume hood | Hamilton | - | Equipment, chloroform usage |
| Funnel (7 X 7 cm) | VWR | 60820-110 | Cranberry rw-FE collection, FE preparation |
| Generic glass slide | Fisher Scientific | 22-038-101 | Bioassay conductance |
| Generic plastic pump spray bottle | VWR | 16126-454 | pass-FE collection, at least 250 ml capacity |
| Glass cell culture tubes | - | - | Storage of ch-FE |
| Glass coverslips (22 x 22 mm) | Fisher Scientific | 12-542B | Bioassay conductance |
| Glass Van Tieghem cells (hand cut glass tubes) | - | - | Chloroform (ch)-FE bioassay, (8 mm OD 6 mm ID) |
| Glass-pipette (1-100 µl) | Hamilton Co. Inc. | #710 | ch-FE bioassay |
| Glycerol | Sigma-Aldrich | G5516 | Lactophenol cotton-blue stain |
| Hemocytometer | Bright-Line | 5971R10 | Equipment |
| Lactic acid | Sigma-Aldrich | W261106 | Lactophenol cotton-blue stain |
| Laminar flow hood | Labconco | 3730400 | Equipment, sterile work environment |
| Metal probe (generic) | - | - | Equipment |
| Microcentrifuge tubes (2 ml) | Fisher Scientific | 05-408-138 | Aqueous treatment mixture storage and preparation |
| Microscope, Leica DMLB | Leica | 020-519.010 | Equipment |
| Mortar (ceramic) | Coors USA | 60313 | Vacuum filter component |
| Nitrile gloves | Fisher Scientific | 19-130-1597D | Flower collection |
| Paper disks (cut paper towels) | Office Basics | KCC01510 | humidity control in bioassay |
| Parafilm | Bemis | PM-996 | Plastic paraffin film |
| Pestle (ceramic) | Coors USA | 60314 | Vacuum filter component |
| Phenol crystals | Fisher Scientific | A92-100 | Lactophenol cotton-blue stain |
| Plastic bags (~100 mm X 152 mm) | Uline | S1294 | Equipment, flower refrigeration |
| Plastic cell culture dishes (9 cm diameter) | Fisher Scientific | FB0875712 | (Petri dish), bioassay conductance |
| Polytetrafluoroethylene (PTFE) lined caps | VWR | 60927-228 | Storage of ch-FE |
| Pyrex beakers (100 ml) | Pyrex | No. 1000 | Preparation of ch-FE |
| Pyrex bread-pan | - | - | pass-FE collection |
| Pyrex graduated cylinder | - | - | Equipment, FE preparation |
| Sealed plastic container (30 mm X 13 mm X 7 mm) | - | - | Bioassay conductance |
| Sharp-pointed dissecting scissors | Fisher Scientific | 8940 | Equipment, to cut cheese-cloth and paper disks |
| Stainless steel mesh strainer | VWR | 470149-756 | Preparation of ch-FE |
| Step drill bit (step-bit) | Dewalt | - | Equipment, rw-FE collection |
| Sterile loop (combi-loop) | Fisher Scientific | 22-363-602 | Culture preparation |
| Telephone wire (internal wires) | - | - | Blueberry rw-FE collection |
| Test tube basket | VWR | 470137-792 | Readily available substitution for plastic mesh [strawberry] basket |
| V8 Juice | Campbell's Soup Company | - | Fungal media component |
| Vintage plastic mesh [strawberry] baskets | Donation | - | pass-FE collection, can substitute for test tube basket (470137-792) |
| Vortex Genie (Vortex) | Fisher Scientific | 12-812 | Spore suspension preparation |
| Whatman No. 1 Qualitative 55 mm circles | Whatman | 1001-055 | Vacuum filter component |
| White plastic twist ties (100 mm) | Uline | S-566W | Cranberry rw-FE collection |
Riferimenti
- Pszczółkowska, A., Okorski, A. First report of anthracnose disease caused by Colletotrichum fioriniae on blueberry in western Poland. Plant Disease. 100, 2167 (2016).
- Oudemans, P. V., Caruso, F. L., Stretch, A. W. Cranberry fruit rot in the northeast: a complex disease. Plant Disease. 82, 1176-1184 (1998).
- Damm, U., Cannon, P. F., Woudenberg, J. H. C., Crous, P. W. The Colletotrichum acutatum species complex. Studies in Mycology. 73, 37-113 (2012).
- Marcelino, J., Giordano, R., Gouli, S., Gouli, V., Parker, B. L., Skinner, M., TeBeest, D., Cesnik, R. Colletotrichum acutatum var. fioriniae (teleomorph: Glomerella acutata var. flioriniae var. nov.) infection of a scale insect. Mycologia. 100, 353-374 (2008).
- Pennycook, S. R. Colletotrichum fioriniae comb. & stat. nov., resolving a nomenclatural muddle. Mycotaxon. 132, 149-154 (2017).
- Shivas, R. G., Tan, Y. P. A taxonomic re-assessment of Colletotrichum acutatum, introducing C. fioriniae comb. et stat. nov and C. simmondsii sp nov. Fungal Diversity. 39, 111-122 (2009).
- Wharton, P. S., Diéguez-Uribeondo, J. The biology of Colletotrichum acutatum. Anales del Jardín Botánico de Madrid. 61, 3-22 (2004).
- Prusky, D., Alkan, N., Mengiste, T., Fluhr, R. Quiescent and necrotrophic lifestyle choice during postharvest disease development. Annual Review of Phytopathology. 51, 155-176 (2013).
- Milholland, R. D. . Compendium of Blueberry and Cranberry Diseases. , (1995).
- DeMarsay, A. . Anthracnose fruit rot of highbush blueberry: biology and epidemiology. , (2005).
- Madden, L. V., Yang, X. S., Wilson, L. L. Effects of rain intensity on splash dispersal of Colletotrichum acutatum. Phytopathology. 86, 864-874 (1996).
- Yang, X., Madden, L. V., Wilson, L. L., Ellis, M. A. Effects of surface-topography and rain intensity on splash dispersal of Colletotrichum acutatum. Phytopathology. 80, 1115-1120 (1990).
- Wharton, P. S., Dickman, J. S., Schilder, A. M. C. Timing of spore release by Colletotrichum acutatum in Michigan blueberry fields. Phytopathology. 92, 86 (2002).
- MacKenzie, S. J., Peres, N. A., Timmer, L. W. Colonization of citrus leaves and secondary conidiation response to citrus flower extracts by non-postbloom fruit drop strains of Colletotrichum acutatum. Tropical Plant Pathology. 35, 333-342 (2010).
- Leandro, L. F. S., Gleason, M. L., Nutter, F. W., Wegulo, S. N., Dixon, P. M. Strawberry plant extracts stimulate secondary conidiation by Colletotrichum acutatum on symptomless leaves. Phytopathology. 93, 1285-1291 (2003).
- Waller, T. J., Vaiciunas, J., Constantelos, C., Oudemans, P. V. Evidence the blueberry floral extracts influence secondary conidiation and appressorial formation of Colletotrichum fioriniae. Phytopathology. 108, 561-567 (2017).
- Gager, J. . The influence of cranberry floral wax on appressorium formation in Colletotrichum fioriniae. , (2015).
- Podila, G. K., Rogers, L. M., Kolattukudy, P. E. Chemical signals from avocado surface wax trigger germination and appressorium formation in Colletotrichum gloeosporioides. Plant Physiology. 103, 267-272 (1993).
- Polashock, J. J., Caruso, F. L., Oudemans, P. V., McManus, P. S., Crouch, J. A. The North American cranberry fruit rot fungal community: a systematic overview using morphological and phylogenetic affinities. Plant Pathology. 58, 1116-1127 (2009).
- Miller, P. M. V-8 juice agar as a general purpose medium for fungi and bacteria. Phytopathology. 45, 461-462 (1955).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon