Method Article
Modifica dei metodi di trattamento per la sindrome dell'uistitì da deperimento con acido tranexamico e misure di supporto
In questo articolo
Riepilogo
Qui, descriviamo i metodi di trattamento modificati per la sindrome dell'uistitì da deperimento (WMS, nota anche come malattia infiammatoria intestinale (IBD) simile) con acido tranexamico. Presentiamo anche come somministrare gli agenti terapeutici per via orale, sottocutanea ed endovenosa.
Abstract
La sindrome dell'uistitì deperito (WMS), una malattia grave nelle colonie di uistitì comune (Callithrix jacchus) in cattività, è associata a un alto tasso di mortalità. La causa specifica della WMS non è ancora chiara e ci sono pochi trattamenti efficaci. In precedenza, avevamo segnalato una terapia con acido tranexamico con misure di supporto come trattamento utile per la WMS. Nel presente studio, descriviamo il metodo modificato: una combinazione di 0,1 ml di acido tranexamico al 5% per via sottocutanea cinque volte a settimana, 2,0 ml di formulazione di aminoacidi per via endovenosa tre volte a settimana, 5,0 ml di lattato di Ringer con 0,1 ml di una formulazione vitaminica per via sottocutanea tre volte a settimana e somministrazione orale di 0,1 ml di una formulazione di ferro cinque volte a settimana. Descriviamo anche come somministrare la soluzione per via endovenosa attraverso la vena safena con una punta di contenimento dell'animale, nonché i metodi dettagliati per la somministrazione orale e sottocutanea. I metodi modificati hanno un'efficienza paragonabile al metodo di trattamento WMS originale.
Introduzione
La sindrome dell'uistitì deperito (WMS) è una malattia grave che colpisce le colonie di uistitì comuni in cattività. I sintomi principali sono perdita di peso, diminuzione della massa muscolare, anemia, ipoalbuminemia ed enterite cronica 1,2,3,4. Alcuni studi hanno riportato che il 60,5% degli uistitì in cattività soppressi presentava evidenza di enterite cronica5 e il 31-44% dei decessi riguardava questa malattia6. L'elevata prevalenza di questa malattia ha reso necessario un trattamento efficace.
Nel 2016, abbiamo riportato che l'acido tranexamico con misure di supporto era un trattamento efficace per la WMS7. Inoltre, la perdita di proteine intestinali degli uistitì affetti da WMS è stata significativamente attenuata con questo trattamento8. Sebbene il protocollo di trattamento originale fosse decisamente efficace, includeva un volume piuttosto elevato di iniezione endovenosa, un'alta dose di formulazione vitaminica e una contenzione quotidiana. Poiché gli uistitì sono suscettibili alla cattura e alla contenzione delle mani, queste azioni devono essere meno frequenti. Pertanto, abbiamo mirato a ridurre il carico pesante per gli animali con alcune modifiche.
Nel presente articolo, forniremo i metodi modificati: iniezione sottocutanea di acido tranexamico non diluito 5 volte a settimana (invece dell'iniezione intraperitoneale di una soluzione di acido tranexamico diluita 5 volte 7 volte a settimana), 2,0 ml di formulazione di aminoacidi per iniezione endovenosa (invece di 3,0 ml), 0,1 ml di formulazione vitaminica per iniezione sottocutanea (invece di 0,5 ml), e somministrazione orale di formulazione di ferro 5 volte a settimana (invece di 7 volte a settimana).
Protocollo
Il presente studio è stato condotto con l'approvazione (W2023-2-041) del Comitato per gli esperimenti sugli animali di RIKEN (Saitama, Giappone) ed è stato condotto in conformità con le linee guida istituzionali per gli esperimenti con gli animali. Nel presente studio sono state utilizzate sei femmine di uistitì (2-6 anni).
1. Criteri per l'inizio del trattamento
- Iniziare il trattamento quando si osserva uno dei seguenti criteri: i) peso corporeo < 300 g o una diminuzione di >20 g del peso corporeo al mese; ii) ipoalbuminemia (albumina sierica < 3,8 g/dL); iii) anemia (ematocrito < 35%); iv) diarrea cronica senza Clostridium difficile, Escherichia coli enteropatogeno o protozoi intestinali; e v) un'apparente diminuzione della massa muscolare.
NOTA: A causa della disidratazione e della successiva emoconcentrazione accompagnata da WMS, i valori di albumina sierica ed ematocrito possono essere artificialmente elevati negli animali colpiti.
2. Somministrazione orale
- Mescolare 0,1 mL della formulazione di ferro (vedere la Tabella dei materiali) con un pezzo di pan di spagna.
- Dare il mosto all'uistitì trattato.
NOTA: Assicurarsi che l'uistitì trattata abbia completamente ingoiato il mosto.
3. Somministrazione sottocutanea
- Cattura l'uistitì affetto da WMS nella gabbia di casa tenendo delicatamente la coda.
- Tieni la parte superiore del corpo dell'animale da dietro con l'altra mano.
- Porta l'animale nella sala di trattamento.
- Lascia che l'animale si aggrappi al petto o al braccio dell'assistente.
- Pulisci l'area della schiena dell'animale con un tampone imbevuto di alcol.
- Iniettare 0,1 mL di acido tranexamico (soluzione al 5%, vedere la Tabella dei Materiali) nella parte posteriore per via sottocutanea utilizzando un ago da 26 G 5 volte alla settimana.
- Iniettare 5,0 mL di lattato di Ringer (vedere la Tabella dei Materiali) con 0,1 mL di una formulazione vitaminica (vedere la Tabella dei Materiali) per via sottocutanea utilizzando un ago da 26 G 3 volte alla settimana.
NOTA: Ogni iniezione deve essere eseguita in ogni punto diverso entro 1 minuto.
4. Somministrazione endovenosa di formulazione di aminoacidi
- Cattura l'uistitì affetto da WMS nella gabbia di casa tenendo delicatamente la coda.
- Tieni la parte superiore del corpo dell'animale da dietro con l'altra mano.
- Porta l'animale nella sala di trattamento.
- Chiedi all'assistente di trattenere la parte superiore del corpo dell'animale tenendo la base di entrambe le braccia e di trattenere la parte inferiore del corpo tenendo la base di entrambe le gambe con l'altra mano. Chiedi all'assistente di posizionare il pollice che trattiene la parte inferiore del corpo dell'animale sul lato anteriore del ginocchio dell'animale per evitare che si pieghi.
- Pulisci il vitello dell'animale con un tampone imbevuto di alcol.
- Iniettare 2,0 mL della formulazione di aminoacidi (vedere la Tabella dei materiali) per via endovenosa attraverso la vena safena utilizzando un ago a farfalla da 27 G tre volte alla settimana.
NOTA: L'iniezione deve essere eseguita il più lentamente possibile fino a 2 minuti. - Dopo l'iniezione, chiedere all'assistente di premere l'area con del cotone idrofilo fino a quando l'emorragia non si ferma.
5. Misurazione del peso corporeo
- Dopo il trattamento (iniezione endovenosa e/o sottocutanea), pesare l'animale con una scatola di trasporto una volta alla settimana per monitorare il peso corporeo.
NOTA: Pesare l'uistitì all'incirca alla stessa ora perché il peso corporeo è influenzato dalla presenza di cibo.
6. Analisi emocromocitometrica completa (CBC) e test chimici del siero
- Cattura l'uistitì affetto da WMS nella gabbia di casa tenendo delicatamente la coda.
- Tieni la parte superiore del corpo dell'animale da dietro con l'altra mano.
- Porta l'animale nella sala di trattamento.
- Chiedi all'assistente di trattenere la parte superiore del corpo dell'animale tenendo la base di entrambe le braccia e di trattenere la parte inferiore del corpo tenendo la base di entrambe le gambe con l'altra mano.
- Chiedi al praticante di tenere la zampa dell'animale che non è trattenuta.
- Pulisci la regione inguinale dell'animale con un tampone imbevuto di alcol.
- Raccogliere 0,4 ml di sangue dalla vena femorale utilizzando un ago da 26 G al mese.
- Utilizzare 0,05 ml di campione di sangue per l'analisi dell'emocromo, compreso l'ematocrito.
- Lasciare riposare il resto del campione di sangue per 1 ora a temperatura ambiente e centrifugare a 1.800 × g per 20 minuti.
- Utilizzare il siero per i test chimici, compresa l'albumina.
NOTA: Il volume del campione di sangue può essere ridotto riducendo al minimo il numero di parametri per il test chimico del siero. Regolare il volume del campione di sangue in base alle condizioni del singolo uistitì.
Risultati
I metodi di trattamento modificati hanno portato a un aumento dell'ematocrito (Figura 1A), dell'albumina sierica (Figura 1B) e del peso corporeo (Figura 1C) negli uistitì affetti da WMS. Differenze significative nell'ematocrito (P < 0,05, test di rango con segno a coppie abbinate di Wilcoxon), albumina sierica (P < 0,05, test di rango con segno a coppie abbinate di Wilcoxon) e peso corporeo (P < 0,05, test di rango con segno a coppie abbinate di Wilcoxon) sono state osservate tra pre e post trattamento.
Sono stati osservati anche gli effetti del trattamento sull'aspetto. La Figura 2 mostra l'aspetto di un uistitì affetto da WMS. Prima del trattamento, sono stati osservati tabefazione, dorso arcuato, pelo ruvido (Figura 2A) e alopecia (Figura 2B), mentre non è stato osservato alcun aspetto anomalo dopo il trattamento (Figura 2C, D).
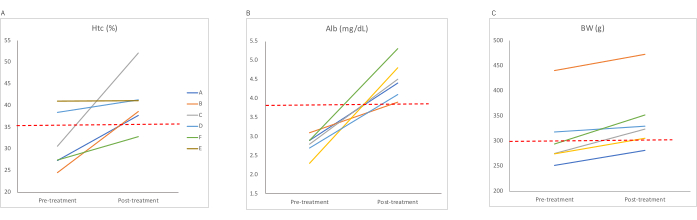
Figura 1: Variazioni (pre vs post trattamento) dell'ematocrito, dell'albumina sierica e del peso corporeo in un uistitì che riceve il trattamento modificato. (A) valori di ematocrito, (B) valori di albumina sierica e (C) peso corporeo. Le linee tratteggiate indicano i valori dei criteri. Abbreviazioni: Htc = ematocrito; Alb = albumina sierica; BW = peso corporeo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Aspetto rappresentativo dell'uistitì affetto da WMS. (A) Aspetto dell'animale pretrattamento: si osservano tabefazione, dorso arcuato e pelo ruvido. (B) Coda dell'animale pretrattato: si osserva alopecia. (C) Aspetto dell'animale dopo il trattamento. (D) Coda dell'animale post-trattamento. Abbreviazione: WMS = sindrome dell'uistitì deperibile. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Nel 2016, abbiamo riportato che l'acido tranexamico con misure di supporto era un trattamento efficace per la WMS, che è stato il primo rapporto a dimostrare la terapia con WMS senza l'uso di glucocorticoidi. Nell'uomo, i glucocorticoidi sono considerati il trattamento più efficace dell'IBD. Tuttavia, il predonizolone, uno dei glucocorticoidi più comunemente usati, non è adatto per il trattamento WMS a causa dei suoi effetti avversi. Sebbene la budesonide, un glucocorticoide, sia stata segnalata per il trattamento WMS9, la terapia è risultata relativamente inefficace negli animali con forme acute di WMS. L'acido tranexamico è un inibitore della plasmina che ha effetti antinfiammatori e non sono stati osservati effetti collaterali degni di nota nei nostri metodi originali. Tuttavia, sebbene il protocollo di trattamento originale fosse decisamente efficace, imponeva un carico pesante per gli animali e chi si prende cura di loro.
Nel presente studio, i metodi di trattamento modificati per la WMS sono stati condotti per ridurre sia il carico fisiologico dell'animale che il carico di lavoro degli assistenti. Nei metodi modificati, la via di somministrazione dell'acido tranexamico è stata modificata (da intraperitoneale a sottocutanea), il che ha contribuito a ridurre il rischio di lesioni agli organi addominali. La soluzione di acido tranexamico non è stata diluita in questo protocollo per ridurre il rischio di contaminazione e il tempo di preparazione. Nei metodi originali, 3,0 ml della formulazione di aminoacidi sono stati iniettati per via endovenosa. Tuttavia, il volume era piuttosto elevato perché si consiglia di somministrare 5,0 ml/kg in bolo10. Pertanto, il volume è stato ridotto nei metodi modificati.
La formulazione vitaminica utilizzata in questo protocollo contiene vitamine B e C. Nel metodo originale, 0,5 ml della formulazione vitaminica contengono 2,5 mg di cloruro di tiamina cloridrato, che era 2,5 volte il fabbisogno dei primati non umani post-svezzamento11. Nel presente metodo, sono stati somministrati 0,1 ml della formulazione vitaminica, che contiene 1,0 mg di cloruro di tiamina cloridrato. La frequenza di somministrazione della formulazione di ferro e della soluzione di acido tranexamico è stata ridotta nei metodi modificati, il che ha contribuito alla riduzione del carico per gli animali e per chi si prende cura di loro.
Come scritto nella sezione Risultati rappresentativi, ci sono stati effetti significativi del trattamento nei metodi modificati. La durata media del trattamento è stata di 37,8 ± 25,34 giorni, più breve di quella dei metodi originali (56 giorni). Poiché gli uistitì sono sensibili allo stress mentale, i trattamenti prolungati hanno l'effetto opposto sull'animale, come la riduzione dell'appetito. Pertanto, raccomandiamo che i caregiver decidano in modo completo i tempi di terminazione del trattamento in base non solo al valore di ciascun parametro, ma anche al comportamento dell'animale.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questa ricerca è stata parzialmente sostenuta dall'Agenzia giapponese per la ricerca e lo sviluppo medico (AMED) nell'ambito del progetto Brain Mapping by Integrated Neurotechnologies for Disease Studies (Brain/MINDS) (numero di sovvenzione JP23dm0207001).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.0 mL Syringe | Terumo Corporation, Tokyo, Japan | SS-01T | For subcutaneously injection of Tranexamic acid |
| 10 mL Syringe | Terumo Corporation, Tokyo, Japan | SS-10SZ | For Intravenous Administration of Amino acid formulation |
| 26 G Needle | Terumo Corporation, Tokyo, Japan | NN-2613S | For subcutaneously injection |
| 27 G Butterfly Needle Type D | Terumo Corporation, Tokyo, Japan | SV-27DL | For Intravenous Administration of Amino acid formulation |
| 5 mL Syringe | Terumo Corporation, Tokyo, Japan | SS-05SZ | For subcutaneously injection of Ringer's lactate and Vitamin formulation |
| Aminoleban Injection | Otsuka Pharma Factory Inc., Tokyo, Japan | 1942 | For subcutaneously injection of Ringer's lactate and Vitamin formulation |
| C-PARA | Takata Pharma Co., Ltd., Saitama, Japan | 120-31960-0 | Vitamin formulation |
| FCV Liquid | Minerva Corporation, Saitama, Japan | Iron formulation | |
| Lactec Injection | Otsuka Pharma Factory Inc., Tokyo, Japan | 0714 | Ringer’s lactate |
| Vasolamin Injection | Meiji Seika Pharma Co., Ltd., Tokyo, Japan | DBASOS | Tranexamic acid |
Riferimenti
- Baxter, V. K., et al. Serum albumin and body weight as biomarkers for the antemortem identification of bone and gastrointestinal disease in the common marmoset. PLoS ONE. 8 (12), e82747(2013).
- Brack, M., Rothe, H. Chronic tubulointerstitial nephritis and wasting disease in marmosets (Callithrix jacchus). Vet Pathol. 18, Suppl 6 45-54 (1981).
- Chalifoux, L. V., Bronson, R. T., Escajadillo, A., McKenna, S. An analysis of the association of gastroenteric lesions with chronic wasting syndrome of marmosets. Vet Pathol Suppl. 7, 141-162 (1982).
- Logan, A. C., Khan, K. N. Clinical pathologic changes in two marmosets with wasting syndrome. Toxicol Pathol. 24 (6), 707-709 (1996).
- Ludlage, E., Mansfield, K. Clinical care and diseases of the common marmoset (Callithrix jacchus). Comp Med. 53 (4), 369-382 (2003).
- Ross, C. N., Davis, K., Dobek, G., Tardif, S. D. Aging phenotypes of common marmosets (Callithrix jacchus). J Aging Res. 2012, 567143(2012).
- Yoshimoto, T., Niimi, K., Takahashi, E. Curative effects of tranexamic acid with supportive measures on wasting marmoset syndrome. Comp Med. 66 (6), 1-6 (2016).
- Niimi, K., et al. Measurement of the α1-proteinase inhibitor (α1-antitrypsin) of common marmoset and intestinal protein loss in wasting syndrome. Biosci Rep. 39 (7), 20190562(2019).
- Otovic, P., Smith, S., Hutchinson, E. The use of glucocorticoids in marmoset wasting syndrome. J Med Primatol. 44 (2), 53-59 (2015).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Lewis, S. M., Hotchkiss, C. E., Ullrey, D. E. Chapter 13. Nutrition and nutritional diseases. The Laboratory Primates. Wolfe-Coote, S. , 181-208 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon