Prelievo di sangue I
Panoramica
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Università di Notre Dame, IN
La raccolta del sangue è un requisito comune per gli studi di ricerca che coinvolgono topi e ratti. Il metodo di prelievo di sangue nei topi e nei ratti dipende dal volume di sangue necessario, dalla frequenza del campionamento, dallo stato di salute dell'animale da dissanguare e dal livello di abilità del tecnico. 1 Tutti i metodi discussi - sanguinamenti del seno retro-orbitale, sanguinamenti iniziali del cecchino della coda e sanguinamenti intracardiaci - richiedono l'uso di un'anestesia generale.
Principi
Prima della procedura di sanguinamento, deve essere determinato il tipo di campione richiesto. Le procedure sperimentali potrebbero richiedere sangue intero, plasma o siero. Per il sangue intero, un anticoagulante deve essere aggiunto al campione. Il plasma, che contiene fibrinogeno e altri fattori di coagulazione quando separato dai globuli rossi, può essere estratto da un campione anticoagulato. Il siero si ottiene attraverso la raccolta del sangue senza un anticoagulante. Il siero risulterà dalla centrifugazione del campione una volta che si è formato un coagulo. Poiché il campione si è coagulato, il siero non conterrà fibrinogeno o altri fattori di coagulazione. Sia il plasma che il siero sono ottenuti attraverso l'uso di una centrifuga a 2200-2500 RPM per un minimo di 15 minuti.
Per un campione che deve produrre sangue intero o plasma, deve essere utilizzato un anticoagulante appropriato. Gli anticoagulanti comunemente usati per gli animali da laboratorio sono eparina, citrato di sodio e acido tetraacetico etilendiammina (EDTA); la cui selezione si basa sulle esigenze di ricerca. Il sequestro, una forma liquida di EDTA, eparina e citrato di sodio, può essere caricato direttamente nella siringa per rivestire le superfici. Ciò consente il contatto dell'anticoagulante direttamente mentre il sangue viene prelevato, aiutando nella prevenzione della coagulazione. Poiché il sangue di ratto coagula più velocemente della maggior parte del sangue dei mammiferi, è essenziale che il corretto rapporto tra anticoagulante e sangue sia utilizzato per la raccolta del sangue.
La selezione dell'ago si basa sulle dimensioni dell'animale e sul sito della venipuntura. In generale, maggiore è il foro dell'ago, più rapidamente il campione può essere raccolto. Meno danni alle cellule del sangue è un altro vantaggio per gli aghi più grandi. Tuttavia, il principale svantaggio degli aghi di grandi dimensioni è il potenziale danno alla nave. Su topi e ratti, le scelte di dimensioni vanno da aghi di calibro 20-29 che sono lunghi 0,5-1,5 pollici. Se un ago è troppo lungo, non solo è scomodo da usare, ma avere lo spazio extra nell'ago potrebbe causare la coagulazione. La dimensione appropriata dell'ago è elencata per ciascun metodo nella sezione procedure.
Anche la dimensione del campione richiesto deve essere predeterminata. A causa delle piccole dimensioni del topo o del ratto, la quantità massima di raccolta di sangue deve essere calcolata per un sanguinamento di sopravvivenza. Un topo medio del peso di 25 grammi ha un volume totale di sangue di 1,8 ml; il ratto medio del peso di 250 grammi ha un volume totale di sangue di 16 ml. Per un singolo campione di sangue su un topo o un ratto senza sostituzione di liquidi, il volume massimo di sangue che può essere rimosso in modo sicuro è del 10% del volume totale del sangue, o 7,7-8 μl / g. Quindi, per un topo medio, il 10% del suo volume di sangue è 193-200 μl. Per un ratto medio di 250 grammi, questo equivale a 1,9-2,0 ml. Gli studi hanno dimostrato che la rimozione di oltre il 15% del volume del sangue può causare shock ipovolemico. 1,2 Tuttavia, con la sostituzione del fluido, è possibile rimuovere fino al 15% del volume totale del sangue, o 12 μl/g. Per un mouse da 25 grammi, questo equivale a 300 μl; per un ratto da 250 grammi, equivale a 3 ml. Per la sostituzione dei liquidi, i fluidi devono essere riscaldati e somministrati per via sottocutanea.
Se è necessario prendere più campioni, il volume del sangue prelevato è ridotto. Il volume massimo di sangue che può essere prelevato a settimana non è superiore al 7,5% del volume ematico totale, o 6 μl/g. Per un topo da 25 grammi, questo equivale a 145-150 μl a settimana. Per un ratto da 250 grammi, questo equivale a 1,45-1,50 ml a settimana. Se il campionamento avverrà ogni 2 settimane, può essere prelevato fino al 10% del volume totale del sangue (8 μl/g). Ciò equivale a 200 μl ogni 2 settimane per un topo medio e fino a 2,00 ml ogni 2 settimane per un ratto da 250 grammi. Uno studio, condotto su ratti con il peso medio di 250 grammi, ha rivelato che quando sono stati rimossi volumi di sangue del 15-20%, ci sono voluti più di 29 giorni perché i livelli ematici si normalizzassero. 1,2 Per la raccolta ripetuta di sangue, la sostituzione del fluido non consente un volume di sangue maggiore o una raccolta di sangue più frequente, in quanto sostituisce solo il volume. L'animale avrà bisogno di tempo per ricostituire le cellule del sangue.
L'uso del plesso retro-orbitale è stata una pratica comune in passato. Tuttavia, sono sorte molte preoccupazioni circa l'umanità di questa procedura. Durante la procedura, un eccessivo movimento del tubo dell'ematocrito una volta posizionato nel canthus mediale dell'occhio può causare danni ai tessuti circostanti, con conseguente gonfiore delle palpebre e / o delle membrane congiuntivali. I tessuti gonfi possono far sporgere il bulbo oculare abbastanza lontano da impedire la chiusura della palpebra, potenzialmente con conseguente essiccazione corneale e danni. Il dolore da gonfiore può innescare graffi e automutilazione che si traduce in enucleazione dell'occhio. Il posizionamento improprio del tubo dell'ematocrito durante un'emorragia retro-orbitale può recidere il nervo ottico, con conseguente cecità. Se il tubo dell'ematocrito è avanzato con un angolo improprio, l'occhio può essere forzato fuori dall'orbita, permettendo alle palpebre di cadere dietro il bulbo oculare. Se ciò si verifica, è molto difficile sostituire correttamente l'occhio nella cavità. Altri problemi che possono sorgere includono la fratturazione delle fragili ossa dell'orbita, la penetrazione del globo oculare che provoca la perdita di umore vitreo o la formazione di un ematoma dietro l'occhio che può causare dolore estremo a causa della pressione sull'occhio e sulle strutture circostanti. Nonostante tutte queste preoccupazioni, se un tecnico esperto esegue la procedura e l'animale è completamente anestetizzato con un anestetico generale, come l'anestesia inalante isoflurano, il sanguinamento retro-orbitale ha dimostrato di essere un metodo efficace di raccolta del sangue nei roditori.
La struttura anatomica dell'area orbitale è diversa tra il topo e il ratto. Il topo ha il seno retro-orbitale, una raccolta di vasi che creano un seno nell'area orbitale. Nell'orbita dell'occhio di ratto, c'è un plesso di vasi che scorrono dietro quell'occhio; tuttavia, non formano un seno, come nel topo. Di conseguenza, è più facile eseguire questa procedura sui topi. Per la raccolta ripetuta del campionamento attraverso il plesso retro-orbitale, è necessario un minimo di 10 giorni tra le emorragie per consentire ai tessuti nell'area di guarire. Sebbene si raccomandi l'anestesia generale, la procedura può essere eseguita nei topi senza anestesia generale se prima della procedura viene applicato un anestetico oftalmico topico, come la proparacaina o la tetracaina. Poiché i ratti non hanno il seno retro-orbitale e poiché le loro membrane intorno all'orbita sono molto più forti, è obbligatorio anestetizzarli per questa procedura.
Campioni seriali di un piccolo volume possono essere ottenuti utilizzando un metodo di clip di coda. L'amputazione iniziale della coda deve essere limitata a una punta della coda, di circa 0,5-1,0 mm di lunghezza nei topi e di 2,0 mm nei ratti. 1 La procedura di taglio della coda per la raccolta del sangue consente la raccolta seriale interrompendo la crosta o il coagulo del taglio originale all'estremità della coda. Generalmente, non è necessaria un'ulteriore amputazione della punta della coda. I volumi di sangue raccolti vanno da 20-100 μL per i topi e 75-150 μL per i ratti. La quantità raccolta è variabile tra gli animali e può essere influenzata dall'età, dallo stato di salute e dal peso.
Il campione raccolto da un cecchino della coda può contenere sia sangue arterioso che venoso, insieme alla contaminazione del prodotto tissutale. La qualità del campione diminuisce se la coda viene accarezzata o "munta" per ottenere più sangue. Per aumentare il flusso sanguigno, la coda può essere riscaldata con impacchi caldi, una lampada di calore o immersione in acqua tiepida. La pressione deve essere applicata alla punta della coda per l'emostasi e gli animali devono essere controllati ogni 5-10 minuti per garantire che l'emostasi sia stata raggiunta. L'emostasi è spesso ritardata con campionamenti ripetuti. Una polvere stiptica può essere utilizzata per l'emostasi. Per l'amputazione iniziale, si raccomanda l'anestesia (generale o locale). Il sanguinamento successivo non dovrebbe richiedere l'anestesia, soprattutto quando gli animali si abituano alla procedura. L'anestesia causerà un calo della pressione sanguigna, rendendo difficile la raccolta del sangue con questa tecnica.
Un'alternativa a un cecchino di coda è il nick della nave di coda. Questa procedura è facilmente eseguibili sia su topi che su ratti. Tuttavia, come con il cecchino della coda, i campioni possono essere contaminati da prodotti tissutali, specialmente nel topo. Per i ratti, un ago ipodermico viene inserito nella nave e il sangue viene raccolto dal mozzo dell'ago. Uno studio ha dimostrato l'uso di un laccio emostatico posto sopra il sito di puntura dell'ago per aiutare nella raccolta del sangue. 3 Una siringa non viene utilizzata per estrarre il sangue dalla nave, poiché la pressione creata dalla siringa farà collassare la nave. Questo metodo può essere utilizzato anche per il campionamento seriale, poiché un coagulo può essere rimosso per far sanguinare nuovamente il sito. Come con i cecchini della coda, è imperativo garantire l'emostasi applicando pressione sul sito e ricontrollando l'animale ogni 5-10 minuti.
Spesso, gli studi richiedono un campione di sangue non vitale e di grandi dimensioni che viene raccolto attraverso il dissanguamento attraverso un sanguinamento intracardiaco o la vena cava caudale. 4 Circa la metà del volume totale del sangue può essere raccolta da un topo o da un ratto mediante puntura cardiaca. Ciò equivale a 40 μl/g o circa 1 ml per un topo medio da 25 grammi. Un ratto da 250 grammi produrrebbe circa 10 ml di sangue. L'animale deve essere anestetizzato per il dissanguamento. L'anestesia inalante o la narcosi CO2 possono essere utilizzate da un tecnico esperto; può anche essere utilizzata l'anestesia iniettabile. Tuttavia, potrebbe esserci una diminuzione della pressione sanguigna e della circolazione, che potrebbe ridurre la quantità di sangue raccolto.
Il metodo della vena cava caudale richiede che l'animale sia profondamente anestetizzato per esporre chirurgicamente la nave. Lanarcosi da CO 2 non è sufficiente, poiché il cuore deve battere e l'animale respirare durante l'astinenza di sangue. Durante la procedura, un prelievo di sangue troppo rapido può causare il collasso del vaso sulla smussatura della siringa, occludendo l'apertura e impedendo la raccolta di sangue. Inoltre, le pareti dei vasi sono sottili e quindi il movimento della mano e dell'ago deve essere evitato per evitare la rottura o la fuoriuscita di sangue dal sito di ingresso dell'ago. Poiché l'ago non passa attraverso la pelle, questo metodo comporta la raccolta di un campione sterile. Devono essere impiegati metodi di eutanasia aggiuntiva per garantire che l'animale non si riprenda dall'anestesia. Questo metodo è spesso seguito da perfusione cardiaca o aortica.
Il metodo intracardiaco può essere eseguito con l'animale trattenuto manualmente una volta anestetizzato (metodo chiuso), oppure il cuore può essere esposto chirurgicamente secondo il protocollo per il metodo di raccolta del sangue della vena cava caudale (metodo aperto). Per il metodo chiuso, i punti di riferimento per il posizionamento dell'ago sono la scanalatura formata dalla gabbia toracica al processo xifoide, sul lato sinistro dell'animale.
Procedura
1. Sanguinamento retro-orbitale
- Attrezzatura
- Preparare un barattolo a campana, o camera di induzione anestetica, per somministrare un gas anestetico come l'isoflurano. Quando si utilizza un barattolo a campana, è imperativo che l'anestetico liquido non entri in contatto con l'animale, per evitare l'assorbimento attraverso la pelle. È possibile utilizzare una piattaforma con piccoli fori.
- Sono preferiti tubi a microematocrito che contengono 50-75 microlitri. I tubi avvolti in mylar hanno meno probabilità di rompersi tra le dita dell'operatore e devono essere considerati una misura di sicurezza.
- Diversi spessori di asciugamani di carta, o altri materiali isolanti, sono posizionati sulla superficie di lavoro per mantenere il calore corporeo dell'animale durante la procedura.
- Preparazione e posizionamento dell'animale
- L'animale viene anestetizzato con un anestetico per inalazione, come l'isoflurano, in un barattolo a campana o in una camera di induzione dell'anestesia a gas, per effetto.
- Una volta che l'animale è completamente anestetizzato, viene rimosso e posto in posizione laterale.
- L'occhio è sporgente posizionando un dito sulla parte superiore della testa e lungo la mascella, e tirando la pelle indietro e verso il basso.
- Evitare di applicare pressione alla trachea, in quanto ciò potrebbe collassare o occludere le vie aeree causando la morte per asfissia.
- Astinenza di sangue
- Il microematocrito è posto nel canthus mediale dell'occhio e diretto caudale con un angolo di 30-45 ° dal piano del naso.
- Applicare pressione ruotando delicatamente il tubo dell'ematocrito. Questo taglierà le membrane congiuntivali e romperà il plesso oculare.
- Il sangue fluirà nel tubo dell'ematocrito per azione capillare.
- Evitare di spingere così in profondità da colpire l'osso nella parte posteriore della cavità oculare.
- Una volta che il sangue inizia a fluire, mantenere la pressione per mantenere l'occhio sporgente.
- Per raccogliere più tubi di sangue, non è necessario posizionare il tubo successivo nel plesso oculare, poiché il sangue continuerà a fluire e può essere raccolto poiché proviene dal canthus mediale.
- Per fermare il sanguinamento, rilasciare la pelle e consentire all'occhio di tornare alla posizione normale. Applicare pressione all'orbita per garantire l'emostasi.
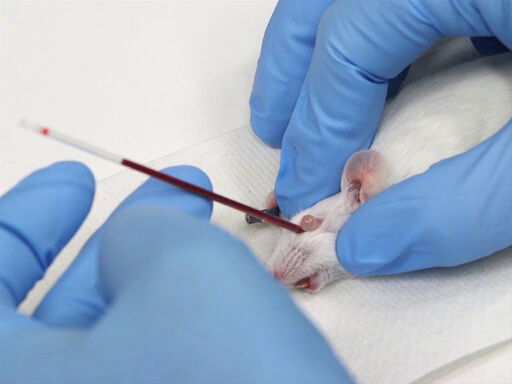
Figura 1. Prelievo di sangue orbitale retrò nei topi.
2. Procedure di spurgo della coda: cecchino della coda e nick della coda
- Attrezzatura
- Una lama sterile per bisturi, preferibilmente una lama numero 11 o una lama di rasoio monofacce, viene utilizzata per effettuare l'amputazione iniziale per il metodo del cecchino della coda. Le forbici non devono essere utilizzate perché il taglio fatto dalle forbici è schiacciante, favorendo così la coagulazione e riducendo il flusso sanguigno. Per la procedura di coda, viene utilizzata una lama di bisturi numero 11 o 15 per effettuare il taglio.
- Viene preparato un tubo di ritenuta che consente l'accesso alla coda del mouse.
- Asciugamani di carta assorbenti o garze sono usati come substrato per eseguire il cecchino della coda.
- Sono richiesti anche tubi di raccolta o tubi di ematocrito.
- La polvere stiptica dovrebbe essere disponibile per aiutare nell'emostasi.
- Limitazione
- L'animale viene inserito nel tubo in modo tale che la coda sia accessibile. Per i limitatori di tipo Broome, l'animale viene tirato prima nella groppa nel tubo. Per altri tubi, l'animale viene posizionato per primo a testa in su.
- Gli animali sono fissati nel tubo in modo tale che non possano girarsi o ritirare la coda.
- Alcuni topi consentiranno il cecchino della coda e la raccolta del sangue con un contenimento manuale minimo se sono autorizzati ad afferrare una superficie ruvida.
- Alcuni ratti richiedono l'anestesia per inalazione per questo metodo di raccolta del sangue.
- Astinenza di sangue
- La coda viene pulita con acqua tiepida per rimuovere i detriti e causare una leggera vasodilatazione. NON usare acqua calda.
- Per il beccaccino della coda, la coda è estesa e l'estremità della coda (0,5-1 mm per i topi e fino a 2 mm per i ratti) viene tagliata con la lama del bisturi.
- Per il nick della coda, la coda è estesa e un taglio viene effettuato con la lama del bisturi a circa 2/3 della distanza dalla groppa, direttamente sopra la vena laterale della coda.
- La coda può essere accarezzata da groppa a punta per favorire il flusso sanguigno; tuttavia, ciò ridurrà la qualità del campione.
- Il sangue viene raccolto dalla punta o dal nick usando tubi di ematocrito o lasciato gocciolare in una fiala di raccolta.
3. Raccolta del sangue cardiaco
- Attrezzatura
- Per un mouse, è preferibile una siringa da 3 cc con un ago da 22-25 gauge x 1 ". Le siringhe più piccole non hanno la stessa rifopressione e possono rendere più difficile l'astinenza di sangue. Aghi più piccoli di 25 gauge limitano il flusso di sangue, portando ad un aumento della coagulazione e danni alle cellule del sangue. Gli aghi più corti di 1 "potrebbero non raggiungere il livello del cuore quando si avvicinano dal diaframma.
- Per un ratto, è preferibile una siringa da 10-12 cc con un ago da 18 gauge x 1,5 ". A seconda delle dimensioni del ratto, una siringa più piccola potrebbe non contenere l'intero volume di sangue da raccogliere, e quindi la siringa dovrebbe essere cambiata durante la procedura. Aghi più piccoli di 20 gauge limitano il flusso del sangue, portando ad un aumento della coagulazione. Gli aghi più corti di 1,5 " potrebbero non raggiungere il livello del cuore quando si avvicinano dal diaframma.
- Un tubo di raccolta del sangue di dimensioni sufficienti viene utilizzato per contenere il sangue raccolto.
- Limitazione
- Una corretta moderazione è essenziale per il successo di questo metodo. L'animale è tenuto dalla collottola con il corpo appeso verticalmente. È importante che il corpo sia dritto per prevenire la deflessione del cuore o una torsione del torace.
- Una posizione alternativa è la reclinata dorsale quando si posiziona l'ago tra le costole sul lato sinistro dell'animale. Ciò è particolarmente utile per ratti molto grandi o quando più animali devono essere dissanguati.
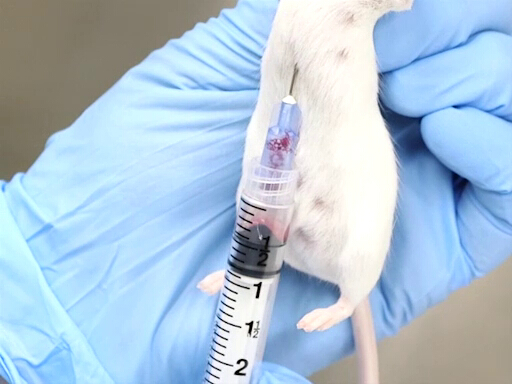
Figura 2. Prelievo di sangue cardiaco con mouse tenuto verticalmente.
- Astinenza di sangue
- L'approccio dall'aspetto posteriore, forando il diaframma è più facilmente realizzabile quando il topo o il topo è tenuto verticalmente dalla collottola.
- L'ago è avanzato nella tacca appena a sinistra dello xifoide dell'animale.
- L'ago deve essere parallelo alla colonna vertebrale e posizionato appena sotto le costole.
- Il cuore si trova approssimativamente a livello del gomito.
- Metti l'ago, smussa, nel petto e perfora il cuore.
- Applicare una leggera retropressione con la siringa. Se l'ago è nel cuore, il sangue scorrerà nella siringa.
- Attendere che il sangue abbia riempito la siringa prima di aggiungere ulteriore pressione di nuovo sulla siringa.
- L'approccio laterale dal lato sinistro dell'animale richiede il posizionamento dell'animale in reclinazione dorsale.
- Il punto di ingresso viene misurato rispetto al punto del gomito sulla parete toracica. Il cuore si trova approssimativamente a livello del gomito.
- L'ago viene inserito perpendicolarmente al piano del tavolo in un punto a metà strada sulla parete toracica come misurato dorsoventralmente.
- Metti l'ago, smussa, nel petto e perfora il cuore.
- Applicare una leggera retropressione con la siringa. Se l'ago è nel cuore, il sangue scorrerà nella siringa.
- Attendere che il sangue abbia riempito la siringa prima di aggiungere ulteriore contropressione sulla siringa.
- L'approccio dall'aspetto posteriore, forando il diaframma è più facilmente realizzabile quando il topo o il topo è tenuto verticalmente dalla collottola.
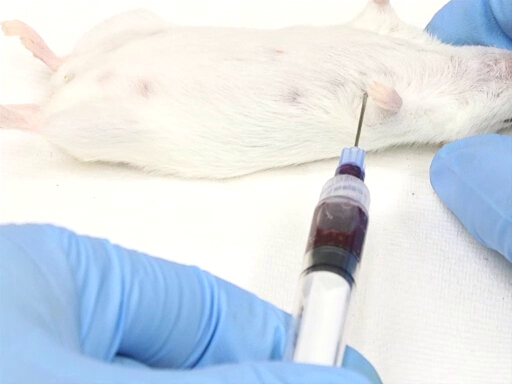
Figura 3. Prelievo di sangue cardiaco con topo in posizione di reclina dorsale.
- Consigli tecnici
- Il cuore normale è situato con l'apice che punta a sinistra. In rari casi, il cuore può essere invertito, con conseguente difficoltà a perforare il cuore.
- Un'eccessiva ripressione sulla siringa può far collassare il cuore, occludendo la smussatura dell'ago e interrompendo il flusso di sangue nella siringa.
- Applicare la ripressione e rilasciarla ripetutamente avvierà la coagulazione nella siringa.
- Applicare delicatamente la pressione al fegato può forzare un volume di sangue aggiuntivo nel sistema circolatorio, rendendolo disponibile per l'astinenza.
4. Astinenza di sangue della vena cava posteriore
- Attrezzatura
- Una siringa TB con un ago calibro 25-29 viene utilizzata per la raccolta del sangue nel topo. Per i ratti, è necessaria una siringa da 10-12 cc con un ago da 22-25 gauge x 1".
- È necessaria una piattaforma chirurgica, un vassoio di dissezione o un'altra superficie per fissare l'animale, insieme a cravatte, nastro adesivo o spilli per fissare gli arti in posizione.
- È necessaria l'anestesia iniettabile o l'anestesia per inalazione. Se si utilizza l'anestesia per inalazione, è auspicabile che l'anestetico venga erogato tramite un vaporizzatore di precisione con un cono nasale. La durata della procedura è tale che l'utilizzo di una camera di induzione senza ulteriore somministrazione di gas anestetico non fornirà tempo sufficiente per completare il prelievo di sangue prima che l'animale si rianima.
- Sono necessarie forbici dell'iride per il topo o forbici affilate per la sala operatoria per il ratto, insieme a piccole pinze atraumatiche per il pollice e una spugna di garza 2 "x 2".
- Limitazione
- Quando l'animale è completamente anestetizzato, come determinato dal pizzico della dita dei dita o dal pizzico della coda, l'animale viene posto in reclinata dorsale.
- Gli arti sono fissati alla piattaforma con nastro o spilli. Gli arti dovrebbero essere estesi lontano dal corpo.
- Ritiro
- La pelle viene sollevata e un piccolo taglio trasversale viene effettuato attraverso la pelle appena sopra il bacino nelle femmine, o appena sopra il prepuzio nei maschi.
- La punta delle forbici viene posizionata nel taglio e un'incisione della linea mediana viene praticata attraverso la pelle dal bacino / prepuzio allo xifoide.
- La pelle viene riflessa lateralmente su ciascun lato. La dissezione smussata può essere necessaria per allentarlo dal muscolo sottostante.
- Il muscolo viene sollevato e un piccolo taglio trasversale viene effettuato attraverso il muscolo appena sopra il taglio della pelle.
- La punta delle forbici viene posizionata nell'addome e un'incisione della linea mediana viene effettuata attraverso il muscolo allo xifoide. Assicurati di inclinare la punta delle forbici verso l'alto per evitare di tagliare organi.
- Tagliare trasversalmente lungo la curva delle costole su ciascun lato. Prestare particolare attenzione a non perforare il fegato.
- Spostare delicatamente l'intestino alla sinistra dell'animale per esporre la vena cava posteriore.
- Posizionare una garza sul fegato e appoggiare l'indice e il medio sul fegato.
- Con l'altra mano, inserire l'ago, smussato verso l'alto, nella vena cava a metà strada tra la giunzione dei vasi renali e la biforcazione iliaca.
- Prelevare lentamente il sangue mentre si applica la pressione sul fegato.
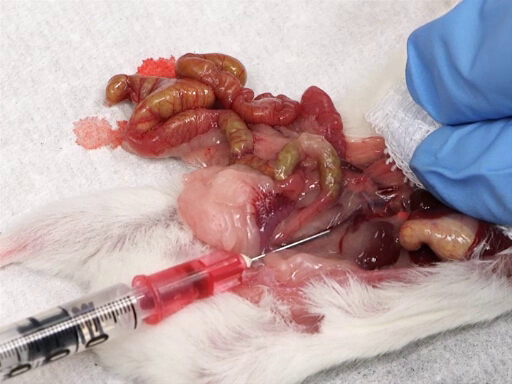
Figura 4. Prelievo di sangue dalla vena cava posteriore.
Applicazione e Riepilogo
La raccolta del sangue per topi e ratti può essere realizzata con una varietà di tecniche. Sebbene molti fattori, come la dimensione del campione, la frequenza del campionamento e le dimensioni e l'età dell'animale influenzino questo, la componente più essenziale è il livello di abilità del tecnico che esegue la raccolta del campione. Per i metodi qui descritti, l'uso corretto degli anestetici è fondamentale anche per i campioni di qualità e il benessere degli animali.
Riferimenti
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Prelievo di sangue I
Lab Animal Research
172.5K Visualizzazioni

Tecniche di manipolazione e contenzione dei roditori
Lab Animal Research
175.5K Visualizzazioni

Procedure di assistenza di base
Lab Animal Research
28.1K Visualizzazioni

Fondamenti di allevamento e svezzamento
Lab Animal Research
35.9K Visualizzazioni

Identificazione dei roditori I
Lab Animal Research
55.0K Visualizzazioni

Identificazione dei roditori II
Lab Animal Research
25.7K Visualizzazioni

Amministrazione composta I
Lab Animal Research
101.2K Visualizzazioni

Amministrazione composta II
Lab Animal Research
35.1K Visualizzazioni

Amministrazione composta III
Lab Animal Research
31.6K Visualizzazioni

Somministrazione composta IV
Lab Animal Research
52.0K Visualizzazioni

Astinenza di sangue II
Lab Animal Research
73.8K Visualizzazioni

Induzione e manutenzione dell'anestesia
Lab Animal Research
50.9K Visualizzazioni

Considerazioni per la chirurgia dei roditori
Lab Animal Research
22.5K Visualizzazioni

Necroscopia diagnostica e prelievo di tessuti
Lab Animal Research
58.4K Visualizzazioni

Raccolta di tessuti sterili
Lab Animal Research
35.0K Visualizzazioni