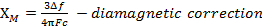Il metodo di Evans
Panoramica
Fonte: Tamara M. Powers, Dipartimento di Chimica, Texas A & M University
Mentre la maggior parte delle molecole organiche sono diamagnetiche, in cui tutti i loro elettroni sono accoppiati in legami, molti complessi di metalli di transizione sono paramagnetici, che ha stati di base con elettroni spaiati. Ricordiamo la regola di Hund, che afferma che per orbitali di energie simili, gli elettroni riempiranno gli orbitali per massimizzare il numero di elettroni spaiati prima di accoppiarsi. I metalli di transizione hanno orbitali dparzialmente popolati le cui energie sono perturbate in misura variabile dalla coordinazione dei ligandi al metallo. Quindi, gli orbitali dsono simili in energia l'uno all'altro, ma non sono tutti degenerati. Ciò consente ai complessi di essere diamagnetici, con tutti gli elettroni accoppiati, o paramagnetici, con elettroni spaiati.
Conoscere il numero di elettroni spaiati in un complesso metallico può fornire indizi sullo stato di ossidazione e sulla geometria del complesso metallico, nonché sulla forza del campo del ligando (campo cristallino) dei ligandi. Queste proprietà hanno un grande impatto sulla spettroscopia e sulla reattività dei complessi di metalli di transizione, e quindi sono importanti da capire.
Un modo per contare il numero di elettroni spaiati è misurare la suscettibilità magnetica, χ, del composto di coordinazione. La suscettibilità magnetica è la misura della magnetizzazione di un materiale (o composto) quando viene inserito in un campo magnetico applicato. Gli elettroni accoppiati sono leggermente respinti da un campo magnetico applicato e questa repulsione aumenta linearmente all'aumentare della forza del campo magnetico. D'altra parte, gli elettroni spaiati sono attratti (in misura maggiore) da un campo magnetico e l'attrazione aumenta linearmente con l'intensità del campo magnetico. Pertanto, qualsiasi composto con elettroni spaiati sarà attratto da un campo magnetico. 1
Quando misuriamo la suscettibilità magnetica, otteniamo informazioni sul numero di elettroni spaiati dal momento magnetico, μ. La suscettibilità magnetica è correlata al momento magnetico, μ dall'equazione 12:
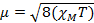 (1)
(1)
La costante 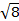 = [(3kB)/Nβ2)], dove β= magnetone di Bohr dell'elettrone (0,93 x 10-20 erg gauss-1), N = numero di Avogadro, e kB = costante di Boltzmann
= [(3kB)/Nβ2)], dove β= magnetone di Bohr dell'elettrone (0,93 x 10-20 erg gauss-1), N = numero di Avogadro, e kB = costante di Boltzmann
XM= suscettibilità magnetica molare (cm3/mol)
T = temperatura (K)
μ = momento magnetico, misurato in unità di magnetone di Bohr, μB = 9,27 x 10-24 JT-1
Il momento magnetico per i complessi è dato dall'equazione 21:
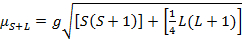 (2)
(2)
g = rapporto giromagnetico = 2,00023 μB
S = numero quantico di spin = ∑ms = [numero di elettroni spaiati, n]/2
L = numero quantico orbitale = ∑ml
Questa equazione ha sia contributi orbitali che di spin. Per i complessi di metalli di transizione di prima fila, il contributo orbitale è piccolo e quindi può essere omesso, quindi il momento magnetico di solo spin è dato dall'equazione 3:
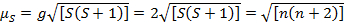 (3)
(3)
Il momento magnetico di sola spin può quindi dare direttamente il numero di elettroni spaiati. Questa approssimazione può essere fatta anche per i metalli più pesanti, sebbene i contributi orbitali possano essere significativi per i metalli di transizione di seconda e terza fila. Questo contributo può essere così significativo da gonfiare il momento magnetico abbastanza che il composto sembra avere più elettroni spaiati di quanti ne abbia. Pertanto, potrebbe essere necessaria un'ulteriore caratterizzazione per questi complessi.
In questo esperimento, il momento magnetico della soluzione di tris(acetilacetonato)ferro(III) (Fe(acac)3) viene determinato sperimentalmente usando il metodo evans nel cloroformio.
Procedura
1. Preparazione dell'inserto capillare
- Usando un accendino o un'altra fiamma a gas, sciogliere la punta di una lunga pipetta Pasteur. Ruotare delicatamente la punta della pipetta nella fiamma fino a formare una piccola lampadina. Lasciare raffreddare il bicchiere.
- In un flaconcino a scintillazione, preparare una soluzione 50:1 (volume) di cloroformio deuterato:proteo. Pipettare 2 mL di solvente deerato, e a questo aggiungere 40 μL di solvente proteo. Chiudere il flaconcino.
- Aggiungere con at
Risultati
Risultatixperimental
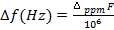 (5)
(5)