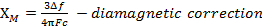El método de Evans
Visión general
Fuente: Tamara M. Powers, Departamento de química, Texas A & M University
Mientras más moléculas son diamagnéticos, en donde todos sus electrones se aparean para arriba en bonos, muchos complejos de metales de transición son paramagnéticos, que tiene fundamento Estados con electrones no apareados. Recordar la regla de Hund, que dice que para orbitales de energías similares, electrones llenarán los orbitarios para maximizar el número de electrones no apareados antes de emparejar para arriba. Metales de transición parcialmente han poblado d-orbitarios cuyas energías están perturbados en diversos grados por la coordinación de los ligandos al metal. Así, los d-orbitarios son similares en energía uno al otro, pero no son todos degenerados. Esto permite complejos diamagnéticos, con todos los electrones en pareja o paramagnética, con electrones no apareados.
Conocer el número de electrones no apareados en un complejo de metal puede proporcionar pistas en el estado de oxidación y geometría de lo complejos del metal, así como en la fuerza de (campo de cristal) del campo de ligando de los ligandos. Estas propiedades afectan grandemente la espectroscopia y la reactividad de complejos de metales de transición y son tan importantes para entender.
Una forma de contar el número de electrones no apareados es para medir la susceptibilidad magnética χ, del compuesto de coordinación. Susceptibilidad magnética es la medida de la magnetización de un material (o compuesto) cuando coloca en un campo magnético aplicado. Electrones apareados son levemente repelidos por un campo magnético aplicado, y esta repulsión aumenta linealmente a medida que la fuerza del campo magnético aumenta. Por otro lado, electrones desparejados son atraídos (a un grado más grande) a un campo magnético, y la atracción aumenta linealmente con la fuerza del campo magnético. Por lo tanto, cualquier compuesto con electrones no apareados se ser atraído por un campo magnético. 1
Cuando se mide la susceptibilidad magnética, obtenemos información sobre el número de electrones no apareados de momento magnético μ. La susceptibilidad magnética se relaciona con el momento magnético, μ ecuación 12:
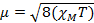 (1)
(1)
La constante 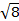 = [(3kB) / Nβ2)], donde β = magneton de Bohr del electrón (0.93 x 10-20 erg gauss-1), N = número de Avogadro y kB = constante de Boltzmann
= [(3kB) / Nβ2)], donde β = magneton de Bohr del electrón (0.93 x 10-20 erg gauss-1), N = número de Avogadro y kB = constante de Boltzmann
XM = susceptibilidad magnética molar (cm3/mol)
T = temperatura (K)
μ = momento magnético, medido en unidades de magneton de Bohr, μB = 9.27 x 10-24 JT-1
El momento magnético de complejos está dada por la ecuación 21:
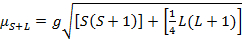 (2)
(2)
g = cociente gyromagnetic = 2.00023 μB
S = Número cuántico de spin = ∑ms = [número de electrones no apareados, n] / 2
L = Número cuántico orbital = ∑ml
Esta ecuación tiene contribuciones de orbital y de spin. Para los complejos de metales de transición de primera fila, la contribución orbital es pequeña y por lo tanto, puede omitirse, por lo que el momento magnético de spin sólo se da por ecuación 3:
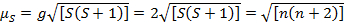 (3)
(3)
El momento magnético de spin sólo así puede dar directamente el número de electrones no apareados. Esta aproximación puede hacerse también para los metales más pesados, aunque orbitales contribuciones pueden ser significativas para los metales de transición de segunda y tercera fila. Esta contribución puede ser tan significativa que infla el momento magnético suficientemente que el compuesto parece más han desapareado electrones que lo hace. Por lo tanto, la caracterización adicional puede ser necesario para estos complejos.
En este experimento, el momento magnético de solución de tris(acetylacetonato)iron(III) (Fe(acac)3) se determina experimentalmente mediante método de Evans en cloroformo.
Procedimiento
1. preparación del relleno capilar
- Utilizando una llama de gas más ligero o de otro, se funden la punta de una pipeta Pasteur largo. Gire suavemente la punta de la pipeta en la llama hasta la forma de una bombilla pequeña. Deje que el vidrio se enfríe.
- En un vial de centelleo, preparar una solución de 50: 1 (volumen) de deuterados: proteo cloroformo. Pipeta 2 mL de disolventes deuterados y a esto agregar 40 μl de disolvente de proteo. Tapa el frasco.
- Cuidadosamente añadir unas gotas de la
Resultados
E xperimental resultados
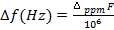 (5)
(5)