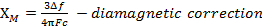Die Evans-Methode
Überblick
Quelle: Tamara M. Powers, Department of Chemistry, Texas A & M Universität
Während die meisten organischen Moleküle diamagnetisch sind, Staaten wobei alles, was ihre Elektronen in Anleihen, viele Übergang Metall komplexe gepaart sind paramagnetisch, sind die Erden hat mit ungepaarten Elektronen. Rückrufaktion Hund'sche Regel, die besagt, dass für orbitale ähnliche Energien, Elektronen die orbitale maximiert die Zahl der ungepaarten Elektronen vor pairing füllen werden. Übergangsmetalle haben teilweise aufgefüllt d-orbitale, dessen Energien sind in unterschiedlichem Ausmaß durch Koordinierung der Liganden an das Metall gestört. So, die d-orbitale sind in Energie einander ähnlich, jedoch nicht alle entartet. Dies ermöglicht eine komplexe diamagnetisch, mit alle Elektronen gepaart oder paramagnetisch mit ungepaarten Elektronen.
Zu wissen, die Zahl der ungepaarten Elektronen in einem Metall komplexe kann Hinweise geben in der Oxidationsstufe und der Geometrie des Metalls komplexe sowie in die Liganden (Kristallfeld) Feldstärke der Liganden. Diese Eigenschaften einen enormen Einfluss auf die Spektroskopie und Reaktivität der Übergang Metall komplexe und sind also wichtig, zu verstehen.
Eine Möglichkeit, die Anzahl der ungepaarten Elektronen wird zur Messung der magnetischen Suszeptibilität χ, der Koordinierung Verbindung. Magnetische Suszeptibilität ist das Maß der Magnetisierung der ein Material (oder Verbindung), wenn in einem angelegten Magnetfeldes platziert. Gepaarte Elektronen sind leicht durch einen angelegten Magnetfeldes abgestoßen, und diese Abstoßung steigt linear als die Stärke des Magnetfeldes erhöht. Auf der anderen Seite ungepaarte Elektronen sind ein Magnetfeld (in größerem Umfang) angezogen, und die Attraktivität steigt linear mit der magnetischen Feldstärke. Daher wird eine Verbindung mit ungepaarten Elektronen ein Magnetfeld angezogen werden. 1
Wenn wir der magnetischen Suszeptibilität messen, erhalten wir Informationen über die Zahl der ungepaarten Elektronen aus das magnetische Moment μ. Die magnetische Suszeptibilität bezieht sich auf das magnetische Moment μ von Gleichung 12:
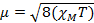 (1)
(1)
Die Konstante 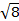 = [(3kB) / Nβ2)], wo β = Bohr Magneton des Elektrons (0,93 X 10-20 Erg Gauß-1), N = Avogadro's Zahl und kB = Boltzmann-Konstante
= [(3kB) / Nβ2)], wo β = Bohr Magneton des Elektrons (0,93 X 10-20 Erg Gauß-1), N = Avogadro's Zahl und kB = Boltzmann-Konstante
XM = molare magnetische Suszeptibilität (cm3/mol)
T = Temperatur (K)
µ = magnetisches Moment, gemessen in Einheiten von Bohr Magneton, µB = 9,27 x 10-24 JT-1
Das magnetische Moment für komplexe ist gegeben durch die Gleichung 21:
 (2)
(2)
g = Gyromagnetic Verhältnis = 2.00023 µB
S = Spin-Quantenzahl = ∑ms = [Anzahl der ungepaarten Elektronen, n] / 2
L = orbital Quantenzahl = ∑ml
Diese Gleichung hat Orbital und Spin Beiträge. Für die erste Zeile Übergang Metall komplexe, die orbitale Beitrag ist klein und daher kann weggelassen werden, damit das Drehen nur magnetische Moment gegeben ist Gleichung 3:
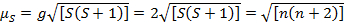 (3)
(3)
Das Spin-nur magnetische Moment kann somit direkt die Zahl der ungepaarten Elektronen geben. Diese Annäherung kann auch für schwerere Metalle erfolgen, obwohl orbital Beiträge für zweite und dritte Reihe Übergangsmetallen wichtig sein könnten. Dieser Beitrag kann so bedeutend, dass es das magnetische Moment genug, das die Verbindung mehr Elektronen ungepaarten haben bläst scheint, als dies der Fall ist. Daher möglicherweise zusätzliche Charakterisierung für diese komplexe erforderlich.
In diesem Experiment wird die Lösung magnetisches Moment des tris(acetylacetonato)iron(III) (Fe(acac)3) bestimmt experimentell mit Evans Methode in Chloroform.
Verfahren
1. Vorbereitung der Kapillare einfügen
- Verwenden eine leichtere oder andere Gasflamme, Schmelzen Sie die Spitze des langen Pasteurpipette. Drehen Sie sanft die Pipettenspitze in der Flamme, bis eine kleine Birne Formen. Lassen Sie das Glas abkühlen lassen.
- In einer Durchstechflasche funkeln bereiten die 50: 1 (Volumen) Lösung von deuterierter: Proteo Chloroform. Pipette 2 mL deuterierte Lösungsmittel und dazu fügen 40 µL Proteo Lösungsmittel. Verschließen Sie das Fläschchen.
- Fügen Sie ein
Ergebnisse
E Xperimental Ergebnisse
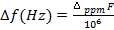 (5)
(5)