Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Fonte: Thomas Chaffee1, Thomas S. Griffith2,3,4e Kathryn L. Schwertfeger1,3,4
1 Dipartimento di Medicina e Patologia di Laboratorio, Università del Minnesota, Minneapolis, MN 55455
2 Dipartimento di Urologia, Università del Minnesota, Minneapolis, MN 55455
3 Masonic Cancer Center, Università del Minnesota, Minneapolis, MN 55455
4 Centro di Immunologia, Università del Minnesota, Minneapolis, MN 55455
Le analisi patologiche delle sezioni tissutali possono essere utilizzate per ottenere una migliore comprensione della normale struttura tissutale e contribuire alla nostra comprensione dei meccanismi della malattia. Le biopsie tissutali, sia da pazienti che da modelli sperimentali in vivo, sono spesso conservate fissando in formalina o paraformaldeide e incorporando nella cera di paraffina. Ciò consente la conservazione a lungo termine e il seziono dei tessuti. I tessuti vengono tagliati in sezioni sottili (5 μm) utilizzando un microtomo e le sezioni sono aderenti a vetrini. Le sezioni dei tessuti possono essere colorate con anticorpi, che consentono il rilevamento di proteine specifiche all'interno delle sezioni tissutali. La colorazione con anticorpi coniugati a fluorofori (noti anche come fluorocromi) - composti che emettono luce a lunghezze d'onda specifiche quando eccitati da un laser - è nota come immunofluorescenza. La capacità di rilevare proteine all'interno di una sezione può fornire informazioni come l'eterogeneità del tipo di cellula all'interno del tessuto, l'attivazione di specifiche vie di segnalazione e l'espressione di biomarcatori. A seconda dei fluorofori utilizzati e del tipo di microscopio disponibile per l'analisi, è possibile utilizzare più colori, il che consente l'analisi multiplexata dei bersagli.
Il seguente protocollo delinea i passaggi di base coinvolti nella colorazione immunofluorescenza delle sezioni di tessuto incorporato di paraffina. È importante notare che questo protocollo non includerà alcun dettaglio sulla fissazione del tessuto, sul processo di incorporamento della paraffina o sul sezionamento dei tessuti. Una volta che i tessuti sono stati sezionati e posizionati su vetrini, vengono reidratati attraverso una serie di incubazioni di etanolo graduato (EtOH). Le sezioni vengono incubate con un reagente bloccante per ridurre il legame non specifico dell'anticorpo alla sezione tissutale. Le sezioni vengono quindi incubate con un anticorpo primario che può o non può essere etichettato direttamente con un fluoroforo. Se l'anticorpo primario non è etichettato direttamente, le sezioni vengono quindi incubate con un anticorpo secondario etichettato con un fluoroforo. Anticorpi diversi possono richiedere condizioni di colorazione diverse, quindi sono inclusi suggerimenti per l'ottimizzazione degli anticorpi. Dopo il lavaggio per rimuovere tutti gli anticorpi non legati, i vetrini sono montati con supporti contenenti DAPI per etichettare fluorescentemente il nucleo. Una volta che il supporto di montaggio si è asciugato, i vetrini possono essere ripresi utilizzando un microscopio con laser in grado di rilevare i diversi fluorofori.
1. Configurazione
- Il tipico protocollo di colorazione prevede i seguenti passaggi:
- Reidratare le sezioni di tessuto sui vetrini utilizzando una serie di etanolo graduati.
- Incubazione delle sezioni tissutali con un tampone bloccante, che aiuterà a bloccare il legame non specifico degli anticorpi al tessuto e ridurre la fluorescenza di fondo.
- Rimozione del tampone bloccante e incubazione della sezione nell'anticorpo primario, momento in cui l'anticorpo legherà il suo
Log in or to access full content. Learn more about your institution’s access to JoVE content here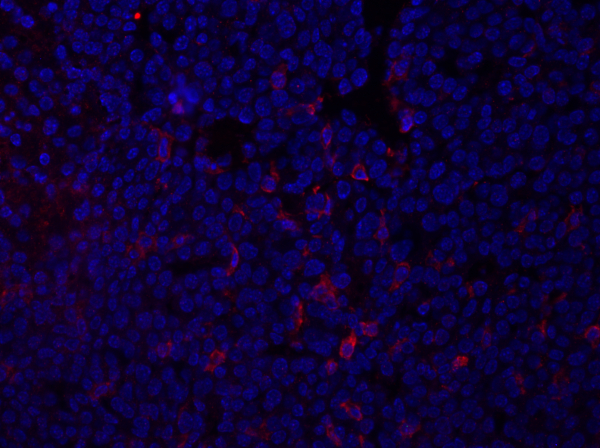
Figura 1: Colorazione F4/80 di una sezione di tumore mammario. Dopo la fissazione, un tumore mammario di topo è stato sezionato e macchiato con anti-F4/80 e montato utilizzando un supporto di montaggio contenente DAPI. La colorazione è mostrata dalla colorazione della superficie cellulare F4/80 in rosso.
L'immunofluorescenza consente lo studio dell'espressione e della localizzazione proteica nel contesto di una sezione tissutale. Questa tecnica può essere utilizzata per capire come i tessuti cambiano nel contesto della malattia esaminando la localizzazione delle proteine o il numero di cellule nei tessuti normali e malati. Le modifiche nella localizzazione o nei modelli di espressione possono essere determinate e collegate ad attributi specifici degli esempi.
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Vai a...
Video da questa raccolta:

Now Playing
Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.4K Visualizzazioni

Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
92.4K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.6K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
236.3K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.3K Visualizzazioni

Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
78.3K Visualizzazioni

Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.2K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
42.9K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.3K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.0K Visualizzazioni

Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.0K Visualizzazioni

Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.3K Visualizzazioni