Method Article
速度論と構造機能解析のアフィニティ定量のための適切なタンパク質濃度の重要性
要約
我々は、ラベルフリーの動力学的特性によってパパインには、いくつかのシスタチンBの変異体の結合の構造機能解析のためのビアコアのX100を使用してタンパク質相互作用解析を適用する。キャリブレーションフリーの濃度分析(シミュレーションプロジェクト)は、検量線を必要とせずに保持結合活性を有するタンパク質の濃度を測定する。我々はシミュレーションプロジェクトを使用して濃度のその確認は、動態解析の信頼性を高め、速度定数が確実に組換えタンパク質の活性が低下している場合でも決定できることを示している。
要約
本研究では、我々は、ビアコアのX100を使ってリアルタイムラベルフリー解析により、ウシのシステインプロテアーゼ阻害剤のシスタチンBとパパイン(図1)、植物のシステインプロテアーゼの触媒的不活性型との間の相互作用を探る。パパインとの相互作用の分野での点突然変異を持ついくつかのシスタチンBの亜種は、生産されています。各シスタチンBのバリアントのために我々は、キャリブレーションフリーの濃度分析を用いてその特異的結合濃度(シミュレーションプロジェクト)を決定し、によって決定される総タンパク質濃度で得られた値を比較する
プロトコル

図1。パパインとシスタチンB複合体(青)(黄)の三次元構造。変異シスタチンBの残基は赤で表示されます。
1。ビアコアシステムを用いたラベルフリー相互作用解析の原理
ビアコアシステムを用いた典型的なラベルフリーの結合実験では、生体分子は、"配位子が"センサーチップの表面に取り付けられていると呼ばれる。フローチャネルのシステムでは検出が行われるチップ表面に接触する、"分析物"と呼ばれるその結合パートナーを、もたらす。分析物がリガンドに結合すると、表面での質量の蓄積の結果としての変化は、表面プラズモン共鳴(SPR)により検出される。 SPRの応答は、結合分析物の量に比例します。
バインディングがリアルタイムで測定されるため、特定の相互作用の速度論的会合および解離速度定数を決定することができます。これらの定数から、それは一定の平衡解離と親和性を計算することが可能です。それは、定常状態のデータバインディングの親和性を計算することも可能です。同様の方法論はまた、特に表面にリガンドに結合するタンパク質の濃度を決定するために使用することができます。
2。タンパク質 - タンパク質相互作用の動力学的特性の分析
ビアコアX100では、速度論的解析は、シングルサイクルカイネティクスを使用して実行することができます。シングルサイクルカイネティクスの実験では、分析物の濃度系列は、注射の間に表面の再生をすることなく、単一の分析サイクルに注入されます。それは適切な再生条件を見つけることが困難な場合そのため、シングルサイクルカイネティクスは、動態解析を可能にします。
運動実験のデータが収集されたら、ビアコアX100の評価ソフトウェアは、相互作用モデルにデータをフィッティングすることによりK A、K D、およびK Dの値を生成します。
3。タンパク質濃度を測定するためのアプローチ
生体分子間の相互作用を分析すると、その機能を理解する上で重要である。核酸に、他のタンパク質へのタンパク質の結合を特徴づける、または小分子には、生化学研究の基本となるものである、と創薬を含む他の多くの分野での使用を検出します。
対話する2つのタンパク質間の相互作用のカイネティクスの正確な測定のためには、検体として使用される実験サンプルに特異的に結合するタンパク質の濃度を知ることが不可欠です。 280やのような比色アッセイの分光光度計の読みは、ブラッドフォード試薬を採用するものが一般的に総タンパク質濃度を決定するために使用されます。しかし、タンパク質の不純物は、結果に影響を与えます。さらに重要なことは、タンパク質の両方のアクティブおよび非アクティブなフォームは、総タンパク質濃度に含まれています。特に誤った折り畳みに起因する非アクティブになる可能性があります換えタンパク質の場合には、サンプル中の特異的結合タンパク質の割合を決定することが重要です。
ビアコアX100で、特異的結合活性に関連する濃度は、いずれかの既知の標準から派生した検量線との結合反応のレベルの比較によって、以上の最近導入された方法論キャリブレーションフリーの濃度分析(シミュレーションプロジェクト)を使用して決定することができます。シミュレーションプロジェクトでは、標準に依存しません。したがって、シミュレーションプロジェクトでは、基準が通常利用できないタンパク質の変異体を、勉強の場合に特に便利です。
シミュレーションプロジェクトの実験では、初期結合率は、チップ表面へのサンプルの拡散が律速される条件下での異なる流量で測定されます。分析物の拡散係数、初期結合速度の1,2から特異的結合濃度を計算するときに、フローセルと流量の大きさが考慮されます。
動力学の実験では、分析物の濃度は、運動の会合速度定数と実験データから親和性の計算に使用されています。シミュレーションプロジェクトとビアコアシステムの動力学的測定は、両方とも同じ相互作用の性質に依存しています。したがって、ビアコア分析によって決定される特異的な結合の濃度ではなく、総タンパク質濃度を使用して、結果の信頼性を向上させます。
4。シスタチンBとパパインの相互作用を特徴づけるビアコア分析を使用して、
哺乳類シスタチンBはこれらのタンパク質は、主にnonsに関与している主にパパインのようなシステインプロテアーゼ、カテプシンB、H、K、LとSの可逆的、競争とタイト結合蛋白質の阻害剤です。選択科目細胞内タンパク質分解。 Cystatinsは、これらの酵素によって不適当なタンパク質分解から細胞や組織を保護するためと推定されています。彼らはまた、寄生虫やウイルスからシステインプロテイナーゼを不活性化し、そのような感染性病原体の侵入に対する防御に参加することができます。さらに、cystatinsは頻繁に構造機能研究におけるモデル酵素として使用されるパパインのようないくつかの植物のシステインプロテイナーゼを、抑制する。 N -およびC末端二ヘアピンループ(によって提供される、阻害剤の側から、2つのタンパク質間相互作用は疎水性接触によって支配されているパパイン3に示すように、とシスタチンBの複合体の三次元構造図1)。本研究では、我々は、C -末端の重要性とパパインの相互作用の分野で点突然変異を含むウシシスタチンBのバリアントを使用してパパインにバインドするためのシスタチンBの第二の結合ループを調べます。我々は、最初の特異的結合使用される4つのシスタチンBの亜種の濃度だけでなく、野生型タンパク質のことを決定する。アクティブシスタチンBの特異的結合濃度が決定されると、野生型およびパパインへの結合シスタチンBの突然変異体の速度と親和性定数はBiacore X100を使用して測定する。
5。楽器と試薬
- シスタチンBの亜種はCys3Ser/His75Gly、Cys3Ser/Leu73Gly、Cys3Ser/Tyr97AlaとCys3Serは、前述の4として生産されています。すべての変異体は、シスタチンBのジスルフィド結合不活性な二量体の形成を防止するため、位置3番目のセリン、システインの追加の置換が含まれています
- パパインのターゲットは、前述の5として用意されています。それは、プロテアーゼは触媒的に不活性レンダリング、アクティブ溝にCys25に接続されたメチルチオ基を有するS -(メチルチオ)パパイン(MMTS -パパイン)です。
- ビアコアX100プラスパッケージとビアコアX100は、特異的結合の濃度と結合速度を測定し解析するために使用されます。
- MMTS -パパインはBiacoreアミンカップリングキットを使用してセンサーチップCM5に固定化されている。
- ランは、25℃で行われ、バッファは、pH7.4の0.01 MのHepes、0.15MのNaCl、0.0034 M EDTA、および0.05%ポリソルベート20ですされています。
- シスタチンBの各バリアント間、センサー表面を10μl/分の流量で30秒間の20mM NaOHで再生成されます。
リガンドMMTS -パパインの6.Immobilization
シミュレーションプロジェクト分析のためのMMTS -パパインの共有結合
シミュレーションプロジェクトでは、速度が表面に検体分子の拡散(大量輸送の制限)によって制限される条件下では結合率の測定に依存しています。これは、リガンドの高い固定化レベルで愛用されています。 MMTS -パパインの固定化を設定し、ビアコアX100 Controlソフトウェアの固定化ウィザードを使用して実行した。
- 10μL/分の流量で7分間スクシンイミド(NHS)とカルボジイミド(EDC)の混合物の注入により、フローセル2の表面を活性化する。フローセル1を基準面として使用するために変更されません。
- 5μl/分の流量で15分間pH4.5中で酢酸ナトリウム緩衝液に50μg/mlでMMTS -パパインを注入する。
- エタノールアミンは、残りの活性エステルを無効にするには10μL/ minの流量で7分間噴射される。
全体のカップリング方法は、フローセル2に固定化〜3000 RU MMTS -パパインになるはずです。
動態解析のためのMMTS -パパインの共有結合
同じ手順は、速度論的解析では、固定化のレベルが拡散によって制限になって結合率を避けるために低くする必要があることを除いて、実際の速度論的解析のためにMMTS -パパインの固定化に使用されます。フローセル1を基準面として使用するためにもこのステップで変更されません。
- 7.1のようにNHSとEDCの混合物で表面の活性化した後、MMTS -パパインは、50秒のために1μg/mlので注入される。その後、表面は、ステップ7.3のようにエタノールの注入で非アクティブ化されます。
カップリングするノイズレベルは、この手順の後に約50 RUでなければなりません。
7。シミュレーションプロジェクトのアッセイを使用してシスタチンBの濃度の決定
- シミュレーションプロジェクトの実験はBiacore X100をプラスパッケージのシミュレーションプロジェクトウィザードに従って設定されています。約10nmの蛋白質は10〜100μL/分48秒重複の流量で注入されます。表面は各サイクルの間に20 mMのNaOHで再生成されます。
- 各流量のための空白の注射などがあります。
- タンパク質濃度は、その後、目を使ってデータバインディング(図3)から決定されますビアコアX100プラスパッケージの評価版ソフトウェアの電子シミュレーションプロジェクトの評価機能。
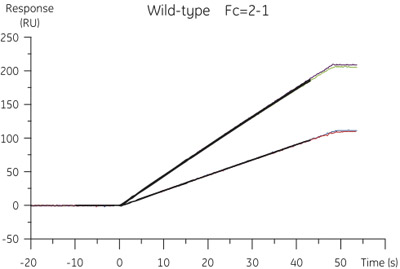
図2野生型シスタチンBの特異的結合濃度データのシミュレーションプロジェクトの分析からの結果が10と100μL/分の流量で得られたセンサーグラムから抽出された。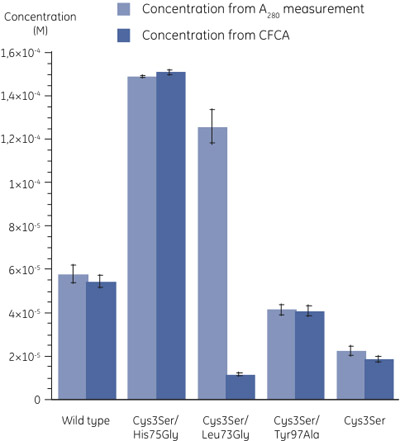
図3。280測定(N = 3)とシミュレーションプロジェクト(N = 2)を用いて決定した変異体の濃度は、。標準エラーは、エラーバーで示されます。 (6)で説明されているようにモル吸光係数を算出した。二つの方法によって決定されるCys3Ser/Leu73Gly変異体の濃度の値には大きな差が観察することができます。 - シミュレーションプロジェクトでその280の測定によって決定された濃度を比較するとき、それは(図3)ほとんどの場合、タンパク質が完全にアクティブな間、Cys3Ser/Leu73Glyバリアントのために、活性タンパク質の割合が非常に低いことは明らかである。下の表は、280で合計濃度に関連したシスタチンBの亜種の活動を示しています。
サンプル 280(%)との関係でシミュレーションプロジェクト 野生型 94 Cys3Ser/His75Gly 101 Cys3Ser/Leu73Gly 9 Cys3Ser/Tyr97Ala 99 Cys3Ser 83
8。パパインに結合シスタチンBの動態を測定
- シミュレーションプロジェクトの測定値に基づいて、2.5からシスタチンBの変異体のそれぞれに40 nmの範囲の2倍の濃度系列を調製する。
- 動力学の実験は、単一サイクルのアプローチでビアコアのX100に速度ウィザードを使用して設定されています。表面は、注射の間に再生成されますが、各分析サイクルの終了後に再生溶液として20mMのNaOHを使用していません。
- サンプルを含む各サイクルは、バッファの代わりにサンプルを注入したブランクサイクル、によって挟まれるように実験を設定します。
- 自動的に参照の空白の減算を実行するにはビアコアX100の動態の評価機能を使用するには、1:1の対話モデルを取り付ける場合は、その前に、データを減算。
- パパインにシスタチンB変異体の結合のために得られた実験データを図4に示されています。以下の表は、会合と解離の速度定数と反応速度解析で得られた平衡解離定数をまとめたものです。
サンプル K A(M -1 s -1と ) K D(S -1) K D(M) 野生型 1.8 × 10 6 0.41 × 10 -3 2.3 × 10 -10 Cys3Ser/His75Gly 1.1 × 10 6 1.7 × 10 -3 1.5 × 10 -9 Cys3Ser/Leu73Gly 1.1 × 10 6 23 × 10 -3 2.2 × 10 -8 Cys3Ser/Tyr97Ala 1.7 × 10 6 12 × 10 -3 7.1 × 10 -9 Cys3Ser 0.9 × 10 6 0.53 × 10 -3 5.8 × 10 -10 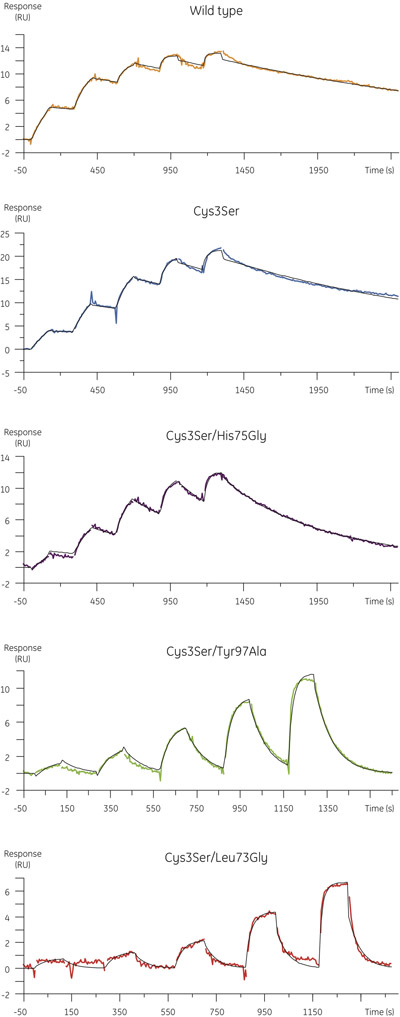
図4。MMTS -パパインに結合シスタチンBの変異体の動力学的プロファイルは、シングルサイクルカイネティクスを使用して決定。センサーグラムは空白と表示基準は、黒で重ねて1時01相互作用モデルのための運動フィットとデータを減算。 - 変異体の組合率は野生型のタンパク質(図5、上のパネル)に匹敵するものですが、変異体の解離速度定数は平衡解離の増加に対応し、大きさの近い2桁高くすることができます定数(図5、下のパネル)。

図5は。率と親和性定数の計算は、シミュレーションプロジェクトから得られた濃度に基づいていた。変異と関連するK A、K dおよびK D、の変化がグラフに示されている。 - 試料濃度は実験データから一定の会合速度の計算のパラメータなので、それはそれが正しいことが重要。代わりにシミュレーションプロジェクト280の測定に基づいて濃度を使用すると、Leu73、交換は他のシスタチンBの亜種に比べ約10倍遅く協会につながると思われる会合速度、のために重要であるという結論につながる。しかし、シミュレーションプロジェクトで測定された特異的結合濃度はこの場合の総タンパク質の約10%です。これは考慮に入れ、これを取られるとき、それはLeu73のための会合速度が他の変異体のそれに似ていることが明らかになる。したがって、シミュレーションプロジェクトは、このように相互作用のメカニズムの適切な解釈を可能に作るK AとK Dの正しい評価が可能になります。
ディスカッション
この作業では、4つの変異体と野生型シスタチンBは、シスタチンBとパパインの相互作用のための第二の結合ループとC末端の重要性を評価するために生産された。本研究では優位性と特異的結合濃度を決定し、構造と機能の関係を理解するために、タンパク質 - タンパク質相互作用の動態を解析するBiacoreのX100を使用しての使いやすさを示した。我々は、総タンパク質濃度の測定はこの場合には結合親和性と速度の決定に大きな測定誤差を導入する結合活性を、減少しているタンパク質変異体を明らかにしないことを示した。シスタチンBの亜種の特異的結合濃度はBiacore X100をとシミュレーションプロジェクトを使用して測定した。動態解析への入力としてシミュレーションプロジェクトで濃度測定を使用することにより相互作用のメカニズムの右の解釈を可能にする、信頼性の高い率との親和性定数をもたらした。
kはわずかに影響を受けたのに対し、変異体の減少親和性は、ほぼ独占的に増加したK D -値によるものであった。この動作は、2番目の結合ループ領域とC末端の両方がパパインに対する阻害剤の結合率のために重要ではないことを示しています。その代わり、彼らは主に複合体が形成された後、酵素に添付された阻害剤を保つことによって結合親和性に寄与する。
開示事項
資料
| Name | Company | Catalog Number | Comments |
| Biacore™ X100 System | GE Healthcare | BR-1100-73 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Biacore™ X100 Plus Package | GE Healthcare | BR-1007-98 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Sensor Chip CM5 | GE Healthcare | BR-1000-14 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Amine Coupling Kit | GE Healthcare | BR-1000-50 | |
| Acetate buffer pH 4.5, 50 ml | GE Healthcare | BR-1003-50 | |
| HBS-EP+ buffer 10X, 4 x 50 ml | GE Healthcare | BR-1008-26 | |
| Plastic Vials 11 mm | GE Healthcare | BR-1002-87 | |
| Rubber caps, type 2 | GE Healthcare | BR-1004-11 |
参考文献
- Christensen, L. L. H. Theoretical analysis of protein concentration determination using biosensor technology under conditions of partial mass transport limitation. Anal. Biochem. 249, 153-164 (1997).
- Sigmundsson, K., Mâsson, G., Rice, R., Beauchemin, N., Öbrink, B. Determination of active concentrations and association and dissociation rate constants of interacting biomolecules: an analytical solution to the theory for kinetic and mass transport limitations in biosensor technology and its experimental verification. Biochemistry. 41 (26), 8263-8276 (2002).
- Stubbs, M. T., Laber, B., Bode, W., Huber, R., Jerala, R., Lenarcic, B., Turk, V. The refined 2.4 A X-ray crystal structure of recombinant human stefin B in complex with the cysteine proteinase papain: a novel type of proteinase inhibitor interaction. EMBO J. 9 (6), 1939-1947 (1990).
- Pol, E., Björk, I. Importance of the second binding loop and the C-terminal end of cystatin B (Stefin B) for inhibition of cysteine proteinases. Biochemistry. 38 (32), 10519-10526 (1999).
- Björk, I., Pol, E., Raub-Segall, E., Abrahamson, M., Rowan, A. D., Mort, J. S. Differential changes in the association and dissociation rate constants for binding of cystatins to target proteinases occurring on N-terminal truncation of the inhibitors indicate that the interaction mechanism varies with different enzymes. Biochem. J. 299, 219-225 (1994).
- Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., Gray, T. How to measure and predict the molar absorption coefficient of a protein. ProteinScience. 4 (11), 2411-2423 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved