Method Article
L'importanza della concentrazione della proteina corretta per Cinetica e determinazione affinità nella struttura-funzione di analisi
In questo articolo
Riepilogo
Noi applichiamo un'etichetta priva di analisi di interazioni proteina utilizzando X100 Biacore per la struttura-funzione di analisi del legame di mutanti diversi cistatina B di papaina attraverso la caratterizzazione cinetica. Calibrazione senza analisi concentrazione (ACCP) misura la concentrazione di proteine con attività di legame mantenuto senza la necessità di una curva standard. Abbiamo dimostrato che la conferma delle concentrazioni utilizzando ACCP aumenta l'affidabilità delle analisi cinetica e che le costanti cinetiche possono essere affidabile anche se l'attività di una proteina ricombinante è ridotta.
Abstract
In questo studio, esploriamo l'interazione tra il bovino B inibitore della proteasi cistatina cisteina e una forma cataliticamente inattiva di papaina (Fig. 1), una proteasi cisteina stabilimento, da un'analisi in tempo reale senza etichetta con X100 Biacore. Diverse varianti di cistatina B con mutazioni puntiformi nelle aree di interazione con la papaina, vengono prodotti. Per ogni variante di cistatina B si determina la concentrazione specifico legame con la calibrazione senza analisi concentrazione (ACCP) e confrontare i valori ottenuti con la concentrazione di proteine totali, come determinato da A
Protocollo

Figura 1. La struttura tridimensionale della cistatina complesso B (blu) con papaina (giallo). Mutato residui cistatina B sono mostrati in rosso.
1. Principi di Label-free Analisi interazione con i sistemi Biacore
In un tipico esperimento senza etichetta vincolante con un sistema Biacore, una biomolecola chiamato il 'ligand' è attaccato alla superficie di un chip del sensore. Un sistema di canali di flusso porta il suo partner di legame, chiamato il 'analita', a contatto con la superficie del chip, in cui la rilevazione si svolge. Quando l'analita si lega al ligando, con conseguente cambiamento di accumulare massa in superficie è rilevata da risonanza plasmonica superficiale (SPR). La risposta SPR è proporzionale alla quantità di analita vincolanti.
Dal momento che l'associazione è misurata in tempo reale, la cinetica di associazione e dissociazione costanti di velocità per una specifica interazione può essere determinato. Da queste costanti, è possibile calcolare l'affinità come la dissociazione costante di equilibrio. E 'anche possibile calcolare l'affinità di dati allo steady-state vincolanti. Una metodologia simile può essere utilizzato anche per determinare la concentrazione di una proteina che si lega specificamente ad un ligando sulla superficie.
2. Analizzando le proprietà cinetiche di interazione proteina-proteina
In X100 Biacore, analisi cinetiche possono essere eseguite utilizzando a ciclo unico cinetica. In un ciclo unico esperimento di cinetica, una serie concentrazione dell'analita viene iniettato in un ciclo di analisi del singolo senza rigenerazione della superficie tra le iniezioni. Pertanto, a ciclo unico cinetica consente l'analisi cinetica quando è difficile trovare le condizioni adatte rigenerazione.
Una volta che i dati di un esperimento di cinetica è stato raccolto, il software X100 Biacore valutazione genera i valori di k A, K d e K D inserendo i dati in un modello di interazione.
3. Approcci per determinare la concentrazione delle proteine
Analizzando le interazioni tra biomolecole è importante per capire la loro funzione. Che caratterizza il legame di proteine ad altre proteine, di acidi nucleici, o di piccole molecole è fondamentale per la ricerca biochimica, e trova impiego in molti altri settori tra cui la scoperta di farmaci.
Per la misurazione accurata della cinetica interazione tra due proteine interagiscono, è essenziale conoscere la concentrazione di proteine legame specifico nel campione sperimentale che viene utilizzato come analita. Una lettura spettrofotometro di A 280 o test colorimetrici come quella impiegando reagente di Bradford è comunemente usato per determinare la concentrazione di proteine totali. Tuttavia, le impurità proteina può influenzare il risultato. Ancora più importante, entrambe le forme attive e inattive della proteina sono inclusi nella concentrazione di proteine totali. In particolare nel caso di proteine ricombinanti, che può essere inattivo a causa di piegatura errato, è importante per determinare la percentuale di proteine legame specifico nel campione.
In X100 Biacore, concentrazione relative a specifiche attività di legame può essere determinato dal confronto dei livelli di risposta legame con una curva di calibrazione derivato da uno standard conosciuto, o utilizzando la calibrazione-Free metodologia più recente introduzione Analisi Concentrazione (ACCP). ACCP non si basa su uno standard. Pertanto, ACCP è particolarmente utile nel caso di studiare forme mutanti di proteine, dove gli standard di solito non sono disponibili.
In un esperimento ACCP, il tasso iniziale legame è misurata a diverse portate in condizioni in cui la diffusione di campione alla superficie del chip è rate-limiting. Il coefficiente di diffusione dell'analita, le dimensioni della cella di flusso e le portate vengono presi in considerazione nel calcolo della concentrazione specifici vincolante dal 1,2 iniziale tasso vincolanti.
In un esperimento cinetica, la concentrazione dell'analita è utilizzato nel calcolo del tasso costante cinetica di associazione e l'affinità dai dati sperimentali. ACCP e misurazione cinetica nei sistemi Biacore entrambi si basano sulle proprietà stessa interazione. Pertanto, usando la concentrazione specifico legame determinata da analisi Biacore, piuttosto che la concentrazione di proteine totali, aumenta l'affidabilità dei risultati.
4. Usando l'analisi Biacore per caratterizzare l'interazione tra la cistatina B e Papaina
Cistatina B dei mammiferi è un inibitore reversibile, inibitore competitivo con le proteine e tight-binding di papaina, come proteinasi cisteina, principalmente catepsina B, H, K, L e S. Queste proteine sono principalmente coinvolti in NONSelettiva degradazione delle proteine intracellulari. Cistatine si presume per proteggere le cellule ei tessuti da proteolisi inappropriate da questi enzimi. Hanno anche inattivare proteinasi cisteina da parassiti e virus e può partecipare alla difesa contro l'invasione di questi agenti infettivi. Inoltre, cistatine inibire diversi cisteina proteinasi vegetali, come la papaina, che è spesso utilizzata come un enzima modello di struttura-funzione studi. La struttura tridimensionale del complesso cistatina B con papaina 3 mostra che l'interazione tra le due proteine è dominato da contatti idrofobiche, che, dal lato inibitori, sono forniti da N-e C-terminale e due anse a gomito ( Figura 1). In questo studio, si esamina l'importanza del C-terminale e il secondo ciclo legame di cistatina B per il legame alla papaina utilizzando bovina cistatina B varianti contenenti mutazioni puntiformi nelle aree di interazione con papaina. Per prima cosa determinare la concentrazione specifico legame delle quattro varianti di cistatina B utilizzati, così come quella della proteina wild-type. Una volta che le concentrazioni specifico legame di cistatina B attivi sono determinati, le costanti di velocità e l'affinità di tipo selvatico e varianti mutanti della cistatina B legame con la papaina sono misurati utilizzando X100 Biacore.
5. Strumenti e reagenti
- Le varianti cistatina B Cys3Ser/His75Gly, Cys3Ser/Leu73Gly, Cys3Ser/Tyr97Ala e Cys3Ser sono prodotti come descritto in precedenza 4. Tutti i mutanti contengono una sostituzione aggiuntiva di cisteina a serina in posizione 3, per evitare la formazione di disolfuro-linked dimeri inattivi di cistatina B.
- L'obiettivo papaina è anche preparato come descritto in precedenza 5. Si tratta di S-(metiltio) papaina (MMTS-papaina) con un gruppo collegato al metiltio Cys25 nella fessura attiva, rendendo il proteasi cataliticamente inattiva.
- X100 Biacore con X100 Biacore Package Plus è usato per misurare e analizzare le concentrazioni specifiche vincolanti e cinetica vincolanti.
- MMTS-papaina è immobilizzato su CM5 Chip sensore utilizzando Biacore Kit di accoppiamento Amine.
- Le piste sono eseguite a 25 ° C, e il buffer è di 0,01 Hepes M a pH 7,4, 0,15 M di NaCl, 0,0034 M EDTA, e 0,05% polisorbato 20.
- Tra ogni variante di cistatina B, la superficie del sensore è rigenerato con 20 mM NaOH per 30 secondi ad una portata di 10 L / min.
6.Immobilization del Ligand MMTS-papaina
Attacco covalente di MMTS-papaina per ACCP analisi
ACCP si basa sulla misurazione del tasso di legame in condizioni in cui è limitato il tasso di diffusione delle molecole di analita alla superficie (limitazione di trasporto di massa). Ciò è favorito da livelli elevati di immobilizzazione del ligando. Immobilizzazione di MMTS-papaina è stata creata ed eseguire utilizzando la procedura guidata immobilizzazione del software di controllo X100 Biacore.
- Attivare la superficie in cella di flusso 2 per l'iniezione di una miscela di succinimide (NHS) e carbodiimmide (EDC) per 7 minuti ad un flusso di 10 L / min. Cella di flusso 1 è lasciato invariato al fine di essere usato come superficie di riferimento.
- Iniettare MMTS-papaina a 50μg/ml in tampone sodio acetato a pH 4,5 per 15 minuti ad un flusso di 5 microlitri / min.
- Etanolammina viene iniettato per 7 minuti ad un flusso di 10 L / min per disattivare rimanenti esteri attivi.
La procedura di accoppiamento tutto dovrebbe tradursi in ~ 3000 RU MMTS-papaina immobilizzato nella cella di flusso 2.
Attacco covalente di MMTS-papaina per l'analisi cinetica
La stessa procedura viene utilizzata per immobilizzare MMTS-papaina per l'analisi cinetica, con la sola differenza che in analisi cinetica, il livello di immobilizzazione deve essere basso per evitare il tasso di diventare vincolante limitata per diffusione. Cella di flusso 1 è lasciato non modificato in questa fase anche per essere usato come superficie di riferimento.
- Dopo l'attivazione della superficie con la miscela di NHS e EDC come in 7.1, MMTS-papaina è iniettato a 1μg/ml per 50 secondi. Dopo che la superficie viene disattivato con un'iniezione di etanolamina come al punto 7.3.
Il livello di accoppiamento deve essere di circa il 50 RU dopo questa procedura.
7. Concentrazione di cistatina B Determinazione del saggio di ACCP
- L'esperimento ACCP è impostato secondo la procedura guidata ACCP in Biacore X100 Plus Package. Circa 10 nM proteina viene iniettata a portate 10 e 100 l / min in duplice copia per 48 secondi. La superficie è rigenerato con 20 mM di NaOH tra ogni ciclo.
- Comprendono le iniezioni in bianco per ogni portata.
- La concentrazione di proteina è quindi determinato dalla associazione dei dati (Figura 3) utilizzando °e ACCP caratteristica valutazione dei X100 Biacore Inoltre la valutazione del software pacchetto.
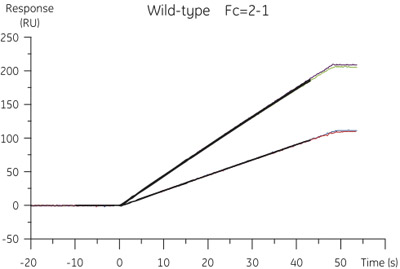
Figura 2. I risultati dell'analisi ACCP di wild-type cistatina B. I dati specifici concentrazione vincolanti è stato estratto dal sensorgrams ottenuto a portate di 10 e 100 l / min.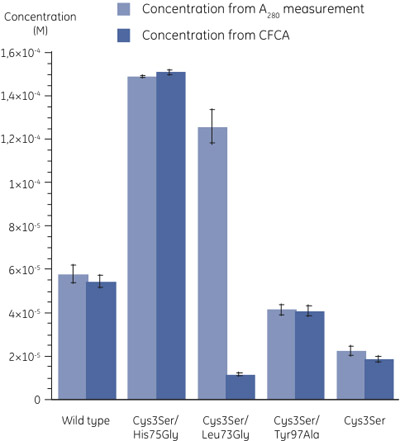
Concentrazioni Figura 3. Dei mutanti determinato utilizzando A 280 misurazioni (n = 3) e ACCP (n = 2). Gli errori standard sono indicati da barre di errore. I coefficienti di assorbimento molare sono stati calcolati come descritto in (6). Una grande differenza nei valori di concentrazione Cys3Ser/Leu73Gly mutante determinato con i due metodi possono essere osservati. - Se si confronta la concentrazione determinata da una misura 280 con quella da ACCP, è chiaro che, mentre nella maggior parte dei casi la proteina è pienamente attiva, per la variante Cys3Ser/Leu73Gly, la frazione di proteina attiva è molto basso (Figura 3). La tabella qui sotto mostra le attività della cistatina B varianti legate alla concentrazione totale da A 280.
Campione ACCP rispetto ad A 280 (%) Tipo selvatico 94 Cys3Ser/His75Gly 101 Cys3Ser/Leu73Gly 9 Cys3Ser/Tyr97Ala 99 Cys3Ser 83
8. Misurazione della Cinetica di cistatina B legame Papaina
- Sulla base delle misurazioni ACCP, preparare una duplice serie di concentrazione da 2,5 a 40 Nm per ciascuna delle varianti della cistatina B.
- L'esperimento cinetica viene configurato tramite la procedura guidata cinetica in X100 Biacore con l'approccio singolo ciclo. La superficie non viene rigenerato tra iniezioni, ma dopo la fine di ogni ciclo di analisi utilizzando 20 mM NaOH come soluzione di rigenerazione.
- Impostare l'esperimento in modo che ogni ciclo che contiene campione è affiancata da un ciclo di vuoto, dove viene iniettato buffer invece di campione.
- Utilizzare la funzione di valutazione cinetica in X100 Biacore per eseguire automaticamente sottrazioni vuoto di riferimento sottratto i dati prima di montare un modello di interazione 1:1.
- I dati sperimentali ottenuti per il legame di varianti cistatina B di papaina è mostrata in Figura 4. La tabella seguente riassume l'associazione e costanti di velocità di dissociazione e la costante di equilibrio di dissociazione ottenuti nelle analisi cinetica.
Campione k un (M -1 s -1) k d (s -1) K D (M) Tipo selvatico 1,8 x 10 6 0,41 x 10 -3 2,3 x 10 -10 Cys3Ser/His75Gly 1,1 x 10 6 1,7 x 10 -3 1,5 x 10 -9 Cys3Ser/Leu73Gly 1,1 x 10 6 23 x 10 -3 2,2 x 10 -8 Cys3Ser/Tyr97Ala 1,7 x 10 6 12 x 10 -3 7,1 x 10 -9 Cys3Ser 0.9 x 10 6 0,53 x 10 -3 5,8 x 10 -10 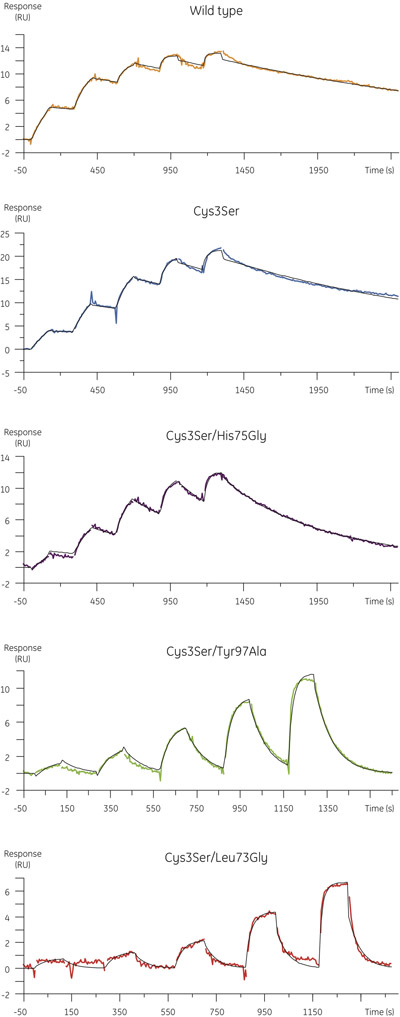
Figura 4. Profili cinetici per le varianti B cistatina legame MMTS-papaina determinato utilizzando cinetica singolo ciclo. Sensorgrams spettacolo vuoto e di riferimento sottratto dati con fit cinetici per 1:1 modello di interazione sovrapposti in nero. - Mentre i tassi di associazione dei mutanti sono paragonabili a quella della proteina wild-type (Figura 5, pannello superiore), le costanti di velocità di dissociazione dei mutanti può essere superiore di quasi due ordini di grandezza, con un corrispondente aumento l'equilibrio di dissociazione costante (Figura 5, riquadro inferiore).

Figura 5. I calcoli delle costanti di velocità e l'affinità sono stati basati sulle concentrazioni ottenute da ACCP. I cambiamenti di k A, K d e K D, associato con le mutazioni sono rappresentati nei grafici. - Dal momento che la concentrazione del campione è un parametro per il calcolo del tasso di associazione costante dai dati sperimentali, èimportante che sia corretta. Utilizzando la concentrazione in base alla misura A 280 invece di CFCA porterebbe alla conclusione che Leu73 è importante per il tasso di associazione, in cui la sostituzione sembra tradursi in circa 10 volte più lento di associazione altre varianti cistatina B. Tuttavia, la concentrazione specifico legame misurata ACCP è solo il 10% delle proteine totali, in questo caso. Quando questo viene preso in considerazione questo diventa chiaro che il tasso di associazione per Leu73 è simile a quella della altre varianti. Pertanto, ACCP permette una corretta valutazione di k a e K D rendendo così possibile l'interpretazione appropriata del meccanismo di interazione.
Discussione
In questo lavoro, quattro mutanti e selvaggia cistatina B tipo sono stati prodotti al fine di valutare l'importanza del secondo ciclo vincolante e C-terminale per l'interazione tra cistatina B e la papaina. Questo studio ha dimostrato il vantaggio e la facilità di utilizzo X100 Biacore per determinare la concentrazione vincolanti e specifici per analizzare la cinetica di interazioni proteina-proteina al fine di comprendere le relazioni tra struttura e funzione. Abbiamo dimostrato che misura la concentrazione totale di proteine non rivela le varianti proteiche che hanno ridotto l'attività vincolante, che in questo caso introduce un errore significativo di misura nella determinazione di affinità di legame e cinetica. Le concentrazioni specifico legame delle varianti della cistatina B sono stati determinati utilizzando ACCP con X100 Biacore. Mediante misure di concentrazione di ACCP come input per l'analisi cinetica portato a tasso affidabili e costanti di affinità, permettendo così la giusta interpretazione del meccanismo di interazione.
Le affinità diminuzione dei mutanti erano quasi esclusivamente a causa di un maggiore K D-value, mentre k uno è stato colpito solo leggermente. Questo comportamento indica che sia la seconda regione ciclo vincolante e il C-terminale non sono importanti per il tasso di legame inibitore alla papaina. Al contrario, contribuiscono ad affinità di legame soprattutto mantenendo l'inibitore attaccato al enzima una volta che il complesso è stato formato.
Divulgazioni
Materiali
| Name | Company | Catalog Number | Comments |
| Biacore™ X100 System | GE Healthcare | BR-1100-73 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Biacore™ X100 Plus Package | GE Healthcare | BR-1007-98 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Sensor Chip CM5 | GE Healthcare | BR-1000-14 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Amine Coupling Kit | GE Healthcare | BR-1000-50 | |
| Acetate buffer pH 4.5, 50 ml | GE Healthcare | BR-1003-50 | |
| HBS-EP+ buffer 10X, 4 x 50 ml | GE Healthcare | BR-1008-26 | |
| Plastic Vials 11 mm | GE Healthcare | BR-1002-87 | |
| Rubber caps, type 2 | GE Healthcare | BR-1004-11 |
Riferimenti
- Christensen, L. L. H. Theoretical analysis of protein concentration determination using biosensor technology under conditions of partial mass transport limitation. Anal. Biochem. 249, 153-164 (1997).
- Sigmundsson, K., Mâsson, G., Rice, R., Beauchemin, N., Öbrink, B. Determination of active concentrations and association and dissociation rate constants of interacting biomolecules: an analytical solution to the theory for kinetic and mass transport limitations in biosensor technology and its experimental verification. Biochemistry. 41 (26), 8263-8276 (2002).
- Stubbs, M. T., Laber, B., Bode, W., Huber, R., Jerala, R., Lenarcic, B., Turk, V. The refined 2.4 A X-ray crystal structure of recombinant human stefin B in complex with the cysteine proteinase papain: a novel type of proteinase inhibitor interaction. EMBO J. 9 (6), 1939-1947 (1990).
- Pol, E., Björk, I. Importance of the second binding loop and the C-terminal end of cystatin B (Stefin B) for inhibition of cysteine proteinases. Biochemistry. 38 (32), 10519-10526 (1999).
- Björk, I., Pol, E., Raub-Segall, E., Abrahamson, M., Rowan, A. D., Mort, J. S. Differential changes in the association and dissociation rate constants for binding of cystatins to target proteinases occurring on N-terminal truncation of the inhibitors indicate that the interaction mechanism varies with different enzymes. Biochem. J. 299, 219-225 (1994).
- Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., Gray, T. How to measure and predict the molar absorption coefficient of a protein. ProteinScience. 4 (11), 2411-2423 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon