Method Article
A importância da concentração de proteína correta para Cinética e Determinação Affinity na estrutura-função Análise
Resumo
Nós aplicamos rótulo sem análise da interação da proteína usando X100 Biacore para estrutura-função de análise da ligação de mutantes B várias cistatina à papaína através da caracterização cinética. Calibração livre de análise de concentração (ACCP) mede a concentração de proteína com actividade de ligação retida sem a necessidade de uma curva padrão. Nós mostramos que a confirmação de concentrações usando ACCP aumenta a confiabilidade da análise cinética e que constantes cinéticas pode ser determinada de forma confiável, mesmo que a atividade de uma proteína recombinante é reduzida.
Resumo
Neste estudo, nós exploramos a interação entre a cisteína protease B bovina cistatina inibidor e uma forma cataliticamente inativos de papaína (Fig. 1), uma protease cisteína planta, por análise em tempo real label-free usando X100 Biacore. Variantes cistatina B com várias mutações pontuais nas áreas de interação com papaína, são produzidos. Para cada variante B cistatina vamos determinar a sua concentração específicos de ligação utilizando a calibragem sem análise de concentração (ACCP) e comparar os valores obtidos com a concentração de proteína total, conforme determinado pelo A
Protocolo

Figura 1. A estrutura tridimensional da cistatina do complexo B (azul) com papaína (amarelo). Resíduos B mutante cistatina são mostrados em vermelho.
1. Princípios de etiqueta livre de Análise de Interação usando Biacore Sistemas
Em um experimento típico rótulo sem ligação usando um sistema Biacore, uma biomolécula chamado de "ligante" está ligado à superfície de um chip sensor. Um sistema de fluxo de canais traz seu parceiro de ligação, denominado o "analito", em contato com a superfície do chip, onde a detecção ocorre. Quando o analito se liga ao ligante, a mudança, resultando em acúmulo de massa na superfície é detectada por ressonância plasmon de superfície (SPR). A resposta SPR é proporcional à quantidade de analito vinculativo.
Uma vez que a ligação é medido em tempo real, a associação cinética e constantes de velocidade de dissociação para uma interação específica pode ser determinada. A partir dessas constantes, é possível calcular a afinidade como a dissociação constante de equilíbrio. Também é possível calcular a afinidade a partir de dados de estado estacionário de ligação. Uma metodologia semelhante pode também ser usado para determinar a concentração de uma proteína que se liga especificamente a um ligante na superfície.
2. Analisar propriedades cinéticas de uma interação proteína-proteína
Em X100 Biacore, análise cinética pode ser realizada em um único ciclo de cinética. Em um ensaio de cinética de ciclo único, uma série de concentração do analito é injetado em um ciclo única análise sem regeneração da superfície entre as injeções. Portanto, um único ciclo de cinética permite a análise cinética quando é difícil encontrar condições adequadas de regeneração.
Uma vez que os dados de um experimento de cinética tiver sido coletado, Biacore software de avaliação X100 gera os valores de k a, k d, e D K ajustando os dados para um modelo de interação.
3. Abordagens para a determinação da concentração de proteínas
Analisar as interações entre biomoléculas é importante para compreender a sua função. Caracterizar a ligação de proteínas a outras proteínas, para ácido nucléico, ou para pequenas moléculas é fundamental para pesquisas bioquímicas, e encontra uso em muitas outras áreas, incluindo a descoberta da droga.
Para uma medição precisa da cinética de interação entre duas proteínas interagem é essencial para conhecer a concentração de proteína se liga especificamente na amostra experimental que é usado como analito. Uma leitura de A espectrofotômetro 280 ou ensaios colorimétricos como o emprego de reagente de Bradford é comumente usado para determinar a concentração de proteína total. No entanto, impurezas proteína pode afetar o resultado. Mais importante ainda, ambas as formas ativa e inativa da proteína estão incluídos na concentração de proteína total. Particularmente no caso de proteínas recombinantes, que podem ser inativo devido a dobrar incorreta, é importante para determinar a porcentagem de proteína se liga especificamente na amostra.
Em X100 Biacore, concentração relacionados com a actividade ligação específica pode ser determinada pela comparação dos níveis de resposta obrigatória a uma curva de calibração deriva de um padrão conhecido, ou usando a calibração livre de metodologia mais recentemente introduzido Análise de Concentração (ACCP). ACCP não depende de um padrão. Portanto, ACCP é particularmente útil no caso de se estudar formas mutantes de proteínas, onde as normas não são geralmente disponíveis.
Em um experimento ACCP, a taxa inicial de ligação é medida a taxas de fluxo diferentes em condições quando a difusão de amostra à superfície do chip é limitante. O coeficiente de difusão do analito, as dimensões da célula de fluxo e as taxas de fluxo são levados em conta no cálculo da concentração específicos de ligação a partir do 1,2 taxa inicial de ligação.
Em um ensaio de cinética, a concentração do analito é usado no cálculo da taxa de associação constante cinética e da afinidade a partir dos dados experimentais. ACCP e medição cinética em sistemas Biacore ambos dependem as propriedades mesma interação. Portanto, usando a concentração de ligação específico determinado pela análise Biacore, ao invés de concentração de proteína total, aumenta a confiabilidade dos resultados.
4. Usando a análise Biacore para caracterizar a interação entre cistatina B e papaína
Cistatina B dos mamíferos é um inibidor reversível da proteína competitiva e tight-binding de proteinases papaína-like cisteína, principalmente catepsina B, H, K, L e S. Estas proteínas são principalmente envolvidos na nonsdegradação da proteína intracelular eletiva. Cistatinas presume-se a proteger as células e tecidos de proteólise inadequado por estas enzimas. Eles também inativar cisteína proteinases de parasitas e vírus e podem participar na defesa contra a invasão de tais agentes infecciosos. Além disso, cistatinas inibir proteinases de várias fábricas cisteína, como papaína, que é freqüentemente usado como uma enzima modelo em estudos de estrutura-função. A estrutura tridimensional do complexo B cistatina com papaína 3 mostra que a interação entre as duas proteínas é dominado por contatos hidrofóbicos, que, do lado inibidor, são fornecidos pelo N-e C-terminal termina e dois loops hairpin ( Figura 1). Neste estudo, examinamos a importância do fim C-terminal e segundo loop de ligação da cistatina B para a ligação com papaína usando cistatina B variantes bovina contendo mutações pontuais nas áreas de interação com papaína. Primeiro, determinar a concentração de ligação específico das quatro variantes cistatina B utilizado, bem como da proteína de tipo selvagem. Uma vez que as concentrações específicos de ligação a cistatina B são determinados ativos, as constantes de velocidade e afinidade de tipo selvagem e variantes mutantes de cistatina B ligação a papaína são medidos através de X100 Biacore.
5. Instrumento e Reagentes
- As variantes B cistatina Cys3Ser/His75Gly, Cys3Ser/Leu73Gly, Cys3Ser/Tyr97Ala e Cys3Ser são produzidos conforme descrito anteriormente 4. Todos os mutantes conter uma substituição adicional de cisteína por serina na posição 3, para impedir a formação de dissulfeto de-linked dímeros inativos da cistatina B.
- O alvo papaína também está preparado como descrito anteriormente 5. É S-(metiltio) papaína (MMTS-papaína), tendo um grupo metiltio anexado ao Cys25 na fenda ativa, tornando a protease cataliticamente inativo.
- Biacore X100 X100 com Biacore pacote Plus é usado para medir e analisar as concentrações específicas de ligação e cinética de ligação.
- MMTS-papaína é imobilizado em CM5 Chip Sensor usando Biacore Kit de acoplamento Amine.
- As corridas são realizadas a 25 ° C, eo buffer é de 0,01 M Hepes, pH 7,4, 0,15 M NaCl, 0,0034 M EDTA, e 0,05% polissorbato 20.
- Entre cada variante de cistatina B, a superfície do sensor é regenerada com NaOH 20 mM por 30 segundos a uma vazão de 10 ml / min.
6.Immobilization do Ligand MMTS-papaína
Ligação covalente de MMTS-papaína para ACCP análise
ACCP depende de medição de taxa de ligação em condições onde a taxa é limitada por difusão de moléculas de analito para a superfície (limitação de transporte de massa). Isto é favorecido por níveis elevados de imobilização do ligante. Imobilização de MMTS-papaína foi criado e executado usando o assistente de imobilização de Biacore software de controle X100.
- Ativar a superfície em célula de fluxo 2 por injeção de uma mistura de succinimide (NHS) e carbodiimida (EDC) durante 7 minutos a uma vazão de 10 ml / min. Uma célula de fluxo é deixada sem modificações, a fim de ser usado como uma superfície de referência.
- Injetar MMTS-papaína na 50μg/ml em tampão acetato de sódio em pH 4,5 por 15 minutos a uma vazão de 5 mL / min.
- Etanolamina é injetado durante 7 minutos a uma vazão de 10 ml / min para desativar restantes ésteres ativo.
O procedimento de acoplamento inteiro deve resultar em ~ 3000 MMTS RU-papaína imobilizada em célula de fluxo 2.
Ligação covalente de MMTS-papaína para análise cinética
O mesmo procedimento é utilizado para imobilizar MMTS-papaína para análise cinética, com a única diferença é que na análise cinética, o nível de imobilização precisa ser baixo para evitar a taxa de ligação a tornar-se limitada por difusão. Uma célula de fluxo é deixado inalterado nesta etapa, assim, a fim de ser usado como uma superfície de referência.
- Após a ativação da superfície com a mistura de NHS e EDC como em 7.1, MMTS-papaína é injetado em 1μg/ml por 50 segundos. Depois que a superfície é desativado com uma injeção de etanolamina como no passo 7.3.
O nível de acoplamento deve ser aproximadamente 50 RU após este procedimento.
7. Concentração de B determinar Cistatina utilizando o ensaio ACCP
- O experimento ACCP está configurado de acordo com o assistente ACCP em Biacore X100 Além do pacote. Aproximadamente 10 nM da proteína é injetada em taxas de fluxo 10 e 100 l / min em duplicado para 48 segundos. A superfície é regenerada com NaOH 20 mM entre cada ciclo.
- Incluem injeções em branco para cada vazão.
- A concentração de proteína é, então, determinada a partir da ligação de dados (Figura 3) usando ªe recurso de avaliação da ACCP Biacore X100 Plus software de avaliação do pacote.
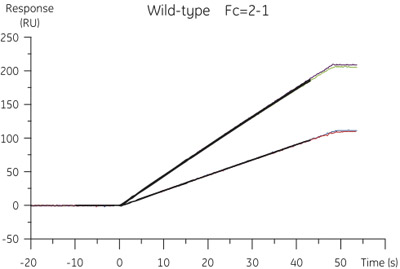
Figura 2. Resultados da análise ACCP de tipo selvagem B. cistatina A concentração de dados específicos de ligação foi extraído do sensorgrams obtidos a taxas de fluxo de 10 e 100 l / min.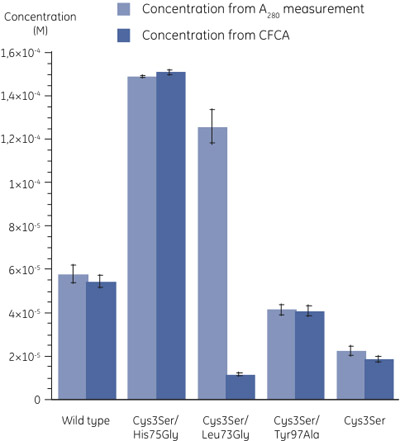
Figura 3. Concentrações dos mutantes determinada utilizando Uma medida 280 (n = 3) e ACCP (n = 2). Os erros padrão são indicados por barras de erro. Os coeficientes de absorção molar foram calculados como descrito em (6). A grande diferença nos valores de concentração de Cys3Ser/Leu73Gly mutante determinada pelos dois métodos podem ser observados. - Ao comparar a concentração determinada por uma medição 280 com que, ACCP, é claro que, embora na maioria dos casos a proteína está totalmente ativo, para a variante Cys3Ser/Leu73Gly, a fração de proteína ativa é muito baixa (Figura 3). A tabela abaixo mostra as atividades de variantes cistatina B relacionadas às concentrações totais por A 280.
Amostra ACCP em relação ao A 280 (%) Tipo selvagem 94 Cys3Ser/His75Gly 101 Cys3Ser/Leu73Gly 9 Cys3Ser/Tyr97Ala 99 Cys3Ser 83
8. Medição da Cinética de cistatina B ligação com papaína
- Com base nas medições ACCP, preparar uma série de concentração duas vezes variando de 2,5 a 40 nM de cada uma das variantes B cistatina.
- O ensaio de cinética é configurado usando o assistente cinética no X100 Biacore com a abordagem de um único ciclo. A superfície não é regenerado entre as injeções, mas após o término de cada ciclo de análise, usando NaOH 20 mM como solução de regeneração.
- Configure o experimento de modo que cada ciclo contendo amostra é ladeada por um ciclo em branco, onde buffer é injetado em vez de amostra.
- Use o recurso de avaliação cinética no X100 Biacore para executar automaticamente subtrações em branco de referência subtraído dos dados antes de montar um modelo de interação 01:01.
- Os dados experimentais obtidos para a ligação de variantes B cistatina a papaína é mostrado na Figura 4. A tabela abaixo resume a associação e constantes de velocidade de dissociação e as constantes de equilíbrio de dissociação obtidos na análise cinética.
Amostra k A (M -1 s -1) k d (s -1) K D (M) Tipo selvagem 1,8 x 10 6 0,41 x 10 -3 2,3 x 10 -10 Cys3Ser/His75Gly 1,1 x 10 6 1,7 x 10 -3 1,5 x 10 -9 Cys3Ser/Leu73Gly 1,1 x 10 6 23 x 10 -3 2,2 x 10 -8 Cys3Ser/Tyr97Ala 1,7 x 10 6 12 x 10 -3 7,1 x 10 -9 Cys3Ser 0,9 x 10 6 0,53 x 10 -3 5,8 x 10 -10 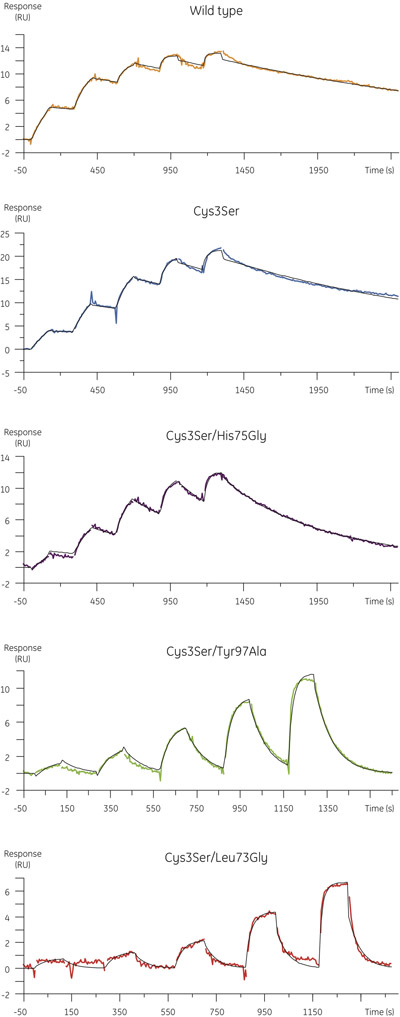
Figura 4. Perfis cinéticos para as variantes cistatina B ligação a MMTS-papaína determinada usando a cinética de um único ciclo. Sensorgrams mostrar em branco-e referência subtraído dos dados com ajuste cinéticos 01:01 modelo de interação sobrepostos em preto. - Enquanto as taxas de associação dos mutantes são comparáveis aos da proteína de tipo selvagem (Figura 5, painel superior), as constantes de velocidade de dissociação dos mutantes pode ser maior em cerca de duas ordens de magnitude, com um aumento correspondente no equilíbrio de dissociação constante (Figura 5, painel inferior).

Figura 5. Os cálculos das constantes de velocidade e afinidade foram baseados nas concentrações obtidas ACCP. As mudanças de k a, d k e K D, associado com as mutações são representadas nos gráficos. - Desde concentração da amostra é um parâmetro para o cálculo da taxa de associação constante a partir dos dados experimentais, éimportante que ele está correto. Usando a concentração com base no A 280 em vez de medição ACCP levaria à conclusão de que Leu73 é importante para a taxa de associação, onde a substituição parece resultar em cerca de 10 vezes mais lenta do que a associação variantes B cistatina outros. No entanto, a concentração de ligação específico medido pela ACCP é apenas cerca de 10% da proteína total neste caso. Quando isso é levado em conta este aspecto torna-se claro que a taxa de associação para Leu73 é semelhante ao das outras variantes. Portanto, ACCP permite a avaliação correta de um k D e K, tornando possível a interpretação adequada do mecanismo de interação.
Discussão
Neste trabalho, quatro mutantes e B cistatina tipo selvagem foram produzidos a fim de avaliar a importância do segundo laço vinculativo e C-terminal termina para a interação entre a cistatina B e papaína. Este estudo demonstrou a vantagem e facilidade de usar X100 Biacore para determinar a concentração de ligação específicos e analisar a cinética de interações proteína-proteína, a fim de compreender a estrutura-função relacionamentos. Nós mostramos que medir a concentração de proteína total não revela as variantes de proteína que reduziram a atividade de ligação, que neste caso apresenta um erro de medição significativos na determinação da afinidade de ligação e cinética. As concentrações de ligação específico das variantes B cistatina foram determinados utilizando ACCP com X100 Biacore. Usando medições de concentração por ACCP como entrada para a análise cinética resultou em taxa de confiança e constantes de afinidade, permitindo assim que a interpretação correta do mecanismo de interação.
As afinidades diminuição dos mutantes eram quase exclusivamente devido a um aumento d k-valor, enquanto k um foi afetada apenas ligeiramente. Este comportamento indica que tanto a região segundo laço de ligação eo fim C-terminal não são importantes para a taxa de ligação do inibidor de papaína. Em vez disso, elas contribuem para afinidade de ligação principalmente por manter o inibidor ligado à enzima uma vez que o complexo foi formado.
Divulgações
Materiais
| Name | Company | Catalog Number | Comments |
| Biacore™ X100 System | GE Healthcare | BR-1100-73 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Biacore™ X100 Plus Package | GE Healthcare | BR-1007-98 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Sensor Chip CM5 | GE Healthcare | BR-1000-14 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html |
| Amine Coupling Kit | GE Healthcare | BR-1000-50 | |
| Acetate buffer pH 4.5, 50 ml | GE Healthcare | BR-1003-50 | |
| HBS-EP+ buffer 10X, 4 x 50 ml | GE Healthcare | BR-1008-26 | |
| Plastic Vials 11 mm | GE Healthcare | BR-1002-87 | |
| Rubber caps, type 2 | GE Healthcare | BR-1004-11 |
Referências
- Christensen, L. L. H. Theoretical analysis of protein concentration determination using biosensor technology under conditions of partial mass transport limitation. Anal. Biochem. 249, 153-164 (1997).
- Sigmundsson, K., Mâsson, G., Rice, R., Beauchemin, N., Öbrink, B. Determination of active concentrations and association and dissociation rate constants of interacting biomolecules: an analytical solution to the theory for kinetic and mass transport limitations in biosensor technology and its experimental verification. Biochemistry. 41 (26), 8263-8276 (2002).
- Stubbs, M. T., Laber, B., Bode, W., Huber, R., Jerala, R., Lenarcic, B., Turk, V. The refined 2.4 A X-ray crystal structure of recombinant human stefin B in complex with the cysteine proteinase papain: a novel type of proteinase inhibitor interaction. EMBO J. 9 (6), 1939-1947 (1990).
- Pol, E., Björk, I. Importance of the second binding loop and the C-terminal end of cystatin B (Stefin B) for inhibition of cysteine proteinases. Biochemistry. 38 (32), 10519-10526 (1999).
- Björk, I., Pol, E., Raub-Segall, E., Abrahamson, M., Rowan, A. D., Mort, J. S. Differential changes in the association and dissociation rate constants for binding of cystatins to target proteinases occurring on N-terminal truncation of the inhibitors indicate that the interaction mechanism varies with different enzymes. Biochem. J. 299, 219-225 (1994).
- Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., Gray, T. How to measure and predict the molar absorption coefficient of a protein. ProteinScience. 4 (11), 2411-2423 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados