このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
不安定な多タンパク質複合体の単離で in vivoで制御セルラー架橋及び免疫磁気アフィニティークロマトグラフィー
要約
細胞透過性架橋剤DSP [ジチオビス - (スクシンイミジルプロピオネート)]安定一過性と不安定な相互作用 in vivoで、。ここでは、免疫沈降によるタンパク質複合体の分離に続いて培養で増殖架橋のセルのテクニックを紹介。
要約
携帯電話機械の動的な性質は、しばしば一過性および/または弱いタンパク質の関連付けに基づいて構築されています。これらの低親和性相互作用は、目的のタンパク質の周りにタンパク質ネットワークの分離と同定のための厳格な方法を排除する。化学架橋剤の使用は、精製のために生化学的な制限をバイパスして、不安定な相互作用の選択的安定化することができます。ここで私たちは12 Å、ジチオビス - (proprionateスクシンイミジル)(DSP)のスペーサーアームでホモ二官能性架橋剤を使用して培養中の細胞のための従順プロトコルを提示する。 DSPは、分子中に存在するジスルフィド結合の還元によって切断される。磁気ビーズによる目的タンパク質のイムノアフィニティークロマトグラフィーを組み合わせた架橋は、特に精製に耐えられないというタンパク質複合体の分離が可能になります。このプロトコルは、通常のウェスタンブロットの技法と互換性があり、それは質量分析法1によってタンパク質の同定のためにスケールアップすることができます。
ステファニーA. ZlaticとパールV.ライダーは、この作品にも同様に貢献した。
プロトコル
1。架橋の準備
- あなたは、標準のチューブの反応あたりタンパク質500μgの単離を可能にするためにプレートに細胞の十分な数が必要になります。単管は十分な免疫ブロットによって目的のタンパク質の推定上のインターアクターの識別のためかもしれません。この場合、ビーズ結合した物質は、SDS - PAGEサンプルバッファー(免疫沈降)で溶出することができます。質量分析のために、標準的な反応の数は少なくとも10倍に増加する必要があるとタンパク質の複合体は、(免疫アフィニティークロマトグラフィー)に使用する抗体によって認識されるペプチド抗原と外の競争によって溶出されるべきである。この戦略は、免疫グロブリンの自由なタンパク質複合体の分離が可能になります。
- 架橋のための最適な細胞密度は75%とコンフルエント90%の間です。高コンフルエントな条件で、細胞はすべての細胞への細胞透過性の架橋剤へのアクセシビリティを低下させる、お互いに山積みする傾向がある。
- 細胞の種類や実験条件はセルプレートの底部にラベルする必要があります。我々は日常的に一人で車を持つコントロールが含まれています。
- 前の架橋へのDSPソリューションを除き、すべてのソリューションを準備します。
- のCaCl 2 0.1mMの及びCaCl 2実験を開始する前に、1mMの(PBS /カルシウム/マグネシウム)でリン酸緩衝生理食塩水バッファの株式を準備します。カルシウムとマグネシウムイオンの添加は、実験の過程で培養プレートに細胞の接着のための非常に重要です。 4℃で保存します。
- 50X完全プロテアーゼインヒビターカクテル - 1mLのMilli - Q水に溶解した1錠。 -20℃で保存
- 20%トリトンX - 100 10グラムトリトンX -100を秤量および50 ml Milli - Q水の合計量に希釈する。 4℃ロック4℃一晩と店舗℃で使用するまで。 1カ月以上保存しないでください。以下に説明する溶解およびIPバッファを準備するには、この20%の株式の希釈液を使用してください。
- pHは7.4〜50倍のDSP焼入れソリューション1Mトリス。室温で保管してください。
- 10 ×バッファーの溶液を調製します。
10Xバッファー:- 50 mLの1 M HEPES
- 150 mLの5 M NaClを
- 10 mLの0.5 M EGTA
- 250μL2 MのMgCl 2
- 7.4にpHを調整する
- 500mLに、最終容量をもたらす
1X Bufferは溶解液と免疫磁気降水量のバッファでも使用されます。
1Xをバッファリング- 10mMのHEPES
- 150mMのNaCl
- 1mMのEGTA
- 0.1mMのMgCl 2の
- pH7.4の
- 溶解バッファー1 ×バッファー+ 0.5%トリトンX - 100。
- 免疫磁気降水バッファ(IPバッファ)1 ×緩衝液、0.1%トリトンX - 100。
2。架橋ソリューションの準備
- セルに適用する前に、すぐにDSPソリューションを準備。 DSPは、高度に疎水性であり、PBS /カルシウム/マグネシウムバッファに希釈する前に、DMSOに溶解してください。 DMSO 1mL中にDSPの40mgを溶解する。これは、DSP(DSPの分子量は404.42グラム/モルである)の100 mM溶液になります。
- ° C PBSにDSP / DMSOの希釈を促進するために、37〜PBS /カルシウム/マグネシウムの適切な量を温める。
各種プレートサイズに必要なボリューム:
ウェルあたり6ウェルプレート2 mLの
プレート当たり10cmの板を10mL
プレート当たり15cmの板を20mL - 温かいPBS /カルシウム/マグネシウムの各1 mLの場合、DSP / DMSOストック溶液の10μLを追加。すべてのDSPが溶解するまで繰り返す混合しながら降下することにより、DSP / DMSOストック溶液のドロップを追加。 PBS /カルシウム/マグネシウムの各1 mLに追加10μLのDMSOの制御ソリューションとなります。
- 10分よりもはや氷水浴中ですべてのPBS /カルシウム/マグネシウムソリューションを置きます。
3。架橋のためにセルを準備します。
- 架橋や車両制御のインキュベーションのためのすべてのプレートに適合します氷水浴を準備する。
- 37℃のインキュベータからプレートを取り出し、氷水浴中にすぐにそれらを置きます。
- 氷冷PBS /カルシウム/マグネシウムで細胞を2回洗浄する。あなたが(セクション2.2を参照)架橋剤インキュベーションに使用するのと同じボリュームを使用してください。
- 回目の洗浄を削除し、車両制御やDSP架橋緩衝液のいずれかを追加。
- 2時間氷上でインキュベートする。あなたはすべてのセルがソリューションでカバーされていることを確認するには、約プレート20分ごとに確認する必要があります。あなたは、DSPの少量の溶液から沈殿することがあります。これは正常です。
4。 DSPの反応の不活性化
- PBS /カルシウム/マグネシウム(PBS /カルシウム/マグネシウムの各1 mLの1 MトリスpH7.4の20μL)の20mMトリスpH7.4の1XのDSP焼入れ溶液を調製します。
- 車両制御との架橋ソリューションを削除します。
- 氷冷不活化ソリューションを追加し、15分間氷上でインキュベートする。
5。細胞溶解
- DSPの消光のインキュベーションの間に、完全なプロテアーゼ阻害剤カクテルでバッファにトリトンX - 100 0.5%の細胞溶解バッファーを準備します。各1 mLの溶解バッファーのために完了の20μL50Xストック溶液を追加。
- 15分DSPの急冷インキュベーション後、PBS /カルシウム/マグネシウムで細胞を2回洗浄する。
- 溶解バッファーを追加する+ 4で細胞や岩石への完全な℃で30分間。いくつかは、各種プレートのサイズについては、溶解バッファーの量を提案した。
- ウェルあたり6ウェルプレートを0.5mL
- プレート当たり10cmのプレートを1 mL
- プレート当たり15cmのプレートを1 mL
- 溶解後、プレートから細胞を収集するために、セルスクレーパーを使用してください。プロテアーゼ活性を最小限に抑えるために氷上でライセートを保つようにしてください
- 4℃で15分間細胞ライセートをスピン·トップスピードで、ベンチトップのミニ遠心(15.000 × g)でのCを。
- 新しいチューブに上清をピペットで。ペレットを捨てる。
- タンパク質レベルを分析し、免疫沈降に進んでください。
6。免疫磁気降水ビーズの準備
注:この手順は、通常2時間の架橋インキュベーションを開始した後に直接起動される。
- 、DYNAL免疫磁気ビーズを30μLを組み合わせるIPバッファー(1 ×緩衝液、0.1%トリトンX - 100)とscrewtopマイクロ遠心チューブに抗原特異的抗体の適切な量の500μL。ネガティブコントロールの抗体フリーと非特異的抗体管準備。抗体の適切な量は別々の実験中に個々の抗原に基づいて決定されるべきである。すべてのIPチューブにラベルを付けます。
- IPチューブを2時間室温でエンドオーバーエンドロッカーでインキュベートすることができます。また、架橋前に4 °日で一晩抗体でIPチューブをインキュベートする。
- インキュベーション後、チューブの底にビーズを収集するために迅速に10秒間のミニ遠心分離を行います。
- 離れてチューブの底から磁気ビーズを引っ張ってくる磁気ホルダー、中にチューブをスライドさせて。安全に道のビーズを使用すると、簡単にすべての非結合抗体を洗い流すことができる。
- このようなゲルローディングチップ、またはインキュベーションバッファーと未結合の抗体を除去するためにP200チップとして小口径アスピレーターチップを使用してください。インキュベーションのボリュームが削除されるとすぐにIPバッファー1 mLに加える。
- 静かに再サスペンドビーズ、チューブにフタをし、エンドオーバーエンド回転で5分間、室温でのすべてのIPチューブをインキュベートする。
- IPバッファの新鮮ミリリットルで一回より5分の洗浄ステップを(6.6を介してステップ6.3)繰り返します。
- 架橋ライセートがビーズに追加する準備ができるまでIPチューブは最後の洗浄のインキュベーションに残すことができます。
7。免疫磁気ビーズとの架橋ライセートをインキュベート
- 最後の洗浄のスピン免疫磁気ビーズの後、ダウンして10秒間のミニ遠心インチその後、磁気ホルダーにチューブをスリップに進んでください。
- 再び、小口径の吸引チップを使用して、チューブからインキュベーションのボリュームを削除します。すぐに免疫磁気ビーズを含むチューブに架橋した細胞溶解液の500μL(1μg/ mlで溶解液を仮定して)追加します。あなたがネガティブコントロールとしてペプチド競争を使用する場合、ペプチドの適切な量は、この時点で含まれるべきである。以前の実験は、適切なペプチドの競争条件を決定するために実行されるべきです。代わりに、ネガティブコントロールとしてライセート無料免疫磁気ビーズを持たせることができます。この場合は、すぐに免疫磁気ビーズへ+完全なライセートバッファー(1 ×バッファー+ 0.5%トリトンX - 100)の500μLを加える。
- 優しくビーズを再懸濁します。再懸濁したビーズで2時間転倒回転で4℃でインキュベートしてください。
8。ビーズからバインドされていない可溶化物を洗う
- かつてライセートが十分なインキュベーション時間を持っていた、ミニ遠心機で素早く10秒間のスピンを行います。その後、磁気ホルダーにチューブをスライドさせます。マグネットホルダーは、実験の残りを氷浴中で維持する必要があります。
- 小口径アスピレーターチップを使用して、すべてのバインドされていないライセートを削除します。すべてのバインドされていないライセートが削除された直後にIPバッファー1 mLを加える。
- チューブにフタをし、静かにビーズを懸濁します。
- 一度ビーズをビーズペレット化のステップ(8.1)を繰り返して再懸濁する。
- 再びインキュベーションのボリュームのすべてをオフに吸引し、すぐにIPバッファー1 mLを加え、その後チューブをキャップ。
- 優しくIPバッファーでビーズを再懸濁します。エンドオーバーエンドロッキングと4℃で5分間再懸濁したビーズをインキュベートする。
- ビーズの洗浄工程を(8.6経由で8.4)4回以上繰り返します。
9。サンプルを変性し、ビーズから収集
- に免疫磁気降水管のすべてが洗浄された後、再堆積物ビーズ(8.1)とスライド管磁気ホルダー。
- 免疫磁気ビーズに結合したタンパク質は変性条件下で除去される。最後のIPバッファの洗浄をオフに吸引し、磁気ホルダーからIPチューブを取り外します。
- 再びチューブの下部にビーズプールにちょうどビーズペレット上にIPチューブに1 ×ゲルサンプルバッファーを追加します。サンプルバッファーの量は、使用するゲルのウェルサイズによって異なります。あなたが穏やかにゲルサンプルバッファーで再懸ビーズのすべてを取得するにはチューブの底をタップする必要がある場合があります。
- 各IPチューブ用変性プロセス(9.3経由で9.2)を繰り返します。
- ゲルサンプルバッファーで再懸濁し、免疫磁気ビーズは、その後75℃に加熱されています°変性プロセスを完了するまで5分間。
- 一度サンプルが変性されているそれは、ウェスタンブロッティングのためにSDS - PAGEゲル上で実行することができます。空に免疫磁気ビーズを遠心分離により、再ペレット化し、磁気ホルダー付きサンプルから削除することができます。
10。抗原ペプチド(免疫アフィニティークロマトグラフィー)による架橋錯体の溶出。
- 免疫磁気免疫沈降管のすべての後にビーズ(8.1)とスライド管は、磁気ホルダーに再沈殿、洗浄されています。上清を吸引除去し、タンパク質複合体のimmunoisolationのために用いられる抗体が認識する抗原ペプチドを添加した緩衝液の10μlを加える。あなたは、効率的な溶出のための10から200μMからの範囲の濃度をテストする必要があります。
- 4℃で2時間ビーズをインキュベート℃を
- マグネチックスタンドでビーズを入れて、慎重に溶出した物質の10 mLを回復する。この上清を保存します。
- すぐにバッファーでビーズを洗浄し、洗浄して廃棄する。ビーズを保存します。
- 1Xの濃度に保存された上清とビーズにゲルサンプルバッファーを追加します。 ℃で5分間75℃これらのチューブをインキュベートします。
- SDS - PAGEによりビーズとペプチドの溶出液を分析する。溶出液は、両方のSDS - PAGEの染色タンパク質または免疫ブロット(図1B)によるIgGの自由であるべきです。 IgGの自由なこの材料は、質量分析に適しています。
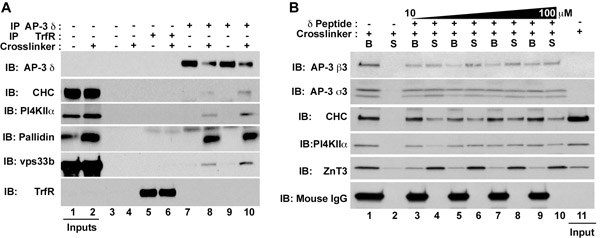
図1。 AP - 3相互作用するタンパク質複合体や膜タンパク質の分離。HEK293細胞()またはPC12細胞は、(B)車両の制御の有無(DMSO、奇数レーン図1A)またはDSP(偶数レーン図1Aまたはすべてのどちらかで処理した図1Bのレーン)。図、明確に抽出物を単独でビーズ(図1A、レーン3-4)、トランスフェリン受容体抗体(図1A、レーン5-6)、またはAP - 3δ抗体(図1A、レーン70から10のいずれかでインキュベートし、図1B、レーン1-10)。免疫複合体はSDS - PAGEサンプルバッファー(図1A)で溶出された、単独でのバッファまたは(図1B、レーン1-2)、またはアミノ酸680 710に対応するδの抗原ペプチドの濃度の増加を補充してバッファ(図1B、レーン3-10):;:人間δ-アダプチン(1923266 GI AAD03777 NCBI)の。このペプチドは、δ抗体を結合する。ペプチド溶出した後、上清(S)とビーズ(B)は、免疫ブロット(図1B)によって分析した。 ;だけでなく、クラスリン重鎖(CHC)、BLOC - 1サブユニットのpallidin、、ホップ、複雑なサブユニットのvps33b:δ、β3、およびσ3サブユニットに対する抗体で検出されたAP - 3は、、以下の可溶性因子とcoprecipitates膜タンパク質のホスファチジルイノシトール4 - キナーゼII型α(PI4KIIα)と亜鉛トランスポーター3(ZnT3)。図中のペプチド溶出した上清中のIgGマウス重鎖が存在しないことに注意してください。 1B。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
DSPは、12Åのスペーサーアームを持つ膜透過性、化学的に還元性架橋剤は、一時的なタンパク質相互作用1,2,3,4を安定させるために使用されます。ここでは、アダプタ複合体AP - 3 5をエンドソームから小胞への膜タンパク質を認識し、ソートする可溶性タンパク質複合体でこの戦略を例示する。 AP - 3は、選択的に亜鉛トランスポーターZnT3と脂質キナーゼ、ホスファチジルイノ?...
Access restricted. Please log in or start a trial to view this content.
謝辞
この作品は、VFに国立衛生研究所(NS42599とGM077569)からの補助金によって支えられて。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline | Invitrogen | P4417 | Dissolve 1 tablet in 200 mL water; add MgCl2 to a final concentration of 1 mM and CaCl2 to a final concentration of 0.1 mM |
| Dithiobis (succinimidyl propionate) (DSP) | Thermo Fisher Scientific, Inc. | 22585 | Moisture sensitive, store in air tight container 4°C |
| Dimethyl sulphoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| Triton X-100, SigmaUltra | Sigma-Aldrich | T9284 | |
| Dynabeads, Sheep anti-Mouse IgG | Invitrogen | 110.31 | Beads are also available as sheep anti-rabbit |
| Dyna-Mag-2 magnet | Invitrogen | 123-21D |
参考文献
- Salazar, G. Hermansky-Pudlak syndrome protein complexes associate with phosphatidylinositol 4-kinase type II alpha in neuronal and non-neuronal cells. J Biol Chem. 284, 1790-1802 (2009).
- Lomant, A. J., Fairbanks, G. Chemical probes of extended biological structures: synthesis and properties of the cleavable protein cross-linking reagent [35S]dithiobis(succinimidyl propionate. J Mol Biol. 104, 243-261 (1976).
- Xiang, C. C. Using DSP, a reversible cross-linker, to fix tissue sections for immunostaining, microdissection and expression profiling. Nucleic Acids Res. 32, e185-e185 (2004).
- Craige, B., Salazar, G., Faundez, V. Phosphatidylinositol-4-Kinase Type II Alpha Contains an AP-3 Sorting Motif and a Kinase Domain that are both Required for Endosome Traffic. Mol Biol Cell. 19, 1415-1426 (2008).
- Newell-Litwa, K., Seong, E., Burmeister, M., Faundez, V. Neuronal and non-neuronal functions of the AP-3 sorting machinery. J Cell Sci. 120, 531-541 (2007).
- Salazar, G. The Zinc Transporter ZnT3 interacts with AP-3 and it is Targeted to a Distinct Synaptic Vesicle Subpopulation. Mol Biol Cell. 15, 575-587 (2004).
- Trinkle-Mulcahy, L. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved