Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement du labiles complexes multi-protéiques par des In vivo Contrôlée Cellulaire réticulation et chromatographie d'affinité immuno-magnétiques
Dans cet article
Résumé
La cellule perméables réticulant DSP [dithiobis (succinimidyl propionate)] stabilise les interactions transitoires et labiles In vivo, Qui permet leur isolement à l'aide des techniques rigoureuses purification des protéines recombinantes complexes. Nous présentons ici une technique pour les cellules de réticulation en culture suivie de l'isolement de complexes protéiques par immunoprécipitation.
Résumé
La nature dynamique des machineries cellulaires est souvent construit sur des associations de protéines transitoires et / ou faible. Ces interactions faible affinité empêche méthodes rigoureuses pour l'isolement et l'identification des réseaux protéiques autour d'une protéine d'intérêt. L'utilisation de réticulants chimiques permet la stabilisation sélective des interactions labiles, contournant ainsi les limites biochimiques pour la purification. Nous présentons ici un protocole prêtent des cellules en culture qui utilise un réticulant homobifonctionnels avec un bras espaceur de 12 Å, dithiobis (succinimidyl propionate) (DSP). DSP est clivée par réduction d'un pont disulfure présent dans la molécule. Réticulation combinée avec la chromatographie d'immunoaffinité de protéines d'intérêt avec des billes magnétiques permet l'isolement de complexes protéiques qui, autrement, ne résisterait pas à la purification. Ce protocole est compatible avec les techniques habituelles de western blot et il peut être étendu pour l'identification des protéines par spectrométrie de masse 1.
Stephanie A. Zlatic et Pearl V. Ryder ont contribué également à ce travail.
Protocole
1. Préparation pour la réticulation
- Vous aurez besoin de la plaque d'un nombre suffisant de cellules pour permettre l'isolement de 500 pg de protéines par tube de réaction standard. Un tube unique peut être suffisante pour l'identification des interacteurs putatif d'une protéine d'intérêt par immunoblot. Dans ce cas, perles du matériel lié peut être élue avec un tampon d'échantillon SDS-PAGE (immunoprécipitation). Pour l'analyse par spectrométrie de masse, le nombre de réactions norme devrait être augmenté d'au moins dix fois et les complexes de protéines doit être élue par hors compétition avec un antigène peptidique reconnue par l'anticorps utilisé (chromatographie d'immunoaffinité). Cette stratégie permettra l'isolement de complexes protéiques libres des immunoglobulines.
- La densité cellulaire optimale pour la réticulation est comprise entre 75% et 90% de confluence. En conditions de haute confluence, les cellules ont tendance à s'empiler les uns des autres, ce qui diminue l'accessibilité aux réticulant cellulaire perméable à toutes les cellules.
- Type de cellules et de l'état expérimental devrait être étiqueté sur le fond de la plaque cellulaire. Nous avons régulièrement inclure des contrôles avec le véhicule seul.
- Préparer toutes les solutions SAUF la solution DSP avant réticulation.
- Préparer un stock de tampon phosphate buffer saline avec CaCl 2 0,1 mM et CaCl2 1 mM (PBS / Ca / Mg) avant de commencer l'expérience. L'addition d'ions calcium et magnésium est essentiel pour l'adhérence des cellules à la plaque de la culture au cours de l'expérience. Conserver à 4 ° C.
- 50X cocktail complet d'inhibiteur de protéase - 1 comprimé dissous dans 1ml eau Milli-Q. Conserver à -20 ° C.
- 20% Triton X-100 Peser 10g de Triton X -100 et diluer dans le volume total de 50 ml d'eau Milli-Q. Rock à 4 ° C pendant la nuit et conserver à 4 ° C jusqu'à utilisation. Ne pas stocker plus de 1 mois. Utiliser des dilutions de ce stock de 20% à préparer les tampons de lyse et IP décrit ci-dessous.
- 50X DSP Trempe solution 1M TRIS à pH 7,4. Stocker à température ambiante.
- Préparer un tampon 10x Une solution.
Tampon 10X A:- 50 mL 1 M HEPES
- 150 ml de NaCl 5 M
- 10 ml 0,5 M EGTA
- 250 uL 2 M MgCl 2
- Ajuster le pH à 7,4
- Amener le volume final à 500 ml
Tampon 1x A est également utilisé dans le lysat et immuno-magnétique-précipitation tampons.
Un tampon 1X- 10 mM Hepes
- 150 mM de NaCl
- 1 mM d'EGTA
- 0,1 mM MgCl 2
- pH 7,4
- Lysis Buffer 1X tampon A + 0,5% de Triton X-100.
- Tampon précipitations immuno-magnétique (IP Buffer) 1X tampon A + 0,1% de Triton X-100.
2. Préparation de la solution de réticulation
- Préparer la solution DSP immédiatement avant l'application aux cellules. DSP est hautement hydrophobe et doit être dissous dans le DMSO avant dilution dans du PBS / Ca / Mg tampon. Dissoudre 40 mg de DSP dans 1 ml de DMSO. Cela fait une solution de 100 mM de DSP (Le poids moléculaire de 404,42 DSP est g / mol).
- Chaud un volume approprié de PBS / Ca / Mg à 37 ° C afin de faciliter la dilution des DSP / DMSO dans du PBS.
Volumes nécessaires pour les tailles de plaques assorties:
6-même plaque de 2 ml par puits
Plaque de 10 cm de 10 ml par plaque
15 cm plaque de 20 ml par plaque - Ajouter 10 ul de solution stock DSP / DMSO pour chaque 1 mL d'eau tiède PBS / Ca / Mg. Ajouter DSP / DMSO goutte à goutte la solution mère avec un mélange répété jusqu'à ce que tous les DSP a dissous. Faire une solution de contrôle de 10 ul de DMSO ajoutée à chaque mL de PBS 1 / Ca / Mg.
- Placez toutes les solutions de PBS / Ca / Mg dans un bain d'eau glacée ne sont plus que 10 min.
3. Préparer les cellules de la réticulation
- Préparer un bain d'eau glacée qui s'adaptera à toutes les plaques de réticulation ou l'incubation de contrôle du véhicule.
- Prenez les plaques de l'incubateur à 37 ° C et placez-les immédiatement dans le bain d'eau glacée.
- Laver les cellules deux fois avec PBS glacé / Ca / Mg. Utilisez le même volume que vous allez utiliser pour l'incubation réticulant (voir section 2.2).
- Retirer second lavage et ajouter le contrôle du véhicule soit ou d'une solution tampon DSP réticulation.
- Incuber dans la glace pendant deux heures. Vous devriez vérifier les plaques d'environ toutes les vingt minutes pour s'assurer que toutes les cellules sont couvertes par la solution. Vous remarquerez peut-être une petite quantité de DSP précipitent hors de la solution. Cela est normal.
4. L'inactivation de la réaction du PSD
- Préparer une solution de trempe 1X DSP de 20 mM de Tris pH 7,4 dans du PBS / Ca / Mg (20 uL d'une pH 7,4 M Tris pour chaque 1 mL de PBS / Ca / Mg).
- Retirez le contrôle du véhicule et des solutions de réticulation.
- Ajouter la solution de l'inactivation glacée et incuber sur de la glace pendant 15 minutes.
5. Lyse cellulaire
- Durant l'incubation trempe DSP, préparer le tampon de lyse cellulaire de 0,5% de Triton X-100 dans le tampon A avec cocktail inhibiteur de protéase complète. Ajouter 20 uL solution stock de 50X sur complètes pour chaque tampon lyse 1 ml.
- Après l'incubation trempe DSP 15 minutes, laver les cellules deux fois avec du PBS / Ca / Mg.
- Ajouter un tampon de lyse complète + aux cellules et de rock à 4 ° C pendant 30 minutes. Certains ont suggéré des volumes de tampon de lyse pour les formats de plaques assorties:
- 6-même plaque de 0,5 ml par puits
- Plaque de 10 cm de 1 ml par plaque
- 15 cm plaque de 1 ml par plaque
- Après la lyse, d'utiliser un grattoir à cellules pour recueillir les cellules de la plaque. Soyez sûr de garder lysats sur la glace afin de minimiser l'activité de la protéase
- Cellulaire Spin lysats pendant 15 minutes à 4 ° C dans une paillasse mini-centrifugeuse à grande vitesse (15.000 xg).
- Pipeter le surnageant dans un nouveau tube. Jeter le culot.
- Analyser les taux de protéines et de procéder à immunoprécipitation.
6. Préparation Perles précipitations immuno-magnétiques
Note: Cette étape est généralement commencé directement après le début de l'incubation de réticulation 2 heures.
- Combinez 30 uL de Dynal billes immunomagnétiques, 500 pi de tampon IP (1x tampon A + 0,1% de Triton X-100) et la quantité appropriée d'antigène-anticorps spécifique à la vissable microtubes. Préparer sans anticorps et des tubes d'anticorps non spécifique pour les contrôles négatifs. La quantité appropriée d'anticorps doit être déterminée sur la base des antigènes individuels au cours des expériences distinctes. Étiqueter tous les tubes de PI.
- Laisser les tubes IP à incuber dans un rocker fin plus-end à la température ambiante pendant deux heures. Alternativement, incuber les tubes IP avec l'anticorps nuit à 4 ° le jour avant la reticulation.
- Après l'incubation, faire un rapide 10 secondes mini-centrifugation pour collecter les perles au fond du tube.
- Faites glisser les tubes dans le support magnétique, qui va tirer les billes magnétiques loin du fond du tube. Avec les perles en toute sécurité hors du chemin, vous pouvez désormais facilement laver tout anticorps non liés.
- Utiliser un embout d'aspiration de petit diamètre, comme une pointe de chargement de gel, ou p200 astuce pour enlever le tampon d'incubation et de tout anticorps non lié. Dès que le volume d'incubation est retiré ajouter dans 1 ml de tampon de propriété intellectuelle.
- Boucher le tube, doucement remettre en suspension les perles, et incuber tous les tubes IP à température ambiante pendant 5 minutes avec bout en bout au cours de rotation.
- Répéter l'étape de lavage de 5 minutes (étapes 6.3 à 6.6) fois de plus avec un millilitre de tampon fraîche IP.
- Les tubes IP peuvent rester dans l'incubation, laver jusqu'à la lysat réticulé est prête à être ajoutée aux billes.
7. Incuber Lysat réticulé avec Immuno-magnétiques Perles
- Après le dernier lavage tour immuno-billes magnétiques, dans une mini-centrifugeuse pendant 10 secondes. Ensuite, passez à glisser les tubes dans le support magnétique.
- Encore une fois, en utilisant une pointe d'aspiration de petit diamètre, retirez le volume d'incubation du tube. Immédiatement ajouter 500 ul de lysat cellulaire réticulé (en supposant lysat à 1 ug / ml) pour les tubes contenant l'immuno-billes magnétiques. Si vous utilisez une concurrence peptide comme contrôle négatif, une quantité appropriée de peptide devraient être inclus à ce stade. Des expériences antérieures doivent être effectués afin de déterminer les conditions de concurrence peptide. Alternativement, vous pouvez avoir gratuitement lysat immuno-billes magnétiques comme contrôle négatif. Dans ce cas, ajouter immédiatement 500 de lysat Tampon (1x tampon A + 0,5% de Triton X-100) + complète sur les billes immuno-magnétiques.
- Resuspendre doucement les perles. Perles en suspension doivent être incubées à 4 ° dans une rotation bout en bout au cours de 2 heures.
8. Lavez Lysat Unbound à partir de perles
- Une fois lysat a eu le temps d'incubation suffisant, faire un rapide tour 10 secondes dans une mini-centrifugeuse. Faites ensuite glisser les tubes dans le support magnétique. Le support magnétique doivent être conservés dans un bain de glace pour le reste de l'expérience.
- En utilisant une pointe de petit aspirateur alésage, enlever tous lysat non lié. Immédiatement après toutes lysat non fixé est éliminé ajouter 1 mL de tampon de propriété intellectuelle.
- Boucher le tube et délicatement remettre en suspension les perles.
- Une fois que les billes sont remises en suspension répétez l'étape de granulation billes (8,1).
- Encore une fois Aspirer la totalité du volume d'incubation et d'ajouter immédiatement 1 ml de tampon IP, puis bouchon du tube.
- Resuspendre doucement les billes en IP Buffer. Incuber perles resuspendues pendant 5 minutes à 4 ° à fin plus-end à bascule.
- Répétez les étapes billes de lavage (8.4 à 8.6) 4 fois plus.
9. Dénaturer échantillon et recueillir des Perles
- Après tous les tubes de précipitations immuno-magnétiques ont été lavés, re-sédimenter les billes de (8,1) et les tubes glisser dans lasupport magnétique.
- Protéines liées aux billes immuno-magnétiques sont enlevés dans des conditions dénaturantes. Aspirer le lavage IP Buffer dernière et retirer le tube de la propriété intellectuelle support magnétique.
- Ajouter 1x tampon échantillon de gel dans le tube IP juste au-dessus du culot talon à la piscine des perles au fond du tube à nouveau. Le montant de tampon d'échantillon dépend de la taille et du gel à être utilisé. Vous devrez peut-être taper doucement le fond du tube pour obtenir toutes les perles en suspension dans le tampon d'échantillon de gel.
- Répétez l'opération de dénaturation (9,2 à 9,3) pour chaque tube IP.
- Immuno-billes magnétiques en suspension dans du tampon échantillon de gel sont ensuite chauffées à 75 ° C pendant 5 minutes pour terminer le processus de dénaturation.
- Une fois l'échantillon a été dénaturé il peut être exécuté sur un gel SDS-PAGE pour western blot. Vidé immuno-billes magnétiques peuvent être re-sédimentées par centrifugation et retiré de l'échantillon avec le support magnétique.
10. Élution des complexes réticulés avec des peptides antigéniques (chromatographie d'immunoaffinité).
- Après tous les tubes de l'immuno-magnétiques immunoprécipitation ont été lavés, re-sédimenter les billes de (8,1) et les tubes diapositives dans le support magnétique. Aspirer le surnageant et ajouter 10 ul de tampon A additionné avec le peptide antigénique reconnu par l'anticorps utilisé pour immunoisolation de complexes protéiques. Vous devriez tester des concentrations allant de 10 à 200 uM pour l'élution efficace.
- Incuber les perles pendant 2 h à 4 ° C.
- Mettez billes dans le support magnétique et soigneusement de récupérer les 10 ml de matériau élue. Sauvegarder cette surnageant.
- Laver rapidement les billes avec un tampon A et jeter le lavage. Enregistrer les perles.
- Ajouter tampon échantillon de gel au surnageant sauvés et des perles à une concentration de 1X. Incuber ces tubes à 75 ° C pendant 5 minutes.
- Analyser des perles et éluat peptidique par SDS-PAGE. L'éluat doit être libre d'IgG à la fois par la protéine tache de SDS-PAGE ou par immunoblots (figure 1B). Ce matériau exempt d'IgG est adapté à la spectrométrie de masse.
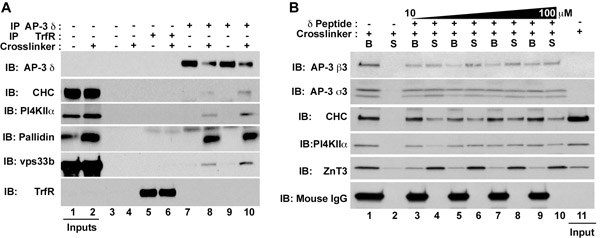
Figure 1. L'isolement de l'AP-3 complexes de protéines qui interagissent et des protéines membranaires. HEK293 (A) ou les cellules PC12 (B) ont été traités soit en présence de maîtrise du véhicule (DMSO, impair voies figure 1A) ou DSP (même ruelles Fig. 1A ou tous les voies dans la figure 1B). Clarification des extraits ont été incubées soit avec des perles seules (Fig. 1A, Lanes 3-4), les anticorps récepteurs de la transferrine (Fig. 1A, Lanes 5-6), ou AP-3 anticorps δ (Fig. 1A, Lanes 7-10; Fig . 1B, pistes 1-10). Des complexes immuns ont été éluées avec un tampon d'échantillon SDS-PAGE (figure 1A), le tampon A, seul ou (Fig. 1B, pistes 1-2), ou le tampon A additionné de concentrations croissantes du peptide antigénique δ correspondant aux acides aminés 680 710 des humains δ-adaptine (NCBI: AAD03777; GI: 1923266) (Fig. 1B, les voies 3-10). Ce peptide se lie l'anticorps δ. Après élution de peptides, les surnageants (S) et des perles (B) ont été analysés par immunoblot (Fig. 1B). AP-3, qui est détectée avec des anticorps contre le δ, β3, et σ3 sous-unités, coprécipités avec les facteurs suivants solubles: clathrine chaîne lourde (CCH), le BLOC-1 pallidin sous-unité, et la sous-unité VPS33B HOUBLON complexes, ainsi que la membrane des protéines phosphatidylinositol-4-kinase de type II alpha (PI4KIIα) et le transporteur de zinc 3 (ZnT3). Notez l'absence de chaînes lourdes IgG de souris dans le peptide élué surnageant dans la Fig. 1B.
Discussion
DSP, une membrane perméable-, réticulant chimiquement réductibles à un bras espaceur de 12 A est utilisé pour stabiliser les interactions entre protéines passagères 1,2,3,4. Ici, nous témoigne de cette stratégie avec le complexe adaptateur AP-3 d'un complexe protéine soluble qui reconnaît et trie les protéines membranaires dans des vésicules à partir des endosomes 5. AP-3 se lie sélectivement au transporteur de zinc ZnT3 et la kinase lipidique phosphatidylinositol-4-kinase de typ...
Remerciements
Ce travail a été soutenu par des subventions des National Institutes of Health à VF (NS42599 et GM077569).
matériels
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline | Invitrogen | P4417 | Dissolve 1 tablet in 200 mL water; add MgCl2 to a final concentration of 1 mM and CaCl2 to a final concentration of 0.1 mM |
| Dithiobis (succinimidyl propionate) (DSP) | Thermo Fisher Scientific, Inc. | 22585 | Moisture sensitive, store in air tight container 4°C |
| Dimethyl sulphoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| Triton X-100, SigmaUltra | Sigma-Aldrich | T9284 | |
| Dynabeads, Sheep anti-Mouse IgG | Invitrogen | 110.31 | Beads are also available as sheep anti-rabbit |
| Dyna-Mag-2 magnet | Invitrogen | 123-21D |
Références
- Salazar, G. Hermansky-Pudlak syndrome protein complexes associate with phosphatidylinositol 4-kinase type II alpha in neuronal and non-neuronal cells. J Biol Chem. 284, 1790-1802 (2009).
- Lomant, A. J., Fairbanks, G. Chemical probes of extended biological structures: synthesis and properties of the cleavable protein cross-linking reagent [35S]dithiobis(succinimidyl propionate. J Mol Biol. 104, 243-261 (1976).
- Xiang, C. C. Using DSP, a reversible cross-linker, to fix tissue sections for immunostaining, microdissection and expression profiling. Nucleic Acids Res. 32, e185-e185 (2004).
- Craige, B., Salazar, G., Faundez, V. Phosphatidylinositol-4-Kinase Type II Alpha Contains an AP-3 Sorting Motif and a Kinase Domain that are both Required for Endosome Traffic. Mol Biol Cell. 19, 1415-1426 (2008).
- Newell-Litwa, K., Seong, E., Burmeister, M., Faundez, V. Neuronal and non-neuronal functions of the AP-3 sorting machinery. J Cell Sci. 120, 531-541 (2007).
- Salazar, G. The Zinc Transporter ZnT3 interacts with AP-3 and it is Targeted to a Distinct Synaptic Vesicle Subpopulation. Mol Biol Cell. 15, 575-587 (2004).
- Trinkle-Mulcahy, L. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon