JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
불안 정한 다중 단백질 단지의 분리에 의해 생체내에 제어 세포 간 연결 및 단백질 자기 동질 크로마 토그래피
요약
세포 투과 crosslinker DSP [dithiobis - (succinimidyl 프로피 온산)] 일시적 안정화와 불안 정한 상호 작용 생체내에. 여기 immunoprecipitation에 의해 단백질 단지의 절연 다음 문화의 성장 crosslinking 전지에 대한 기술을 제시한다.
초록
세포 기계의 동적 특성은 자주 일시적 및 / 또는 약한 단백질 연결에 내장되어 있습니다. 이러한 낮은 친화도 상호 작용 관심의 단백질 주변의 분리 및 단백질 네트워크의 식별에 대한 엄격한 방법을 배제. 화학 crosslinkers의 사용은 따라서 정화에 대한 생화 학적 한계를 거치지 않고 불안 정한 상호 작용의 선택 안정화 수 있습니다. 여기에 우리가의 스페이서 팔로 homobifunctional crosslinker를 사용하는 문화의 세포에 대한 의무 프로토콜을 현재 12, dithiobis - (succinimidyl proprionate) (DSP). DSP는 분자에 존재 disulphide 결합의 감소에 의해 죽습니다. 자석 구슬과 관심의 단백질의 면역 크로마 토그래피와 결합 가교 달리 정화 견딜 않을 단백질 단지의 절연을 수 있습니다. 이 프로토콜은 일반적인 서양 얼룩 기술과 호환되며 그것은 대량 분석법 1 단백질 식별을 위해 확장할 수 있습니다.
스테파니 A. Zlatic와 진주 V. 라이더이 작품에 동일하게 기여.
프로토콜
1. Crosslinking 준비
- 당신은 표준 튜브 반응 당 단백질 500 μg의 고립을 허용 접시에 세포의 충분한 번호가 필요합니다. 하나의 튜브가 immunoblot으로 관심의 단백질 putative interactors의 식별하기에 충분한 수 있습니다. 이 경우 비드 바운드 자료는 SDS - PAGE 샘플 버퍼 (immunoprecipitation)로 eluted 수 있습니다. 질량 분광법의 분석을 위해, 표준 반응의 숫자는 적어도 10 배 증가되어야하며 단백질 단지는 (면역 친 화성 크로마 토그래피) 사용 항체에 의해 인식 펩타이드 항원과 함께 밖으로 경쟁에 의해 eluted해야합니다. 이 전략은 면역 글로불린 무료 단백질 단지의 격리를 허용합니다.
- crosslinking에 대한 최적의 세포 밀도가 75 % confluency 90% 사이입니다. 높은 confluency 조건에서, 세포는 모든 세포에 세포 투과 crosslinker에 접근을 감소하는, 서로에 대한 더미하는 경향이있다.
- 세포 종류와 실험 조건은 셀 플레이트의 하단에 표시해야합니다. 우리는 일상적으로 혼자 자동차와 컨트롤을 포함합니다.
- 이전 crosslinking에 DSP 솔루션을 제외한 모든 솔루션을 준비합니다.
- CaCl 2 0.1 MM 및 CaCl 2 실험을 시작하기 전에 1 ㎜ (PBS / CA / MG)과 인산염 버퍼 호수 버퍼의 재고를 준비합니다. 칼슘 및 마그네슘 이온의 또한이 실험의 과정 동안 문화 판에 세포 접착을 위해 중요합니다. 4 스토어 ° C.
- 50X 완료 테아제 억제제 칵테일 - 1mL 밀리 Q의 물속에 녹아있는 한 타블렛. -20 ° C.에 저장
- 20% 트리톤 X - 100은 10g 트리톤 Triton X -100 밖으로 체중 50 ML 밀리 Q 워터의 전체 볼륨에 희석. 4 록 ° C 4 박 및 저장 ° C까지 사용. 이상 1 개월 보관하지 마십시오. 아래에 설명된 용해 및 IP 버퍼를 준비하는이 20 % 주식 dilutions을 사용합니다.
- 산도 7.4에 50X DSP 칭 솔루션 1M 트리스. 상온에서 보관하십시오.
- 10X 버퍼에게 솔루션을 준비합니다.
10X 버퍼 :- 50 ML 1 M HEPES
- 150 ML 5 M NaCl
- 10 ML 0.5 M EGTA
- 250 μL 2 M MgCl 2
- 7.4으로 산도를 조정
- 500 ML에 마지막으로 볼륨을 가지고
1X 버퍼는 또한 lysate와 단백질 자석 - 강수량 버퍼에 사용됩니다.
1X 버퍼- 10 MM Hepes
- 150 MM NaCl
- 1 ㎜ EGTA
- 0.1 MM MgCl 2
- 산도 7.4
- 용해 버퍼 1X 버퍼 + 0.5 % 트리톤 X - 100.
- 단백질 마그네틱 강수량의 버퍼 (IP 버퍼) 1X 버퍼 + 0.1 % 트리톤 X - 100.
2. Crosslinking 솔루션 준비
- 즉시 세포에 적용하기 전에 DSP 솔루션을 준비합니다. DSP는 매우 소수성이며 PBS / CA / MG 버퍼로 diluting 전에 DMSO에 용해한다. DMSO 1 ML에 DSP의 40 밀리그램을 디졸브. 이것은 DSP (DSP의 분자량은 404.42 g / 몰입니다)의 100 MM 솔루션을합니다.
- PBS로 DSP / DMSO의 희석을 용이하게하기 위해서 ° C에서 37로 PBS / CA / MG의 적절한 볼륨을 따뜻하게.
여러 플레이트 크기에 필요한 볼륨 :
물론 당 6 - 음 판 2 ML
판 당 10cm 플레이트 10 ML
판 당 15cm 플레이트 20 ML - 따뜻한 PBS / CA / MG의 모든 1 ML위한 DSP / DMSO 재고 솔루션의 10μL를 추가합니다. 모든 DSP가 해산 때까지 반복 혼합과 드롭하여 DSP / DMSO 재고 솔루션 드롭을 추가합니다. PBS / CA / MG의 모든 1 ML에 추가 10 μL DMSO의 제어 솔루션을 확인하십시오.
- 10 분 이상 더 이상 얼음 물을 욕조에있는 모든 PBS / CA / MG 솔루션을 놓으십시오.
3. Crosslinking에 대한 셀 준비
- crosslinking 또는 차량 제어 보육에 대한 모든 번호판을 맞게 얼음 물 목욕을 준비합니다.
- 37 ° C 배양기에서 접시를 타고 얼음 물을 욕조에 바로 놓으십시오.
- 얼음처럼 차가운 PBS / CA / MG와 세포 두 번 씻으십시오. 당신은 (섹션 2.2 참조) crosslinker 배양에 사용되는 같은 볼륨을 사용합니다.
- 두번째 세척을 제거하고 차량 제어 또는 DSP의 crosslinking 버퍼 솔루션 중 하나를 추가합니다.
- 두 시간 동안 얼음에 품어. 당신은 접시 모든 세포 솔루션이 적용되는 것을 보장하기 위해 대략 매 20 분 확인하시기 바랍니다. 당신은 DSP의 작은 금액이 솔루션의 밖으로 침전물이 나타날 수 있습니다. 이것은 정상입니다.
4. DSP 반응의 불활 성화
- PBS / CA / MG (PBS / CA / MG의 모든 1 ML 1 M 트리스 산도 7.4의 20 μL) 20 MM 트리스 산도 7.4의 1X DSP 담금질 솔루션을 준비합니다.
- 차량 제어 및 crosslinking 솔루션을 제거합니다.
- 얼음처럼 차가운 불활 성화 솔루션을 추가하고 15 분 동안 얼음에 품어.
5. 세포 용해
- DSP 담금질 보육 동안 0.5 % 트리톤 버퍼에 X - 100과 함께 완전한 테아제 억제제 칵테일의 세포 용해 버퍼를 준비합니다. 모든 1 ML의 용해 버퍼에 대한 완벽한 20 μL 50X 재고 솔루션을 추가합니다.
- 십오분 DSP 담금질 보육 다음, PBS / CA / MG와 세포 두 번 씻는다.
- 30 분 용해 버퍼 + 4 셀 및 바위 완료 ° C를 추가합니다. 일부는 여러 플레이트 크기에 대한 용해 버퍼의 볼륨을 제안 :
- 물론 당 6 - 잘 플레이트 0.5 ML
- 판 당 10cm 플레이트 1 ML
- 판 당 15cm 플레이트 1 ML
- 용해 후, 접시에서 세포를 수집하는 세포 스크레이퍼를 사용합니다. 단백 분해 효소 활동을 최소화하기 위해 얼음에 lysates을 유지하시기 바랍니다
- 스핀 셀룰라 최고 속도 (15.000 XG)에서 벤치 탑 미니 원심 분리기 4 15 분 ° C에 대한 lysates.
- 새로운 튜브에 뜨는를 피펫. 펠렛 폐기하십시오.
- 단백질 수준을 분석하고 immunoprecipitation과 함께 진행합니다.
6. 단백질 자기 강수량 비즈 준비
참고 :이 단계는 일반적으로 직접 2 시간 crosslinking 보육을 시작 후에 시작됩니다.
- 30 Dynal immunomagnetic 구슬 μL, IP 버퍼 500 μL (1X 버퍼 + 0.1 % 트리톤 X - 100) 및 microcentrifuge 튜브를 screwtop하는 항원 특정 항체의 해당 금액을 결합합니다. 부정적인 컨트롤에 대한 항체가없는가 아닌 특정 항체 튜브 준비합니다. 항체의 적절한 금액은 별도의 실험을하는 동안 각각의 항원에 따라 결정되어야합니다. 모든 IP 튜브 라벨.
- IP 튜브가 두 시간 동안 실온에서 엔드 오버 엔드 로커에서 부화 수 있습니다. 또는, crosslinking하기 전에 4 명이 하루 밤새 항체로 IP 튜브를 품어.
- 부화 후, 튜브의 하단에있는 비즈를 수집하는 빠른 10초 미니 원심 분리 해.
- 멀리 튜브의 바닥에서 자기 구슬을 끌 수있는 자석 홀더로 튜브 슬라이드. 안전하게 비켜 비즈와 함께, 당신은 지금 쉽게 어떤 언바운드 항체를 멀리 세척하실 수 있습니다.
- 이러한 겔 로딩 팁 또는 부화 버퍼 및 언바운드 항체를 제거하는 p200 팁 등 작은 구멍 흡인기 팁을 사용합니다. 부화 볼륨이 제거되자 마자 IP 버퍼 1 ML에 추가합니다.
- 부드럽게 다시 중단 비즈, 튜브를 캡 및 엔드 오버 엔드 회전 5 분 실온에서 모든 IP 튜브를 품어.
- 한번 더 IP 버퍼의 새로운 밀리리터로 5 분 세척 단계를 (6.6 단계를 통해 6.3) 반복합니다.
- 가교 lysate의 비즈에 추가 준비가 될 때까지 IP 튜브는 지난 씻어 보육에 남아있을 수 있습니다.
7. 단백질 자성 비즈와 가교 Lysate를 품어
- 마지막 세척 회전 단백질 자석 구슬 후, 아래로 10 초 동안 미니 원심 분리기 인치 그런 다음 자석 홀더에 튜브를 살짝로 진행합니다.
- 다시, 작은 구멍 열망 팁을 사용하면, 튜브에서 부화 볼륨을 제거합니다. 즉시 단백질 자석 구슬이 들어있는 튜브에 가교 세포 lysate (1 μg / ML에서 lysate를 가정) 500 μL를 추가합니다. 당신은 부정적인 제어로 펩타이드 경쟁을 사용한다면, 펩타이드의 적절한 금액은이 시점에서 포함되어야합니다. 이전 실험은 적절한 펩타이드의 경쟁 조건을 결정하기 위해 수행되어야합니다. 또는, 당신은 부정적인 제어로 lysate 무료 단백질 자석 구슬을 할 수 있습니다. 이 경우에는 즉시 단백질 자석 구슬에 + 완료 Lysate 버퍼 (1X 버퍼 + 0.5 % 트리톤 X - 100) 500 μL를 추가합니다.
- 부드럽게 구슬을 resuspend. Resuspended 구슬은 2 시간 엔드 오버 엔드 회전에서 4 명이에 incubated해야합니다.
8. 비즈에서 언바운드 Lysate 와시
- 일단 lysate는 미니 원심 분리기의 빨리 10초 스핀은 충분한 부화 시간을 가지고 있습니다. 그런 다음 튜브는 자석 홀더에 끼웁니다. 자석 홀더는 실험의 나머지 얼음 욕조에 보관해야합니다.
- 작은 구멍 흡인기 팁을 사용하여 모든 언바운드 lysate를 제거합니다. 모든 언바운드 lysate를 제거 직후 것은 IP 버퍼 1 ML를 추가합니다.
- 튜브 뚜껑 부드럽게 구슬을 resuspend.
- 일단 구슬이 비드 pelleting 단계 (8.1)을 반복 resuspended 있습니다.
- 다시 부화 볼륨의 모든을 대기음 즉시 IP 버퍼 1 ML을 추가한 다음 튜브를 마개.
- 부드럽게 IP 버퍼에있는 구슬을 resuspend. 엔드 오버 엔드 락을 함께 4 명이시 5 분 resuspended 구슬을 품어.
- 비드 세척 단계를 (8.6 통해 8.4) 4 번 이상 반복합니다.
9. 샘플 변성과 비즈의 수집
- 로 단백질 자석 강수량 튜브의 모든 바뀌어진 후, 다시 침전 비즈 (8.1)와 슬라이드 튜브자석 홀더.
- 단백질 자석 구슬에 바인딩 단백질이 조건을 denaturing에서 제거됩니다. 마지막 IP 버퍼 세척을 기음과 자석 홀더에서 IP 튜브를 제거합니다.
- 또 튜브의 하단에있는 수영장에서 구슬을하는 비드 펠렛 위의 IP 튜브에 1X 젤 샘플 버퍼를 추가합니다. 샘플 버퍼의 양은 사용하는 젤의 잘 크기에 따라 달라집니다. 당신은 부드럽게 젤 샘플 버퍼에 resuspended 구슬을 모두 얻을 수있는 튜브의 바닥을 도청 할 수 있습니다.
- 각 IP 튜브 denaturing 과정 (9.3 통해 9.2)를 반복합니다.
- 젤 샘플 버퍼에 resuspended 단백질 자석 구슬은 다음 75 온수 아르 ° denaturing 프로세스를 완료하기 위해 5 분간 C.
- 일단 예제가 서부 모래 바닥에 대한 SDS - PAGE 젤에서 실행할 수있는 변성되었습니다. 비운 단백질 자성 비즈는 원심 분리하여 다시 pelleted과 자석 홀더와 샘플에서 제거할 수 있습니다.
10. Antigenic의 펩티드와 가교 단지 (면역 친 화성 크로마 토그래피)의 용출.
- 단백질 자석 immunoprecipitation 튜브의 모든 후 자석 홀더에 다시 침전 비즈 (8.1)와 슬라이드 튜브는 씻어되었습니다. 뜨는을 기음과 버퍼 10 μl를 추가 단백질 단지의 immunoisolation에 사용되는 항체에 의해 인식 antigenic의 펩타이드와 함께 보충. 당신이 효율적인 용출에 대한 10-200 μm의까지 농도를 테스트해야합니다.
- 4 2 H에 대한 구슬을 품어 ° C.
- 자기 스탠드에 구슬을 넣어 조심스럽게 eluted 소재의 10 ML을 복구합니다. 이 표면에 뜨는를 저장합니다.
- 신속 버퍼와 비즈를 세척하고 세척을 삭제. 구슬을 저장합니다.
- 1X의 농도에 저장된 뜨는와 구슬로 젤 샘플 버퍼를 추가합니다. ° C 5 분 75 다음 튜브를 품어.
- SDS - PAGE에 의해 구슬과 펩타이드 eluate를 분석합니다. eluate 모두 SDS - PAGE의 얼룩 단백질이나 immunoblots (그림 1B)에 의해 IgG 무료로해야합니다. IgG 무료이 자료는 질량 분광법에 적합합니다.
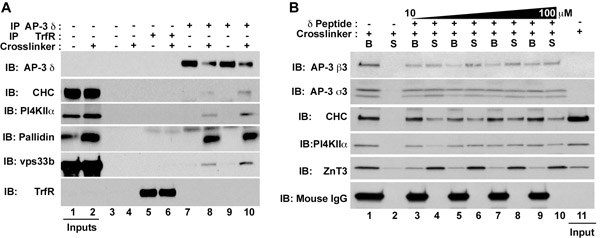
그림 1. AP - 3 상호 작용하는 단백질 합성물과 막 단백질의 분리. HEK293 세포 (A) 또는 PC12 세포 (B) 차량 제어의 존재에 중 처리 (DMSO, 홀수 차선 그림 1A) 또는되었습니다 DSP (심지어는 골목길이 그림. 1A 또는 모든 그림의 1B에서 차선). 그림, 명확히 추출물 혼자 비즈 (그림 1A, 레인스 3-4), 트랜스페린 수용체 항체 (그림 1A, 레인스 5-6) 또는 AP - 3 δ 항체 (그림 1A, 레인스 70-10과 중 incubated되었습니다 . 1B, 골목길 10-10). 면역 단지는 SDS - PAGE 샘플 버퍼 (그림 1A)와 eluted했고 혼자 버퍼 또는 (그림의 1B, 차선 1-2), 또는 아미노산 680 710에 해당하는 δ의 antigenic의 펩타이드의 증가 농도와 보충 버퍼 (그림의 1B, 차선 3-10) :; 인간 δ - adaptin (1,923,266 GI AAD03777 NCBI)의. 이 펩티드는 δ 항체를 바인딩합니다. 펩타이드 용출 후, supernatants (S)과 구슬 (B)가 immunoblot (그림의 1B)에 의해 분석되었다. ;뿐만 아니라 clathrin 중쇄 (CHC), 공산권 - 1 subunit의 pallidin, 그리고 홉스 복잡한 subunit의 vps33b : δ, β3 및 σ3 subunits에 대한 항체로 검색된 AP - 3, 다음과 같은 수용성 요소로 coprecipitates 멤브레인는 phosphatidylinositol - 4 - 키나제 타입 II 알파 (PI4KIIα)와 아연 전송 3 (ZnT3)을 단백질. 펩타이드의 IgG 마우스 무거운 체인의 부재는 그림 뜨는을 eluted합니다. 1B.
Access restricted. Please log in or start a trial to view this content.
토론
DSP, 멤브레인 - 침투성, 12의 스페이서 암과 화학적 줄이할 수있는 crosslinker는 과도 단백질 상호 작용 1,2,3,4를 안정화하는 데 사용됩니다. 여기서 우리는 어댑터 복잡한 AP - 3 5 endosomes에서 vesicles에 막 단백질을 인식하고 각종 가용성 단백질 복합이 전략을 exemplified. AP - 3 선택 아연 수송 ZnT3 및 지질 키나제 phosphatidylinositol - 4 - 키나제 타입 II 알파지만 트랜스페린 수용체 1,4,6에
Access restricted. Please log in or start a trial to view this content.
감사의 말
이 작품은 VF에 국립 보건원 (NS42599 및 GM077569)에서 보조금에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline | Invitrogen | P4417 | Dissolve 1 tablet in 200 mL water; add MgCl2 to a final concentration of 1 mM and CaCl2 to a final concentration of 0.1 mM |
| Dithiobis (succinimidyl propionate) (DSP) | Thermo Fisher Scientific, Inc. | 22585 | Moisture sensitive, store in air tight container 4°C |
| Dimethyl sulphoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| Triton X-100, SigmaUltra | Sigma-Aldrich | T9284 | |
| Dynabeads, Sheep anti-Mouse IgG | Invitrogen | 110.31 | Beads are also available as sheep anti-rabbit |
| Dyna-Mag-2 magnet | Invitrogen | 123-21D |
참고문헌
- Salazar, G. Hermansky-Pudlak syndrome protein complexes associate with phosphatidylinositol 4-kinase type II alpha in neuronal and non-neuronal cells. J Biol Chem. 284, 1790-1802 (2009).
- Lomant, A. J., Fairbanks, G. Chemical probes of extended biological structures: synthesis and properties of the cleavable protein cross-linking reagent [35S]dithiobis(succinimidyl propionate. J Mol Biol. 104, 243-261 (1976).
- Xiang, C. C. Using DSP, a reversible cross-linker, to fix tissue sections for immunostaining, microdissection and expression profiling. Nucleic Acids Res. 32, e185-e185 (2004).
- Craige, B., Salazar, G., Faundez, V. Phosphatidylinositol-4-Kinase Type II Alpha Contains an AP-3 Sorting Motif and a Kinase Domain that are both Required for Endosome Traffic. Mol Biol Cell. 19, 1415-1426 (2008).
- Newell-Litwa, K., Seong, E., Burmeister, M., Faundez, V. Neuronal and non-neuronal functions of the AP-3 sorting machinery. J Cell Sci. 120, 531-541 (2007).
- Salazar, G. The Zinc Transporter ZnT3 interacts with AP-3 and it is Targeted to a Distinct Synaptic Vesicle Subpopulation. Mol Biol Cell. 15, 575-587 (2004).
- Trinkle-Mulcahy, L. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유