Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dayanıksız Multi-protein Kompleksleri izolasyonu In vivo Kontrollü Hücresel Çapraz Bağlama ve immuno-manyetik Afinite Kromatografisi
Özet
Hücre geçirgen çapraz bağlayıcı DSP [dithiobis-(succinimidyl propiyonat)] stabilize geçici ve labil etkileşimleri In vivo Sıkı protein kompleksi arıtma teknikleri kullanarak kendi izolasyon sağlar. Burada immunoprecipitation protein kompleksleri izolasyonu, kültürde yetişen crosslinking hücreler için kullanılan bir tekniktir.
Özet
Hücresel makine dinamik doğası, sıklıkla geçici ve / veya zayıf protein dernekler üzerine inşa edilmiştir. Bu düşük afinite etkileşimleri ilgi bir protein etrafında izolasyon ve protein ağlarının belirlenmesi için sıkı yöntemleri engellemektedir. , Kimyasal crosslinkers kullanımı, böylece arıtma için biyokimyasal sınırlamalar atlayarak, labil etkileşimleri seçici istikrar sağlar. Burada bir ayırıcı bir kol ile bir homobifunctional çapraz bağlayıcı kullanır kültür hücreleri için mükellef bir protokol mevcut 12 Å, dithiobis (succinimidyl proprionate) (DSP). DSP molekülü bir disülfit bağ azaltılması bölünmüş. Manyetik boncuklar ile ilgi proteinlerin immünoafinite kromatografisi ile kombine Çapraz bağlama, aksi arıtma dayanamaz protein kompleksleri izolasyonu sağlar. Bu protokol düzenli western blot teknikleri ile uyumlu ve kütle spektrometresi 1 protein tanımlanması için büyütülüyor olabilir.
Stephanie A. Zlatic ve Pearl V. Ryder, bu çalışmaya eşit katkıda bulundu.
Protokol
1. Crosslinking için hazırlık
- 500 mg standart tüp reaksiyonu başına protein izolasyonu izin plaka için yeterli sayıda hücre gerekecektir. Bir tek tüp, immunoblotting faiz bir protein varsayılan interactors tanımlama için yeterli olabilir. Bu durumda, boncuk bağlı malzeme, SDS-PAGE örnek tamponu (immunoprecipitation) ile yıkandı olabilir. Kütle spektrometresi analizi için, standart reaksiyonlar sayısı en az on kat artmış olmalı ve protein kompleksleri kullanılan antikor (immünoafinite kromatografisi) tarafından tanınan bir peptid antijeni ile rekabet ile yıkandı, olmalıdır. Bu strateji, immünglobulin protein kompleksleri izolasyonu sağlayacaktır.
- Crosslinking için en uygun hücre yoğunluğu% 75 ve% 90 confluency arasında. Yüksek confluency koşullarda, hücreler, tüm hücrelerin hücre geçirgen çapraz bağlayıcı erişilebilirlik azalır, birbirlerine kazık eğilimindedir.
- Hücre tipi ve deneysel durum hücre plakanın alt tarafında etiketli olmalıdır. Biz rutin olarak tek başına araç ile kontroller içerir.
- DSP çözümü DIŞINDA önce crosslinking tüm çözümler hazırlayın.
- CaCl 2 0.1 mM CaCl 2 deney başlamadan önce 1 mM (PBS / Ca / Mg) ile fosfat tamponlu salin tampon stok hazırlayın. Ayrıca kalsiyum ve magnezyum iyonlarının hücreleri deney sırasında kültür plakasına yapışması için kritik öneme sahiptir. 4 ° C saklayınız
- 50X Komple Proteaz İnhibitör Kokteyl - 1 ml Milli-Q su içinde çözünmüş 1 tablet. -20 ° C'de muhafaza
- % 20 Triton X-100 10g Triton X -100 dışarı tartılır ve 50 ml Milli-Q Su toplam hacmi içinde sulandırmak. Rock, 4 ° C 4 geceleme ve mağaza ° C kullanana kadar. 1 aydan fazla tutmayın. Bu% 20 hisse senedinin aşağıda açıklanan parçalama ve IP tamponlar hazırlamak için dilüsyonları kullanın.
- PH 7.4 50X DSP Quenching Çözüm 1M TRIS. Oda sıcaklığında saklayın.
- 10x Tampon bir çözüm hazırlayın.
10X Tampon A:- 50 mL 1 M Hepes
- 150 mL 5 M NaCl
- 10 ml 0.5 M EGTA
- 250 mcL 2 M MgCl 2
- PH 7.4 'e ayarlayın
- Son hacim 500 mL getirin
1x Tampon lizat ve immuno-manyetik yağış tamponlar kullanılır.
A 1X Buffer- 10 mM HEPES
- 150 mM NaCl
- 1 mM EGTA
- 0.1 mM MgCl 2
- pH: 7.4
- Lizis Tampon 1X Buffer A +% 0.5 Triton X-100.
- İmmüno-Manyetik Yağış Buffer (IP Tampon) 1X Buffer A +% 0.1 Triton X-100.
2. Crosslinking Çözüm hazırlanması
- DSP çözümü hücrelere başvuran hemen önce hazırlayın. DSP son derece hidrofobik ve PBS / Ca / Mg tampon içine seyreltilmesi önce DMSO içinde çözülmüş olmalıdır. DSP DMSO 1 ml 40 mg çözülür. Bu 100 mM DSP (DSP molekül ağırlığı 404,42 g / mol dür) bir çözüm haline getirir.
- PBS içine DSP / DMSO seyreltme kolaylaştırmak için 37 ° C sipariş PBS / Ca / Mg uygun bir hacmi ısıtmak için.
Çeşit çeşit plaka boyutları için gerekli Hacimler:
Ortalama 6-plaka 2 mL
10 cm plakası plaka başına 10 ml
15 cm plakası plaka başına 20 ml - DSP / DMSO sıcak PBS / Ca / Mg her 1 mL stok çözelti 10μL ekleyin. DSP eriyene kadar DSP / DMSO stok solüsyonu damla damla tekrarlanan karıştırma ekleyin. Her 1 mL PBS / Ca / Mg 10 mcL DMSO bir kontrol çözümü olun.
- 10 dakika daha uzun bir buz-su banyosu tüm PBS / Ca / Mg çözümleri yerleştirin.
3. Hücreler Crosslinking için hazırlayın
- Crosslinking veya araç kontrol inkübasyon için tüm plakaları uyacak bir buz-su banyosu hazırlayın.
- 37 ° C inkübatör plakalarını alın ve hemen buz-su banyosu içine koyun.
- Buz gibi soğuk PBS / Ca / Mg hücreler iki kez yıkayın. (Bkz. bölüm 2.2), çapraz bağlayıcı inkübasyon için kullanacağınız aynı hacimde kullanın.
- Ikinci yıkama çıkarın ve araç kontrolü veya DSP crosslinking tampon çözelti ya ekleyin.
- Iki saat boyunca buz üzerinde inkübe edin. Plakalar tüm hücreleri çözümü ile kaplı olduğundan emin olmak için yaklaşık her yirmi dakikada bir kontrol etmelisiniz. DSP küçük bir miktar çözüm çökelerek görebilirsiniz. Bu normal bir durumdur.
4. DSP Reaksiyon inaktivasyonu
- PBS / Ca / Mg (her 1 mL PBS / Ca / Mg 20 mcL için 1 M Tris pH: 7.4) 20 mM Tris, pH 7.4 1X DSP soğutmadan çözüm hazırlayın.
- Araç kontrol ve crosslinking çözümler çıkarın.
- Inaktivasyon çözüm buz ekleyin ve 15 dakika boyunca buz üzerinde kuluçkaya yatmaktadır.
5. Hücre Lizis
- DSP su verme kuluçka sırasında,% 0.5 Triton Tampon X-100 ile komple proteaz inhibitörü kokteyl hücre lizis tamponu hazırlamak. Her 1 mL lizis tamponu için tam 20 mcL 50X stok solüsyonu ekleyin.
- PBS / Ca / Mg, 15 dakika DSP su verme inkübasyon sonra, hücreler iki kez yıkayın.
- 30 dakika lizis tamponu + 4 kaya hücreleri ve Komple ° C ekleyin. Bazı çeşit çeşit plaka boyutları için lizis tamponu hacimleri önerilmektedir:
- Ortalama 6-plaka 0,5 mL
- 10 cm plakası plaka başına 1 ml
- 15 cm plakası plaka başına 1 ml
- Parçalama işleminden sonra, plaka hücreleri toplamak için bir hücre kazıyıcı kullanın. Proteaz aktivitesi en aza indirmek için, buz üzerinde lizatları tutmak için emin olun.
- Spin hücre, en yüksek hızı (15.000 xg) bir tezgah üstü mini-santrifüj 15 dakika 4 ° C lizatları.
- Taze bir tüpe süpernatantı Pipet. Pelet atın.
- Protein düzeyleri analiz ve immunoprecipitation devam.
6. Immuno-manyetik Yağış Boncuk hazırlanması
Not: Bu adım, genellikle 2 saat crosslinking inkübasyon doğrudan başından itibaren başlatılır.
- 30 Dynal immunomagnetic boncuk mcL, 500 mcL IP Buffer (Tampon 1x A +% 0.1 Triton X-100) ve mikrosantrifüj tüpler screwtop uygun miktarda antijen-antikor birleştirin. Negatif kontroller için antikor ücretsiz ve non-spesifik antikor tüpleri hazırlayın. Uygun miktarda antikor ayrı deneyler sırasında bireysel antijenlere göre tespit edilmelidir. Tüm IP tüpler Etiket.
- IP tüpler iki saat boyunca oda sıcaklığında bir sonu aşırı uç rocker inkübe izin verin. Alternatif olarak, crosslinking 4 ° gün önce gece IP tüpler antikor ile inkübe edin.
- Inkübasyondan sonra, tüpün alt kısmında boncuk toplamak için 10 saniyede hızlı bir mini-santrifüj yapın.
- Tüpler tüp alt uzak manyetik boncuk çekin manyetik tutucu, içine kaydırın. Güvenli bir şekilde çıkış yolu boncuklar ile artık kolayca herhangi bir bağlanmamış antikor uzak yıkayabilirsiniz.
- Bir jel yükleme ucu veya kuluçka tampon ve kaldırmak için herhangi bir bağlanmamış antikor P200 ucu gibi küçük bir delik aspiratör ucu kullanın. Inkübasyon hacmi kaldırıldı mümkün olduğu kadar erken IP Buffer 1 ml ekleyin.
- Nazikçe yeniden askıya boncuk, boru kılıfı, ve tüm IP tüpleri üzerinde uç uç rotasyon ile 5 dakika oda sıcaklığında inkübe edin.
- IP Buffer taze bir mililitre ile bir kez daha 5 dakika yıkama adım (6.3 6.6 yoluyla adımları) tekrarlayın.
- Çapraz lizat boncuklar eklenmek üzere hazır olana kadar IP tüpler son yıkama inkübasyon kalır.
7. Immuno-manyetik Boncuk Çapraz Lizat inkübe
- Son yıkama spin immuno-manyetik bilye sonra, aşağı 10 saniye için bir mini-santrifüj. Sonra manyetik tutucunun içine tüpler kayma devam edin.
- Yine küçük bir delik aspirasyon ucu kullanarak, tüpten kuluçka hacmi çıkarın. Hemen immuno-manyetik bilye içeren tüplere çapraz hücre lizatı (1 mcg / mL lizat varsayarak) 500 mcL ekleyin. Negatif kontrol olarak peptid rekabet olacak, uygun bir miktarda peptit bu noktada dahil edilmelidir. Önceki deneyler, uygun peptid rekabet koşulları belirlemek için yapılmalıdır. Alternatif olarak, bir negatif kontrol olarak lizat ücretsiz immuno-manyetik bilye olmasını isteyebilirsiniz. Bu durumda, hemen immuno-manyetik bilye + Komple Lizat Buffer (Tampon 1x A +% 0.5 Triton X-100) 500 mcL ekleyin.
- Yavaşça boncuk tekrar süspansiyon. Yeniden süspanse boncuk, 2 saat için bir bitiş üzerinde uç dönme 4 ° inkübe edilmelidir.
8. Boncuk Sınırsız Lizat yıkayın
- Lizat bir mini-santrifüj 10 saniyelik hızlı bir dönüş yeterli inkübasyon süresi etti. Sonra tüpler manyetik tutucu içine kaydırın. Manyetik tutucu deney kalanı için bir buz banyosunda tutulmalıdır.
- Küçük bir delik aspiratör ucu kullanarak, tüm bağlanmamış lizat çıkarın. Tüm bağlanmamış lizat kaldırıldıktan hemen sonra IP Buffer 1 ml ekleyin.
- Tüp kap boncuklar ve yavaşça tekrar süspansiyon haline getirin.
- Boncuk boncuk peletleme adım (8.1) tekrar yeniden süspanse.
- Yine tüm inkübasyon hacmi aspirat ve hemen IP Buffer 1 ml ekleyin, daha sonra tüp kap.
- IP Tampon boncuk yavaşça tekrar süspansiyon. Yeniden süspanse boncuk üzerinde uç uç sallanan ile 4 ° az 5 dakika inkübe edin.
- Boncuk yıkama adımları (8.4) 8.6 üzerinden 4 kez daha tekrarlayın.
9 - Örnek doğasını ve Boncuk toplama
- Içine tüm immuno-manyetik yağış tüpler yıkanır sonra tekrar tortu boncuk (8.1) ve slayt tüplermanyetik tutucu.
- Immuno-manyetik bilye bağlı proteinler denatüre koşulları kaldırıldı. Aspire son IP Tampon yıkama ve manyetik sahibinden IP tüp kaldırmak.
- 1x Jel Örnek Tampon tekrar tüpün alt kısmında havuz boncuk boncuk pelet Yukarıdaki IP tüp ekleyin. Örnek tampon miktarı kullanılmak üzere jel iyi büyüklüğüne bağlıdır. Jel Örnek Tampon yeniden süspanse boncuk almak için tüpün alt hafifçe dokunmanız gerekebilir.
- Her IP tüpü için (9.3 üzerinden 9.2) denatüre işlemi tekrarlayın.
- Jel Örnek Tampon yeniden süspanse immuno-manyetik bilye sonra 75 ısıtılır ° C denatüre işlemini tamamlamak için 5 dakika.
- Sonra örnek batı blot SDS-PAGE jel üzerinde çalıştırılabilir denatüre olmuştur. Boşaltılmış immuno-Manyetik Boncuk santrifüj yeniden pelet ve manyetik tutucu ile örnek kaldırılır olabilir.
10 Çapraz antijenik Peptitler Kompleksleri (immunoaffiniti Kromatografisi) Elüsyon.
- Immuno manyetik immunoprecipitation tüplerin sonra manyetik tutucu içine yeniden tortu boncuk (8.1) ve slayt tüpleri, yıkanmış edilmiştir. Süpernatant aspire ve 10 ul Tampon eklemek protein kompleksleri immunoisolation için kullanılan antikor tarafından tanınan antijenik peptit ile desteklenmiştir. 10-200 mcM verimli yürütülmesi için değişen konsantrasyonlarda test etmelidir.
- 4 boncuk 2 saat süreyle inkübe ° C
- Boncuk manyetik stand koyun ve 10 ml yıkandı, malzeme dikkatli bir şekilde kurtarabilirsiniz. Bu süpernatant kaydedin.
- Tampon bir hızla boncuk yıkama ve yıkama atın. Boncuklar kaydedin.
- 1X bir konsantrasyon kaydedilen süpernatant ve boncuklar Jel Örnek Tamponu ekleyin. Bu tüpler 75 ° C'de 5 dakika inkübe edin.
- Boncuk ve peptid eluat SDS-PAGE ile analiz edin. Eluat hem SDS-PAGE leke protein veya immunoblots (Şekil 1B) IgG arındırılmış olmalıdır. IgG Bu malzeme, kütle spektrometresi için uygundur.
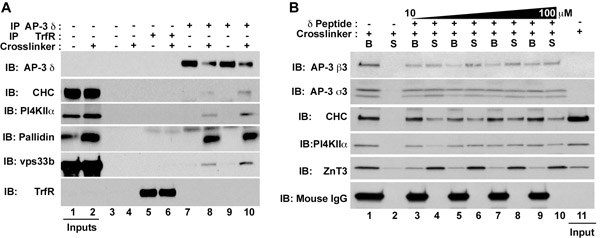
Şekil 1. AP-3 etkileşim protein kompleksleri ve membran proteinlerinin izolasyonu HEK293 hücreleri (A) veya PC12 hücreleri (B) araç kontrol varlığı ya da tedavi (DMSO, tek şerit Şekil 1A) veya DSP (hatta şerit Şekil 1A veya tüm Şekil 1B kulvar). Şekil Aydınlatılmış özleri yalnız boncuklarla (Şekil 1A, Lanes 3-4), transferrin reseptör antikorları (Şekil 1A, Lanes 5-6), ya da AP-3 δ antikorlar (Şekil 1A, Lanes 7-10 ya inkübe edildi. 1B, şerit 1-10). SDS-PAGE örnek tamponu (Şekil 1A) immün kompleksler ile yıkandı, bir başına Tampon veya (Şekil 1B, şerit 1-2), veya δ antijenik peptid amino asitler 680 710 karşılık artan konsantrasyonları ile desteklenmiş Tampon (Şekil 1B, şerit 3-10):;: insan δ-adaptin (1.923.266 gi AAD03777 NCBI). Bu peptid δ antikor bağlar. Peptid elüsyon sonra, süpernatantlar (S) ve boncuklar (B), immunoblotting (Şekil 1B) tarafından analiz edildi. Yanı sıra, clathrin ağır zincir (ÇHC), BLOK-1 altbirim pallidin ve HOPS karmaşık altbirim vps33b: δ, β3 ve σ3 alt birimden karşı antikor tespit AP-3, aşağıdaki çözünür faktörler coprecipitates membran fosfatidilinositol-4-kinaz tip II alfa (PI4KIIα) ve çinko taşıyıcı 3 (ZnT3) proteinleri. Peptid IgG ağır zincir fare yokluğunda Şekil süpernatant yıkandı, unutmayın. 1B.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
DSP, geçirgen bir zar, 12 Å bir ayırıcı kolu ile kimyasal indirgenebilir çapraz bağlayıcı geçici protein etkileşimleri 1,2,3,4 stabilize etmek için kullanılır. Burada adaptör kompleksi AP-3, 5 endosomes veziküller içine zarı proteinleri tanır ve sıralar çözünebilir bir protein kompleksi ile bu stratejinin bir örneğini verdi . AP-3 seçici çinko taşıyıcı ZnT3 ve lipid kinaz fosfatidilinositol-4-kinaz tip II alfa değil transferrin reseptör 1,4,6 bağlar. Biz...
Access restricted. Please log in or start a trial to view this content.
Teşekkürler
Bu çalışma, VF için Ulusal Sağlık Enstitüleri (NS42599 ve GM077569) hibe ile desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline | Invitrogen | P4417 | Dissolve 1 tablet in 200 mL water; add MgCl2 to a final concentration of 1 mM and CaCl2 to a final concentration of 0.1 mM |
| Dithiobis (succinimidyl propionate) (DSP) | Thermo Fisher Scientific, Inc. | 22585 | Moisture sensitive, store in air tight container 4°C |
| Dimethyl sulphoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| Triton X-100, SigmaUltra | Sigma-Aldrich | T9284 | |
| Dynabeads, Sheep anti-Mouse IgG | Invitrogen | 110.31 | Beads are also available as sheep anti-rabbit |
| Dyna-Mag-2 magnet | Invitrogen | 123-21D |
Referanslar
- Salazar, G. Hermansky-Pudlak syndrome protein complexes associate with phosphatidylinositol 4-kinase type II alpha in neuronal and non-neuronal cells. J Biol Chem. 284, 1790-1802 (2009).
- Lomant, A. J., Fairbanks, G. Chemical probes of extended biological structures: synthesis and properties of the cleavable protein cross-linking reagent [35S]dithiobis(succinimidyl propionate. J Mol Biol. 104, 243-261 (1976).
- Xiang, C. C. Using DSP, a reversible cross-linker, to fix tissue sections for immunostaining, microdissection and expression profiling. Nucleic Acids Res. 32, e185-e185 (2004).
- Craige, B., Salazar, G., Faundez, V. Phosphatidylinositol-4-Kinase Type II Alpha Contains an AP-3 Sorting Motif and a Kinase Domain that are both Required for Endosome Traffic. Mol Biol Cell. 19, 1415-1426 (2008).
- Newell-Litwa, K., Seong, E., Burmeister, M., Faundez, V. Neuronal and non-neuronal functions of the AP-3 sorting machinery. J Cell Sci. 120, 531-541 (2007).
- Salazar, G. The Zinc Transporter ZnT3 interacts with AP-3 and it is Targeted to a Distinct Synaptic Vesicle Subpopulation. Mol Biol Cell. 15, 575-587 (2004).
- Trinkle-Mulcahy, L. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır