È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di Labile Multi-proteina complessi da In vivo Controllato Cellular Cross-Linking e Immuno-magnetica Cromatografia di affinità
In questo articolo
Riepilogo
La cellula permeabile reticolante DSP [dithiobis-(succinimidile propionato)] stabilizza le interazioni transienti e labile In vivo, Che consente loro isolamento utilizzando rigorosi tecniche di purificazione di proteine complesse. Qui vi presentiamo una tecnica per la reticolazione cellule in coltura seguita da isolamento di complessi proteici da immunoprecipitazione.
Abstract
La natura dinamica di macchine cellulare è spesso costruito sulle associazioni di proteine transitori e / o debole. Queste interazioni bassa affinità preclude metodi rigorosi per l'isolamento e l'identificazione di reti di proteine intorno ad una proteina di interesse. L'uso di reticolanti chimici permette la stabilizzazione selettiva delle interazioni labili, aggirando così le limitazioni biochimiche per la purificazione. Qui vi presentiamo un protocollo suscettibile di cellule in coltura che utilizza un reticolante homobifunctional con un braccio distanziatore di 12 Å, dithiobis-(succinimidile propionato) (DSP). DSP è scissa dalla riduzione di un legame disolfuro presenti nella molecola. Cross-linking in combinazione con la cromatografia di immunoaffinità di proteine di interesse con perline magnetiche permette l'isolamento di complessi proteici che altrimenti non avrebbe resistere purificazione. Questo protocollo è compatibile con le normali tecniche di Western Blot e può essere scalata per l'identificazione delle proteine mediante spettrometria di massa 1.
Stephanie A. Zlatic e Pearl V. Ryder contribuito in maniera uguale a questo lavoro.
Protocollo
1. Preparazione per reticolazione
- Avrete bisogno di piatto un numero sufficiente di celle per consentire l'isolamento di 500 mg di proteine per reazione tubo standard. Un tubo singolo può essere sufficiente per l'identificazione di putativi interattori di una proteina di interesse da immunoblot. In questo caso tallone materiale legato può essere eluito con SDS-PAGE tampone del campione (immunoprecipitazione). Per l'analisi di spettrometria di massa, il numero di reazioni standard dovrebbe essere aumentata almeno dieci volte e complessi di proteine deve essere eluita da fuori concorso con un antigene peptide riconosciuto dal anticorpo utilizzato (immunoaffinità cromatografia). Questa strategia permetterà l'isolamento di complessi proteici liberi di immunoglobuline.
- La densità cellulare ottimale per reticolazione è compresa tra 75% e il 90% confluenza. In condizioni di elevata confluenza, le cellule tendono ad accumularsi uno sull'altro, che diminuisce l'accessibilità alla cella-permeabile reticolante a tutte le celle.
- Tipo di cellula e dalle condizioni sperimentali devono essere etichettati sul fondo della piastra cellulare. Ci sono controlli di routine con solo veicolo.
- Preparare tutte le soluzioni TRANNE la soluzione DSP prima di reticolazione.
- Preparare uno stock di tampone fosfato tampone salino con CaCl 2 0,1 mM e CaCl 2 1 mM (PBS / Ca / Mg) prima di iniziare l'esperimento. L'aggiunta di ioni calcio e magnesio è fondamentale per l'adesione delle cellule alla piastra di coltura nel corso dell'esperimento. Conservare a 4 ° C.
- 50X completa inibitori della proteasi Cocktail - 1 compressa sciolta in 1 ml di acqua Milli-Q. Conservare a -20 ° C.
- 20% di Triton X-100 Pesare 10g Triton X -100 e diluire a volume totale di 50 ml di acqua Milli-Q. Roccia a 4 ° C per una notte e conservare a 4 ° C fino all'uso. Non conservare per più di 1 mese. Utilizzare diluizioni di questo stock del 20% per preparare il buffer di lisi e IP descritto di seguito.
- 50X DSP tempra Soluzione TRIS 1M a pH 7.4. Conservare a temperatura ambiente.
- Preparare un tampone 10x Una soluzione.
Buffer 10X A:- 50 ml 1 M HEPES
- 150 ml di NaCl 5 M
- 10 mL 0,5 M EGTA
- 250 microlitri 2 M MgCl 2
- Regolare il pH a 7,4
- Portare il volume finale a 500 ml
Buffer 1x A è utilizzato anche in lisato e immuno-magnetico-precipitazione buffer.
Un tampone 1X- 10 mM Hepes
- 150 mM NaCl
- 1 mM EGTA
- 0.1 mM MgCl 2
- pH 7,4
- Tampone di Lysis Buffer 1X A + 0,5% Triton X-100.
- Immuno-magnetica Buffer Precipitazioni (IP Buffer) 1X tampone A + 0,1% Triton X-100.
2. Preparazione della soluzione di reticolazione
- Preparare la soluzione DSP immediatamente prima di applicare alle cellule. DSP è altamente idrofoba e deve essere sciolto in DMSO prima di diluire in PBS / Ca / Mg buffer. Sciogliere 40 mg di DSP in 1 ml di DMSO. Questo rende una soluzione 100 mM di DSP (Il peso molecolare di DSP è 404,42 g / mol).
- Caldo un volume adeguato di PBS / Ca / Mg a 37 ° C al fine di facilitare la diluizione del DSP / DMSO in PBS.
Volumi necessari per dimensioni piatto assortito:
6-pozzetti 2 mL per pozzetto
10 centimetri tavola 10 mL per piastra
15 centimetri piatto 20 ml per piastra - Aggiungere 10μL di DSP / DMSO soluzione madre per ogni 1 ml di PBS caldo / Ca / Mg. Aggiungi DSP / DMSO goccia a goccia soluzione madre con miscelazione ripetuto fino a quando tutti i DSP si è dissolto. Ottenere una soluzione di controllo di 10 microlitri di DMSO aggiunto ad ogni 1 ml di PBS / Ca / Mg.
- Mettere tutti PBS / Ca / Mg soluzioni in un bagno di acqua e ghiaccio non più di 10 min.
3. Preparare Celle per reticolazione
- Preparare un bagno di ghiaccio d'acqua che si adatta tutte le lastre di reticolazione o controllo di incubazione del veicolo.
- Prendere le piastre dal 37 ° C incubatore e metterli immediatamente in ghiaccio acqua sporca.
- Lavare le cellule due volte con gelida PBS / Ca / Mg. Utilizzare lo stesso volume che verrà utilizzato per l'incubazione reticolante (vedi sezione 2.2).
- Rimuovere il secondo lavaggio e aggiungere il controllo di veicoli o di una soluzione tampone reticolazione DSP.
- Incubare in ghiaccio per due ore. Si dovrebbe controllare le piastre circa ogni venti minuti per assicurare che tutte le cellule sono coperti da una soluzione. Si può notare una piccola quantità di DSP precipitare dalla soluzione. Questo è normale.
4. Inattivazione di reazione DSP
- Preparare una soluzione 1X tempra DSP di 20 mM Tris pH 7.4 in PBS / Ca / Mg (20 ml di 1 M Tris pH 7,4 per ogni 1 ml di PBS / Ca / Mg).
- Rimuovere il controllo del veicolo e le soluzioni reticolazione.
- Aggiungi ghiacciata soluzione inattivazione e incubare in ghiaccio per 15 minuti.
5. Cellula Lysis
- Durante l'incubazione tempra DSP, preparare il tampone di lisi delle cellule del 0,5% Triton X-100 in tampone A con cocktail Completa inibitore della proteasi. Aggiungere 20 ul di soluzione di 50X magazzino completo per ogni buffer 1 lisi ml.
- Seguendo i 15 minuti di incubazione tempra DSP, lavare le cellule due volte con PBS / Ca / Mg.
- Aggiungi tampone di lisi + completa alle cellule e rock a 4 ° C per 30 minuti. Alcuni hanno suggerito volumi di tampone di lisi per dimensioni piatto assortito:
- 6-pozzetti 0,5 mL per pozzetto
- 10 centimetri piastra 1 ml per piastra
- 15 centimetri piastra 1 ml per piastra
- Dopo la lisi, usare un raschietto cellula per raccogliere le cellule dalla piastra. Essere sicuri di mantenere lisati sul ghiaccio per ridurre al minimo l'attività della proteasi
- Spin lisati cellulari per 15 minuti a 4 ° C in un banco mini-centrifuga alla massima velocità (15.000 xg).
- Pipettare il supernatante in una nuova provetta. Eliminare il pellet.
- Analizzare i livelli di proteine e procedere con immunoprecipitazione.
6. Preparazione Immuno-magnetico Perline Precipitazioni
Nota: questo passaggio è di solito avviato direttamente dopo l'inizio l'incubazione reticolazione 2 ore.
- Unire 30 ml di Dynal sfere immunomagnetiche, 500 ml di IP Buffer (1x tampone A + 0,1% Triton X-100) e la giusta quantità di antigene-anticorpo specifico per screwtop tubi microcentrifuga. Preparare anticorpi liberi e non specifici anticorpi tubi per i controlli negativi. La giusta quantità di anticorpi deve essere determinato sulla base di singoli antigeni durante gli esperimenti separati. Etichetta tutti i tubi IP.
- Lasciare i tubi IP ad incubare in una soluzione end-over-end rocker a temperatura ambiente per due ore. In alternativa, incubare i tubi IP con anticorpi overnight a 4 ° il giorno prima della reticolazione.
- Dopo l'incubazione, fare un rapido 10 secondi mini-centrifugazione per raccogliere le perle sul fondo della provetta.
- Far scorrere i tubi nel supporto magnetico, che farà rientrare il sfere magnetiche lontano dal fondo della provetta. Con le perle in modo sicuro fuori del modo, si può ora facilmente lavare via ogni anticorpo non legato.
- Utilizzare una piccola mancia aspiratore portava come una punta di caricamento del gel, o P200 punta a rimuovere il tampone di incubazione e qualsiasi anticorpo non legato. Non appena il volume di incubazione è stato rimosso aggiungere in 1 ml di IP Buffer.
- Chiudere la provetta, delicatamente risospendere le perline, e tutti i tubi IP incubare a temperatura ambiente per 5 minuti con end-over-end di rotazione.
- Ripetere la fase di lavaggio 5 minuti (6,3 punti con 6,6) ancora una volta con un millilitro fresco di IP Buffer.
- I tubi IP può rimanere in incubazione ultimo lavaggio fino a quando il lisato reticolato è pronto per essere aggiunto ai talloni.
7. Incubare lisato reticolato con Immuno-magnetico Perline
- Dopo l'ultimo lavaggio di spin immuno-magnetico perline, giù in una mini-centrifuga per 10 secondi. Quindi procedere a scivolare i tubi nel supporto magnetico.
- Ancora una volta, con una piccola mancia aspirazione foro, rimuovere il volume di incubazione dal tubo. Immediatamente aggiungere 500 microlitri di lisato cellulare reticolato (assumendo lisato a 1 mg / ml) per i tubi contenenti immuno-magnetico perline. Se si prevede di utilizzare concorrenza peptide come controllo negativo, una quantità appropriata di peptide dovrebbe essere incluso, a questo punto. Precedenti esperimenti devono essere effettuati per determinare adeguate condizioni di concorrenza peptide. In alternativa, si consiglia di avere lisato libero immuno-magnetico perle come controllo negativo. In questo caso, immediatamente aggiungere 500 ml di lisato Buffer (1x tampone A + 0,5% Triton X-100) + completa per immuno-magnetico perline.
- Risospendere delicatamente le sfere. Microsfere in sospensione devono essere incubate a 4 ° in un fine-over-end di rotazione per 2 ore.
8. Lavare LISATO Unbound di Perline
- Una volta lisato ha avuto il tempo sufficiente incubazione, fare un rapido giro 10 secondi in un mini-centrifuga. Quindi, far scorrere i tubi nel supporto magnetico. Il supporto magnetico deve essere conservato in un bagno di ghiaccio per il resto l'esperimento.
- Utilizzando una piccola mancia aspiratore foro, rimuovere tutti i lisato non legato. Immediatamente dopo che tutti lisato non legato viene rimosso aggiungere 1 ml di IP Buffer.
- Chiudere la provetta e delicatamente risospendere le sfere.
- Una volta che le perle sono risospeso ripetere il passaggio tallone pellettizzazione (8,1).
- Ancora una volta aspirato fuori tutto il volume di incubazione e subito aggiungere 1 ml di IP Buffer, poi tappo il tubo.
- Risospendere delicatamente le perle in IP Buffer. Incubare microsfere in sospensione per 5 minuti a 4 ° con end-over-end a dondolo.
- Ripetere le operazioni di lavaggio tallone (8,4 per 8,6) 4 volte di più.
9. Denaturare campione e raccogliere da perline
- Dopo che tutte le immuno-magnetico tubi precipitazione sono stati lavati, ri-sedimento le perline (8,1) e tubi di scivolare nellasupporto magnetico.
- Le proteine legate alla immuno-magnetico perline vengono rimossi in condizioni di denaturazione. Aspirare fuori l'ultimo lavare IP Buffer e rimuovere il tubo IP dal supporto magnetico.
- Aggiungi 1x Sample Buffer Gel al tubo IP appena sopra il pellet tallone mettere in comune le perline sul fondo del tubo di nuovo. La quantità di tampone campione dipende dalle dimensioni e del gel da utilizzare. Potrebbe essere necessario premere delicatamente il fondo della provetta per ottenere tutte le microsfere in sospensione nel Sample Buffer Gel.
- Ripetere il processo di denaturazione (9,2 per 9,3) per ogni tubo IP.
- Immuno-magnetico perline risospese nel tampone Gel campioni vengono poi riscaldate a 75 ° C per 5 minuti per completare il processo di denaturazione.
- Una volta che il campione è stato denaturato può essere eseguito su un gel SDS-PAGE per blotting occidentale. Svuotato Immuno-Magnetic Beads può essere ri-pellet per centrifugazione e rimosso dal campione con il supporto magnetico.
10. Eluizione dei complessi reticolato con peptidi antigenici (immunoaffinità Chromatography).
- Dopo che tutte le immuno-magnetico tubi immunoprecipitazione sono stati lavati, ri-sedimento le perline (8,1) e tubi diapositiva nel supporto magnetico. Aspirare il surnatante e aggiungere 10 ml di tampone A integrato con il peptide antigenico riconosciuto dagli anticorpi utilizzati per immunoisolamento di complessi proteici. È necessario verificare concentrazioni comprese 1-20 mM per l'eluizione efficiente.
- Incubare le perline per 2 ore a 4 ° C.
- Mettere perle nello stand magnetico e con attenzione recuperare i 10 ml di materiale eluito. Salva questo supernatante.
- Lavare rapidamente le perline con tampone A e scartare il lavaggio. Salva le perline.
- Aggiungi Sample buffer Gel per il supernatante salvato e perline per una concentrazione di 1X. Incubare le provette a 75 ° C per 5 minuti.
- Analizzare perline e eluato peptide mediante SDS-PAGE. L'eluato dovrebbe essere libero di IgG sia da proteine macchia di SDS-PAGE o immunoblot (Figura 1B). Questo materiale libero di IgG è adatto per spettrometria di massa.
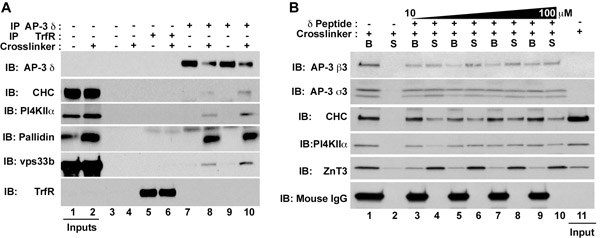
Figura 1. Isolamento di AP-3 complessi di proteine che interagiscono e proteine di membrana. Cellule HEK293 (A) o cellule PC12 (B) sono stati trattati sia in presenza di controllo del veicolo (DMSO, dispari corsie Fig. 1A) o DSP (anche corsie fig. 1A o tutti corsie in Fig. 1B). Estratti chiarito sono state incubate sia con perline da solo (Fig. 1A, Lanes 3-4), anticorpi contro il recettore della transferrina (Fig. 1A, Lanes 5-6), o AP-3 anticorpi δ (Fig. 1A, Lanes 7-10; Fig. . 1B, corsie 1-10). Immunocomplessi sono stati eluiti con SDS-PAGE tampone del campione (Fig. 1A), tampone A soli o (Fig. 1B, corsie 1-2), o tampone A integrato con concentrazioni crescenti del peptide antigenico δ corrispondente al aminoacidi 680 710 delle risorse umane δ-adaptin (NCBI: AAD03777; gi: 1923266) (Fig. 1B, corsie 3-10). Questo peptide si lega l'anticorpo δ. Dopo l'eluizione peptide, surnatanti (S) e perline (B) sono stati analizzati mediante immunoblot (Fig. 1B). AP-3, che viene rilevata con anticorpi contro il δ, β3 e σ3 subunità, coprecipitates con i seguenti fattori solubili: clatrina catena pesante (CHC), il BLOC-1 pallidin subunità, e il luppolo vps33b subunità complesso, così come le proteine di membrana fosfatidil-4-chinasi di tipo II alfa (PI4KIIα) e il trasportatore di zinco 3 (ZnT3). Si noti l'assenza di IgG catene del mouse pesanti nel peptidi eluiti surnatante in fig. 1B.
Discussione
DSP, una membrana permeabile, reticolante chimicamente riducibili con un braccio distanziatore di 12 A viene utilizzato per stabilizzare le interazioni proteina transitoria 1,2,3,4. Qui abbiamo esemplificato questa strategia con il complesso adattatore AP-3 un complesso proteina solubile che riconosce e ordina proteine di membrana in vescicole da endosomi 5. AP-3 si lega selettivamente al trasportatore di zinco ZnT3 e la chinasi dei lipidi fosfatidilinositolo-4-chinasi di tipo II, ma non dei ...
Riconoscimenti
Questo lavoro è stato sostenuto dalle concessioni dal National Institutes of Health a VF (NS42599 e GM077569).
Materiali
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline | Invitrogen | P4417 | Dissolve 1 tablet in 200 mL water; add MgCl2 to a final concentration of 1 mM and CaCl2 to a final concentration of 0.1 mM |
| Dithiobis (succinimidyl propionate) (DSP) | Thermo Fisher Scientific, Inc. | 22585 | Moisture sensitive, store in air tight container 4°C |
| Dimethyl sulphoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| Triton X-100, SigmaUltra | Sigma-Aldrich | T9284 | |
| Dynabeads, Sheep anti-Mouse IgG | Invitrogen | 110.31 | Beads are also available as sheep anti-rabbit |
| Dyna-Mag-2 magnet | Invitrogen | 123-21D |
Riferimenti
- Salazar, G. Hermansky-Pudlak syndrome protein complexes associate with phosphatidylinositol 4-kinase type II alpha in neuronal and non-neuronal cells. J Biol Chem. 284, 1790-1802 (2009).
- Lomant, A. J., Fairbanks, G. Chemical probes of extended biological structures: synthesis and properties of the cleavable protein cross-linking reagent [35S]dithiobis(succinimidyl propionate. J Mol Biol. 104, 243-261 (1976).
- Xiang, C. C. Using DSP, a reversible cross-linker, to fix tissue sections for immunostaining, microdissection and expression profiling. Nucleic Acids Res. 32, e185-e185 (2004).
- Craige, B., Salazar, G., Faundez, V. Phosphatidylinositol-4-Kinase Type II Alpha Contains an AP-3 Sorting Motif and a Kinase Domain that are both Required for Endosome Traffic. Mol Biol Cell. 19, 1415-1426 (2008).
- Newell-Litwa, K., Seong, E., Burmeister, M., Faundez, V. Neuronal and non-neuronal functions of the AP-3 sorting machinery. J Cell Sci. 120, 531-541 (2007).
- Salazar, G. The Zinc Transporter ZnT3 interacts with AP-3 and it is Targeted to a Distinct Synaptic Vesicle Subpopulation. Mol Biol Cell. 15, 575-587 (2004).
- Trinkle-Mulcahy, L. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon