É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de proteínas lábeis Multi-Complexos por In vivo Controlled Cellular Cross-Linking and Imuno-magnética cromatografia de afinidade
Neste Artigo
Resumo
A célula permeável reticulador DSP [dithiobis (succinimidyl propionato)] estabiliza interações transitória e instável In vivo, Que permite o seu isolamento usando técnicas de purificação de proteínas rigorosos complexo. Aqui nós apresentamos uma técnica para as células cultivadas em cultura de reticulação seguido pelo isolamento de complexos de proteínas por imunoprecipitação.
Resumo
A natureza dinâmica de máquinas celular é freqüentemente construída sobre associações de proteína transitória e / ou fraco. Essas interações de baixa afinidade impede métodos rigorosos para o isolamento e identificação de redes de proteínas em torno de uma proteína de interesse. O uso de reticuladores química permite a estabilização seletiva das interações lábil, ignorando assim as limitações bioquímicas para a purificação. Aqui apresentamos um protocolo favorável para células em cultura que usa um reticulador homobifunctional com um braço espaçador de 12 Å, dithiobis (succinimidyl proprionate) (DSP). DSP é clivada pela redução de uma ligação de dissulfeto presentes na molécula. Cross-linking combinada com cromatografia de imunoafinidade de proteínas de interesse com esferas magnéticas permite o isolamento de complexos de proteínas que, do contrário não resistiria a uma purificação. Este protocolo é compatível com técnicas regulares western blot e pode ser ampliada para identificação de proteínas por espectrometria de massa 1.
Stephanie A. Zlatic e Pearl V. Ryder contribuíram igualmente para este trabalho.
Protocolo
1. Preparando-se para Crosslinking
- Você vai precisar de placa de um número suficiente de células para permitir o isolamento de 500 mg de proteína por reação de tubo padrão. Um único tubo pode ser suficiente para a identificação de supostos interatores de uma proteína de interesse por immunoblot. Neste caso, o material ligado talão pode ser eluída com SDS-PAGE tampão de amostra (imunoprecipitação). Para análise por espectrometria de massa, o número de reações padrão deve ser aumentado, pelo menos, dez vezes e complexos de proteína deve ser eluída por a concorrência com um antígeno de peptídeo reconhecido pelo anticorpo utilizado (cromatografia de imunoafinidade). Esta estratégia vai permitir o isolamento de complexos de proteínas livres de imunoglobulina.
- A densidade celular ideal para a reticulação é entre 75% e 90% confluência. Em condições de alta confluência, as células tendem a se acumular uns sobre os outros, o que diminui a acessibilidade ao reticulador celular permeável a todas as células.
- Tipo de célula e condição experimental deve ser colocado na parte inferior da placa celular. Rotineiramente incluir controlos com veículo sozinho.
- Prepare todas as soluções EXCETO a solução DSP antes de reticulação.
- Prepare um estoque de tampão fosfato-salina tamponada com CaCl 2 0,1 mM e CaCl 2 1 mM (PBS / Ca / Mg) antes de iniciar o experimento. A adição de íons de cálcio e magnésio é fundamental para a adesão das células à placa de cultura durante o curso do experimento. Armazenar a 4 ° C.
- 50X Cocktail Inibidor da Protease Completa - 1 tablete dissolvido em 1 ml de água Milli-Q. Armazenar a -20 ° C.
- 20% Triton X-100 Pesar 10g Triton X -100 e diluir em volume total de 50 ml de água Milli-Q. Rocha a 4 ° C durante a noite e armazenar a 4 ° C até o uso. Não armazenar por mais de um mês. Use diluições deste estoque de 20% para preparar o buffers lise e IP descrito abaixo.
- 50X Quenching DSP solução 1M de TRIS pH 7.4. Conservar à temperatura ambiente.
- Preparar um tampão 10x uma solução.
Tampão 10X A:- 50 mL 1 M HEPES
- 150 mL de NaCl 5 M
- 10 mL 0,5 M EGTA
- 250 L 2 M MgCl 2
- Ajustar o pH para 7,4
- Trazer um volume final de 500 mL
1x tampão A também é usado em lisado e-magnético-imuno precipitação buffers.
Um buffer 1X- 10 mM Hepes
- 150 mM NaCl
- 1 mM EGTA
- 0,1 mM MgCl 2
- pH 7,4
- Lise Tampão Tampão 1X A + 0,5% Triton X-100.
- Imuno-precipitação Magnetic buffer (Buffer IP) 1X tampão A + 0,1% Triton X-100.
2. Preparar a Solução Crosslinking
- Prepare a solução DSP imediatamente antes de aplicar para as células. DSP é altamente hidrofóbico e deve ser dissolvido em DMSO antes de se diluir em PBS / Ca / Mg buffer. Dissolver 40 mg de DSP em 1 mL de DMSO. Isso faz com que uma solução de 100 mM de DSP (O peso molecular de DSP é 404,42 g / mol).
- Quente um volume adequado de PBS / Ca / Mg a 37 ° C, a fim de facilitar a diluição do DSP / DMSO em PBS.
Volumes necessários para tamanhos variados placa:
6-bem placa 2 mL por poço
10 centímetros placa 10 mL por placa
15 centímetros placa 20 mL por placa - Adicionar 10μL de DSP / DMSO solução estoque para cada 1 mL de PBS quente / Ca / Mg. Adicionar DSP / DMSO gota a gota, solução estoque com mistura repetido até que todos os DSP se dissolveu. Faça uma solução de controle de 10 DMSO mL adicionados a cada 1 mL de PBS / Ca / Mg.
- Coloque todas as soluções de PBS / Ca / Mg em um banho de água gelada não superior a 10 min.
3. Prepare Células para Crosslinking
- Prepare um banho de água gelada que vai caber todas as placas de reticulação ou incubação controle do veículo.
- Pegue pratos da incubadora de 37 ° C e colocá-los imediatamente para o banho de água gelada.
- Lave as células duas vezes com PBS gelado / Ca / Mg. Use o mesmo volume que você irá usar para a incubação reticulador (ver secção 2.2).
- Remover segunda lavagem e adicionar qualquer controle do veículo ou DSP solução tampão de reticulação.
- Incubar no gelo durante duas horas. Você deve verificar as placas aproximadamente a cada 20 minutos para garantir que todas as células estão cobertas pela solução. Você pode notar uma pequena quantidade de DSP precipitar para fora da solução. Isso é normal.
4. Inativação de Reação DSP
- Prepare uma solução de têmpera 1X DSP de 20 mM Tris pH 7,4 em PBS / Ca / Mg (20 mL de 1 M Tris pH 7,4 para cada 1 mL de PBS / Ca / Mg).
- Remova o controle do veículo e soluções de reticulação.
- Adicionar gelada solução inativação e incubar no gelo por 15 minutos.
5. Lise celular
- Durante a incubação DSP quenching, preparar o tampão de lise celular de 0,5% Triton X-100 em tampão Um coquetel inibidor de protease com Completo. Adicionar 20 mL de solução estoque 50X de completas para cada 1 mL tampão de lise.
- Após a incubação 15 minutos quenching DSP, lave as células duas vezes com PBS / Ca / Mg.
- Adicionar tampão de lise + Completo para células e rock a 4 ° C por 30 minutos. Alguns sugeriram volumes de tampão de lise para tamanhos variados placa:
- 6-bem placa 0,5 mL por poço
- 10 centímetros placa 1 mL por placa
- 15 centímetros placa 1 mL por placa
- Após a lise, use um raspador de celular para coletar as células da placa. Certifique-se de manter lisados no gelo para minimizar a atividade de protease
- Lisados de células giro por 15 minutos a 4 ° C em uma bancada de mini-centrífuga em alta velocidade (15.000 xg).
- Pipetar o sobrenadante para um novo tubo. Descartar o pellet.
- Analisar os níveis de proteína e prosseguir com imunoprecipitação.
6. Preparando Beads Imuno-magnética Precipitação
Nota: Esta etapa é geralmente iniciado diretamente após o início da incubação de reticulação duas horas.
- Combine 30 mL de Dynal esferas imunomagnéticas, 500 mL de tampão de IP (1x tampão A + 0,1% Triton X-100) e a quantidade adequada de antígeno-anticorpo específico para screwtop tubos de microcentrífuga. Prepare-anticorpo livre e tubos de anticorpos não-específicas dos controlos negativos. A quantidade adequada de anticorpos deve ser determinado com base em antígenos individuais durante experimentos separados. Rotular todos os tubos de IP.
- Permitir que os tubos de IP para incubar em um rocker end-over-end em temperatura ambiente por duas horas. Alternativamente, incubar os tubos IP com anticorpo overnight a 4 ° dia anterior ao crosslinking.
- Após a incubação, fazer um rápido 10 segundo mini-centrifugação para coletar as esferas na parte inferior do tubo.
- Deslize os tubos no suporte magnético, que vai puxar a esferas magnéticas longe do fundo do tubo. Com as contas em segurança para fora do caminho, agora você pode facilmente lavar qualquer anticorpo não ligado.
- Use uma ponta do aspirador pequeno furo, como uma ponta de carga gel, ou p200 dica para remover o tampão de incubação e qualquer anticorpo não ligado. Assim como o volume de incubação é removido adicionar 1 mL de tampão de IP.
- Tampe o tubo, delicadamente ressuspender as esferas, e incubar todos os tubos IP em temperatura ambiente por 5 minutos com fim-over-final da rotação.
- Repita o passo de lavagem de 5 minutos (passos 6,3 por 6,6) mais uma vez com um mililitro de tampão fresco IP.
- Os tubos de IP pode permanecer na incubação, lavar durar até o lisado reticulado está pronto para ser adicionado às esferas.
7. Incubar Lysate Crosslinked com Imuno-magnética Beads
- Após a última rodada lavar imuno-magnética contas, para baixo em uma mini-centrífuga por 10 segundos. Em seguida, proceder a deslizar os tubos no suporte magnético.
- Mais uma vez, usando uma ponta de aspiração pequeno furo, retire o volume de incubação do tubo. Imediatamente adicionar 500 mL de lisado celular reticulado (assumindo lisado a 1 mg / mL) para os tubos contendo imuno-magnética contas. Se você estará usando competição peptídeo como controle negativo, uma quantidade adequada de peptídeo deve ser incluída neste momento. Experiências anteriores devem ser realizados para determinar as condições de concorrência adequadas peptídeo. Alternativamente, você pode querer ter lisado livre imuno-magnética contas como controle negativo. Neste caso, adicionar 500 mL de imediato de Lysate Buffer (1x tampão A + 0,5% Triton X-100) + completo para as contas imuno-magnética.
- Delicadamente ressuspender as esferas. Grânulos em suspensão devem ser incubadas a 4 ° em uma rotação fim-over-end por 2 horas.
8. Lavar Lysate Unbound de Contas
- Uma vez lisado teve tempo de incubação suficiente, faça uma rotação rápida 10 segundo de uma mini-centrífuga. Em seguida, deslize os tubos no suporte magnético. O suporte magnético deve ser mantida em banho de gelo para o restante do experimento.
- Usando um pequeno furo ponta do aspirador, remova todos os lisado desacoplado. Imediatamente depois de tudo lisado não ligado é removido adicionar 1 mL de tampão de IP.
- Tampe o tubo e ressuspender delicadamente as contas.
- Uma vez que as contas são ressuspenso repita o passo de revestimento de esferas (8.1).
- Novamente aspirar fora de todos o volume de incubação e imediatamente adicionar 1 mL de tampão de IP, então a tampa do tubo.
- Delicadamente ressuspender as contas em Tampão IP. Incubar grânulos em suspensão por 5 minutos a 4 ° com fim-over-end de balanço.
- Repita os passos talão de lavar roupa (8,4 por 8,6) 4 vezes mais.
9. Desnaturar Amostra e Coleta de Contas
- Depois de todos os tubos de imuno-magnética precipitação foram lavados, re-sedimento as esferas (8.1) e tubos de deslize para osuporte magnético.
- Proteínas vinculados às esferas imuno-magnéticos são removidos em condições de desnaturação. Aspirar fora do tampão de lavagem última IP e remova o tubo de IP do suporte magnético.
- Adicionar 1x tampão de amostra para o tubo de Gel IP logo acima do pellet de contas para as contas piscina na parte inferior do tubo novamente. A quantidade de tampão de amostra depende do tamanho bem do gel a ser utilizado. Você pode precisar bata suavemente o fundo do tubo para obter todas as contas ressuspenso no tampão de amostra Gel.
- Repita o processo de desnaturação (9,2 por 9,3) para cada tubo de IP.
- Imuno-magnética contas ressuspenso em tampão de amostra Gel são, então, aquecido a 75 ° C por 5 minutos para completar o processo de desnaturação.
- Uma vez que a amostra foi desnaturado que pode ser executado em um gel SDS-PAGE para secar ocidental. Esvaziado Imuno-Magnética Beads pode ser re-peletizada por centrifugação e retirado da amostra com o suporte magnético.
10. Eluição dos Complexos Crosslinked com peptídeos antigênicos (cromatografia de imunoafinidade).
- Depois de todos os tubos de imuno-magnética imunoprecipitação foram lavados, re-sedimento as esferas (8.1) e tubos de deslize no suporte magnético. Aspirar o sobrenadante e adicionar 10 ml de tampão A suplementado com o peptídeo antigênico reconhecido pelo anticorpo utilizado para immunoisolation de complexos de proteínas. Você deve testar concentrações que variam de 10-200 M para eluição eficiente.
- Incubar as contas por 2 horas a 4 ° C.
- Coloque contas no suporte magnético e cuidadosamente recuperar os 10 mL do material eluído. Salvar este sobrenadante.
- Lavar rapidamente as contas com tampão A e descartar a lavagem. Salvar as contas.
- Adicionar tampão de amostra Gel para o sobrenadante guardado e contas a uma concentração de 1X. Incubar os tubos a 75 ° C por 5 minutos.
- Analisar contas e eluato peptídeo por SDS-PAGE. O eluído deve ser livre de IgG tanto por proteína mancha de SDS-PAGE ou por Immunoblots (Figura 1B). Este material livre de IgG é adequado para espectrometria de massa.
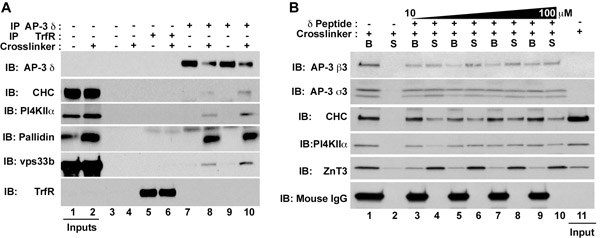
Figura 1. Isolamento de AP-3 complexos de proteínas que interagem e proteínas da membrana. HEK293 células (A) ou células PC12 (B) foram tratados na presença de controle de veículo (DMSO, ímpar pistas Figura 1A) ou DSP (mesmo pistas fig. 1A ou todos os faixas em Fig 1b). Extratos clarificados foram incubadas ou com contas sozinho (Fig. 1A, Lanes 3-4), anticorpos de receptor de transferrina (Fig. 1A, Lanes 5-6), ou AP-3 anticorpos δ (Fig. 1A, Lanes 10/07; Fig. . 1B, faixas 1-10). Imunocomplexos foram eluídos com SDS-PAGE tampão de amostra (Fig. 1A), Buffer A sozinho ou (Fig. 1B, faixas 1-2), ou tampão A suplementado com concentrações crescentes do peptídeo antigênico δ correspondente aos aminoácidos 680 710 dos direitos humanos δ-adaptin (NCBI: AAD03777; gi: 1923266) (Fig. 1B, faixas 3-10). Este peptídeo se liga o anticorpo δ. Após eluição peptídeo, sobrenadantes (S) e esferas (B) foram analisados por immunoblot (Figura 1B). AP-3, que é detectado com anticorpos contra o δ, β3 e σ3 subunidades, coprecipitates com os seguintes fatores solúveis: cadeia pesada clatrina (CHC), o BLOC-1 pallidin subunidade, eo HOPS vps33b subunidade complexo, bem como proteínas da membrana fosfatidilinositol-4-quinase tipo II alfa (PI4KIIα) e que o transportador de zinco 3 (ZnT3). Observe a ausência de cadeias de IgG do mouse pesados no sobrenadante eluído peptídeo na fig. 1B.
Access restricted. Please log in or start a trial to view this content.
Discussão
DSP, uma membrana permeável, reticulador quimicamente redutível com um braço espaçador de 12 Å é usado para estabilizar as interações proteína transitória 1,2,3,4. Aqui nós exemplificou essa estratégia com o complexo adaptador de AP-3 um complexo de proteínas solúveis que reconhece e classifica as proteínas da membrana em vesículas de endossomos 5. AP-3 se liga ao transportador de zinco ZnT3 e os lipídios quinase fosfatidilinositol-4-quinase tipo II alpha, mas não receptor de tran...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Este trabalho foi financiado por subvenções dos Institutos Nacionais de Saúde para VF (NS42599 e GM077569).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline | Invitrogen | P4417 | Dissolve 1 tablet in 200 mL water; add MgCl2 to a final concentration of 1 mM and CaCl2 to a final concentration of 0.1 mM |
| Dithiobis (succinimidyl propionate) (DSP) | Thermo Fisher Scientific, Inc. | 22585 | Moisture sensitive, store in air tight container 4°C |
| Dimethyl sulphoxide (DMSO) Hybri-Max | Sigma-Aldrich | D2650 | |
| Triton X-100, SigmaUltra | Sigma-Aldrich | T9284 | |
| Dynabeads, Sheep anti-Mouse IgG | Invitrogen | 110.31 | Beads are also available as sheep anti-rabbit |
| Dyna-Mag-2 magnet | Invitrogen | 123-21D |
Referências
- Salazar, G. Hermansky-Pudlak syndrome protein complexes associate with phosphatidylinositol 4-kinase type II alpha in neuronal and non-neuronal cells. J Biol Chem. 284, 1790-1802 (2009).
- Lomant, A. J., Fairbanks, G. Chemical probes of extended biological structures: synthesis and properties of the cleavable protein cross-linking reagent [35S]dithiobis(succinimidyl propionate. J Mol Biol. 104, 243-261 (1976).
- Xiang, C. C. Using DSP, a reversible cross-linker, to fix tissue sections for immunostaining, microdissection and expression profiling. Nucleic Acids Res. 32, e185-e185 (2004).
- Craige, B., Salazar, G., Faundez, V. Phosphatidylinositol-4-Kinase Type II Alpha Contains an AP-3 Sorting Motif and a Kinase Domain that are both Required for Endosome Traffic. Mol Biol Cell. 19, 1415-1426 (2008).
- Newell-Litwa, K., Seong, E., Burmeister, M., Faundez, V. Neuronal and non-neuronal functions of the AP-3 sorting machinery. J Cell Sci. 120, 531-541 (2007).
- Salazar, G. The Zinc Transporter ZnT3 interacts with AP-3 and it is Targeted to a Distinct Synaptic Vesicle Subpopulation. Mol Biol Cell. 15, 575-587 (2004).
- Trinkle-Mulcahy, L. Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. J Cell Biol. 183, 223-239 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados