このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
成人海馬ホッキョクジリス神経幹細胞の増殖と分化
要約
神経幹細胞は、成人の非冬眠年子北極ジリス(AGS)の海馬から調製した。これらの神経幹細胞は、グリア培養とほぼ50:50ニューロンとして、数多くの通路を通って拡大して区別し、維持することができます。
要約
北極ジリス(Urocitellus parryii、AGSは、1)凍結近くまたは下の中核体温で冬眠する能力内で一意です。これらの動物はまた、 インビボ 2,3 の脳と生体 4,5 における酸素-グルコース欠乏に虚血性損傷をレジスト。これらのユニークな資質は、傷害や虚血による細胞死と非常に低温を耐えるためにAGSのニューロンの容量を占めることができる固有の神経細胞の特性を調べるためにAGSの神経細胞を分離するために弾みを提供。これらの細胞の特徴的な性質を可能にする特定するタンパク質や遺伝子のターゲットは、虚血性適応症の数のためにと耐寒性の研究のための効果的な治療法の発見に役立つ可能性。大人AGSの海馬は、文化の中でこれらの幹細胞の容易な拡張を可能にする、増殖を続ける神経幹細胞が含まれています。ここでは、研究者が目的の任意の数のためにこれらの幹細胞と分化した神経細胞を利用することができる方法を説明します。分裂細胞の数を最小限に抑えるために有毒な化学薬品を使用せずに密接に次の手順を実行して、AGSの神経幹細胞は、2つの通路以上によって拡張することができますし、TUJ1陽性ニューロン(〜50%)の高い文化に分化した。虚血は神経新生6、MEK / ERKおよびPI3K/AKTの生存シグナル伝達経路生体 7 および in vitro 8(ケレハー-アンダーソン、ドリューら 、準備中) における虚血耐性に寄与するを経由して進行する神経新生を誘導する。これらのユニークな神経細胞のさらなる特徴は、これらのメソッドの一部またはすべてを使用して、多くの面に進めることができます。
プロトコル
1。 AGS神経幹細胞およびメディアの準備
- 以前に9に記載の方法で分離された成体海馬のホッキョクジリス(AGS)神経幹細胞は、現在凍結バイアルとして市販品を入手することができます。細胞は、細胞が凍結状態のままことを確認するためにドライアイスを含む絶縁パッケージで一晩出荷されています。整合性を維持するために、° C、または液体窒素デュワーの気相で-150より低い温度で受領し、保管後直ちに細胞を解凍してください。
- agsNSC基礎培地を準備+ 5%FBSを95mlのagsNSC基礎培地に5 mLのFBSを(LS - 1012)を追加することによって、
- 50 mLのagsNSC基礎培地を500μLB - 27サプリメント(Invitrogen)を添加することによりagsNSC拡張培地を準備。使用するまで1mLのアリコート、-20℃で保存中にB27の残りの部分を分ける。
- agsNSC基礎培地の暖かい25mLの+ 5%FBSおよび37℃の水浴中でagsNSC拡張培地20ml。
- ポリ- L -オルニチンと拡張に使用されるコートフラスコ
- ポリ- L -オルニチン(10μg/ mL)を実用的なソリューションを解凍。 ° C一度融解した一ヶ月、最大2〜8の間でソリューションを保存する。
- one通気T - 75フラスコに8 mLのポリ- L -オルニチンワーキングソリューションを追加し、均等にフラスコの全培養表面上にソリューションを配布する。 (使用することができる他の培養容器のためのワーキング溶液の量を調整する0.5を使用してください- 10 cm 2で培養面当たり1.0 mLのポリ- L -オルニチンワーキングソリューションを)
- 24時間以上、37℃でフラスコをインキュベートする。 (CO 2を追加することなくインキュベーターの使用は、ポリ- L -オルニチン被覆された培養容器のインキュベーションのために推奨されます。)コーティングフラスコをインキュベーターで2週間にするため、最大保存することができます。
- 使用前に、フラスコからポリ- L -オルニチン、ワーキング溶液を吸引除去し、無菌組織培養グレードの水で2回洗浄。フラスコは、使用前にはほぼドライになるまで液体を吸引除去する。
- デュワーからバイアルを取り出し、バイアルのキャップをしっかりとシールされていることを確認してください。バイアルがほぼ完全に解凍されるまで約60〜90秒のためのまたは37℃の水浴でバイアルの底半分を残してバイアルの上部を押しながら、氷の小さな量が依然として表示されるはずです。潜在的な汚染を避けるために、水をバイアルのキャップをしてください。 、雪解けを超えていないかなど、そうすることで細胞を損傷する恐れがあります。
- 70%エタノールまたはイソプロパノールとバイアルの外側をスプレーして、生物学的安全キャビネット内でバイアルを置きます。汚染やスプラッタを避けるために慎重にキャップを外します。
- 優しく滅菌ピペットを用いてagsNSC基礎培地を1mL + 5%FBSを追加することで、バイアル内のセルを再サスペンド。暖かいagsNSC基礎培地25 mLに再懸濁した細胞を移し、+ 5%FBSを50 mL遠心管に。
- 希釈細胞懸濁液で一回クライオバイアルをすすぐ。 6分間、150 xgで細胞を遠心分離します。最良の結果を得るには、個々の遠心タイプの速度を計算する。
- 細胞がスピンダウンしている間、乾燥したポリ- L -オルニチン被覆したT - 75フラスコにagsNSC拡張培地10mlを追加し、RH FGF -ベーシック(40ng/mL)の40μLを加える。遠心分離の後、ペレットを吸引しないように注意しながら上澄み液を吸引除去する。 agsNSC拡張培地10mlに細胞を再懸濁する。 T - 75フラスコ内のメディアにagsNSC増殖培地に再懸濁した細胞を移す。
- ゆっくりと均等に容器内のセルを配布するために培養容器を左右に揺らし。
- 37℃、5%CO 2インキュベーター内で場所シード培養容器。細胞がフラスコに付着し、播種の2時間以内にプロセスを形成するために開始する必要があります。細胞が浮遊を維持し、培地内に設置丸めた場合には、5%FBSで細胞を遠心分離し、新鮮培地とフラスコと手順1.8から1.10までを実行します。
2。 AgsNSCの拡大
- 2日間(〜48時間)細胞を解凍し、播種後、完全培地の交換は20 agsNSC拡張培地1mlを加えたRH FGF -基本の40μLのスパイクを使用して実行する必要があります。
- RHの40μLFGF -基本的な接種翌日にあるスパイクがフラスコ。細胞は、接種後第3または第4日目で75から80パーセントのコンフルエントに達したときにトリプシンできるようになります。培養は、より長いインキュベーションは、細胞が神経細胞や神経細胞に分化し始めることを可能にするので、予防接種が推奨されていない後4日以上のための未分化幹細胞は、手順3でトリプシン処理によりけがをする恐れがあります。 RH FGF - basicが最大1週間までは4℃で保存しても活性を維持することができます。より多くの時間が必要な場合はRH FGF -基本でも-20℃で一つの追加の凍結/融解を通過することができます。
3。細胞のトリプシン処理
- agsNSCは3〜4日間接種した後に継代してください。 agsNSCが再び展開される場合、継代前に24時間と一週間の間にポリ- L -オルニチン被覆したフラスコを準備します。
- 吸引する培養容器から培地。表面積の各75センチメートル2の容器に0.05%Trypsin/0.02%EDTA 2.5 mLの(CM - 0017)を追加します。すべての細胞をトリプシン/ EDTAでコーティングされるように静かに渦巻く。細胞は通常細胞の合流点に応じて、60秒以内に表面からデタッチし始める。トリプシン以上しない、そうすることとしては、細胞を損傷します。静かにいくつかの側面から培養容器をタップすると剥離を奨励する。
- 細胞が切り離されると、agsNSC基礎培地10 mLを加え+ 5%FBSをフラスコに。ゆっくりとトリプシン溶液のすべてを確実にするために渦が中和される。無菌実験室の技術を使用して、agsNSC基礎培地5パーセントFBS 10mLを含有する滅菌遠心チューブに細胞をピペットで。 + agsNSC基礎培地の追加の10mLで再びフラスコを洗浄することにより、5%FBSを繰り返し、最初の洗浄と組み合わせる。
- 前述のように6分間、150 xgで細胞を遠心分離します。遠心後、細胞がきれいに緩いペレットを形成すべきである。穏やかに10 mLのピペットを用いて2Xピペッティングによる遠心管から中和トリプシンと培地を吸引除去し、予め温めておいたagsNSC基礎培地10ml(毎T - 75フラスコ)+ 5%FBSに再度サスペンド細胞ペレット。下記のようにセル数を実行します。
4。セルのめっきのための標準的な計算
- 無菌操作、スワール細胞懸濁液を使用し、マイクロ遠心チューブに細胞懸濁液の15μLを転送する。 0.4%トリパンブルーの15μLを追加。穏やかに混合し、そのような会議を(カタログ#1490:Hausser科学、カウンティングブライトラインとしてクリーンな血球計算盤のチャンバーのそれぞれに細胞懸濁液の10μLをロードhttp://www.hausserscientific.com/hausserbrightlinedirect.htm )。
- 血球計算盤で4象限の最小値をカウントします。トリパンブルー陽性の青色の細胞が死んでいるとカウントされるべきではない。正確な細胞数の場合は、象限当たりのセルの最適な数は25から75セルになります。
- 細胞をカウントした後、4象限の平均を計算する。 mL当たりの細胞数を決定するために10,000および希釈率で(推奨ボリュームを使用する場合は2)で細胞数の平均値を掛けます。合計パーセントの生存率が低く92%以上の場合、原因の数が存在する可能性があることに注意してください。低い可能性の一つの理由は、前のFBSとトリプシン中和に、トリプシン処理を超える可能性があります。もう一つの理由は、トリプシンの血清中濃度(FBS)が低すぎると細胞はトリプシン処理が続行されることがあります。第三に、細胞は幹細胞は、トリプシン処理中に怪我につながる、細胞間接触による差別化を引き起こして、あまりにも合流されている可能性があります。このメソッドは密接に続いている場合に3つ以上の倍加の収率は〜50万の初期数から>400万細胞の集団を与えて、期待されることがあります。
5。別の拡張フラスコの接種
- つの容器に接種するために必要なセルの合計数を決定するために、接種する容器の表面積(cm 2での)で(1cm 2当たり6600細胞またはT - 75フラスコ当たり500,000個の細胞)、目的の播種密度を掛けます。複数の容器を接種する場合は船舶の合計数によって、容器当たりのセル数を掛けます。各容器に接種するために必要な細胞懸濁液の体積(mL)を決定するために、細胞懸濁液中の生細胞/ mLの番号を使用して、1つの容器に接種するために必要なセル数を割ります。複数の容器を接種すると接種する船舶の総数で1容器に必要量を乗じて必要な細胞懸濁液の総体積を計算する場合。
- 緩いペレットを残し、agsNSC基礎培地中の細胞の目的のボリューム+ 5%FBSを遠心分離します。通常、500,000個の細胞は、+5%FBSは前述のようagsNSC基礎培地に25 mLの合計量に取り込まれます。液体を吸引しagsNSC拡張培地10mlに緩いペレットを再サスペンドこの余分な遠心分離工程は、接種前にFBSを除去する必要がある。 T - 75フラスコに予め温めておいたagsNSC拡張培地10mlを追加。 T - 75フラスコに再懸濁した細胞懸濁液10mLを追加する次にRHフラスコにFGF -基本の40μLを加える。一度にで動作するようにフラスコの最大数を決定する際にはトリプシン処理し、接種が1.5時間よりも時間がかかるてはならないことを検討してください。数々のフラスコを使用している場合は一つには、完全なメディアの交換のための十分なメディアを持つ必要があります。
- やさしく均等に細胞を分散し、前述のように37℃、5%CO 2インキュベーター、中に培養容器を配置する左右にフラスコを揺らし。
6。差別化のためのウェルプレートへの接種のための細胞の希釈
- 任意のマルチウェルフォーマットが使用されていますが、BDアンジオジェネシスポリ- L -リジンコートした96ウェルプレートへの接種はdesされる可能性がありますここcribed。 96マルチウェルプレート用ウェル当たり0.2mLので接種するウェルの数を乗じて、実験に必要な細胞懸濁液の量を決定し、接種中にボリューム内の任意の損失をカバーする約10%を追加します。 75000細胞/ mLの細胞密度に希釈を計算する。 2%FBS(表1)の最終濃度を達成するために分化培地に添加するFBSの量を決定します。 FBSと分化培地を混ぜる。慎重にFBSと分化培地の計算量で細胞を混ぜる。 (注:遠心操作中に細胞がagsNSC基礎培地でいる+ 5%FBS FBSは、遠心操作中に細胞を保護し、細胞接着FBSがdifferentionを阻害促進するが、2%FBSを希釈すると、マルチウェル表面への細胞の接着を可能にする。。。 2%FBSは、その後の分化を促進するためにさらに希釈される。インスリン - トランスフェリン - セレン(ITS - E)も分化を促進するために分化培地に含まれています。
- バイオセーフティキャビネットでは、無菌combitipのリザーバーからのマルチチャンネルピペットと大型オリフィスのヒントを使用してポリ- L -リジンコートした96ウェルプレートの各ウェルに希釈した細胞懸濁液の200μlのを分注する。 37℃で1.5〜2時間プレートをインキュベート° C、5%CO 2。細胞が接続した後、120〜約90分後に、慎重に各ウェルを使用して、大きなオリフィスピペットの先端から培地の50%(96ウェルプレートに100μL)を取り外します。慎重に再び大規模なオリフィスのピペットチップを使用して、暖かいagsNSC分化培地で削除ボリュームを交換してください。 (標準オリフィスのヒントを使用すると、細胞を傷つける可能性があります)。
- 二日接種後(〜48時間)、agsNSC分化培地と大きなオリフィスのピペットチップを使用して50%の培地交換を行います。
7。ニューロンのメンテナンス
- 指示通りNeuraLife、グルタミンおよびB27を使用して神経維持培地を準備します。神経細胞維持培地は毎週準備する必要があります。
- 最後agsNSC分化培地の変化、通常は4日目接種後二日後には、神経維持培地を使用して50%の培地交換を行います。
- 2〜3日おき神経維持培地を使用して50%の培地の交換を実行し続けます。神経突起は、ニューロン維持培地に変更し数日以内に表示されます。細胞は、神経維持培地に転送されるの3週間以内にご使用ください。ニューロンは、市販の神経細胞のマーカーの数を用いて同定することができる。アストロサイトはまた、常に観察される。
- 文化集団は、通常、全細胞数に対する神経細胞の40%以上の比率を表す。 NeuraLife以外のニューロンの保守メディアの使用は、形態学的に成熟して見ていないとのような文化の中で長く生存することはできません劣るセルを提供することがあります。
8。代表的な結果:
ホッキョクジリスの成体神経幹細胞は500,000-600,000 cells/75mmフラスコに接種した場合、少なくとも二つの経路の場合は3〜5日間毎に24時間を倍増していきます。これらの細胞は容易にbasicFGFとB27の除去および1-2%のFBSと1%のインスリン/トランスフェリン/セレンの存在と区別されます、とTUJ1(Covance)14-21日以内に陽性ニューロン(図2参照)になります。全細胞に対する神経細胞の比率は、文化の年齢に依存して40から60パーセント、(図3)の間になります。神経細胞は、少なくとも21日後に播種を介して12日後に播種から実験に利用することができる。
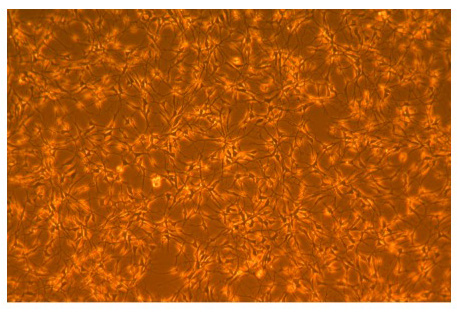
図1。 AGS成体海馬神経幹細胞の顕微鏡写真。
ポリ- L -オルニチン被覆したフラスコにagsNSC基礎培地で成長の3日後のAGSの成体海馬神経幹細胞の位相顕微鏡写真。ダブリングはおよそ24時間に発生します。 100Xの倍率での写真。
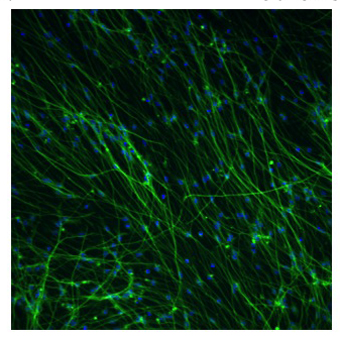
図2。差別化されたAGS成体海馬神経幹細胞の蛍光顕微鏡写真
AGS神経幹細胞は、前の固定から17日間以上Neuralifeに保持されて、4日間分化のメディアを行った。細胞を4%パラホルムアルデヒドとInvitrogenからTUJ1一次抗体(Covance)およびAlexa Fluor 568二次抗体(緑色)を使用して同定された神経細胞で固定した。ヘキスト染料33343は、すべての核(青色)を染色するために追加されました。細胞数、ニューロンの数とニューロンの比率は、神経突起伸長のソフトウェアとセロミクスからArrayscan楽器を用いて測定した。この写真は約57%のニューロンを表しています。 10X倍率
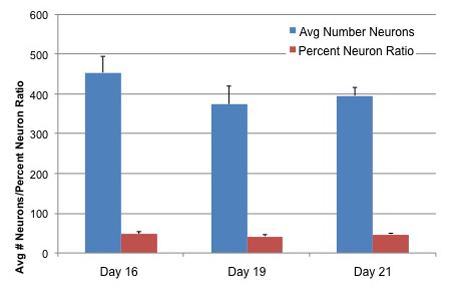
図3。ニューロンの数字と3での差別化AGS神経幹細胞のニューロンの比率文化の年齢
AGS神経幹細胞は、前に固定の12、15および17日間Neuralifeに保持されて、4日間分化のメディアを行った。細胞を固定し、神経細胞はTUJ1一次抗体(Covance)と同定された。 Hoechst色素は、全細胞の識別のためのすべての核を染色するために追加されました。細胞数、ニューロンの数とパーセントのニューロンの比は、神経突起伸長のソフトウェアとセロミクスからArrayscan楽器を用いて測定した。値は、条件ごとに15の井戸+ SDの平均値を表しています。
継代と播種で使用されている表1サンプルの計算
- 70万細胞/ mLの細胞懸濁液を使用する
- 75000細胞/ mLまたは各ウェルに0.2 mLの体積のウェルあたり15,000細胞の細胞密度を使用する。
- よく= 19.2 mLまたは所望の最終容積21 mLの0.2 mLで96ウェルを接種する。
- (最終濃度xの最終容積)÷初期濃度=初期ボリューム
(21 mLのX 75000細胞/ mL)÷ 700,000 = 2.25 mLの - 細胞懸濁液中のFBSのボリューム。 2.25 mLの= 2.25 mLの× 0.05 = 0.1125 mLの
- FBSの容積は21 mLの= 21 mLのX 0.02 = 0.42 mLを必要と
- 分化培地に追加するFBSの体積= 0.42 mLの - 0.1125 mLの= 0.3075 mLの
- 分化培地の量は= 21 mLの - 2.25 mLの細胞懸濁液 - 0.3075 mLの5%FBS = 18.44 mLであった。
- 0.308 mLのFBSを18.44 mLの分化培地を組み合わせて、細胞懸濁液の2.25 mLを加える。
ディスカッション
AGS成体神経幹細胞は強固であり、それらの基本的な神経幹細胞の性質の研究のための神経幹細胞の優秀な源となっ多数の通路を拡張することができます。膨張率は、約1倍ごとに24時間ですが、細胞間の接触は、星状膠細胞への分化を支持するため、これらの細胞は、前に到達合流へ継代する必要があります。接触を介したの分化は、したがって、差別化はトリプシン処理し、通過する前に始...
開示事項
謝辞
この作品は、米陸軍医学研究および資材コマンド助成金#05178001で神経疾患と脳卒中の国立研究所からNS041069 - 06でサポートされていました。我々は、プロトコル上で有益なコメントをジョエルVonnahmeに感謝。
資料
| Name | Company | Catalog Number | Comments |
| agsNSC | Lifeline Cell Technology | FC-0004 | |
| agsNSC Expansion kit | Lifeline Cell Technology | LL-0008 | Alternative source for DMEM/F12, B27 and rhFGFb (www.invitrogen.com) |
| agsNSC differentiation kit | Lifeline Cell Technology | LL-0009 | Alternative source for DMEM/F12 and ITS-x (www.invitrogen.com) |
| NeuraLife maintenance media kit | Lifeline Cell Technology | LL-0012 | Alternative sources are NeuraBasal (LifeLine) or Neurobasal (in vitrogen), glutamine and B27 (www.invitrogen.com)Differentiated cells are maintained for up to 3 weeks in NeuroLife, but no more than 2 weeks in Neurobasal (www.invitrogen.com) |
| Micrometer (such as a Bright Line Counting Chamber) | Hausser Scientific | 1490 | http://www.hausserscientific.com/hausserbrightlinedirect.htm |
| Biocoat Poly-L-Lysine coated 96 well plates | BD Biosciences | 356516 | www.bdbiosciences.com |
| Large orifice pipette tips | Fisher Scientific | 02-707-141 | Avoids neuronal cell damage when pippetting. http://www.fishersci.com |
参考文献
- Barnes, B. M. Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator. Science. 244, 1593-1595 (1989).
- Dave, K. R., Prado, R., Raval, A. P., Drew, K. L., Perez-Pinzon, M. A. The Arctic ground squirrel brain is resistant to injury from cardiac arrest during euthermia. Stroke. 37, 1261-1265 (2006).
- Dave, K. R. Protein kinase C epsilon activation delays neuronal depolarization during cardiac arrest in the euthermic arctic ground squirrel. J Neurochem. 110, 1170-1179 (2009).
- Ross, A. P., Christian, S. L., Zhao, H. W., Drew, K. L. Persistent tolerance to oxygen and nutrient deprivation and N-methyl-D-aspartate in cultured hippocampal slices from hibernating Arctic ground squirrel. J Cereb Blood Flow Metab. 26, 1148-1156 (2006).
- Christian, S. L. Arctic ground squirrel (Spermophilus parryii) hippocampal neurons tolerate prolonged oxygen-glucose deprivation and maintain baseline ERK1/2 and JNK activation despite drastic ATP loss. J Cereb Blood Flow Metab. 28, 1307-1319 (2008).
- Jin, K. Evidence for stroke-induced neurogenesis in the human brain. Proc Natl Acad Sci U S A. 103, 13198-13202 (2006).
- Maysami, S., Lan, J. Q., Minami, M., Simon, R. P. Proliferating progenitor cells: a required cellular element for induction of ischemic tolerance in the brain. J Cereb Blood Flow Metab. 28, 1104-1113 (2008).
- Sung, S. M. Hypoxia/reoxygenation stimulates proliferation through PKC-dependent activation of ERK and Akt in mouse neural progenitor cells. Neurochem Res. 32, 1932-1939 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J Neurosci Methods. 71, 143-155 (1997).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Mol Cell Neurosci. 8, 389-404 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved