JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
성인 Hippocampal 북극 그라운드 다람쥐 신경 줄기 세포의 성장과 분화
요약
신경 줄기 세포는 성인이 아닌 최대 절전 모드 예알링 북극 그라운드 다람쥐 (AGS)의 해마에서 준비되었다. 이러한 신경 줄기 세포는 여러 통로를 통해 확장 차별과 glial 문화에 거의 신경 50:50로 유지하실 수 있습니다.
초록
북극 그라운드 다람쥐 (Urocitellus parryii, AGS)는 냉동 니어 1 또는 아래 핵심 체온과 최대 절전 모드로 자신의 능력 독특합니다. 이 동물은 또한 생체내 2,3와 산소 - 포도당 체외 4,5에서 빈곤의 뇌에 허혈성 손상에 저항. 이러한 독특한 자질 부상 국소 빈혈로 인한 세포 죽음과 아주 차가운 온도에 저항하는 AGS의 뉴런의 용량을 차지 수있는 고유의 연결 특성을 검사 AGS의 뉴런을 분리하는 자극을 제공했습니다. 확인 단백질 또는 이들 세포의 독특한 속성에 대한 허용 유전자 목표는 허혈성 징후의 번호와 추위 관용의 학습을위한 효과적인 치료법의 발견에 도움 수 있습니다. 성인 AGS의 해마 문화에서 이러한 줄기 세포 쉽게 확장 있도록 분아 따위에 의해 번식이 계속 신경 줄기 세포가 포함되어 있습니다. 우리는 여기서 연구자는 목적의 번호에 대한 이러한 줄기 세포와 차별화된 뉴런을 활용할 수있는 방법을 설명합니다. 밀접하게 다음 단계를 수행하여 AGS 신경 줄기 세포는 두 구절 이상을 통해 확장 가능하고 나누어 세포의 수를 최소화하기 위해 독성 화학 물질을 이용하지 않고 TUJ1 - 긍정적인 뉴런 (~ 50 %)의 높은 문화를 차별. 국소 빈혈은 neurogenesis 6 MEK / ERK 및 PI3K/Akt의 생존 신호 전달 경로 생체내 7과 체외 8 (켈러허 - 앤더슨, 드류 외., 준비)에 국소 빈혈 방지에 기여를 통해 수익금 neurogenesis를 유도. 이러한 고유 신경 세포의 자세한 특성은 이러한 방법의 일부 또는 전부를 사용하여 여러 전선에서 사전하실 수 있습니다.
프로토콜
1. AGS 신경의 줄기 세포와 미디어 준비
- 방식으로 분리된 신경 줄기 세포가 이전 9 설명한 성인 hippocampal 북극 그라운드 다람쥐 (AGS)는 지금 cryopreserved 튜브로 상업적으로 구할 수 있습니다. 세포는 세포가 cryopreserved 상태로 유지되도록 드라이 아이스가 들어있는 절연 패키지로 야간 배송됩니다. 무결성을 유지하기 위해 풀어 -150보다 낮은 즉시 수신 및 저장시 세포 ° C, 또는 액체 질소 듀어의 기상 단계 인치
- agsNSC 기초 매체를 준비 + 5% FBS를 95 ML agsNSC 기초 중간 5 ML FBS을 (LS - 1012)을 추가하여
- 500 μL B - 27 보충 (Invitrogen) 50 ML agsNSC 기초 중간에 추가하여 agsNSC 확장 매체를 준비합니다. 사용까지 1mL aliquots 및 -20 ° C에서 저장으로 B27의 나머지 부분을 나눕니다.
- agsNSC 기초 매체의 따뜻한 25 ML + 5% FBS 및 37 ° C 물 목욕에 agsNSC 확장 중 20 ML.
- 폴리 - L - ornithine과 확장에 사용되는 문장의 flasks
- 폴리 - L - ornithine (10 μg / ML) 작업 솔루션을 녹여. ° C 한번 해동 1 개월 최대 2-8 사이의 솔루션을 저장합니다.
- 한 통풍 T - 75 플라스크 8 ML 폴리 - L - Ornithine 작업 솔루션을 추가하고 균일하게 술병의 전체 문화 표면을 통해 솔루션을 배포합니다. (사용 0.5 사용할 수있는 다른 문화 선박에 대한 작업 솔루션의 크기를 조정 -.. 10cm 두 문화의 표면 당 1.0 ML 폴리 - L - Ornithine 작업 솔루션)
- 24 시간 최소 37 ° C에서 flasks을 품어. (추가 CO 2없이 보육의 사용은 폴리 - L - Ornithine 코팅 문화 선박의 보육에 대한 선호합니다.) 코팅 flasks는 인큐베이터 두 주에 저장할 수 있습니다.
- 전에 사용하려면, 술병에서 폴리 - L - Ornithine 작업 솔루션을 기음과 무균 조직 배양 등급 물로 두 번 씻어. 플라스크를 사용하기 전에 거의 건조 때까지 액체를 대기음.
- 듀어에서 병을 제거하고 유리 뚜껑이 안전하게 밀폐되어 있는지 확인합니다. 병에 거의 완전히 해동 때까지 약 60~90초 또는 37 ° C 물 목욕에있는 유리병의 아래쪽 절반을 떠나는 유리병의 위쪽을 잡고, 얼음의 작은 금액이 계속 표시됩니다. 잠재적인 오염을 방지하기 위해, 물의 유리 뚜껑을 유지. , 해동 이상하지 않는 이렇게하면 세포가 손상될 수 있습니다.
- 70 % 에탄올 또는 이소프로판올로 유리병의 외관을 스프레이, 다음 생물 학적 안전 캐비닛에 병을 놓습니다. 오염이나 튀기지 않도록 조심스럽게 뚜껑을 제거합니다.
- 부드럽게 멸균 피펫을 사용하여 agsNSC 기저 미디어 1 ML + 5% FBS을 추가하여 유리병에있는 세포를 다시 일시 중지합니다. 따뜻한 agsNSC 기초 중의 25 ML에 다시 정지 세포를 전송 + 5% FBS를 50 ML의 원심 분리기 튜브 인치
- 희석 세포 현탁액과 함께 한 번 cryo - 병을 린스. 육분 150 XG에서 세포를 원심 분리기. 최상의 결과를 얻으려면 각각의 원심 분리기 유형에 대한 속도를 계산합니다.
- 세포가 다운 스피닝 있지만, 건조 폴리 - L - ornithine 코팅 T - 75 플라스크에 agsNSC 확장 중 10 ML를 추가하고 RH FGF - 기본 (40ng/mL) 40 μL를 추가합니다. 원심 분리 후, 펠렛을 대기음하지 않도록 돌봐 뜨는 액체를 대기음. agsNSC 확장 중 10 ML에있는 세포를 다시 일시 중지합니다. T - 75 플라스크에있는 미디어로 agsNSC 확장 중간에 다시 정지 세포를 전송합니다.
- 부드럽게 골고루 용기 내에 세포를 배포하는 문화 선박 사이드 - 투 - 쪽 바위.
- 37 ° C 5 % CO 2 배양기에 넣어 씨앗 문화 들어왔습니다. 세포는 술병에 부착하고 시딩 두 시간 프로세스를 형성하기 시작한다. 세포 부유 남아 매체 내의 최대 고사리면 5% FBS에서 세포를 원심 분리기 신선한 매체와 플라스크와 같이 1.8-1.10을 실행합니다.
2. AgsNSC 확대
- 이틀 (~ 48 시간) 세포를 해동 및 시딩 후, 전체 매체 교체는 20 agsNSC 확장 매체의 ML 플러스 RH FGF - 기본의 40 μL의 스파이크를 사용하여 수행되어야합니다.
- RH 하루를 다음의 접종에서 FGF - 기본 40 μL와 스파이크 flasks. 세포들은 접종 후 3,4 일로 75-80%의 합류에 도달하면 trypsinize 준비가되어있을 것입니다. 더 이상 배양은 세포가 3 단계 중 trypsinization에 의해 부상을 수 뉴런과 뉴런으로 차별화 시작할 수 있기 때문에 접종 후 사일 이상에 대한 Culturing가 undifferentiated 줄기 세포는하지 않는 것이 좋습니다. RH FGF - 기본은 최대 일주일 4 ° C에서 저장하고 계속 활동을 유지할 수 있습니다. 더 많은 시간이 필요한지 RH FGF - 기본은 또한 -20 ° C에 하나의 추가적인 동결 / 해동을 통해 이동할 수 있습니다.
3. 셀 Trypsinization
- agsNSC는 3~4일 접종 후 passaged해야합니다. agsNSC 다시 확장 될 수 passaging 전에 24 시간 그리고 1 주일 사이에 폴리 - L - ornithine 코팅 플라스크를 준비합니다.
- 를 기음문화 선박의 매체입니다. 0.05 % 2.5 ML 추가 Trypsin/0.02 % 면적의 각 75cm 2 혈관에 EDTA (에틸렌 다이아 민 테트라 초산) (CM - 0017). 모든 세포를 보장하기 위해 부드럽게 소용돌이는 트립신 / EDTA (에틸렌 다이아 민 테트라 초산)로 코팅하고 있습니다. 세포는 일반적으로 세포의 합류에 따라, 60 초 내에 표면에서 이탈을 시작합니다. trypsinize 이상하지 마, 이렇게 같이하면 세포를 손상됩니다. 부드럽게 여러 방면에서 문화의 혈관을 감청하는 것은 부대를 권장합니다.
- 세포 분리가되면 agsNSC 기초 중간 10 ML을 추가 + 5% FBS를 술병 수 있습니다. 부드럽게 트립신 솔루션을 모두 보장하기 위해 소용돌이가 무력화됩니다. 무균 실험실 기법을 사용 agsNSC 기초 중간 5% FBS 10 ML를 포함하는 멸균 원심 튜브에 세포를 피펫. + agsNSC 기초 중간의 추가 10 ML로 다시 술병을 씻는 5 % FBS를 반복하고 처음으로 세척과 결합.
- 육분 150 XG에 원심 분리기 세포는 위에서 설명한. 원심 분리 후, 세포가 깨끗한 느슨한 펠렛을 형성한다. 부드럽게 최대 pipetting과 10 ML의 피펫과 아래 배하여 원심 튜브에서 무력화 트립신과 매체를 기음과 미리 예열 agsNSC 기초 매체의 10 ML에 다시 중지 세포 펠릿 (당 T - 75 플라스크) + 5% FBS. 아래 설명된 셀 개수를 수행합니다.
4. 전지 도금 표준 계산
- 무균 기술을 사용하여, 소용돌이 세포 현탁액과 microcentrifuge 관에 전송 세포 현탁액 15 μL. 0.4 % Trypan 블루 15 μL를 추가합니다. 부드럽게 믹스와 같은 챔버 (카탈로그 # 1490 : Hausser 과학, 계산 밝은 라인으로 깨끗한 hemacytometer의 방으로 각 세포 현탁액 10 μL를 로드할 수 http://www.hausserscientific.com/hausserbrightlinedirect.htm ).
- hemacytometer 4 quadrants의 최소 개수. Trypan 블루 양성하는 푸른 세포가 죽은 계산되지 않습니다. 정확한 셀 카운트 들어, 사분면마다 세포의 최적의 숫자는 25-75 전지해야합니다.
- 세포를 계산 후, 4 quadrants의 평균을 계산합니다. 10000에 의해 및 희석 요인에 의해 세포 카운트 평균을 곱하고 (2면 추천 볼륨을 사용) ML 당 세포의 수를 결정합니다. 총 비율 생존 미만 92% 경우 원인이 다수있을 수 있습니다. 낮은 생존을위한 하나의 이유는 FBS와 중화를 트립신하기 전에, trypsinization 이상있을 수 있습니다. 또 다른 이유는 트립신에 혈청의 농도 (FBS)이 너무 낮은이고 세포 trypsinized로 계속있을 수 있습니다. 셋째, 세포가 줄기 세포가 trypsinization 동안 부상에 이르는, 세포 - 세포 접촉에 의한 차별화하는 원인도 합류되었을 수도 있습니다. 이 방법은 밀접하게 이어지는 경우 3 명 이상 doublings의 수율은 ~ 500,000의 초기 숫자에서> 4,000,000 세포의 인구를 제공 기대 수 있습니다.
5. 다른 확장 플라스크에 접종
- 한 그릇을 예방하는 데 필요한 세포의 총 수를 확인하려면 주사하는 선박의 면적 (cm 2)에 의해 (cm 2 당 6,600 세포 또는 T - 75 플라스크 당 500,000 세포) 원하는 시딩 밀도를 곱하면됩니다. 하나 이상의 혈관을 inoculating 것은 선박의 총 숫자로 선박 당 세포의 숫자를 곱하면. 각 함선을 예방하는 데 필요한 세포 현탁액의 볼륨을 (ML)를 확인하려면, 실행 가능한 세포 / 세포 현탁액의 ML의 수를 한 그릇을 예방하는 데 필요한 세포의 수를 나눕니다. 하나 이상의 혈관을 inoculating 것은 주사하는 선박의 총 수를 한 선박에 필요한 볼륨을 곱하여 필요한 세포 현탁액의 전체 볼륨을 계산하는 경우.
- 느슨한 펠렛을 떠나, agsNSC 기초 매체 세포의 원하는 볼륨 + 5% FBS를 원심 분리기. 일반적으로 500000 전지는 5% FBS과 같이 이전에 설명한 agsNSC 기초 중간에 25 ML 총 부피로 이동됩니다. 액체를 대기음하고이 추가 원심 분리 단계는 접종 전에 FBS를 제거하는 데 필요한 agsNSC 확장 중 10 ML에 느슨한 펠렛을 다시 일시 중지합니다. T - 75 플라스크에 미리 예열 agsNSC 확장 중 10 ML을 추가합니다. T - 75 플라스크에 resuspended 세포 현탁액의 10 ML을 추가하면 다음 RH 술병에 FGF - 기본 40 μL를 추가합니다. 한 번에 작업할 flasks의 최대 개수를 결정할 때 trypsinization 및 접종은 1.5 시간보다 더 오래 걸릴없는 것을 고려하십시오. 수많은 flasks를 사용하는 경우 하나는 전체 미디어의 변화에 대한 충분한 미디어가 있어야합니다.
- 부드럽게 골고루 세포를 배포 좌우로 술병을 바위와 같은 이전에 설명한 37 ° C 5 % CO 2 배양기로 배양 혈관을 넣으십시오.
6. 차별 화를위한 웰 플레이트에 접종에 대한 세포의 희석
- 모든 멀티 - 음 형식으로 사용하지만, BD Biocoat 폴리 - L - 라이신 코팅 96 잘 접시에 접종이 데스는 수도여기 cribed. 96 멀티 잘 접시 잘 당 0.2 ML로 주사하는 우물의 수를 곱하여 실험에 필요한 세포 현탁액의 볼륨을 확인하고 접종하는 동안 볼륨의 손실을 충당하기 위해 약 10 %를 추가합니다. 75,000 세포 / ML의 세포 밀도로 희석을 계산합니다. 2퍼센트 FBS의 최종 농도 (표 1)을 달성하기 위해 차별화 매체에 추가로 FBS의 양을 결정합니다. FBS와 차별화 매체를 섞는다. 조심스럽게 FBS와 차별화 매체의 계산 볼륨있는 세포를 섞는다. (참고 : 원심 분리하는 동안 세포가 agsNSC 기초 중간에 + 5% FBS FBS는 원심 분리하는 동안 세포를 보호하고 세포 접착력 FBS가 differention을 억제 용이 동안 2 % FBS를 Diluting하면 다중 잘 표면에 세포의 접착력을 수 있습니다... 2% FBS는 다음 분화를 촉진하기 위해 추가로 희석합니다. 인슐린 트랜스페린 - 셀레늄은 (ITS - E)도 차별을 홍보하기 위해 차별화 매체에 포함되어 있습니다.
- biosafety 캐비닛에서 멀티 채널 피펫 및 대형 구멍 도움말을 사용하여 폴리 - L - 라이신 코팅 96 - 웰 플레이트의 각 잘하는 살균 combitip 저수지에서 희석 세포 현탁액 200 UL 하는걸. 37 1.5-2 시간 동안 접시를 품어 ° C 5 % CO 2. 세포는 첨부에 대한 90-120분 후 신중하게 각 잘 사용하는 대형 오리피스 피펫 팁의 매체 (96 - 웰 플레이트 100 μL)를 50 %를 제거한 후. 조심스럽게 다시 큰 오리피스 피펫 팁을 사용하여 따뜻한 agsNSC 차별화 매체로 제거 볼륨을 교체하십시오. (표준 오리피스 팁 사용은 세포를 다치게 수 있습니다.)
- 이틀 접종 후 (~ 48 시간), agsNSC 차별 매체 및 대형 오리피스 피펫 팁을 사용하여 50 % 중간 변경을 수행합니다.
7. 뉴런의 유지 보수
- 지침에 따라 NeuraLife, 글루타민과 B27를 사용하여 유지 보수의 연결 매체를 준비합니다. 의 연결을 유지 매체는 매주 준비되어야합니다.
- 마지막 agsNSC 차별화 매체 변경, 일반적으로 주 4 게시물 접종 후 이틀의 연결을 유지 매체를 사용하여 50 % 중간 대체를 수행합니다.
- 모든 2~3일의 연결을 유지 매체를 사용하여 50 %의 중간 교체를 수행하는 계속합니다. 의 연결 프로세스의 연결을 유지 매체로 변화 몇 일 이내에 나타납니다. 세포의 연결을 유지 매체로 전송되는 3 주 이내에 사용해야합니다. 뉴런은 상용의 연결 마커 번호를 사용하여 확인할 수 있습니다. Astrocytes도 항상 관찰됩니다.
- 문화 집단은 일반적으로 전체 휴대폰 번호로 뉴런의 이상 40 % 비율을 표현한다. NeuraLife 이외의 다른 신경 세포 유지 보수 미디어의 사용은 morphologically 성숙 보이지 않으며 한 문화에서 생존하지 않을 수 있습니다 하부 세포를 제공할 수 있습니다.
8. 대표 결과 :
북극 그라운드 다람쥐 성인 신경 줄기 세포가 500,000-600,000 cells/75mm 플라스크에 씨앗을 때 적어도 두 구절에 대한 3-5일의 모든 24 시간을 두 번 나갈 것입니다. 이러한 세포는 쉽게 basicFGF와 B27의 제거 및 1-2% FBS의 존재와 1 %의 인슐린 / 트랜스페린 / 셀레늄과 구분되며, 14-21일 이내 TUJ1 (Covance) 긍정적인 뉴런 (그림 2 참조)가 될 것입니다. 총 세포 뉴런의 비율은 문화의 연령에 따라 40~60%, (그림 3) 사이의 범위를합니다. 뉴런은 최소한 21일 포스트 시딩 통해 12일 포스트 시딩에서 실험을 위해 활용 수 있습니다.
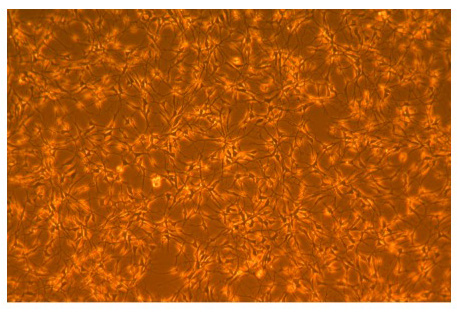
그림 1. AGS 성인 hippocampal 신경 줄기 세포의 현미경 사진.
폴리 - L - Ornithine 코팅 flasks에 agsNSC 기저 미디어 성장의 3 일 다음 AGS 성인 hippocampal 신경 줄기 세포의 위상 현미경 사진. 배로 약 24 시간마다 발생합니다. 100X 확대 사진.
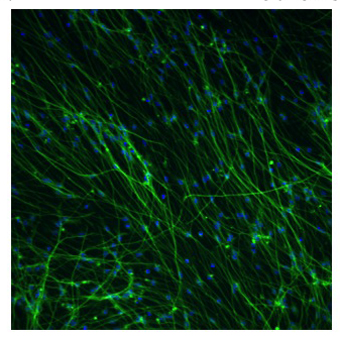
그림 2. 차별 AGS 성인 hippocampal 신경 줄기 세포의 형광 현미경
AGS 신경의 줄기 세포는 그 전에 해결 17 일간 Neuralife 유지 사일에 대한 차별화 미디어를 받게되었습니다. 전지는 4 % paraformaldehyde와 Invitrogen에서 TUJ1 기본 항체 (Covance)와 알렉사 플루어 568 차 항체 (녹색)를 사용하여 식별 뉴런과 해결되었습니다. Hoechst 염색 33,343은 모든 핵 (파란색)를 얼룩이 추가되었습니다. 휴대폰 번호, 뉴런 번호 및 신경 세포 비율은 neurite 가지 소프트웨어 및 Cellomics에서 Arrayscan 악기를 사용하여 결정됩니다. 이 사진은 약 57%의 뉴런을 나타냅니다. 10X 확대
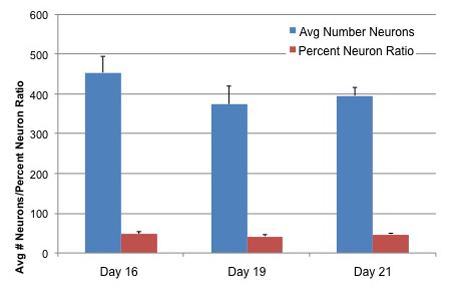
그림 3. 신경 세포의 숫자 세에서 차별 AGS 신경 줄기 세포의 신경 세포 비율문화 시대
AGS 신경의 줄기 세포 전에 해결 12, 15 및 17 일간 Neuralife 유지 후, 4 일간 차별화 미디어를 받게되었습니다. 세포 고정과 뉴런은 TUJ1 기본 항체 (Covance)로 식별되었습니다. Hoechst 염색은 총 세포 식별에 대한 모든 핵을 얼룩에 추가되었습니다. 휴대폰 번호, 신경 세포의 숫자와 %의 신경 세포 비율은 neurite 가지 소프트웨어 및 Cellomics에서 Arrayscan 악기를 사용하여 결정됩니다. 값 조건 당 15 웰스 + SD의 의미를 나타냅니다.
passaging 및 시딩에서 사용되는 표 1. 샘플 계산
- 700000 셀 / ML 세포 현탁액을 사용하여
- 75,000 셀 / ML 또는 15000 세포의 세포 밀도마다 잘 각 잘 0.2 ML 볼륨을 사용합니다.
- 잘 = 19.2 ML 또는 원하는 최종 볼륨을 21 ML 당 0.2 ML에서 96 우물을 Inoculating.
- (최종 농도 X 최종 볼륨) ÷ 초기 농도 = 초기 볼륨
(21 ML X 75,000 전지 / ML) ÷ 70 = 2.25 ML - 세포 현탁액의 FBS의 볼륨. 2.25 ML = 2.25 ML X 0.05 = 0.1125 ML
- FBS의 볼륨은 21 ML = 21 ML X 0.02 = 0.42 ML이 필요
- 차별화 매체에 추가할 FBS의 볼륨 = 0.42 ML - 0.1125 = 0.3075 ML ML
- 2.25 ML 세포 현탁액 - - 0.3075 ML 5% FBS가 = 18.44 ML 차별화 매체 = 21 ML의 볼륨.
- 0.308 ML FBS와 18.44 ML 차별 매체를 결합하고 세포 현탁액의 2.25 ML를 추가합니다.
토론
AGS 성인 신경 줄기 세포가 견고하고 그 기본적인 신경 줄기 세포 특성의 연구에 대한 신경 줄기 세포의 훌륭한 소스가 만드는 수많은 구절에 대한 확장하실 수 있습니다. 확장 속도가 약 두 배로 모든 이십사시간이지만, 세포 사이의 접촉 astrocytes에 차별을 선호하기 때문에 이러한 세포는 사전에 도달 합류하는 passaged해야합니다. 연락처 - 중재 차별 따라서 차별이 trypsinization하고 통과하기 전에 ?...
공개
감사의 말
이 작품은 미국 육군 의료 연구 및 Materiel 명령 부여 # 05178001로하고 신경 장애 및 뇌졸중의 국립 연구소에서 NS041069 - 06에 의해 지원되었다. 우리는 프로토콜에 도움이 덧글에 대한 조엘 Vonnahme 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| agsNSC | Lifeline Cell Technology | FC-0004 | |
| agsNSC Expansion kit | Lifeline Cell Technology | LL-0008 | Alternative source for DMEM/F12, B27 and rhFGFb (www.invitrogen.com) |
| agsNSC differentiation kit | Lifeline Cell Technology | LL-0009 | Alternative source for DMEM/F12 and ITS-x (www.invitrogen.com) |
| NeuraLife maintenance media kit | Lifeline Cell Technology | LL-0012 | Alternative sources are NeuraBasal (LifeLine) or Neurobasal (in vitrogen), glutamine and B27 (www.invitrogen.com)Differentiated cells are maintained for up to 3 weeks in NeuroLife, but no more than 2 weeks in Neurobasal (www.invitrogen.com) |
| Micrometer (such as a Bright Line Counting Chamber) | Hausser Scientific | 1490 | http://www.hausserscientific.com/hausserbrightlinedirect.htm |
| Biocoat Poly-L-Lysine coated 96 well plates | BD Biosciences | 356516 | www.bdbiosciences.com |
| Large orifice pipette tips | Fisher Scientific | 02-707-141 | Avoids neuronal cell damage when pippetting. http://www.fishersci.com |
참고문헌
- Barnes, B. M. Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator. Science. 244, 1593-1595 (1989).
- Dave, K. R., Prado, R., Raval, A. P., Drew, K. L., Perez-Pinzon, M. A. The Arctic ground squirrel brain is resistant to injury from cardiac arrest during euthermia. Stroke. 37, 1261-1265 (2006).
- Dave, K. R. Protein kinase C epsilon activation delays neuronal depolarization during cardiac arrest in the euthermic arctic ground squirrel. J Neurochem. 110, 1170-1179 (2009).
- Ross, A. P., Christian, S. L., Zhao, H. W., Drew, K. L. Persistent tolerance to oxygen and nutrient deprivation and N-methyl-D-aspartate in cultured hippocampal slices from hibernating Arctic ground squirrel. J Cereb Blood Flow Metab. 26, 1148-1156 (2006).
- Christian, S. L. Arctic ground squirrel (Spermophilus parryii) hippocampal neurons tolerate prolonged oxygen-glucose deprivation and maintain baseline ERK1/2 and JNK activation despite drastic ATP loss. J Cereb Blood Flow Metab. 28, 1307-1319 (2008).
- Jin, K. Evidence for stroke-induced neurogenesis in the human brain. Proc Natl Acad Sci U S A. 103, 13198-13202 (2006).
- Maysami, S., Lan, J. Q., Minami, M., Simon, R. P. Proliferating progenitor cells: a required cellular element for induction of ischemic tolerance in the brain. J Cereb Blood Flow Metab. 28, 1104-1113 (2008).
- Sung, S. M. Hypoxia/reoxygenation stimulates proliferation through PKC-dependent activation of ERK and Akt in mouse neural progenitor cells. Neurochem Res. 32, 1932-1939 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J Neurosci Methods. 71, 143-155 (1997).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Mol Cell Neurosci. 8, 389-404 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유