É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Crescimento e Diferenciação de Adultos Hippocampal terra ártico Squirrel células-tronco neurais
Neste Artigo
Resumo
Células-tronco neurais foram preparadas a partir do hipocampo de adultos não-hibernando yearling esquilos do Ártico (AGS). Essas células-tronco neurais pode ser expandida através de numerosas passagens, diferenciados e mantidos como um neurônio quase 50:50 para a cultura da glia.
Resumo
Esquilos do Ártico (Urocitellus parryii, AGS) são únicos em sua capacidade de hibernação com uma temperatura corporal central perto ou abaixo de zero 1. Estes animais também resistem lesão isquêmica no cérebro in vivo 2,3 e oxigênio privação glucose-in vitro 4,5. Estas qualidades únicas forneceu o ímpeto para isolar neurônios AGS para analisar características inerentes neuronal que poderia explicar a capacidade dos neurônios AGS para resistir a ferimentos e morte celular causada por isquemia e temperaturas extremamente frias. Identificar proteínas ou genes alvos que permitem as propriedades distintivas dessas células poderia auxiliar na descoberta de terapias eficazes para um número de indicações isquêmica e para o estudo da tolerância ao frio. Hipocampo adulto AGS contém células-tronco neurais que continuam a proliferar, permitindo a fácil expansão dessas células-tronco em cultura. Descrevemos aqui métodos pelos quais os pesquisadores podem utilizar estas células-tronco e neurônios diferenciados para qualquer número de finalidades. Ao acompanhar de perto estes passos a AGS células-tronco neurais pode ser expandida através de duas passagens ou mais e depois diferenciada para uma cultura rica em TUJ1 positivo neurônios (~ 50%) sem a utilização de produtos químicos tóxicos para minimizar o número de células em divisão. Isquemia induz a neurogênese 6 e neurogênese que procede via MEK / ERK e caminhos de sobrevivência PI3K/AKT contribui para a resistência a isquemia in vivo e in vitro 7 8 (Kelleher-Anderson, Drew et al., Em preparação). Caracterização adicional dessas células neurais única pode avançar em várias frentes, usando alguns ou todos esses métodos.
Protocolo
1. AGS Neural Stem Cell e Mídia Preparação
- Esquilo à terra ártico do hipocampo adulto (AGS) células-tronco neurais de forma isolada descrito anteriormente 9 pode agora ser obtido comercialmente como frascos criopreservados. Células são enviados durante a noite em pacotes isolados contendo gelo seco para assegurar que as células permanecem em estado criopreservados. Para manter a integridade, descompacte as células imediatamente após o recebimento e armazenar a menor do que -150 ° C, ou em fase de vapor de um líquido de nitrogênio Dewar.
- Prepare Médio Basal agsNSC + 5% de SFB, adicionando 5 mL FBS (LS-1012) a 95 mL Basal Medium agsNSC
- Prepare Médio Expansão agsNSC adicionando 500 B-27 mL Suplemento (Invitrogen) para 50 mL Basal Medium agsNSC. Divida o restante do B27 em 1mL alíquotas e armazenar a -20 ° C até o uso.
- De 25 mL quentes do Médio Basal agsNSC + 5% de SFB e 20 ml de meio de expansão agsNSC em um banho de água 37 ° C.
- Frascos de revestimento usados para a expansão com poli-L-ornitina
- Descongele a solução de poli-L-ornitina (10 mcg / mL) de trabalho. Armazenar a solução entre 2-8 ° C por até um mês depois de descongelado.
- Adicionar 8 mL de solução Poly-L-Ornitina trabalhando para um frasco de T-75 ventilados e distribuir uniformemente a solução sobre a superfície toda a cultura do balão. (Ajuste quantidade de solução de trabalho para os navios outra cultura que pode ser utilizado Use 0.5 -.. 1,0 mL de solução Poly-L-Ornitina de trabalho por 10 Superfície cultura cm 2)
- Incubar frascos a 37 ° C por um mínimo de 24 horas. (O uso de uma incubadora sem CO adicionou 2 é o preferido para a incubação de Poly-L-Ornitina vasos cultura revestido.) Frascos revestidos pode ser armazenado por até duas semanas na incubadora.
- Antes do uso, aspirado Poly-L-Ornitina solução de trabalho do frasco e lavar duas vezes com água estéril de cultura de tecidos grau. Aspirar líquido até que o frasco está quase seco antes de usar.
- Remover um frasco do Dewar e verifique se a tampa do frasco está bem vedado. Segure a parte superior do frasco deixando a metade inferior do frasco em banho-maria a 37 ° C por cerca de 60-90 segundos ou até que frasco é quase completamente descongelado, uma pequena quantidade de gelo ainda deve ser visível. Para evitar a contaminação potencial, manter a tampa do frasco para fora da água. Não mais de degelo, pois isso pode danificar as células.
- Pulverizar o exterior do frasco com etanol 70% ou isopropanol, em seguida, coloque o frasco dentro de um armário de segurança biológica. Remova a tampa com cuidado para evitar contaminação ou splatter.
- Suavemente re-suspender as células dentro do frasco, adicionando 1 mL de agsNSC media Basal + 5% de SFB, utilizando uma pipeta estéril. Transferência das células re-suspensão de 25 ml de meio agsNSC quente Basal + 5% de SFB em um tubo de centrífuga de 50 mL.
- Lavar o frasco crio uma vez com suspensão diluída de células. Centrifugar as células a 150 xg por 6 minutos. Para melhores resultados, calcular a velocidade para cada tipo de centrifugação individual.
- Enquanto as células estão girando para baixo, adicione 10 ml de meio de expansão agsNSC para o T-75 poli-L-ornitina seca revestida frasco e adicionar 40 mL de rh FGF-básico (40ng/mL). Após centrifugação, aspirar o sobrenadante com cuidado para não aspirar o sedimento. Re-suspender as células em 10 mL de agsNSC Médio Expansão. Transferência das células ressuspensas em Medium Expansão agsNSC na mídia no frasco T-75.
- Agite levemente o navio cultura lado a lado para distribuir uniformemente as células dentro do vaso.
- Lugar navio cultura semeada em 37 ° C, 5% CO 2 incubadora. Células deve anexar ao balão e começam a se formar os processos dentro de duas horas de semeadura. Se as células permanecem flutuantes e enrolado dentro do meio, em seguida, centrifugar células em 5% FBS e executar passos 1,8-1,10 com meio fresco e frasco.
2. Expansão da AgsNSC
- Dois dias (~ 48 horas) após o descongelamento e semeando as células, uma substituição médio completo deve ser realizado utilizando 20 ml de meio de expansão agsNSC além de um aumento de 40 mL rh FGF-básico.
- Frascos de pico com 40 mL de rh FGF-básicos sobre a inoculação no dia seguinte. As células estarão prontos para trypsinize quando eles chegaram a confluência de 75-80% pelo terceiro ou quarto dia após a inoculação. Cultivo das células-tronco indiferenciadas por mais de 4 dias após a inoculação não é recomendado porque de incubação mais longo irá permitir que as células começam a se diferenciar para neurônios e os neurônios podem ser feridos por tripsinização durante a etapa 3. O rh FGF-básico pode ser armazenado a 4 ° C por até uma semana e ainda manter a atividade. O rh FGF-básico também pode ir através de um congelamento adicionais / descongelar a -20 ° C, se é necessário mais tempo.
3. Tripsinização de Células
- agsNSC várias passagens deve ser 3 a 4 dias após a inoculação. Prepare num balão de poli-L-ornitina revestido entre 24 horas e uma semana antes passaging se o agsNSC será ampliado novamente.
- Aspirar omédio do navio cultura. Adicionar 2,5 mL de 0,05% Trypsin/0.02% EDTA (CM-0017) para o vaso para cada 75 cm 2 de superfície. Agite cuidadosamente para garantir que todas as células são revestidas com o Tripsina / EDTA. Células normalmente começam a se destacar a partir da superfície em 60 segundos, dependendo da confluência das células. Não mais de trypsinize, pois isso irá danificar as células. Batendo o navio cultura de vários lados incentivará desapego.
- Quando as células se destaquem, adicionar 10 mL de meio basal agsNSC + 5% de SFB ao balão. Agite suavemente para garantir toda a solução de tripsina é neutralizado. Usando técnicas de laboratório asséptico, pipeta as células em um tubo de centrifugação estéril, contendo 10 mL de agsNSC Basal média 5% de SFB. Repita por lavagem do frasco novamente com um adicional de 10 mL de meio basal agsNSC + 5% FBS e combinar com a primeira lavagem.
- Células Centrifugar a 150 xg por 6 minutos, como descrito acima. Após a centrifugação, as células devem formar um pellet limpa solta. Aspirar tripsina neutralizado e médio a partir do tubo de centrifugação e volte a suspender o pellet celular em 10 mL (por frasco de T-75) da pré-aquecido Médio Basal agsNSC + 5% FBS cuidado pipetando para cima e para baixo 2X com uma pipeta de 10 mL. Realizar uma contagem de células, como descrito abaixo.
4. Cálculo padrão para Galvanização de Células
- Utilizando uma técnica asséptica, redemoinho de suspensão da célula e transferir 15 mL da suspensão de células em um tubo de microcentrífuga. Adicionar 15 mL de 0,4% Trypan Blue. Misture delicadamente e coloque 10 mL de suspensão celular para cada uma das câmaras de um hemocitômetro limpas, como a Linha Brilhante Contando Câmara (catalogo 1490: Hausser Científico, http://www.hausserscientific.com/hausserbrightlinedirect.htm ).
- Contagem de um mínimo de 4 quadrantes no hemocitômetro. As células azuis que são positivos para Trypan Blue estão mortos e não devem ser contados. Para contagem de células precisos, o número ideal de células por quadrante deve ser 25-75 células.
- Após a contagem das células, calcular a média dos quatro quadrantes. Multiplique a média da contagem de células por 10.000 e pelo fator de diluição (2 se estiver usando os volumes recomendado) para determinar o número de células por mL. Note que se a viabilidade percentual total é inferior a 92% pode haver um número de causas. Uma das razões para a viabilidade baixo pode ser mais tripsinização, antes de tripsina neutralização com FBS. Outra razão pode ser que a concentração de soro (FBS) para tripsina é muito baixa e as células continuam a ser tripsinizados. Em terceiro lugar, as células podem ter sido muito confluentes, fazendo com que as células-tronco se diferenciar devido ao contato célula-célula, levando a lesão durante tripsinização. Se este método é seguido de perto um rendimento de 3 ou mais duplicações podem ser esperados, dando uma população de> 4.000.000 células de um número inicial de ~ 500 mil.
5. Inoculação de um outro frasco de expansão
- Para determinar o número total de células necessárias para inocular um navio, multiplique a densidade de semeadura desejada (6.600 células por cm 2 ou 500.000 células por T-75 frasco) pela área da superfície (em cm 2) do navio a ser inoculado. Se inoculando mais de um navio multiplicar o número de células por navio pelo número total de navios. Para determinar o volume (mL) de suspensão de células necessárias para inocular cada navio, divide o número de células necessárias para inocular um navio pelo número de células viáveis / mL em suspensão de células. Se inoculando mais de um navio calcular o volume total da suspensão de células necessárias multiplicando o volume necessário para um navio pelo número total de navios a serem inoculados.
- Centrifugar o volume desejado de células em meio basal agsNSC + 5% de SFB, deixando um pellet solta. 500.000 células normalmente são levados a um volume total de 25 mL em meio basal agsNSC 5% FBS como descrito anteriormente. Aspirar líquidos e re-suspensão do sedimento solto em 10 ml de meio de expansão agsNSC Esta etapa de centrifugação adicional é necessário para remover FBS antes da inoculação. Adicionar 10 mL do pré-aquecido médio Expansão agsNSC ao balão T-75. Adicionar a 10 mL de suspensão de células em suspensão para o frasco T-75, em seguida, adicionar 40 mL de rh FGF-básico para o frasco. Considere que a tripsinização e inoculação não deve demorar mais do que 1,5 horas ao decidir o número máximo de frascos para trabalhar com um a qualquer momento. É preciso também ter meios suficientes para mudanças completas de mídia se utilizando frascos numerosos.
- Agite levemente o frasco de lado a lado para distribuir uniformemente as células e coloque os vasos em uma cultura de 37 ° C, 5% incubadora de CO 2, como descrito anteriormente.
6. Diluição das células para a inoculação das Placas Bem para Diferenciação
- Qualquer formato multi-bem poderia ser usado, mas a inoculação em BD Biocoat Poly-L-lisina 96 placas revestidas bem é desoriginalmente descrita aqui. Determinar o volume de suspensão de células necessárias para a sua experiência através da multiplicação do número de poços a serem inoculados em 0,2 mL por poço de uma placa de 96 multi-bem e adicione cerca de 10% para cobrir qualquer perda de volume durante a inoculação. Calcular a diluição para uma densidade celular de 75.000 células / mL. Determinar a quantidade de FBS ser adicionadas ao meio de diferenciação para alcançar uma concentração final de FBS 2% (Tabela 1). Misture o FBS e Médias Diferenciação. Misturar cuidadosamente as células com o volume calculado de Medium Diferenciação com FBS. (Nota: Durante a centrifugação, as células estão em meio basal agsNSC + 5% FBS Enquanto FBS protege as células durante a centrifugação e facilita a adesão celular FBS inibe differention Diluir FBS a 2% vai permitir a adesão das células à superfície multi-bem... A FBS 2% é então diluída a fim de promover a diferenciação. Insulin-transferrina-selênio (ITS-e) também está incluída no Médio diferenciação para promover a diferenciação.
- Em um armário de biossegurança, dispensar 200 uL da suspensão diluída de células de um reservatório Combitip estéril para cada poço de uma poli-L-lisina placa revestida de 96 poços, utilizando uma pipeta multi-canal e dicas orifício grande. Incubar as placas durante 1,5-2 horas a 37 ° C, 5% CO 2. Depois que as células têm anexados, após cerca de 90 a 120 minutos, remova cuidadosamente a 50% (100 mL para placas de 96 poços) do meio de cada cavidade utilizando ponteiras grande orifício. Cuidadosamente substituir o volume removido com Medium Diferenciação quente agsNSC, novamente usando a ponteira grande orifício. (O uso de dicas de orifício padrão pode ferir as células).
- Dois dias após a inoculação (~ 48 horas), executar uma mudança média de 50% usando Médio Diferenciação agsNSC e ponteiras grande orifício.
7. Manutenção de Neurônios
- Prepare Médio Manutenção Neuronal usando glutamina NeuraLife e B27 de acordo com as instruções. Médio Manutenção neuronal deve ser preparado semanalmente.
- Dois dias após a mudança Médio agsNSC Diferenciação passado, após a inoculação normalmente Dia 4, realizar uma substituição médio de 50% usando Médio Manutenção Neuronal.
- Continuar a realizar substituições médio de 50% usando Médio Manutenção Neuronal a cada 2 a 3 dias. Processos neuronais deve aparecer dentro de poucos dias de mudar para Médio Manutenção Neuronal. As células devem ser usados dentro de 3 semanas de serem transferidos para meio de manutenção Neuronal. Neurônios podem ser identificados através de um número de marcadores disponíveis comercialmente neuronal. Astrócitos também vai ser sempre observado.
- Populações cultura tipicamente expressar uma proporção maior do que 40% dos neurônios ao número total de células. O uso de meios de manutenção de neurônios que não pode fornecer células NeuraLife inferior que não parecem morfologicamente maduros e podem não sobreviver o maior tempo na cultura.
8. Resultados representativos:
O solo do Ártico esquilo adulto células-tronco neurais vai continuar a dobrar a cada 24 horas durante 3 a 5 dias por pelo menos duas passagens quando semeada em 500,000-600,000 frasco cells/75mm. Estas células diferenciam facilmente com a remoção de basicFGF e B27 ea presença de 1-2% FBS e 1% de insulina / Transferrina / Selenium, e se tornará TUJ1 (Covance) neurônios positivos dentro de 14-21 dias (ver Figura 2). A proporção de neurônios a células totais irá variar entre 40-60%, dependendo da idade da cultura (Figura 3). Neurônios podem ser utilizados para a experimentação de 12 dias pós-semeadura através de pelo menos 21 dias pós-semeadura.
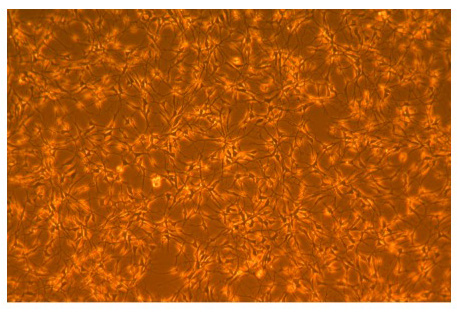
Figura 1. Fotomicrografia de AGS adulto hipocampo células-tronco neurais.
Fotomicrografia fase de adulto AGS hipocampo células-tronco neurais após 3 dias de crescimento em agsNSC media basal em Poly-L-Ornitina frascos revestidos. Duplicação ocorre aproximadamente a cada 24 horas. Foto com ampliação de 100X.
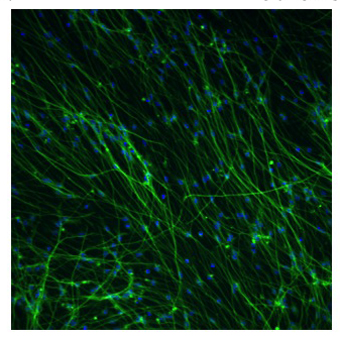
Figura 2. Fluorescentes micrografia da diferenciados para adultos AGS hipocampo células-tronco neurais
Células-tronco neurais AGS foram submetidos a media de diferenciação para quatro dias, em seguida, mantidos em Neuralife para mais 17 dias antes do assentamento. As células foram fixadas com paraformaldeído 4% e os neurônios identificados usando TUJ1 anticorpo primário (Covance) e Alexa Fluor 568 anticorpo secundário (verde) de Invitrogen. Hoechst 33343 foi adicionado corante para corar todos os núcleos (azul). Número de celular, número de neurônios e relação de neurônio foram determinados utilizando software crescimento de neuritos eo instrumento de Arrayscan Cellomics. Esta foto representa aproximadamente 57% neurônios. Aumento de 10x
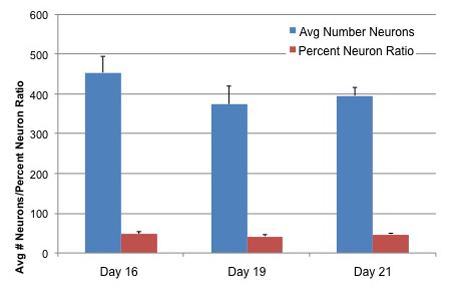
Figura 3. Número de neurônios e Relação Neuron Diferenciadas de AGS células-tronco neurais em trêsidades cultura
Células-tronco neurais AGS foram submetidos a media de diferenciação para quatro dias, em seguida, mantidos em Neuralife por 12, 15 e 17 dias antes da fixação. As células foram fixadas e neurônios identificados com TUJ1 anticorpo primário (Covance). Hoechst corante foi adicionado em todos os núcleos da mancha para a identificação de células total. Número de celular, número de neurônios e relação de neurônio por cento foram determinados utilizando software crescimento de neuritos eo instrumento de Arrayscan Cellomics. Valores representam média de 15 poços por condição + SD.
Cálculos tabela 1. Amostra utilizada na semeadura e passaging
- Usando 700.000 células / mL suspensão celular
- Usando uma densidade celular de 75.000 células / mL ou 15.000 células por poço de 0,2 mL de volume em cada poço.
- Inoculando 96 poços em 0,2 mL por poço = 19,2 mL ou desejado volume final 21 mL.
- (Volume x final Concentração Final) ÷ concentração inicial = Volume inicial
(21 mL x 75.000 células / mL) ÷ 700.000 = 2,25 mL - Volume de FBS em suspensão celular. 2,25 mL = 2,25 mL x = 0,05 mL 0,1125
- Volume de FBS necessários em 21 mL = 21 mL x 0,02 = 0,42 mL
- Volume de FBS para adicionar ao Médio Diferenciação = mL 0,42-,1125 mL = 0,3075 mL
- Volume Médio de Diferenciação = mL 21-2,25 suspensão de células mL - 0,3075 mL de 5% FBS = 18,44 mL.
- Combine 18,44 Médio Diferenciação mL com 0,308 mL FBS e adicionar 2,25 mL de suspensão celular.
Discussão
AGS adulto células-tronco neurais são robustos e podem ser expandidos para inúmeras passagens tornando-os uma excelente fonte de células-tronco neurais para estudo de propriedades básicas das células-tronco neurais. A taxa de expansão é de aproximadamente um dobrando a cada 24 horas, mas essas células devem ser várias passagens antes de chegar a confluência porque o contato entre as células irão favorecer a diferenciação de astrócitos. Contato mediado-diferenciação, portanto, fazer com que a proporçã...
Divulgações
Agradecimentos
Este trabalho foi apoiado pelos EUA de Investigação Médica do Exército e Comando de Material da bolsa # 05178001 e pelo NS041069-06 do Instituto Nacional de Distúrbios Neurológicos e Derrame. Agradecemos a Joel Vonnahme para comentários úteis sobre o protocolo.
Materiais
| Name | Company | Catalog Number | Comments |
| agsNSC | Lifeline Cell Technology | FC-0004 | |
| agsNSC Expansion kit | Lifeline Cell Technology | LL-0008 | Alternative source for DMEM/F12, B27 and rhFGFb (www.invitrogen.com) |
| agsNSC differentiation kit | Lifeline Cell Technology | LL-0009 | Alternative source for DMEM/F12 and ITS-x (www.invitrogen.com) |
| NeuraLife maintenance media kit | Lifeline Cell Technology | LL-0012 | Alternative sources are NeuraBasal (LifeLine) or Neurobasal (in vitrogen), glutamine and B27 (www.invitrogen.com)Differentiated cells are maintained for up to 3 weeks in NeuroLife, but no more than 2 weeks in Neurobasal (www.invitrogen.com) |
| Micrometer (such as a Bright Line Counting Chamber) | Hausser Scientific | 1490 | http://www.hausserscientific.com/hausserbrightlinedirect.htm |
| Biocoat Poly-L-Lysine coated 96 well plates | BD Biosciences | 356516 | www.bdbiosciences.com |
| Large orifice pipette tips | Fisher Scientific | 02-707-141 | Avoids neuronal cell damage when pippetting. http://www.fishersci.com |
Referências
- Barnes, B. M. Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator. Science. 244, 1593-1595 (1989).
- Dave, K. R., Prado, R., Raval, A. P., Drew, K. L., Perez-Pinzon, M. A. The Arctic ground squirrel brain is resistant to injury from cardiac arrest during euthermia. Stroke. 37, 1261-1265 (2006).
- Dave, K. R. Protein kinase C epsilon activation delays neuronal depolarization during cardiac arrest in the euthermic arctic ground squirrel. J Neurochem. 110, 1170-1179 (2009).
- Ross, A. P., Christian, S. L., Zhao, H. W., Drew, K. L. Persistent tolerance to oxygen and nutrient deprivation and N-methyl-D-aspartate in cultured hippocampal slices from hibernating Arctic ground squirrel. J Cereb Blood Flow Metab. 26, 1148-1156 (2006).
- Christian, S. L. Arctic ground squirrel (Spermophilus parryii) hippocampal neurons tolerate prolonged oxygen-glucose deprivation and maintain baseline ERK1/2 and JNK activation despite drastic ATP loss. J Cereb Blood Flow Metab. 28, 1307-1319 (2008).
- Jin, K. Evidence for stroke-induced neurogenesis in the human brain. Proc Natl Acad Sci U S A. 103, 13198-13202 (2006).
- Maysami, S., Lan, J. Q., Minami, M., Simon, R. P. Proliferating progenitor cells: a required cellular element for induction of ischemic tolerance in the brain. J Cereb Blood Flow Metab. 28, 1104-1113 (2008).
- Sung, S. M. Hypoxia/reoxygenation stimulates proliferation through PKC-dependent activation of ERK and Akt in mouse neural progenitor cells. Neurochem Res. 32, 1932-1939 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J Neurosci Methods. 71, 143-155 (1997).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Mol Cell Neurosci. 8, 389-404 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados