Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Wachstum und Differenzierung von adulten Hippocampus Arctic Ground Squirrel Neural Stem Cells
In diesem Artikel
Zusammenfassung
Neurale Stammzellen wurden aus dem Hippocampus von erwachsenen, nicht überwinternde einjährige Arctic Erdhörnchen (AGS) aufgestellt. Diese neuralen Stammzellen können durch zahlreiche Passagen erweitert werden, differenziert und gepflegt wie ein fast 50:50 Neuron zu Gliazellen Kultur.
Zusammenfassung
Arctic Erdhörnchen (Urocitellus parryii, AGS) sind einzigartig in ihrer Fähigkeit, mit einer Körpertemperatur in der Nähe oder unter dem Gefrierpunkt 1 überwintern. Diese Tiere auch gegen ischämischen Schädigung des Gehirns in vivo 2,3 und Sauerstoff-Glukose-Entzug in vitro 4,5. Diese einzigartigen Eigenschaften gaben den Anstoß zu AGS Neuronen zu isolieren, um inhärente neuronalen Eigenschaften, die für die Kapazität des AGS Neuronen zu Verletzungen und zum Zelltod durch Ischämie verursacht und extrem kalten Temperaturen widerstehen Konto konnte zu untersuchen. Identifizieren Proteine oder Gen-Targets, die für die besonderen Eigenschaften dieser Zellen ermöglichen könnte, in der Entdeckung von wirksamen Therapien für eine Reihe von ischämischen Indikationen und für das Studium der Kältetoleranz Hilfe. Adult AGS Hippocampus enthält neurale Stammzellen, die sich zu vermehren weiter und ermöglicht den problemlosen Ausbau dieser Stammzellen in Kultur. Wir beschreiben hier Methoden, mit denen Forscher die Stammzellen und differenzierten Neuronen für eine beliebige Anzahl von Zwecken nutzen kann. Durch die enge folgenden Schritte der AGS neuralen Stammzellen können durch zwei Passagen oder mehr erweitert werden und dann differenziert, um eine Kultur mit hohem TUJ1-positive Neuronen (~ 50%) ohne den Einsatz von giftigen Chemikalien, die Zahl der sich teilenden Zellen zu minimieren. Ischämie induziert Neurogenese 6 und Neurogenese, die über MEK / ERK-und PI3K/Akt Überleben Signalwege trägt zur Ischämie Widerstand in vivo 7 und in vitro 8 (Kelleher-Anderson, Drew et al., In Vorbereitung) verläuft. Die weitere Charakterisierung dieser einzigartigen neuronalen Zellen können an vielen Fronten voraus, mit einigen oder allen dieser Methoden.
Protokoll
1. AGS Neural Stem Cell and Media Preparation
- Adult Hippocampus Arctic Ziesel (AGS) neurale Stammzellen in einer Art und Weise isoliert zuvor beschriebenen 9 kann ab sofort im Handel als kryokonserviert Fläschchen erhältlich. Die Zellen werden über Nacht in isolierten Pakete mit Trockeneis, um sicherzustellen, dass die Zellen in einer kryokonservierten Zustand bleiben ausgeliefert. Zur Aufrechterhaltung Integrität, entpacken Sie die Zellen sofort nach Erhalt und an einem niedriger als -150 ° C oder in der Gasphase eines Flüssigstickstoff Dewar.
- Bereiten agsNSC Basal Medium + 5% FBS durch Zugabe von 5 ml FBS (LS-1012) auf 95 mL agsNSC Basal Medium
- Bereiten agsNSC Expansion Medium durch Zugabe von 500 ul B-27 Supplement (Invitrogen) zu 50 mL agsNSC Basal Medium. Teilen Sie den Rest der B27 in 1 ml Aliquots und bei -20 ° C bis zur Verwendung.
- Warm 25 ml agsNSC Basal Medium + 5% FBS und 20 ml agsNSC Expansion Medium in einem 37 ° C Wasserbad.
- Coat-Kolben für die Erweiterung mit Poly-L-Ornithin verwendet
- Thaw der Poly-L-Ornithin (10 ug / mL) funktionierende Lösung. Bewahren Sie die Lösung zwischen 2-8 ° C für bis zu 1 Monat nach dem Auftauen.
- 8 ml Poly-L-Ornithin funktionierende Lösung zu einem belüfteten T-75 Kolben und verteilen die Lösung über die gesamte Kultur Oberfläche des Kolbens. (Passen Umfang der Arbeitszeit für andere Kulturgefäße, die verwendet werden mit 0,5 mag -.. 1,0 ml Poly-L-Ornithin funktionierende Lösung pro 10 cm 2 Kulturfläche)
- Inkubieren Kolben bei 37 ° C für mindestens 24 Stunden. (Verwenden eines Inkubators ohne Zusatz von CO 2 ist für die Inkubation von Poly-L-Ornithin beschichteten Kulturgefäße bevorzugt.) Beschichtete Kolben für gespeichert werden können bis zu zwei Wochen in den Brutkasten.
- Vor dem Gebrauch absaugen Poly-L-Ornithin funktionierende Lösung aus dem Kolben und waschen zweimal mit steriler Gewebekultur-Wasser. Flüssigkeitsaufnahme, bis der Kolben ist fast trocken sein.
- Nehmen Sie ein Fläschchen aus dem Dewar und überprüfen Sie, ob Sie den Verschluss fest verschlossen ist. Halten Sie die Oberseite der Durchstechflasche Verlassen der unteren Hälfte der Flasche in einem 37 ° C Wasserbad für ca. 60-90 Sekunden oder bis Fläschchen fast vollständig aufgetaut ist, eine kleine Menge Eis sollte noch sichtbar sein. Um mögliche Kontaminationen, halten Sie den Verschluss aus dem Wasser. Nicht zu tauen, da dies kann die Zellen schädigen.
- Besprühen Sie die Außenseite der Flasche mit 70% Ethanol oder Isopropanol, dann die Flasche in einem biologischen Sicherheitsschrank. Entfernen Sie den Deckel vorsichtig, um eine Verunreinigung oder Spritzer zu vermeiden.
- Vorsichtig wieder die Zellen in der Ampulle durch Zugabe von 1 ml agsNSC Basal Medien + 5% FBS mit einer sterilen Pipette. Übertragen Sie die resuspendierten Zellen in 25 ml warmem agsNSC Basal Medium + 5% FBS in einer 50 ml-Zentrifugenröhrchen.
- Spülen Sie die Kryo-Röhrchen einmal mit verdünnten Zellsuspension. Zentrifugieren Sie die Zellen bei 150 xg für 6 Minuten. Für beste Ergebnisse, die Berechnung der Geschwindigkeit für jedes einzelne Zentrifuge Typ.
- Während die Zellen Spinnen sind hinunter, 10 ml agsNSC Expansion Medium auf die trockene Poly-L-Ornithin beschichteten T-75 einwiegen und 40 ul rh FGF-basic (40ng/mL). Nach der Zentrifugation absaugen die überstehende Flüssigkeit darauf achten, nicht saugen das Pellet. Re-die Zellen in 10 ml agsNSC Expansion Medium. Übertragen Sie die resuspendierten Zellen in agsNSC Expansion Medium in den Medien in den T-75 Kolben.
- Schütteln Sie die Kulturgefäß Seite an Seite gleichmäßig zu verteilen Zellen innerhalb des Gefäßes.
- Ort ausgesät Kulturgefäß in ein 37 ° C, 5% CO 2-Inkubator. Die Zellen sollten in den Kolben legen und beginnen, um Prozesse innerhalb von zwei Stunden der Aussaat zu bilden. Wenn die Zellen schweben bleiben und ballte innerhalb des Mediums, dann Zentrifuge Zellen in 5% FBS und führen Sie die Schritte 1,8-1,10 mit frischem Medium und Kolben.
2. Ausbau der AgsNSC
- Zwei Tage (~ 48 Stunden) nach dem Auftauen und Aussäen der Zellen, sollte eine vollständige Medium Ersatz erfolgt mit 20 ml agsNSC Expansion Medium plus 40 ul spike von rh FGF-basic werden.
- Spike-Kolben mit 40 ul rh FGF-basic am Tag nach der Impfung. Die Zellen werden bereit sein, trypsinize, wenn sie 75-80% Konfluenz von der dritten oder vierten Tag nach der Impfung erreicht haben. Die Kultivierung der undifferenzierten Stammzellen für länger als 4 Tage nach der Impfung wird nicht empfohlen, da längere Inkubationszeit wird es Zellen zu beginnen, zu Neuronen und Neuronen differenzieren kann durch Trypsinierung in Schritt 3 verletzt werden. Die rh FGF-basic kann bei 4 ° C gelagert werden bis zu einer Woche und noch pflegen Aktivität. Die rh FGF-basic kann auch durch einen zusätzlichen Frost / Tau bei -20 ° C zu gehen, wenn mehr Zeit benötigt wird.
3. Trypsinierung der Zellen
- agsNSC sollte 3 bis 4 Tage nach der Inokulation passagiert werden. Bereiten Sie eine Poly-L-Ornithin beschichteten Kolben zwischen 24 Uhr und eine Woche vor Passagierung wenn die agsNSC wieder ausgebaut werden soll.
- Saugen Sie dasMedium aus dem Kulturgefäß. Fügen Sie 2,5 ml 0,05% Trypsin/0.02% EDTA (CM-0017), um das Schiff für jede 75 cm 2 Oberfläche. Vorsichtig, um alle Zellen zu gewährleisten sind mit dem Trypsin / EDTA beschichtet. Zellen, die normalerweise anfangen, von der Oberfläche lösen innerhalb von 60 Sekunden, abhängig von der Mündung der Zellen. Nicht über trypsinize, als damit die Zellen beschädigen. Leichtes Antippen des Kulturgefäß von mehreren Seiten ermutigen Distanz.
- Sobald die Zellen ablösen, 10 ml agsNSC Basal Medium + 5% FBS in den Kolben. Vorsichtig schwenken, um alle Trypsin-Lösung gewährleistet wird neutralisiert. Unter aseptischen Labormethoden, Pipette die Zellen in ein steriles Zentrifugenröhrchen mit 10 ml agsNSC Basal Medium +5% FBS. Wiederholen Sie durch Waschen der Kolben wieder mit einem zusätzlichen 10 ml agsNSC Basal Medium + 5% FBS und verbinden sich mit der ersten Wäsche.
- Centrifuge Zellen bei 150 xg für 6 Minuten, wie oben beschrieben. Nach der Zentrifugation sollte die Zellen bilden eine saubere lose Pellets. Saugen Sie neutralisiert Trypsin und Medium aus dem Zentrifugenröhrchen und resuspendieren Sie das Zellpellet in 10 mL (pro T-75 Kolben) der vorgewärmten agsNSC Basal Medium + 5% FBS durch vorsichtiges Auf-und Abpipettieren 2X mit einer 10 ml Pipette. Führen Sie eine Zellzahl wie unten beschrieben.
4. Standard-Berechnung für Beschichtung von Zellen
- Unter aseptischen Bedingungen, wirbeln die Zellsuspension und Transfer 15 ul der Zellsuspension zu einem Reaktionsgefäß. Add 15 ul von 0,4% Trypanblau. Vorsichtig mischen und Last 10 ul Zellsuspension zu jedem der beiden Kammern in einem sauberen Hämazytometer wie eine helle Linie Zählkammer (Katalog # 1490: Hausser Scientific, http://www.hausserscientific.com/hausserbrightlinedirect.htm ).
- Graf ein Minimum von 4 Quadranten auf der Hämazytometer. Die blauen Zellen, die positiv für Trypanblau sind tot und sollte nicht gezählt werden. Für eine genaue Zellzahl, sollte die optimale Anzahl von Zellen pro Quadrant 25-75 Zellen.
- Nach Auszählung der Zellen, berechnen den Mittelwert der 4-Quadranten. Multiplizieren Sie die durchschnittliche Zellzahl von 10.000 und mit dem Verdünnungsfaktor (2, wenn mit den empfohlenen Mengen), die Anzahl der Zellen pro ml zu bestimmen. Beachten Sie, dass, wenn Gesamtanteil Lebensfähigkeit weniger als 92% kann es zu einer Reihe von Ursachen haben. Ein Grund für die niedrige Rentabilität kann über Trypsinierung werden, vor der Neutralisation mit FBS Trypsin. Ein weiterer Grund kann sein, dass die Konzentration von Serum (FBS), um Trypsin zu niedrig ist und die Zellen weiterhin trypsiniert werden. Drittens kann die Zellen zu konfluenten haben, was Stammzellen zur Differenzierung durch Zell-Zell-Kontakt, was zu Verletzungen während Trypsinierung. Wenn diese Methode aufmerksam verfolgt eine Ausbeute von 3 oder mehr Verdoppelungen erwartet werden, was einer Bevölkerung von> 4.000.000 Zellen aus einer anfänglichen Anzahl von ~ 500.000.
5. Inokulation von weiterer Expansion Flask
- Zur Ermittlung der Gesamtzahl der Zellen erforderlich, um ein Schiff zu impfen, multiplizieren Sie den gewünschten Aussaatdichte (6.600 Zellen pro cm 2 oder 500.000 Zellen pro T-75 Kolben) durch die Fläche (in cm 2) des Schiffes, geimpft werden. Wenn Impfung mehr als ein Schiff multiplizieren Sie die Anzahl der Zellen pro Schiff durch die Gesamtzahl der Schiffe. Zur Ermittlung des Volumens (ml) der Zellsuspension benötigt, um jedes Schiff zu impfen, teilen Sie die Anzahl der Zellen erforderlich, um ein Schiff durch die Anzahl der lebensfähigen Zellen / ml in der Zellsuspension zu impfen. Wenn Impfung mehr als ein Schiff berechnet das Gesamtvolumen der Zellsuspension durch Multiplikation des Volumens für ein Schiff durch die Gesamtzahl von Schiffen geimpft werden mussten benötigt.
- Zentrifugieren Sie die gewünschte Lautstärke von Zellen in agsNSC Basal Medium + 5% FBS, so dass eine lose Pellets. Normalerweise 500.000 Zellen sind auf ein Gesamtvolumen von 25 mL in agsNSC Basal Medium +5% FBS, wie vorher beschrieben hat. Flüssigkeitsaufnahme und Re-suspendieren die losen Pellets in 10 ml agsNSC Expansion Medium Diese zusätzliche Zentrifugationsschritt erforderlich FBS vor der Inokulation zu entfernen. Fügen Sie 10 ml vorgewärmten agsNSC Expansion Medium, um die T-75 Kolben. Fügen Sie die 10 ml des resuspendierten Zellsuspension auf die T-75 Kolben fügen Sie dann 40 ul rh FGF-basic in den Kolben. Bedenken Sie, dass die Trypsinierung und Impfung sollte nicht länger als 1,5 Stunden bei der Entscheidung die maximale Anzahl von Flaschen mit einem beliebigen Zeitpunkt zu arbeiten. Man sollte auch genügend Medien für komplette Medien ändert sich, wenn mit zahlreichen Flaschen.
- Schütteln Sie die Flasche von einer Seite zur gleichmäßigen Verteilung der Zellen und Ort der Kultur Schiffe in einem 37 ° C, 5% CO 2-Inkubator, wie zuvor beschrieben.
6. Verdünnung der Zellen für die Beimpfung des Well Platten für Differenzierung
- Jeder Multi-Well-Format kann verwendet werden, aber Inokulation in BD Biocoat Poly-L-Lysin-beschichtete 96-Well-Platten described hier. Bestimmen Sie das Volumen der Zellsuspension für Ihr Experiment durch Multiplikation der Anzahl von Brunnen, die von 0,2 ml pro Vertiefung für eine 96-Multi-Well-Platte geimpft werden benötigt, und fügen Sie ca. 10% zu einem Verlust an Volumen während der Impfung zu decken. Berechnen Sie die Verdünnung auf eine Zelldichte von 75.000 Zellen / ml. Bestimmen Sie die Höhe der FBS auf die Differenzierung Medium hinzugefügt werden, um eine Endkonzentration von 2% FBS (Tabelle 1) zu erreichen. Mix der FBS und Differenzierung Medium. Vorsichtig die Zellen mit den berechneten Umfang der Differenzierung Medium mit FBS. (Anmerkung: Während des Laufs werden die Zellen in agsNSC Basal Medium + 5% FBS Während FBS Zellen schützt während der Zentrifugation und erleichtert die Zelladhäsion FBS hemmt differention Verdünnung FBS bis 2% wird die Haftung der Zellen an die Multi-Well-Oberfläche zu ermöglichen... Die 2% FBS wird dann weiter die Differenzierung fördern verdünnt. Insulin-Transferrin-Selen (ITS-e) ist auch in der Differenzierung Medium zur Differenzierung zu fördern enthalten.
- In einem Biosicherheitswerkbank, verzichten 200 ul verdünnt Zellsuspension aus einer sterilen Combitip Reservoir in jede Vertiefung einer Poly-L-Lysin-beschichtete 96-Well-Platte mit einer Mehrkanal-Pipette und große Öffnung Tipps. Die Inkubation für 1,5-2 Stunden bei 37 ° C, 5% CO 2. Nachdem die Zellen angeschlossen haben, nach etwa 90 bis 120 Minuten, entfernen Sie vorsichtig 50% (100 ul für 96-Well-Platten) des Mediums aus jedem Well mit großer Öffnung Pipettenspitzen. Vorsichtig wieder die Lautstärke mit warmem agsNSC Differenzierung Medium entfernt, erneut mit großer Öffnung Pipettenspitzen. (Verwendung von Standard-Öffnung Tipps können die Zellen schädigen).
- Zwei Tage nach der Impfung (~ 48 Stunden), führen Sie einen 50% mittlere Veränderung mit agsNSC Differenzierung Mittlere und große Öffnung Pipettenspitzen.
7. Wartung von Neuronen
- Bereiten Neuronale Wartung Medium mit NeuraLife, Glutamin und B27 nach den Anweisungen. Neuronale Wartung Medium sollte wöchentlich vorbereitet werden.
- Zwei Tage nach der letzten agsNSC Differenzierung Medium ändern, in der Regel Tag 4 nach der Inokulation, führen Sie einen 50% mittel-Ersatz Verwendung neuronaler Wartung Medium.
- Weiter zu 50% mittel-Ersatz Verwendung neuronaler Wartung Medium alle 2 bis 3 Tage durchführen. Neuronale Prozesse sollten innerhalb weniger Tage zu ändern, um neuronale Wartung Medium erscheinen. Die Zellen sollten innerhalb von 3 Wochen nach der neuronalen Wartung Medium übertragen werden. Neuronen können unter Verwendung einer Reihe von im Handel erhältlichen neuronalen Marker werden. Astrozyten wird auch immer beachtet werden.
- Kultur der Bevölkerung in der Regel Ausdruck einer mehr als 40%-Verhältnis von Neuronen insgesamt Zellzahl. Die Verwendung von Neuron Wartung andere Medien als NeuraLife können vorsehen, minderwertige Zellen, die nicht aussehen, morphologisch reif und kann nicht so lange in Kultur überleben.
8. Repräsentative Ergebnisse:
Die Arctic Ziesel adulten neuralen Stammzellen wird auch weiterhin alle 24 Stunden für 3 bis 5 Tage für mindestens zwei Passagen verdoppeln, wenn bei 500.000-600.000 cells/75mm ausgesät. Diese Zellen werden leicht mit der Entfernung von basicFGF und B27 und das Vorhandensein von 1-2% FBS und 1% Insulin / Transferrin / Selen zu differenzieren, und wird TUJ1 (Covance) positive Neurone in 14-21 Tagen (siehe Abbildung 2) werden. Das Verhältnis von Neuronen insgesamt Zellen zwischen 40-60%, abhängig vom Alter der Kultur (Abbildung 3) Bereich. Neuronen können für Experimente von 12 Tagen nach der Aussaat über mindestens 21 Tage nach der Aussaat genutzt werden.
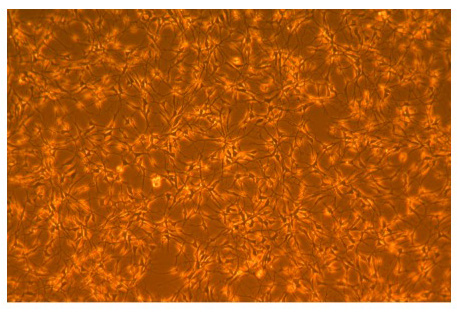
Abbildung 1. Mikrophotographie von AGS erwachsenen Hippocampus neuronale Stammzellen.
Phase Mikrophotographie AGS erwachsenen Hippocampus neuronale Stammzellen folgenden 3 Tagen Wachstum in agsNSC Basalmedien in Poly-L-Ornithin beschichteten Kolben. Die Verdoppelung tritt etwa alle 24 Stunden. Foto bei 100-facher Vergrößerung.
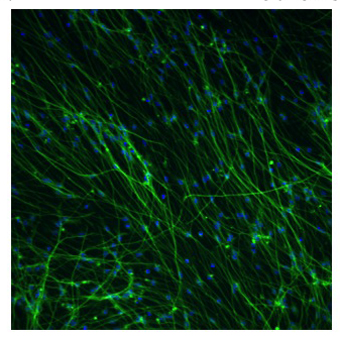
Abbildung 2. Fluorescent Aufnahme von differenzierten AGS erwachsenen Hippocampus neuronale Stammzellen
AGS neuralen Stammzellen wurden Differenzierung Medien für 4 Tage, dann in Neuralife für 17 Tage vor dem Fixieren erhalten unterzogen. Die Zellen wurden mit 4% Paraformaldehyd und Neuronen identifiziert mit TUJ1 Primärantikörper (Covance) und Alexa Fluor 568 Sekundärantikörper (grün) von Invitrogen fixiert. Hoechst-Farbstoff 33343 wurde hinzugefügt, um alle Kerne (blau) gefärbt. Zellzahl, Neuron-Nummer und Neuron-Verhältnis wurden anhand von Neuritenwachstum Software und die ArrayScan Instrument aus Cellomics. Dieses Foto entspricht etwa 57% Neuronen. 10-facher Vergrößerung
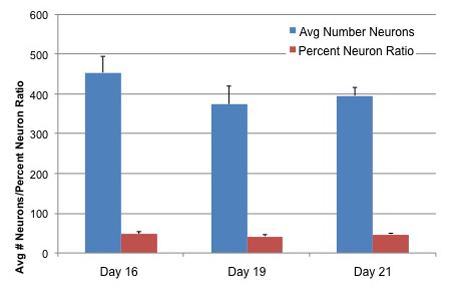
Abbildung 3. Neuron Zahlen und Neuron Verhältnis Differenzierte AGS neuralen Stammzellen an dreiKultur im Alter
AGS neuralen Stammzellen wurden Differenzierung Medien für 4 Tage ausgesetzt, dann erhalten in Neuralife für 12, 15 und 17 Tage vor der Fixierung. Die Zellen wurden fixiert und Neuronen mit TUJ1 Primärantikörper (Covance) identifiziert. Hoechst-Farbstoff zugegeben, um alle Keime für insgesamt Zellidentifizierung Fleck. Zellzahl, Neuron Anzahl und Prozent Neuron-Verhältnis wurden anhand von Neuritenwachstum Software und die ArrayScan Instrument aus Cellomics. Die Werte stellen Mittelwerte von 15 Wells pro Bedingung + SD.
Tabelle 1. Beispielrechnungen in die Passage und Aussaat verwendet
- Mit 700.000 Zellen / ml Zellsuspension
- Mit einer Zelldichte von 75.000 Zellen / ml bzw. 15.000 Zellen pro Vertiefung von 0,2 ml Volumen in jede Vertiefung.
- Impfen 96 Vertiefungen mit 0,2 ml pro Well = 19,2 ml oder gewünschte Endvolumen 21 mL.
- (Endkonzentration x Endvolumen) ÷ anfängliche Konzentration = Initial Volume
(21 mL x 75.000 Zellen / ml) ÷ 700.000 = 2,25 mL - Volumen der FBS in Zellsuspension. 2,25 ml = 2,25 ml x 0,05 = 0,1125 mL
- Volumen der FBS benötigt in 21 mL = 21 mL x 0,02 = 0,42 mL
- Volumen der FBS auf Differenzierung Medium hinzufügen = 0,42 mL - 0,1125 ml = 0,3075 mL
- Volumen der Differenzierung Medium = 21 ml - 2,25 ml Zellsuspension - 0,3075 mL 5% FBS = 18,44 mL.
- Kombinieren 18,44 ml Differenzierungsmedium mit 0,308 mL FBS und fügen 2,25 ml Zellsuspension.
Diskussion
AGS adulten neuralen Stammzellen sind robust und können für eine Vielzahl von Passagen macht sie eine ausgezeichnete Quelle von neuralen Stammzellen für das Studium der grundlegenden neuronalen Stammzell-Eigenschaften erweitert werden. Die Erweiterung liegt bei etwa einer Verdoppelung alle 24 Stunden, aber diese Zellen müssen vor dem Erreichen der Konfluenz passagiert werden, weil der Kontakt zwischen den Zellen wird die Differenzierung zu Astrozyten zu begünstigen. Kontakt-vermittelte Differenzierung wird dazu bei...
Offenlegungen
Danksagungen
Diese Arbeit wurde vom US Army Medical Research und Materiel Command gewähren # 05178001 und NS041069-06 aus dem National Institute of Neurological Disorders and Stroke unterstützt. Wir danken Joel Vonnahme für hilfreiche Kommentare über das Protokoll.
Materialien
| Name | Company | Catalog Number | Comments |
| agsNSC | Lifeline Cell Technology | FC-0004 | |
| agsNSC Expansion kit | Lifeline Cell Technology | LL-0008 | Alternative source for DMEM/F12, B27 and rhFGFb (www.invitrogen.com) |
| agsNSC differentiation kit | Lifeline Cell Technology | LL-0009 | Alternative source for DMEM/F12 and ITS-x (www.invitrogen.com) |
| NeuraLife maintenance media kit | Lifeline Cell Technology | LL-0012 | Alternative sources are NeuraBasal (LifeLine) or Neurobasal (in vitrogen), glutamine and B27 (www.invitrogen.com)Differentiated cells are maintained for up to 3 weeks in NeuroLife, but no more than 2 weeks in Neurobasal (www.invitrogen.com) |
| Micrometer (such as a Bright Line Counting Chamber) | Hausser Scientific | 1490 | http://www.hausserscientific.com/hausserbrightlinedirect.htm |
| Biocoat Poly-L-Lysine coated 96 well plates | BD Biosciences | 356516 | www.bdbiosciences.com |
| Large orifice pipette tips | Fisher Scientific | 02-707-141 | Avoids neuronal cell damage when pippetting. http://www.fishersci.com |
Referenzen
- Barnes, B. M. Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator. Science. 244, 1593-1595 (1989).
- Dave, K. R., Prado, R., Raval, A. P., Drew, K. L., Perez-Pinzon, M. A. The Arctic ground squirrel brain is resistant to injury from cardiac arrest during euthermia. Stroke. 37, 1261-1265 (2006).
- Dave, K. R. Protein kinase C epsilon activation delays neuronal depolarization during cardiac arrest in the euthermic arctic ground squirrel. J Neurochem. 110, 1170-1179 (2009).
- Ross, A. P., Christian, S. L., Zhao, H. W., Drew, K. L. Persistent tolerance to oxygen and nutrient deprivation and N-methyl-D-aspartate in cultured hippocampal slices from hibernating Arctic ground squirrel. J Cereb Blood Flow Metab. 26, 1148-1156 (2006).
- Christian, S. L. Arctic ground squirrel (Spermophilus parryii) hippocampal neurons tolerate prolonged oxygen-glucose deprivation and maintain baseline ERK1/2 and JNK activation despite drastic ATP loss. J Cereb Blood Flow Metab. 28, 1307-1319 (2008).
- Jin, K. Evidence for stroke-induced neurogenesis in the human brain. Proc Natl Acad Sci U S A. 103, 13198-13202 (2006).
- Maysami, S., Lan, J. Q., Minami, M., Simon, R. P. Proliferating progenitor cells: a required cellular element for induction of ischemic tolerance in the brain. J Cereb Blood Flow Metab. 28, 1104-1113 (2008).
- Sung, S. M. Hypoxia/reoxygenation stimulates proliferation through PKC-dependent activation of ERK and Akt in mouse neural progenitor cells. Neurochem Res. 32, 1932-1939 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J Neurosci Methods. 71, 143-155 (1997).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Mol Cell Neurosci. 8, 389-404 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten