Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Croissance et différenciation des cellules adultes hippocampe Arctic écureuil souches neurales au sol
Dans cet article
Résumé
Les cellules souches neurales ont été préparés à partir de l'hippocampe d'adultes non-hibernation yearlings spermophiles arctiques (AGS). Ces cellules souches neurales peuvent être complétés par de nombreux passages, différenciés et entretenu comme un neurone près 50:50 à la culture gliales.
Résumé
Les spermophiles arctiques (Urocitellus parryii, AGS) sont uniques dans leur capacité à hiberner avec une température corporelle de près ou en dessous de zéro 1. Ces animaux aussi résister à une lésion ischémique du cerveau in vivo 2,3 et de l'oxygène du glucose in vitro, la privation 4,5. Ces qualités uniques ont donné l'impulsion à isoler les neurones AGS afin d'examiner les caractéristiques inhérentes neuronales qui pourraient rendre compte de la capacité des neurones à résister à l'AGS blessures et la mort cellulaire provoquée par l'ischémie et les températures extrêmement froides. Identifier ou protéines cibles de gènes qui permettent pour les propriétés distinctives de ces cellules pourrait aider à la découverte de thérapies efficaces pour un certain nombre d'indications ischémiques et pour l'étude de la tolérance au froid. Adulte AGS hippocampe contient des cellules souches neurales qui continuent à proliférer, ce qui permet une extension facile de ces cellules souches en culture. Nous décrivons ici les méthodes par lesquelles les chercheurs peuvent utiliser ces cellules souches et les neurones différenciés pour n'importe quel nombre de buts. En suivant de près les étapes les cellules souches neurales AGS peut être étendu grâce à deux passages ou plus, puis différenciées pour une culture riche en TUJ1 neurones positifs (~ 50%) sans utiliser des produits chimiques toxiques afin de minimiser le nombre de cellules en division. L'ischémie induit neurogenèse 6 et neurogenèse qui procède par MEK / ERK et voies de survie PI3K/Akt de signalisation contribue à la résistance d'ischémie in vivo et in vitro 7 8 (Kelleher-Anderson, Drew et al., En préparation). Une caractérisation plus poussée de ces cellules uniques neurones peuvent avancer sur plusieurs fronts, en utilisant tout ou partie de ces méthodes.
Protocole
1. Cellule AGS souches neurales et les médias Préparation
- Adulte hippocampique écureuil au sol de l'Arctique (AGS) des cellules souches neurales isolées dans une manière décrite précédemment 9 peut maintenant être obtenu commercialement comme flacons cryopréservés. Les cellules sont expédiés dans des emballages nuit isolée contenant de la glace sèche pour s'assurer que les cellules restent dans un état cryopréservés. Pour maintenir l'intégrité, déballer les cellules immédiatement après la réception et stocker à plus bas que -150 ° C, ou dans la phase vapeur de l'azote liquide Dewar.
- Préparer agsNSC milieu de base + 5% de FBS en ajoutant 5 ml de FBS (LS-1012) à 95 ml agsNSC milieu de base
- Préparer moyen d'extension agsNSC en ajoutant 500 B-27 uL Supplément (Invitrogen) à 50 mL agsNSC milieu de base. Répartissez le reste de la B27 dans 1mL aliquotes et conserver à -20 ° C jusqu'à utilisation.
- Chaude 25 ml de milieu de base + 5% agsNSC FBS et 20 ml de milieu Expansion agsNSC dans un bain à 37 ° C l'eau.
- Manteau flacons utilisés pour l'expansion de poly-L-ornithine
- Décongelez la solution de poly-L-ornithine (10 pg / ml) de travail. Conserver la solution à 2-8 ° C pendant jusqu'à un mois une fois décongelé.
- Ajouter 8 ml de poly-L-ornithine solution de travail à l'un ventilé T-75 flacon et répartir uniformément la solution sur toute la surface de culture de la fiole. (Ajuster quantité de solution de travail pour les navires de la culture d'autres qui peuvent être utilisés Utiliser 0,5 -.. 1,0 ml de poly-L-ornithine solution de travail par 10 cm de surface de culture 2)
- Incuber flacons à 37 ° C pendant un minimum de 24 heures. (L'utilisation d'un incubateur sans ajouter du CO 2 est préféré pour l'incubation de poly-L-ornithine récipients de culture enduits.) Flacons couchés peuvent être stockées pendant jusqu'à deux semaines dans l'incubateur.
- Avant d'utiliser, aspirer poly-L-ornithine solution de travail de la fiole et laver deux fois avec de l'eau stérile pour culture de tissus. Aspirer le liquide jusqu'à ce que le flacon est presque à sec avant utilisation.
- Supprimer un flacon de la Dewar et vérifier que le bouchon du flacon est correctement scellé. Tenir le haut du flacon en laissant la moitié inférieure de la fiole dans un bain d'eau à 37 ° C pendant environ 60-90 secondes ou jusqu'à ce que le flacon est presque complètement décongelés; une petite quantité de glace doit toujours être visible. Pour éviter une contamination potentielle, gardez le bouchon du flacon de l'eau. Ne pas trop dégel, car cela pourrait endommager les cellules.
- Vaporiser l'extérieur de la fiole avec de l'éthanol à 70% ou isopropanol, puis placer le flacon dans une enceinte de sécurité biologique. Retirez le bouchon avec précaution pour éviter la contamination ou les éclaboussures.
- Doucement remettre en suspension les cellules dans le flacon en ajoutant 1 ml de milieux de base agsNSC + 5% de FBS aide d'une pipette stérile. Transférer les cellules remises en suspension à 25 ml d'eau tiède moyen basal agsNSC + 5% SVF dans un tube à centrifuger de 50 ml.
- Rincer la cryo-flacon une fois avec la suspension cellulaire diluée. Centrifuger les cellules à 150 xg pendant 6 minutes. Pour de meilleurs résultats, calculer la vitesse pour chaque type de centrifugeuse individuelle.
- Alors que les cellules sont filer vers le bas, ajoutez 10 ml de milieu d'expansion à l'agsNSC sèche de poly-L-ornithine T-75 revêtement des fioles, ajouter 40 ul de rh FGF-base (40ng/mL). Après la centrifugation, aspirer le surnageant en prenant soin de ne pas aspirer le culot. Re-suspendre les cellules dans 10 ml de milieu Expansion agsNSC. Transférer les cellules remises en suspension dans un milieu de agsNSC expansion dans les médias dans le ballon de T-75.
- Secouez doucement le récipient de culture côte à côte afin de répartir uniformément les cellules dans le vaisseau.
- Récipient de culture ensemencée en place de 37 ° C, 5% de CO 2 incubateur. Les cellules doivent attacher le ballon et commencent à former des processus dans les deux heures de l'ensemencement. Si les cellules restent flottants et en boule dans le milieu, puis centrifuger les cellules de 5% de FBS et exécutez les étapes 1.8 à 1.10 avec un milieu frais et de fiole.
2. Expansion des AgsNSC
- Deux jours (~ 48 heures) après la décongélation et l'ensemencement des cellules, un remplacement plein milieu devrait être effectuée en utilisant 20 ml de milieu Expansion agsNSC plus un pic 40 uL de rh FGF-base.
- Flacons de Spike avec 40 uL de rh FGF-base sur l'inoculation jour suivant. Les cellules seront prêtes à trypsiniser quand ils ont atteint la confluence de 75-80% par la troisième ou quatrième jour après l'inoculation. La culture des cellules souches indifférenciées pendant plus de 4 jours après l'inoculation n'est pas recommandée car incubation plus longue permettra aux cellules commencent à se différencier pour les neurones et les neurones peuvent être blessés par trypsinisation pendant l'étape 3. Le FGF-RH de base peuvent être conservés à 4 ° C pendant une semaine et toujours maintenir l'activité. Le FGF-rh base peut également passer par un gel des supplémentaires / dégel à -20 ° C si plus de temps est nécessaire.
3. Trypsinisation des cellules
- agsNSC doivent être repiquées 3 à 4 jours après l'inoculation. Préparer un flacon de poly-L-ornithine enduit entre 24 heures et une semaine avant repiquage si l'agsNSC sera élargi à nouveau.
- Aspirer lemoyenne du récipient de culture. Ajouter 2,5 ml de 0,05% Trypsin/0.02% EDTA (CM-0017) à la cuve pour chaque 75 cm 2 de surface. Agiter doucement pour s'assurer que toutes les cellules sont recouvertes avec la trypsine / EDTA. Les cellules commencent normalement à se détacher de la surface dans les 60 secondes, en fonction de la confluence des cellules. Ne pas trop trypsiniser, car cela pourrait endommager les cellules. Tapotant doucement le récipient de culture de plusieurs côtés encouragera le détachement.
- Une fois que les cellules se détachent, ajouter 10 ml de milieu de base + 5% agsNSC FBS dans le ballon. Remuer doucement pour assurer l'ensemble de la solution de trypsine est neutralisée. En utilisant des techniques de laboratoire d'asepsie, une pipette les cellules dans un tube à centrifuger stérile contenant 10 ml de FBS agsNSC basale moyenne 5%. Répétez en lavant le flacon à nouveau avec un supplément de 10 ml de milieu de base + agsNSC 5% de FBS et de combiner avec le premier lavage.
- Centrifuger les cellules à 150 xg pendant 6 minutes comme décrit ci-dessus. Après centrifugation, les cellules doivent former un nettoyage granulés en vrac. Aspirer la trypsine neutralisée et moyennes du tube de centrifugation et de remettre en suspension les cellules dans 10 ml granulés (par T-75 flacon) de pré-chauffé moyen basal agsNSC + 5% de FBS par un léger pipetage haut et en bas 2X avec une pipette de 10 ml. Effectuer une numération cellulaire comme décrit ci-dessous.
4. Calcul standard pour le placage des cellules
- En utilisant une technique aseptique, tourbillon de la suspension cellulaire et le transfert 15 ul de la suspension cellulaire dans un tube à centrifuger. Ajouter 15 ul de 0,4% au bleu Trypan. Mélanger doucement et une charge de 10 uL de suspension cellulaire à chacune des chambres d'un hématimètre propres comme une ligne lumineuse Comptage Chambre (catalogue # 1490: Hausser scientifique, http://www.hausserscientific.com/hausserbrightlinedirect.htm ).
- Comptez un minimum de 4 quadrants sur l'hématimètre. Les cellules bleues qui sont positifs pour Bleu Trypan sont morts et ne doivent pas être comptés. Pour nombre de cellules précises, le nombre optimal de cellules par quadrant devrait être de 25 à 75 cellules.
- Après comptage des cellules, de calculer la moyenne des quatre quadrants. Multipliez le nombre moyen de cellules par 10 000 et par le facteur de dilution (2 si vous utilisez les volumes recommandés) pour déterminer le nombre de cellules par mL. Notez que si la viabilité pourcentage total est inférieur à 92% il peut y avoir un certain nombre de causes. Une des raisons de faible viabilité peut être plus trypsinisation, avant neutralisation par la trypsine de FBS. Une autre raison peut être que la concentration de sérum (FBS) à la trypsine est trop faible et les cellules continuent à être traitées à la trypsine. Troisièmement, les cellules peuvent avoir été trop confluentes, causant des cellules souches à se différencier en raison de contact cellule-cellule, conduisant à des blessures lors de trypsinisation. Si cette méthode est suivie de près un rendement de 3 ou plus doublements on peut s'attendre, ce qui donne une population de> 4.000.000 cellules à partir d'un nombre initial de 500 000 ~.
5. L'inoculation d'un autre flacon Expansion
- Pour déterminer le nombre total de cellules nécessaires pour inoculer un navire, il faut multiplier la densité de semis souhaitée (6600 cellules par cm 2 ou 500 000 cellules par flacon T-75) par la surface (en cm 2) du navire à être inoculés. Si l'inoculation plus d'un navire de multiplier le nombre de cellules par navire par le nombre total de navires. Pour déterminer le volume (ml) de suspension de cellules nécessaires pour inoculer chaque navire, divisez le nombre de cellules nécessaires pour inoculer un navire par le nombre de cellules viables / ml dans la suspension cellulaire. Si l'inoculation plus d'un navire de calculer le volume total de suspension cellulaire nécessaire en multipliant le volume nécessaire pour un navire par le nombre total de navires de se faire vacciner.
- Centrifuger le volume souhaité de cellules dans un milieu basal agsNSC + 5% de FBS, laissant un lâche granulés. Normalement 500.000 cellules sont portées à un volume total de 25 ml dans le milieu basal agsNSC 5% de FBS, comme décrit précédemment. Aspirer le liquide et re-suspendre le culot dans lâches 10 ml de milieu Expansion agsNSC Cette étape de centrifugation supplémentaire est nécessaire pour éliminer FBS avant l'inoculation. Ajouter 10 ml de pré-chauffé moyen d'extension agsNSC le ballon T-75. Ajouter les 10 ml de suspension cellulaire en suspension dans le flacon T-75, puis ajouter 40 ul de rh FGF-base dans le ballon. Considérons que la trypsination et l'inoculation devrait pas prendre plus de 1,5 heures au moment de décider le nombre maximum de flacons de travailler avec à tout moment. On devrait aussi avoir assez de journalistes pour les changements de supports complète si vous utilisez des flacons nombreux.
- Secouez doucement le ballon de côté à l'autre afin de répartir uniformément les cellules et les vaisseaux lieu de culture dans un 37 ° C, 5% de CO 2 incubateur, comme décrit précédemment.
6. Dilution des cellules pour l'inoculation des plaques Eh bien pour la différenciation
- Toute multi-format et pourrait être utilisé, mais l'inoculation dans BD Biocoat poly-L-lysine revêtement des plaques de 96 puits est described ici. Déterminer le volume de suspension cellulaire nécessaire pour votre expérience en multipliant le nombre de puits pour être inoculé par 0,2 ml par puits d'une 96 plaque multi-puits et ajouter environ 10% pour couvrir toute perte de volume lors de l'inoculation. Calculer la dilution à une densité cellulaire de 75 000 cellules / mL. Déterminer le montant de FBS à être ajouté au milieu de différenciation pour obtenir une concentration finale de 2% de FBS (tableau 1). Mélanger le FBS et milieu de différenciation. Mélanger délicatement les cellules avec le volume calculé de milieu de différenciation avec du FBS. (Note: Lors de la centrifugation les cellules basales sont en moyenne agsNSC + 5% SVF Bien FBS protège les cellules pendant la centrifugation et facilite l'adhésion des cellules inhibe FBS differention dilution à 2% de FBS permettra à l'adhérence des cellules à la surface multi-puits... Le FBS 2% est ensuite diluée pour promouvoir la différenciation. Insulin-transferrine-Sélénium (ITS-e) est également inclus dans le milieu de différenciation pour promouvoir la différenciation.
- Dans une enceinte de biosécurité, de distribuer 200 uL de suspension cellulaire diluée à partir d'un réservoir Combitip stérile pour chaque puits d'une poly-L-lysine plaque de 96 puits revêtus à l'aide d'une pipette multi-canaux et des conseils grand orifice. Incuber les plaques pendant 1,5-2 heures à 37 ° C, 5% de CO 2. Après que les cellules ont attaché, après environ 90 à 120 minutes, retirez soigneusement de 50% (100 ul pour plaques 96 puits) du milieu de chaque puits en utilisant de grands embouts de pipette orifice. Replacez soigneusement le volume enlevé avec milieu de différenciation chaude agsNSC, là encore en utilisant de grands embouts de pipette orifice. (Utilisation des conseils orifice normalisé peut blesser les cellules).
- Deux jours après l'inoculation (~ 48 heures), effectuer un changement de milieu à 50% en utilisant milieu de différenciation agsNSC et grands embouts de pipette orifice.
7. Entretien des neurones
- Préparer le milieu d'entretien neuronale utilisant NeuraLife, la glutamine et B27 selon les instructions. Milieu d'entretien neuronale devrait être préparée par semaine.
- Deux jours après le dernier changement de différenciation agsNSC moyen, normalement Jour 4 après l'inoculation, effectuer un remplacement moyen de 50% en utilisant un milieu d'entretien neuronale.
- Continuer à effectuer des remplacements moyenne de 50% en utilisant un milieu d'entretien neuronale tous les 2 à 3 jours. Processus neuronaux devrait apparaître dans quelques jours du passage à un milieu d'entretien neuronale. Les cellules doivent être utilisées dans les 3 semaines d'être transférés à un milieu d'entretien neuronale. Les neurones peuvent être identifiés en utilisant un nombre de marqueurs neuronaux disponibles commercialement. Les astrocytes sera également toujours être observées.
- Populations Culture expriment généralement un ratio supérieur à 40% des neurones au nombre total de cellules. L'utilisation des médias d'entretien des neurones autres que NeuraLife peut fournir des cellules inférieures qui ne regardent pas morphologiquement matures et peuvent ne pas survivre aussi longtemps dans la culture.
8. Les résultats représentatifs:
L'Arctique spermophile cellules souches neurales adultes continuera à doubler tous les 24 heures pendant 3 à 5 jours pour au moins deux passages où ensemencées à 500,000-600,000 flacon cells/75mm. Ces cellules vont différencier facilement avec la suppression de basicFGF et B27 et la présence de FBS 1-2% et 1% insuline / Transferrine / sélénium, et deviendra TUJ1 (Covance) neurones positifs dans 14-21 jours (voir Figure 2). Le ratio des neurones aux cellules totale sera comprise entre 40-60%, dépendant de l'âge de la culture (figure 3). Les neurones peuvent être utilisés pour l'expérimentation de 12 jours après l'ensemencement à travers au moins 21 jours après le semis.
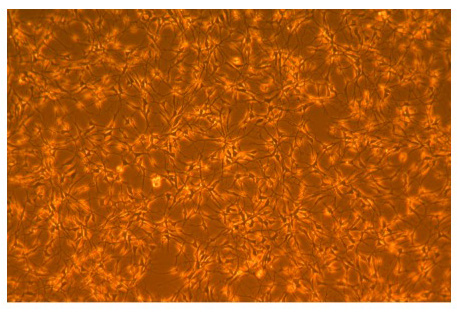
Figure 1. Microphotographie d'AGS pour adultes hippocampique cellules souches neurales.
Photomicrographie phase de l'AGS pour adultes hippocampique cellules souches neurales suivante 3 jours de croissance dans les médias agsNSC basale en poly-L-ornithine flacons enduits. Doubler survient environ toutes les 24 heures. Photo à un grossissement de 100x.
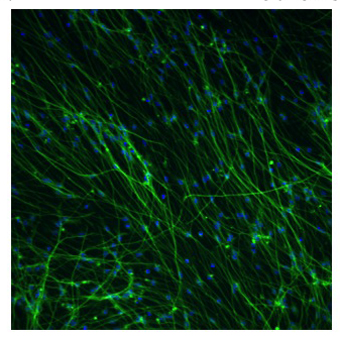
Figure 2. Fluorescent micrographie différenciés AGS adulte hippocampique cellules souches neurales
Cellules souches neurales AGS ont été soumis à des médias de différenciation pour 4 jours, puis maintenue dans Neuralife pour 17 jours de plus avant de fixer. Les cellules ont été fixées avec du paraformaldéhyde 4% et les neurones identifiés à l'aide TUJ1 anticorps primaire (Covance) et Alexa Fluor 568 anticorps secondaire (vert) d'Invitrogen. Colorant Hoechst 33343 a été ajouté pour colorer tous les noyaux (bleu). Le nombre de cellules, le nombre de neurones et le ratio de neurone ont été déterminés en utilisant le logiciel neurites et l'instrument de Arrayscan Cellomics. Cette photo représente environ 57% des neurones. Grossissement 10X
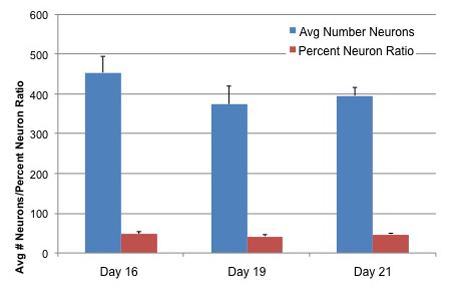
Figure 3. Nombres de neurones et des cellules Ratio Neuron AGS différenciés souches neurales moins troisles âges de la culture
Cellules souches neurales AGS ont été soumis à des médias de différenciation pour 4 jours, puis maintenue dans Neuralife pour les jours 12, 15 et 17 avant la fixation. Les cellules ont été fixées et les neurones identifiés avec TUJ1 anticorps primaire (Covance). Colorant Hoechst a été ajouté pour colorer tous les noyaux de cellules pour l'identification totale. Le nombre de cellules, le nombre de neurones et le ratio de neurone pour cent ont été déterminés en utilisant le logiciel neurites et l'instrument de Arrayscan Cellomics. Les valeurs représentent moyenne de 15 puits par condition + SD.
Exemple de tableau des calculs 1. Utilisé dans repiquage et le semis
- Utiliser 700 000 cellules / ml de suspension cellulaire
- En utilisant une densité cellulaire de 75 000 cellules / ml ou 15 000 cellules par puits de 0,2 ml de volume dans chaque puits.
- Inoculation 96 puits à raison de 0,2 ml par puits = 19,2 mL ou désiré volume final 21 ml.
- (Final Volume x concentration finale) ÷ concentration initiale = volume initial
(21 ml x 75 000 cellules / mL) ÷ 700 000 = 2,25 mL - Volume de FBS en suspension de cellules. = 2,25 mL 2,25 mL x 0,05 = 0,1125 ml
- Volume de FBS nécessaire dans 21 ml = 21 ml x 0,02 = 0,42 ml
- Volume de FBS à ajouter à milieu de différenciation = 0,42 ml - 0,1125 0,3075 ml = ml
- Le volume de milieu de différenciation = 21 ml - 2,25 ml de suspension cellulaire - 0,3075 ml 5% de FBS = 18,44 mL.
- Combinez 18,44 milieu de différenciation mL avec 0.308 FBS ml et ajouter 2,25 ml de suspension cellulaire.
Discussion
AGS cellules adultes souches neurales sont robustes et peuvent être étendues pour de nombreux passages qui en fait une excellente source de cellules souches neurales pour l'étude de la base neurale propriétés de cellules souches. Le taux d'expansion est d'environ un doublement tous les vingt-quatre heures, mais ces cellules doivent être repiquées avant d'atteindre la confluence, car le contact entre les cellules seront privilégier la différenciation d'astrocytes. Contactez-médiatisée de di...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par l'US Army Medical Research et le Commandement du matériel octroi # 05178001 et par NS041069-06 de l'Institut national des troubles neurologiques et des maladies. Nous remercions Joël Vonnahme des commentaires utiles sur le protocole.
matériels
| Name | Company | Catalog Number | Comments |
| agsNSC | Lifeline Cell Technology | FC-0004 | |
| agsNSC Expansion kit | Lifeline Cell Technology | LL-0008 | Alternative source for DMEM/F12, B27 and rhFGFb (www.invitrogen.com) |
| agsNSC differentiation kit | Lifeline Cell Technology | LL-0009 | Alternative source for DMEM/F12 and ITS-x (www.invitrogen.com) |
| NeuraLife maintenance media kit | Lifeline Cell Technology | LL-0012 | Alternative sources are NeuraBasal (LifeLine) or Neurobasal (in vitrogen), glutamine and B27 (www.invitrogen.com)Differentiated cells are maintained for up to 3 weeks in NeuroLife, but no more than 2 weeks in Neurobasal (www.invitrogen.com) |
| Micrometer (such as a Bright Line Counting Chamber) | Hausser Scientific | 1490 | http://www.hausserscientific.com/hausserbrightlinedirect.htm |
| Biocoat Poly-L-Lysine coated 96 well plates | BD Biosciences | 356516 | www.bdbiosciences.com |
| Large orifice pipette tips | Fisher Scientific | 02-707-141 | Avoids neuronal cell damage when pippetting. http://www.fishersci.com |
Références
- Barnes, B. M. Freeze avoidance in a mammal: body temperatures below 0 degree C in an Arctic hibernator. Science. 244, 1593-1595 (1989).
- Dave, K. R., Prado, R., Raval, A. P., Drew, K. L., Perez-Pinzon, M. A. The Arctic ground squirrel brain is resistant to injury from cardiac arrest during euthermia. Stroke. 37, 1261-1265 (2006).
- Dave, K. R. Protein kinase C epsilon activation delays neuronal depolarization during cardiac arrest in the euthermic arctic ground squirrel. J Neurochem. 110, 1170-1179 (2009).
- Ross, A. P., Christian, S. L., Zhao, H. W., Drew, K. L. Persistent tolerance to oxygen and nutrient deprivation and N-methyl-D-aspartate in cultured hippocampal slices from hibernating Arctic ground squirrel. J Cereb Blood Flow Metab. 26, 1148-1156 (2006).
- Christian, S. L. Arctic ground squirrel (Spermophilus parryii) hippocampal neurons tolerate prolonged oxygen-glucose deprivation and maintain baseline ERK1/2 and JNK activation despite drastic ATP loss. J Cereb Blood Flow Metab. 28, 1307-1319 (2008).
- Jin, K. Evidence for stroke-induced neurogenesis in the human brain. Proc Natl Acad Sci U S A. 103, 13198-13202 (2006).
- Maysami, S., Lan, J. Q., Minami, M., Simon, R. P. Proliferating progenitor cells: a required cellular element for induction of ischemic tolerance in the brain. J Cereb Blood Flow Metab. 28, 1104-1113 (2008).
- Sung, S. M. Hypoxia/reoxygenation stimulates proliferation through PKC-dependent activation of ERK and Akt in mouse neural progenitor cells. Neurochem Res. 32, 1932-1939 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J Neurosci Methods. 71, 143-155 (1997).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Mol Cell Neurosci. 8, 389-404 (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon