このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
粘着テープベースのサンプリングと蛍光の組み合わせその場でハイブリダイゼーションサルモネラ生鮮食品について
要約
このプロトコルは、急速な細胞全体の検出に続いてトマトや他の生鮮食品の表面のサンプリングのための簡単な粘着テープベースのアプローチを、説明してサルモネラ蛍光を使用してその場でハイブリダイゼーション(FISH)。
要約
このプロトコルは、 サルモネラの迅速なカルチャに依存しない検出のためのin situハイブリダイゼーション(FISH) でオンテープ蛍光続いてトマトや他の生鮮食品の表面の粘着テープベースのサンプリングのためのシンプルなアプローチを、説明します。セル充電されたテープは、検出前に固相濃縮のための選択寒天培地に直接フェースダウンに配置することができます。また、少量の液体富化(液面のminiculture)はフローサイトメトリーを経由してFISHと分析に続いて、非選択培養液中のテープの表面に行うことができます。開始するには、無菌の粘着テープが新鮮な農産物と接触させ、物理的にこれらの表面上に存在する微生物を抽出し、穏やかな圧力が適用され、テープが削除されます。テープは、顕微鏡用スライドガラスの上にまで粘着側にマウントされ、サンプリングされた細胞を、10ホルマリン%(30分)と段階的エタノールシリーズを用いて脱水(50、80、および95%、3分ごとの濃度)で固定されています。次に、細胞に帯電したテープは、 サルモネラをターゲットとしたDNAプローブのカクテルを含むバッファーでスポットし、15でハイブリダイズさせる- 55℃で30分間、非結合プローブを除去するための洗浄バッファーでリンス短いが続く。接着、FISH -標識細胞は、蛍光顕微鏡を使用して表示しているDNA色素4',6 -ジアミジノ-2 - フェニルインドール(DAPI)との結果で対比されています。固相濃縮するために、細胞に帯電したテープは、適当な選択寒天の表面に直接フェースダウン配置され、 サルモネラ microcoloniesのその場成長に許可するようにインキュベートし、上記のようFISHと顕微鏡が続きます。液面minicultureの場合は、セルに帯電したテープは、粘着面を上に配置され、シリコン灌流チャンバーが適用されているので、テープや顕微鏡のスライドの形防水チャンバー内の底部トリプチケースソイの小さい容積(≤500μL)ブロス(TSB)が導入されています。入口ポートは封印されており、チャンバーを35℃でインキュベートされる - 37 ° C、テープ抽出した微生物の増殖ベースの増幅を可能にする。インキュベーション後、入口ポートが開封され、細胞が分離し、混合精力的なバックで前後にピペッティング、遠心分離を介して収穫し、10%で固定されている中性緩衝ホルマリン。最後に、サンプルをハイブリダイズし、 サルモネラ属菌の存在を明らかにするためにフローサイトメトリーを介して検査されます。ここで説明したように、私たちの"テープ- FISH"のアプローチは、シンプルかつ迅速なサンプリングとトマトの表面のサルモネラの検出を提供することができます。我々はまた、ほうれん草とハラペーニョペッパーを含む生鮮食品の他のタイプを、サンプリングするためのこのアプローチを使用している。
プロトコル
1。滅菌粘着テープで表面のサンプリング
- サンプリングに使用するテープを選択します。市販のカビ - テープまたはCON -タクト - それはサンプリングのテープは、使いやすさのための滅菌と特別にパッケージされている。しかし、我々は、透明(光学的に透明な)一般的なオフィスのテープも使用できることを見出した。
- 粘着テープの10cmの部分(紙のテンプレートを使用することができる)の非粘着面に1cm 2の正方形を描画するための恒久的なマーカーを使用してください。これは、テープの一部が、食品または環境表面をサンプリングするために使用されている注目のための視覚的なガイドとして機能します。
- サンプリングする面に対向する粘着面とテープの"C"字型のループを形成。これを行うには、テープの背面に描かれた四角(非粘着面)(図1)に対して、親指と中指と位置と粘着末端の人差し指を保持する。
- サンプリングされる表面にテープを置き、軽く表面に対してマークされた領域を押してください。テープの端を放出することなく、テープの粘着面は気泡を避け、試料表面と完全に接触することを保証するために人差し指を使う。
- さらにモーションを使用して、徐々に物理的に表面結合微生物を抽出し、離れてサンプルからテープを引き出します。一般的な透過的なオフィスのテープを使用してガラスの顕微鏡スライド上に、セルチャージャーテープ、粘着面を固定します。フラット、非しわになりやすい面が作成されるよう、テープの適切なテンション/ストレッチングを確認してください。これは変形/ハイブリダイゼーションの間その後の加熱中にテープのカールの問題を最小限に抑えることができます。
2。固相濃縮および液面Miniculture
- 固体相の濃縮は、サンプリングされた細胞を寒天表面に直接接触して配置されるようにキシロース-リジン-タージトール4(XLT - 4)寒天プレート上に直接フェースダウンテープを置くことによって行われます。テープのテンプレート/サンプルの接触部は、寒天の表面とテープの一端が緩く濃縮に続く寒天表面からテープを簡単に除去を容易にするために、ペトリ皿の側壁に付着さと同じ高さに配置されます。
- プレートを反転(結露を避けるために)と35℃でインキュベートされる- 37℃のサルモネラの十分な成長を可能にする。検出可能なレベルに細胞を豊かにするために必要な潜伏期間の長さは初期のサルモネラ汚染レベルに依存します。我々は8時間の濃縮後に低い初期接種から優れた微小コロニー形成を観察した。
- 希望の濃縮期間の後、寒天プレートを開きます。テープは、インキュベーション中に、その粘着性を保持します。ゆっくりとテープ寒天界面に形成microcoloniesの最大回収を確実にするために人差し指を使って寒天に対してテープを押してください。ペトリ皿の壁に取り付けられた端からテープをつかみ、ゆっくりと、さらに動きでそれを削除してください。上記のセクション1.5で説明したように顕微鏡スライド上に細胞チャージャーテープ、最大粘着面を、マウントします。以下"固定と脱水"の手順に進みます。
- 液面minicultureの場合、上記のセクション1.5で説明したように顕微鏡スライド上にサンプリングに使用されるテープを固定することから始めます。次に、底部上を向いて、細胞に帯電したテープから構成されている密封されたチャンバを形成する非無菌シリコン灌流チャンバー(Coverwell、グレースバイオ研究所、(株))とテープのテンプレート化/サンプルの接触部を、カバーしています。しっかりと、かつ慎重に防水シールを確保するためにチャンバーを押してください。
- 柔軟なゲルローディングピペットチップ、室の小さな入口ポートのいずれかを経由して転送≤500μLトリプチケースソイブロスまたは他の適切な増菌培地を使用する。 35 -37で蒸発し、インキュベートするスライドを防ぐために透明なオフィステープで両方のポートを密封° Cに十分な濃縮のために必要に応じて。すべての操作が良好なサンプリングと処理の慣行にしたがって行われるべきですが、ポートシールテープまたは灌流室の無菌性は、液面のminiculture時に必須ではありません。 FISHとフローサイトメトリーの組み合わせは、 サルモネラ属の明確な差別が可能になります。サンプル自体から来ると予想非標的植物の最大の貢献と、存在する可能性がある非標的細菌から。以下"固定と脱水"の手順に進みます。
3。固定と脱水
- 直接表面のサンプリング用やサルモネラの固相濃縮のための。 XLT - 4寒天上、25℃で30分間細胞を固定、テープの上で実行〜500μLをサンプルの接触面積をカバーすることによりC 10%中性緩衝化ホルマリン。
- 密閉式容器内に固定液を捨て(化学フードの下毒性/刺激性の蒸気への曝露を最小限にするため)。
- エタノール系列で脱水し(50%、80%、95%、300μL/ 3分ごとに濃度)。下記の"ハイブリダイゼーション"の手順に進みます。
- 500μLの液面のminicultureのサンプルの固定用の、潅流チャンバーが開封され、かつ柔軟なゲルローディングピペットチップはenrichateを抽出するために使用されます。上下に迅速なピペッティングが、残りのテープ結合細胞の効果的な除去を保証するために使用されます。
- 次に、全体の500μLminiculture量は微量遠心チューブに移し、2,000 × gで(5分)でスピンダウンしています。上清は廃棄され、ペレットは、10%の等量に再懸濁し、30〜60秒間激しくボルテックスれる中性緩衝ホルマリン。細胞を25℃で30分のために固定されています
- 次に、固定液が除去され、サンプルは次のように、細胞の保存バッファーに再懸濁する。 60秒、50%非変性エタノール50%の等量に再懸濁し、リン酸 - サンプルは、2,000 × gで(5分、25℃)上清を捨てている、ペレットを30を激しくボルテックスしている時にスピンダウンしている緩衝生理食塩水。固定された細胞は-20℃で(年間)無期限に保存することができます注意:液体が(例えば、固定液または別のバッファを導入する際に)変更されるたびに、それは(ボルテックスで)完全に再懸濁させることが重要である最小限の部分(〜10から20μL)で細胞ペレット"発信"液体のシステムの。これは、凝集を防止し、個々のセルの偶数濁液が得られることを確認するのに役立ちます。下記の"ハイブリダイゼーション"の手順に進みます。
4。交配
- 材料表に記載されている商用分子生物学グレードのソリューションを用いてハイブリダイゼーション/洗浄バッファーを準備します。最後のバッファ成分の濃度は、0.7MのNaCl、0.1 Mトリスは[pHを8.0]、10mMのEDTA、0.1%ドデシル硫酸ナトリウムは、分子のグレードの水と最終的な目的のボリュームに構成し、0.22μmのシリンジやカップのフィルターを使用してフィルタリングされます。プローブを添加していない同一のバッファは、(下記参照)、洗浄バッファーとして使用されます。 〜55の予熱ハイブリダイゼーションおよび洗浄バッファー℃の
- 蛍光標識追加Sal3(Nordentoft ら、1997;。5' - AAT CAC TTC ACC TAC GTG - 3')とザルム- 63(クッターら、2006;。5' - TCG ACT GAC TTC AGC TCC - 3'予熱したハイブリダイゼーションバッファーに)オリゴヌクレオチドプローブ(材料表)。 5 ngのμL-1の合計プローブ濃度は、(;碧砂とブレーム-ステッチャー、2009A 2.5 ngのμL-1各プローブなど)が使用されます。
- 直接テープへと固相濃縮サンプルについては、プローブのカクテルを含むハイブリダイゼーション緩衝液300μlでテープのテンプレート化サンプルの接触面積をオーバーレイし、55℃に設定されて湿った、密封されたインキュベーションチャンバーにテープ結合細胞をハイブリダイズスライドモート機器(材料表)などの直接接触インキュベーターが使用されている場合、サンプルは15分間ハイブリダイズされ、> 20枚のスライドを同時に処理することができます。このようなバンビーノ機器(材料表)のような回転式のハイブリダイゼーションオーブンを使用している場合、スライドはハイブリダイゼーション用の50 mLのポリプロピレン遠心チューブ、チューブごとにスライドに配置されます。熱伝達が直接ではないため、これらのサンプルは、より長い期間(最長30分)にハイブリダイズさせる。
- ハイブリダイゼーション後、スライドが削除され、プローブを含むハイブリダイゼーションバッファーのオーバーレイは破棄されます。スライドは、予熱した洗浄バッファのオーバーレイまたはいずれかとし(最大30分)のどちらか簡潔に、ゆっくりと傾斜スライド(300μL、それぞれの3リンス)を介してバッファの小さなボリュームをピペッティングすることにより予熱洗浄バッファーですすぎ、または正式に洗浄しています予熱した洗浄バッファーを含む50 mLポリプロピレン製遠心チューブに浸漬。我々の経験では、正式な洗浄が改善された結果を(非連結プローブから以下ヘイズ)を提供しますが、簡単なリンスはサルモネラ属の明確な検出に適しています。次に、スライドの下に"検出"のステップに移る前に空気乾燥する。
- 液面のminicultureサンプルのハイブリダイゼーションは、積極的なペレットのボルテックスとを含む100μL予熱したハイブリダイゼーションバッファーに再懸濁し、続いて2000 × gで5分間(-20℃でたての固定または記憶バッファに保持されている)サンプルをスピンダウンして実行されます。プローブのカクテル。サンプルは55℃でハイブリダイズしている500℃μL予熱した洗浄バッファーを添加し、続いてヒートブロックまたは他の適切なインキュベーションの駅(材料表)、上で30分間。テープバウンドサンプルと同様に、これらのサンプルは、正式に断続的にボルテックスしながら55℃でさらに培養して30 minでこの洗浄バッファーでC、にのためにまで洗浄することができる。また、サンプルは徹底的に分析するための即時の収穫(下)に続いて、500μL予熱した洗浄緩衝液の添加後ボルテックスすることができます。
- サルモネラ属菌を検出するための準備に。フローサイトメトリーを経由して、液面のminicultureのサンプルは5分2,000 xgでスピンダウンしている、上清を捨て、サンプルは300μL室温に再懸濁している(〜25℃)PBS。サンプルは遠い施設への輸送が必要な場合は遅延がハイブリダイゼーションと解析との間で期待されている場合、または、サンプルは前のANAに冷蔵または氷の上で開催することができる溶解。また、サンプルは、細胞の保存バッファー(PBSと無水エタノールの50:50混合物)に転送し、でかなりの損失のない週までは-20℃で保持することができるプローブ与え蛍光(碧砂とブレーム - ステッチャー、2009B) 。
5。検出
- サルモネラ属の上にテープを検出するため。蛍光顕微鏡を介して、テープに直接または固相濃縮サンプルは、核の対比4を含む〜10μLVectashield H - 1200封入剤'、6 - ジアミジノ-2 - フェニルインドール(DAPI)、カバースリップをマウントした、と重ねてその後、10分間暗所でインキュベートした。
- 液浸油は、カバースリップ上に配置され、そしてサンプルは、高倍率の油浸対物(63xまたは100倍)を用いて検討されています。 DAPIフィルターが焦点に試料をもたらすために使用されている、顕微鏡は、適切なフィルターに切り替えられます(緑または赤、エンドラベルプローブするために使用される染料に応じて)およびサルモネラの細胞は、それらの蛍光(図にしたがって視覚的に採点されます2と3)。
- 液面のminicultureサンプルのサイトメトリー検出のために、様々な楽器がローカル可用性に応じて、使用することができます。私たちの研究室では、PBSに懸濁した検体を5 mLの丸底サンプリングチューブ(BDファルコン)に移し、647 nmの(材料表)で励起したFACSCantoフローサイトメーターを用いて検討している。合計細菌の高い数字を含む豊かなサンプルについては、"低流量"の設定は(10μL分-1)が使用されますと5,000-50,000イベントが収集されます。データはFlowJoソフトウェア(バージョン8.8.6、ツリースター社、オレゴン州アッシュランド)または他の適切な解析ソフトウェア(図4、パネルAおよびB)を用いて分析されています。
6。代表的な結果
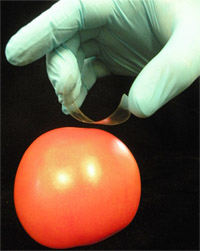
図1。 サルモネラ属菌のサンプリングのために粘着テープを使用してください。人為的に汚染されたトマトの表面から。

図2。直接テープへのサンプリングとトマトの表面(100 Xの油浸対物)からネズミチフス菌 ATCC 14028の魚群探知のための典型的な結果。テキサスレッドでラベルされたプローブ(Sal3/Salm-63)の2プローブのカクテルが使用されたこれらの細胞を標識する。

図3。キシロースリジンタージトール- 4(XLT - 4)37℃8時間のオンテープ濃縮℃、後の寒天の表面に形成されたネズミチフス菌 ATCC 14028のMicrocoloniesは初期接種は人工的に汚染されたトマトの表面から採取した。固相濃縮、検出のために利用可能な細胞数が増加し、また、細胞rRNAの内容を向上させます。

図4。 S.のサンプリングのための粘着テープの使用FISHとフローサイトメトリー(パネル)を介して、または500μLのトリプチケースソイブロス(パネルBで満たされた灌流チャンバ内で5時間の非選択的液面minicultureの濃縮後に直接分析に続いて人工的に汚染されたトマトの表面からenterica血清型ネズミチフス菌、 )。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
農産物表面の病原体の検出のための簡単かつ迅速な方法は、タイムリーで実用的なデータを提供することにより、食品媒介疾患の軽減に役立つことがあります。粘着テープベースのサンプリング方法は1950年代から、環境への臨床的および食品微生物学で使用され、直接顕微鏡検査またはのための固体培地に付着した微生物の移転に続いて、微生物の除去のために表面に"スコッチ"...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
この作業のための資金はBFBSに成長アイオワ値基金賞によって提供されていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Fungi-Tape sampling tape | Scientific Device Laboratory | 745 | http://www.scientificdevice.com/ |
| Con-Tact-It sampling tape | Birko Corporation, Denver, CO | http://www.birkocorp.com/ | |
| Clear office tape, generic | Various | Should be optically clear, have low intrinsic fluorescence | |
| Food surface | Local Grocery Store | Tomat–s (red tomat–s on the vine, not waxed or oiled) used here | |
| Trypticase Soy Broth | Difco Laboratories | 211768 | For non-selective liquid surface miniculture enrichment |
| Xylose-lysine-Tergitol 4 agar base | Difco Laboratories | 223420 | For Salmonella-selective agar (XLT-4) |
| Xylose-lysine-Tergitol 4 agar supplement | Difco Laboratories | 235310 | For Salmonella-selective agar (XLT-4) |
| Formalin solution | Sigma-Aldrich | HT5011 | 10% solution, neutral, buffered (cell fixative) |
| Absolute ethanol | Sigma-Aldrich | E7023 | Molecular biology grade (pre-hybridization dehydration) |
| 1.5 ml microcentrifuge tubes | Various | RNase- and DNase-free | |
| Microscope slides and cover slips | Thermo Fisher Scientific, Inc. | ||
| NaCl solution | Sigma-Aldrich | S5150 | Molecular biology grade, 5M solution (hybridization buffer component) |
| Tris-EDTA buffer solution (100X concentrate) | Sigma-Aldrich | T9285 | 1M Tris [pH 8.0], 0.1M EDTA (hybridization buffer component) |
| Sodium dodecyl sulfate solution | Sigma-Aldrich | L4522 | 10% solution in 18 megohm water (hybridization buffer component) |
| Sal3 and Salm-63 oligonucleotide probes | Integrated DNA Technologies | 5’-labeled with 6-carboxyfluorescein (FAM) or Texas Red (for microscopy) or Cy5 (for cytometry), HPLC-purified | |
| Variable speed microcentrifuge | Various | Use rotor diameter to calculate RPM needed for RCF values described in protocol | |
| CoverWell perfusion chamber | Grace Bio-Lab Inc. | PC1R-2.0 | Non-sterile |
| Gel loading pipette tips (FS MultiFlex) | Thermo Fisher Scientific, Inc. | 05-408-151 | Long, thin tips for easy access to small sampling ports and maneuverability within chamber |
| Aluminum heat block or precision-controlled heating station | Various | Eppendorf Thermomixer R dry block heating and cooling shaker used here | |
| Bambino mini hybridization oven | Boekel Scientific | Model 230300 | Slides are placed in 50 ml polypropylene centrifuge tubes for hybridization, heat transfer not direct |
| Slide Moat slide hybridizer | Boekel Scientific | Model 240000 | Provides rapid, direct transmission of heat through glass slide |
| Vectashield H-1200 mounting medium with 4’,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-1200 | Minimizes quenching of fluorescence during microscopy, provides DAPI counterstain |
| Fluorescence microscope | Various | Leitz Laborlux S used here | |
| Digital camera | Various | Canon PowerShot A640 camera used here | |
| Image acquisition software | Various | Axiovision software v. 4.6 (Carl Zeiss) used | |
| Adobe Photoshop | Adobe | For minimal processing of images (overlay of images taken in different channels) | |
| Flow cytometer | Various | FACSCanto flow cytometer (BD Biosciences, San Jose, CA) with red (647 nm) excitation used | |
| Flow cytometry analysis software | Various | FlowJo software v. 8.7.1 (Tree Star, Inc.) used |
参考文献
- Almeida, C., Azevedo, N. F., Fernandes, R. M., Keevil, C. W., Vieira, M. J. Fluorescence in situ hybridization method using a peptide nucleic acid probe for the identification of Salmonella spp. in a broad spectrum of samples. Appl. Environ. Microbiol. 76, 4476-4485 (2010).
- Barnetson, R. S., Milne, L. J. R. Skin sampling for Candida with adhesive tape. Br. J. Dermatol. 88, 487-491 (1973).
- Bisha, B., Brehm-Stecher, B. F. Simple adhesive-tape-based sampling of tomato surfaces combined with rapid fluorescence in situ hybridization for Salmonella detection. Appl. Environ. Microbiol. 75, 1450-1455 Forthcoming.
- Bisha, B., Brehm-Stecher, B. F. Flow-through imaging cytometry for characterization of Salmonella subpopulations in alfalfa sprouts, a microbiologically complex food system. Biotechnol. J. 4, 880-887 (2009).
- Edwards, R. W., Hartman, E. A simple technique for collecting fungus specimens from infected surfaces. Lloydia. 15, 39-39 (1952).
- Evancho, G. M., Sveum, W. H., Moberg, L. J., Frank, J. F. Microbiological monitoring of the food processing environment. Compendium of Methods for the Microbiological Examination of Foods. Pouch Downes, F., Ito, K. , 4th edition, American Public Health Association. Washington, D.C. (2001).
- Fung, D. Y. C., Lee, C. Y., Kastner, C. L. Adhesive tape method for estimating microbial load on meat surfaces. J. Food. Prot. 43, 295-297 (1980).
- Kutter, S., Hartmann, A., Schmid, M. Colonization of barley (Hordeum vulgare) with Salmonella enterica and Listeria spp. FEMS Microbiol. Ecol. 56, 262-271 (2006).
- La Cono, V., Urz, C. Fluorescent in situ hybridization applied on samples taken with adhesive tape strips. J. Microbiol. Meth. 55, 65-71 (2003).
- Lakshmanan, C., Schaffner, D. W. Understanding and controlling microbiological contamination of beverage dispensers in university foodservice operations. Food Prot. Trends. 26, 27-31 (2005).
- Langvad, F. A simple and rapid method for qualitative and quantitative study of the fungal flora of leaves. Can. J. Microbiol. 26, 666-670 (1980).
- Nordentoft, S., Christensen, H., Wegener, H. C. Evaluation of a fluorescence-labelled oligonucleotide probe targeting 23S rRNA for in situ detection of Salmonella serovars in paraffin-embedded tissue sections and their rapid identification in bacterial smears. J. Clin. Microbiol. 35, 2642-2648 (1997).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved