このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
遺伝子デリバリーの患者の組織及び審査のex vivoでの文化
要約
この記事では、遺伝子デリバリー研究やIVISの生物発光イメージング法を用いて遺伝子発現のその後の分析のための患者の組織切片の文化を説明します。
要約
このビデオでは、遺伝子デリバリーの研究のためのex vivoでのモデルのような患者組織の使用について説明します。手術時に得られた新鮮な患者の組織を培養にスライスされ、維持されます。 ex vivoのモデルシステムは、そのまま患者の組織や遺伝子発現に遺伝子の物理的な配信を可能にIVIS検出システムを用いて生物発光イメージングにより解析される。生物発光検出システムは、組織の犠牲を必要とせず、個々のスライス内の遺伝子発現の迅速かつ正確な定量化を示しています。このスライスの組織培養系は、正常および悪性組織を含む組織のさまざまなタイプが使用され、私たちは無傷の組織の均質性と個々の患者間の変化度の高い効果を研究することができますすることができます。このモデルシステムは、動物モデルに代わるものとして、臨床試験に入る前に補完的な臨床モードなど、特定の状況で使用することができる。
プロトコル
メディアと試薬の調製
- 抗生物質溶液
リン酸塩は、200 U / mlペニシリン、200μg/ mlのストレプトマイシン、5μg/ mlのfungizoneで緩衝食塩水(PBS) - コレクションと治療培地
200 U / mlペニシリンとダルベッコ改変イーグル培地(DMEM)、200μg/ mlのストレプトマイシン、5μg/ mlのfungizone - 培地
10%熱不活性化ウシ胎児血清を含むコレクションの培地
I.組織の収集と保管
患者組織採取のための承認は、コルクの教育病院の臨床研究倫理委員会から入手したものとインフォームドコンセントは、患者の手術前日から入手した。肝臓の組織は、悪性疾患に対する部分肝切除を受けた患者から得た。
- 新鮮な患者組織は、外科的切除の時点で得られる。
- 組織は、4℃(組織が生存率の有意な損失なしで最大12時間冷蔵保存されることがあります、しかし、即時処理が推奨されています)で、コレクションのメディアに格納されています。
II。組織切片の調製と文化
スライスは、ビブラトーム(ライカ、ドイツ)を用いて行った。組織スライスシステムは、製造業者の指示に従って使用されていました。組織のスライス標本を70%2 - プロパノールで洗浄器具を使用して無菌フードの下で行われた。スライス厚が2000ミクロンに設定し、22〜26 rpmで往復刃を使用してカットされます。
- 組織は、抗生物質溶液で3回洗浄する。
- 組織は、非毒性接着剤(Dermabond)を使用して、取り付けの段階に添付されます。
- スライス厚が設定され、スライスは、22〜26 rpmで達成されます。
- スライスは37 6ウェル培養皿(ウェルあたりつのスライス)の培養培地中で加湿環境で、5%CO 2とCに保持されます。
III。組織切片への遺伝子デリバリー
- スライスは2時間℃で治療前に37℃でプレインキュベートされています。
- 培養液は、治療の培地に置き換えられます。
- スライスは、直接ウイルスベクター(ウイルス粒子Ad5.CMVluc [1 × 10 9]25μlの)で注入されています。また、粒子は、受動的注入のために、培地に添加してもよい。
- インキュベーションの2時間後、血清を培地に添加される。
IV。生物発光分析による遺伝子発現の解析
- スライスは、ルシフェリン基質を100μl(3 mg / ml)を注射する。
- 6ウェル培養皿は、ステージ上に配置し、10分間インキュベートする。
- スライスは、高感度(図1)で5分間撮像される。
V.代表の結果
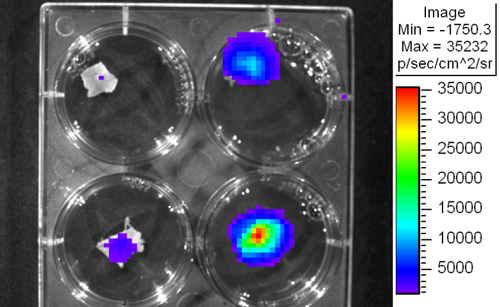
図1。IVISの検出システムを用いて患者の肝臓のスライスの生物発光イメージング。
ディスカッション
我々は、 生体外での患者の組織培養法と非固定のヒト組織内遺伝子送達の評価のための生物発光検出システムを説明します。方法は、培養組織スライスのシンプルかつ再現可能な方法を提供しています。それは、悪性組織を含めてヒト組織の様々に無傷のヒト組織への遺伝子デリバリーの研究、遺伝子送達の解析を可能にし、敬意を持つ個々の患者の間で変動度の高い効果に関する重...
開示事項
謝辞
この作品は、コーク南診療所ビクトリア大学病院乳ファンド、アイルランド癌協会(CRI07TAN)とコークがん研究センターで賄われていた。 CMVプロモーターの転写制御下で複製無能な組換えアデノウイルス5粒子が教授アンドリューベイカー、グラスゴー大学から親切な贈り物だった。
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma-Aldrich | D6429 | |
| PBS | Sigma-Aldrich | D8537 | |
| Firefly Luciferin | Biosynth International, Inc | ||
| Dermabond | Johnson & Johnson | ||
| Vibrotome | Leica Microsystems | VT 1000 A |
参考文献
- van de Bovenkamp, M., Groothuis, G. M., Draaisma, A. L., Merema, M. T., Bezuijen, J. I., van Gils, M. J. Precision-cut liver slices as a new model to study toxicity-induced hepatic stellate cell activation in a physiologic milieu. Toxicol Sci. 85, 632-638 (2005).
- Speirs, V., Green, A. R., Walton, D. S., Kerin, M. J., Fox, J. N., Carleton, P. J. Short-term primary culture of epithelial cells derived from human breast tumours. Br J Cancer. 78, 1421-1429 (1998).
- Kirby, T. O., Rivera, A., Rein, D., Wang, M., Ulasov, I., Breidenbach, M. A novel ex vivo model system for evaluation of conditionally replicative adenoviruses therapeutic efficacy and toxicity. Clin Cancer Res. 10, 8697-8703 (2004).
- Josserand, V., Texier-Nogues, I., Huber, P., Favrot, M. C., Coll, J. L. Non-invasive in vivo optical imaging of the lacZ and luc gene expression in mice. Gene Ther. 14, 1587-1593 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved