このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
β-グルクロニダーゼ(GUS)に基づく細胞死アッセイ
要約
一般的にこのようなDNAラダーやTUNELアッセイのような哺乳類のシステムで使用されるプログラム細胞死のアッセイは、しばしば植物に再現することは困難です。 GUSレポーターシステムと組み合わせることで、我々は特定の遺伝子の潜在的な死の特性を解析するために迅速、植物ベースのトランジェントアッセイを提案する。
要約
我々は、同時に細胞死の推定正または負の調節で、レポーター遺伝子、β-グルクロニダーゼ(GUS)を発現する新規の一時的な植物発現システムを開発した。このシステムでは、N. benthamianaの葉を分析する遺伝子を含む35S駆動発現カセットと同じ場所に浸潤、およびGUSベクターpCAMBIA 2301車両としてアグロバクテリウム株LBA4404を使用しています。生きている細胞が発生するGUSの発現に必要とされているため、このマーカー遺伝子は、細胞死の正の調節因子と共発現されると、GUS活性の損失が予想されます。同様に、GUS活性は、抗アポトーシス遺伝子をベクターコントロールと比較して使用する場合に観察される増加した。以下に示すように、我々が正常にプロと抗死のプレーヤーの両方を分析するために私たちのラボでこの制度を利用しています。これらは、植物の抗アポトーシスBcl - 2の関連athanoGene(BAG)家族だけでなく、そのようなBAXのような細胞死の既知の哺乳類の誘導を、含まれています。さらに、我々はこれらのタンパク質の可能な翻訳後修飾/アクティベーションについての手がかりを提供することができるタンパク質内の特定の切り捨て、の死の機能を解析するためにこの制度を利用しています。ここで、我々は、特定の遺伝子の死の機能を検討する上で最初のステップとして、迅速かつ高感度の植物ベースの手法を提案する。
プロトコル
タバコbenthamiana植物は25℃での温度制御成長チャンバーで栽培されています。 3月6日週令の植物の完全に展開された健康な葉が使用されます。
ヒント:より良い結果が新たに出現した葉を使用して得られる
1。アグロバクテリウム一時的な浸透のプロトコル:
日1
- 細胞死のために、アッセイする遺伝子(群)とを含むベクターを用いて適切なベクターを含むアグロバクテリウムツメファシエンス(LBA4404株)のグリセロールストックを持つストリークLB /リファンピシン(25μg/ mlの)/カナマイシン(100μg/ ml)を寒天プレート構成的プロモーターの下でGUSカセット。常にネガティブコントロールとして空のベクターコントロールが含まれています。
- 28℃で2日間インキュベートする。
日3
- 以前に縞各LB /リファンピシン/カナマイシンプレートから単一コロニーとリファンピシン(25μg/ mlの)とカナマイシン(100μg/ ml)を含むLB 2 mlを接種する。
- 最大成長の密度に達するまで、200rpmで24時間28℃で振盪することにより、各培養液を、。
ヒント:クランピングは、時々ケースの文化は徹底的に進める前に(ピペッティングすなわち)再懸する必要があるで、観察される。
日4
- インキュベーションの後、新鮮なLB(適切な抗生物質を含む)とアセトシリンゴン(最終濃度25μM)で10 mLまでの総容積を増加させる。
- 別の16時間28℃で振盪することにより、各培養液を、。
日5
- 翌日は、室温で10分間4000 × gで(アセトシリンゴンを追加しない)浸潤の培地(10 mMのMgSO 4を 7H 2 O、9mmのMES、pHは5.6)と遠心分離を10 mlを加えることによって二度、それぞれの文化を洗う。
- 最後の遠心分離工程の後に、アセトシリンゴン(100μM)を含む5mlの浸透培地中でそれぞれの文化を再懸濁します。
- OD 600nmのを測定し、0.1と0.9の間で測定値が許容範囲です。
ヒント:0.1と低いのOD 600nmのは問題もなく使用されている、しかし、より高いODSは、より一貫性のある結果を生むかもしれません。 - 感染症のためのアグロバクテリウム培養液を準備するより3時間培養をインキュベートする。
- 分析する遺伝子(群)とGUSカセットを含む培養と1:1の比率で、ネガティブコントロール(アグロバクテリウムは、空のベクターを含む)を含む混合培養。
- 1mlの無針注射器(図1)を使用して新興の葉の背軸(下)側に潜入。
ヒント:ネガティブコントロールの混合物(空のベクトル+ GUSカセット)と同じ植物の反対側の葉の上に(遺伝子X + GUSカセット)、アッセイする遺伝子を含有する混合物の両方に潜入。それぞれの治療のために三重工場を使用してください。 - 3日後の浸潤の消費税は、GUS蛋白質の発現のために葉やアッセイに潜入。
2。組織化学的GUSアッセイ
日8
- 切除した葉にX - gluc基板媒体に潜入掃除機。
- 室温で一晩、または個別の青色染色が表示されるまで、暗闇の中でインキュベートする。
日9
- 蒸留水ですすいでください。
- クロロフィルが削除されるまで、再び蒸留水に転送し、70%エタノールでインキュベートする。視覚的にGUSの発現レベルを評価する。
3。蛍光MUGアッセイ:
日8
- 液体窒素を使用して、すり鉢で浸透した葉ディスクを粉砕することにより総タンパク質を分離します。 GUS抽出バッファー(50mMのNAPI液(pH7.0)、10mMのEDTA、0.1%トリトンX - 100、0.1%N -ラウロイルサルコシンナトリウム塩、β-メルカプトエタノール(0.7μL/ ml)を氷上でサンプルを保ちながらの100μLのを追加。
- 4℃で5分間、14,000 gでサスペンションを遠心し、全可溶性タンパク質として上清を取る。
- 製造元の指示に従って光度計を使用して濃度を測定します。
- GUS抽出バッファーを使用して、各サンプルの総可溶性タンパク質100μgのためにタンパク質の濃度を調整します。
- 2 mMの最終濃度にGUS抽出緩衝液中で調製MUG基板(4 - メチルウンベリフェリル-β- D -グルクロニド三水和物)を追加します。サンプルあたり100μL(タンパク質+マグの基板)の合計量は十分なはずです。
- 37℃で1時間反応をインキュベート℃に
- GUSストップバッファー(0.2 M Na 2 CO 3)を800μlを添加して反応を停止します。
- 蛍光が365 nmと455 nmの発光波長の励起波長でプレートリーダーを使用してMU標準曲線に値を比較測定します。蛋白質/分nmolのMU /μgの全可溶性としてGUS活性のレベルを報告する。
4。株式とソリューション:
- アセトシリンゴン(1 M)株式(FW = 196.2グラム) - DMSO 5mL中0.981グラム
- カナマイシン(100 mg / ml)を株式には、 -のdH 2 0で準備する-フィルター滅菌
- リファンピシン(25 mg / ml)の株価は - DMSOで準備
- ルリア - ベルターニ(LB)液体増殖培地:(1L)
1%(w / v)のバクト - トリプトン、10gの
0.5%(w / v)のバクト酵母エキス、5gの
170 mM塩化ナトリウム10グラム
pHは - 7 - アセトシリンゴン(25μM)を1mlの最終容量の1Mストックの=25μlの
- 浸透ミディアム:(1L)
10mMのMgSO 4を 0.7のdH 2 0(FW = 246.48グラム)、2.4648グラム
9mmのMES(FW = 213.25グラム)、1.91925グラム
pH値 - 5.6 - アセトシリンゴン(100μM)を1mlの最終容量の1M株式=100μlの
- GUS抽出バッファー
50mMのNAPI液(pH7.0)、10mMのEDTA、0.1%トリトンX - 100、0.1%N -ラウロイルサルコシンナトリウム塩、β-メルカプトエタノール(0.7μL/ ml)を - 2倍のリン酸緩衝液
0.2MのNaH 2 PO 4、0.2 MのNa 2 HPO 4 pHを7 - X - Gluc基質溶液
0.1mlのメタノール5 - ブロモ-4 - クロロ-3 - インドリルBD -グルクロニド(X - Gluc)1mgを溶解する。 、20μlの0.1Mフェリシアン化カリウム、10μlのトリトンX - 100を10%、蒸留水850μlを1ミリリットル2倍のリン酸緩衝液を追加します。
5。代表的な結果:
細胞死が発生したときに、このプロトコルに続いて、GUSの発現の消失が期待されている。我々は同時にCYTO -保護シロイヌナズナのBcl - 2関連athanoGene(BAG)ファミリーのメンバーを持つβ-グルクロニダーゼレポーター遺伝子、(GUS)を発現している。我々の共同浸潤N. benthamianaは、アグロバクテリウム LBA4404株を用いて35S駆動型BAGの発現カセットとGUSベクターをpCAMBIA 2301を残します。図2に示すように、GUS染色で可視増加は、この浸潤後に観察された。逆に、Bcl - 2ファミリーの既知のアポトーシスメンバーBAXが使用された時、GUS染色の著しい減少は、(図2)が観察された。どちらの場合でも、GUS発現は、コントロールに比べて目に見えて違っていた。しかし、表現の差は少ないが明らかであるときは、蛍光MUGアッセイは、GUS発現をquanitateに行うことができます。

図1。 Nの背軸側のアグロバクテリウムの混合物の浸透の例benthamianaは、1mlの無針注射器を使用して残します。
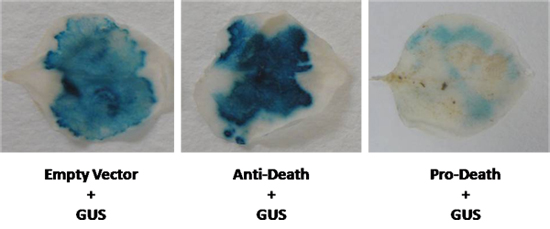
図2。 GUSのベクトルはNで共発現されたbenthamianaは抗死の遺伝子、および細胞死の既知の誘導剤で残します。 GUSのレベルは空のベクトル制御(GUSコントロール)と比較した。
ディスカッション
これは、哺乳類のシステムでは一般的な植物で細胞死の検出技術を使用することは困難です。 GUSレポーターシステムと組み合わせることで、我々は細胞死のプレイヤーの検出と解析のための植物ベースの、敏感な手法を提案する。このメソッドは、生きている細胞が発生するGUSの発現に必要であるという単純な事実を利用しています。意味のある結果と再現性を確保するためには、GUSのカ...
開示事項
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| リファンピシン | VWR | IC19549001 | DMSOに25mg/mLの株式 |
| 4' -ヒドロキシ-3'、5' -ジメトキシ(アセトシリンゴン) | VWR | TCD2666 | DMSOの0.981グラム/ mLの(1M株) |
| 2 - (4 - モルホリノ)エタンスルホン酸一水和物(MES) | VWR | EM - 6110 | 浸透培地1 Lを作るための水の1.92グラム/ L |
| バクトトリプトン | フィッシャー | BP1421 - 2 | LB培地1 Lを作るための水で10g / L |
| バクト酵母エキス | VWR | EM1.03753.0500 | LB培地1 Lを作るための水に5グラム/ L |
| ナトリウム塩化 | VWR | EM - 7710 | LB培地1 Lを作るための水で10g / L |
| ナトリウム一塩基性リン酸一水和物 | VWR | MK - 7868〜12 | バッファNAPIの50mmの作るための水に2.5グラム/ L |
| リン酸ナトリウム、二塩基七水和物 | VWR | EMD - SX0715 - 1 | バッファNAPIの50mmの作るための水に5グラム/ L |
| 硫酸マグネシウム七水和物 | VWR | EM - MX0070 - 1 | 浸透培地1 Lを作るための水では2.5 g / Lの |
| N -ラウロイルサルコシン | VWR | TCL0151 - 500G | GUS緩衝液で0.1%v / vの |
| 5 - ブロモ-4 - クロロ-3 - インドキシル-β- D -グルクロニドシクロヘキシル塩(X - gluc) | ゴールドのバイオテクノロジー | G1281C | メタノール100%の1mg/100uL |
| 4 - メチルウンベリフェリル-μ- D -グルクロニド水和物(MUG) | シグマ | M5664 | GUS抽出バッファー100μlの2 mMの |
| フェロシアン化カリウム三水和物 | VWR | EM - PX1460 - 1 | X - glucの基質溶液のための100mMの株式 |
| β-メチルウンベリフェロン(MU) | シグマアルドリッチ | M1381 | MU検量線の使用GUS抽出バッファー用 |
| ナトリウム炭酸 | VWR | EM - SX0395 - 11 | GUSストップバッファを作るための水に0.2 M |
参考文献
- Jefferson, R. A. GUS fusions: , β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J. 6, 3901-3901 (1987).
- Nishihara, M. Expression of the β-Glucuronidase Gene in Pollen of Lily (Lilium longiflorum), Tobacco (Nicotiana tabacum), Nicotiana rustica, and Peony (Paeonia lactiflora) by Particle Bombardment. Plant Physiol. 102, 357-357 (1993).
- Hodal, L. . Plant Science. 87, 115-115 (1992).
- Kabbage, M. The BAG proteins: a ubiquitous family of chaperone regulators. Cell Mol. Life Sci. . 65, 1390-1390 (2008).
- Kang, C. H. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants. Cell Death Differ. 13 (1), 84-84 (2006).
- Yan, J. . Plant Science. 165 (1), 1-1 (2006).
- Takayama, S., Reed, J. C. Molecular chaperone targeting and regulation by BAG family proteins. Nat Cell Biol. 3 (10), 237-237 (2001).
- Takayama, S. Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity. Cell. 80 (2), 279-279 (1995).
- Vitha, S. Quantitative β-glucuronidase assay in transgenic plants. Biol. Plant. 35, 151-151 (1993).
- Otha, S. Construction and Expression in Tobacco of a β-Glucuronidase (GUS) Reporter Gene Containing an Intron Within the Coding Sequence. Plant Cell Physiol. 31, 805-805 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved