Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un β-glucuronidase (GUS) dosage basé mort cellulaire
Dans cet article
Résumé
Programmé dosages mort cellulaire couramment utilisés dans les systèmes mammifères tels que l'ADN ou l'échelonnement des essais TUNEL, sont souvent difficiles à reproduire dans les plantes. En combinaison avec un système rapporteur GUS, nous proposons un rapide, usine de dosage basé transitoires pour analyser les propriétés de mort potentielle de gènes spécifiques.
Résumé
Nous avons développé un nouveau système d'expression transitoire plante qui exprime simultanément le gène rapporteur, β-glucuronidase (GUS), avec les régulateurs putatifs positifs ou négatifs de la mort cellulaire. Dans ce système, N. feuilles benthamiana sont co-infiltrée avec une cassette d'expression conduit 35S contenant le gène à analyser, et le vecteur de GUS pCAMBIA 2301 en utilisant la souche d'Agrobacterium LBA4404 comme un véhicule. Parce que les cellules vivantes sont nécessaires pour l'expression de GUS de se produire, la perte de l'activité GUS est attendue lors de ce gène marqueur est co-exprimé avec les régulateurs positifs de la mort cellulaire. De même, augmentation de l'activité GUS est observée lorsque gènes anti-apoptotiques sont utilisés par rapport à la lutte antivectorielle. Comme indiqué ci-dessous, nous avons utilisé avec succès ce système dans notre laboratoire pour analyser les deux joueurs pro et anti-mort. Il s'agit notamment de l'usine anti-apoptotique Bcl-2 Associated athanoGene (SAC) de la famille, ainsi que, connue des inducteurs de mort cellulaire chez les mammifères, tels que BAX. De plus, nous avons utilisé ce système pour analyser la fonction mort de troncatures spécifiques au sein des protéines, ce qui pourrait fournir des indices sur l'éventuelle modification post-traductionnelle / activation de ces protéines. Ici, nous présentons une méthode rapide et sensible des plantes basée, comme une première étape dans l'étude des fonctions mort de gènes spécifiques.
Protocole
Nicotiana benthamiana sont cultivés dans une chambre de croissance à température contrôlée à 25 ° C. Entièrement développé feuilles saines de 3-6 semaines vieilles plantes sont utilisées.
Astuce: De meilleurs résultats sont obtenus en utilisant des feuilles naissantes
1. Protocole de l'infiltration d'Agrobacterium transitoires:
Jour 1
- Plaques d'agar LB Streak / rifampicine (25 pg / ml) / kanamycine (100 ug / ml) avec des stocks de glycérol d'Agrobacterium tumefaciens (souche LBA 4404) contenant les vecteurs appropriés avec les gène (s) à doser pour la mort de la cellule et le vecteur contenant la cassette GUS sous un promoteur constitutif. Toujours inclure un contrôle vecteur vide comme contrôle négatif.
- Incuber à 28 ° C pendant 2 jours.
Jour 3
- Inoculer 2 ml de LB contenant de la rifampicine (25 ug / ml) et à la kanamycine (100 ug / ml) avec une seule colonie de chaque LB / rifampicine / kanamycine plaque préalablement striée.
- Incuber chaque culture en secouant à 28 ° C pendant 24 heures à 200 rpm jusqu'à la densité de croissance maximal est atteint.
Astuce: agglomérante est parfois observé, dans lequel les cultures de cas doivent être soigneusement remis en suspension (par exemple aspiration et refoulement) avant de procéder.
Jour 4
- Après incubation, augmenter le volume total à 10 mL avec LB frais (contenant les antibiotiques appropriés) et acétosyringone (concentration finale de 25 pM).
- Incuber chaque culture en secouant à 28 ° C pendant 16 heures.
Jour 5
- Le jour suivant, lavez chaque culture à deux reprises en ajoutant 10 ml (ne pas ajouter acétosyringone) moyen d'infiltration (10 mM MgSO 4 .7 H 2 O, 9 mM MES, pH 5,6) et centrifuger à 4000 xg pendant 10 min à température ambiante.
- Après l'étape de centrifugation finale, resuspendre chaque culture dans 5 ml contenant une infiltration moyenne acétosyringone (100 uM).
- Mesurer la 600nm OD, mesure entre 0,1 et 0,9 sont acceptables.
Astuce: OD 600nm d'aussi faible que 0,1 ont été utilisées sans problème, cependant, plus OD peut produire des résultats plus cohérents. - Incuber les cultures pour plus de 3 heures pour préparer les cultures de l'infection par Agrobacterium.
- Mélanger les cultures contenant le gène (s) pour être analysés et le contrôle négatif (tumefaciens contenant le vecteur vide) dans un rapport 1:1 avec la culture contenant la cassette GUS.
- Infiltrer la abaxiale (sous) côté du nouveau feuilles émergentes en utilisant un 1 ml sans aiguille de seringue (Fig. 1).
Astuce: infiltrer la fois le mélange contrôle négatif (vecteur vide + cassette GUS) et le mélange contenant le gène à doser (gène GUS x + cassette) sur les feuilles opposées de la même plante. Utiliser des plantes en triple pour chaque traitement. - 3 jours après l'infiltration d'accise infiltré feuilles et de dosage pour l'expression des protéines GUS.
2. Histochimiques GUS test
Jour 8
- Vide infiltrer le milieu substrat X-gluc dans les feuilles excisées.
- Incuber dans l'obscurité à température ambiante pendant une nuit ou jusqu'à coloration bleue apparaît distincte.
Jour 9
- Rincer à l'eau distillée.
- Incuber dans l'éthanol à 70% jusqu'à la chlorophylle est enlevé, puis transfert à l'eau distillée à nouveau. Visuellement évaluer les niveaux d'expression de GUS.
3. MUG test fluorométrique:
Jour 8
- Isoler des protéines totales par broyage disques foliaires infiltré dans un mortier à l'aide d'azote liquide. Ajouter 100 ul de tampon d'extraction GUS (50 mM pH 7,0 NaPi, EDTA 10 mM, 0,1% de Triton X-100, 0,1% de sel de sodium de N-lauroylsarcosine, β-mercaptoéthanol (0,7 ug / ml) tout en gardant l'échantillon sur la glace.
- Centrifuger la suspension à 14000 g pendant 5 min à 4 ° C et de prendre surnageant protéine soluble totale.
- Mesurer la concentration en utilisant un Nanodrop conformément aux instructions du fabricant.
- Ajuster la concentration de protéines pour 100 ug de protéines solubles totales pour chaque échantillon en utilisant un tampon d'extraction GUS.
- Ajouter un substrat MUG (4-méthyl-β-D-glucuronide trihydraté) préparé dans un tampon d'extraction GUS à une concentration finale de 2 mM. Un volume total de 100 ul par échantillon (protéines + substrat MUG) devrait être suffisant.
- Incuber les réactions pendant 1 heure à 37 ° C.
- Arrêtez réactions en ajoutant 800 ul de GUS butoir (0,2 M Na 2 CO 3).
- Mesure de fluorescence en utilisant un lecteur de plaques à une longueur d'onde d'excitation de 365 nm et longueur d'onde d'émission de 455 nm et comparer les valeurs d'une courbe de MU standard. Rapport du taux d'activité GUS en nmol MU / ug de protéines solubles totales / min.
4. Stocks et solutions:
- Acétosyringone (1 M) stock (FW = 196,2 g) - 0,981 g dans 5 ml de DMSO
- Kanamycine (100 mg / ml) de bouillon - préparer en DH 2 0 - stériliser par filtration
- La rifampicine (25 mg / ml) de bouillon - préparer dans le DMSO
- Luria-Bertani (LB) milieux de croissance liquide: (1L)
1% (p / v) bacto-tryptone, 10 g
0,5% (p / v) bacto-extrait de levure, 5 g
170 mM de chlorure de sodium 10 g
pH - 7 - Acétosyringone (25 uM) = 25 pi d'un stock de 1 M dans un volume final de 1 ml
- Moyen d'infiltration: (1L)
10 mM MgSO 4 0,7 dH 2 0 (FW = 246,48 g), 2,4648 g
9 mM MES (FW = 213,25 g), 1,91925 g
pH - 5,6 - Acétosyringone (100 pM) = 100 pi d'un stock 1M dans un volume final de 1 ml
- GUS tampon d'extraction
NaPi 50 mM pH 7,0, EDTA 10 mM, 0,1% de Triton X-100, 0,1% de sel de sodium de N-lauroylsarcosine, β-mercaptoéthanol (0,7 ug / ml) - Tampon phosphate 2x
0,2 M NaH 2 PO 4 et 0,2 M Na 2 HPO 4 pH 7 - Solution de substrat X-Gluc
Dissoudre 1 mg de 5-bromo-4-chloro-3-indolyl bD-glucuronide (X-Gluc) dans 0,1 ml de méthanol. Ajouter 1 ml de tampon phosphate de 2x, 20 de potassium 0,1 M ul ferricyanure, 10 ul Triton X-100 de 10% et 850 pl d'eau distillée.
5. Les résultats représentatifs:
Suite à ce protocole, la perte d'expression de GUS est attendue lors de la mort cellulaire survient. Nous avons simultanément exprimé le gène rapporteur, β-glucuronidase (GUS) avec un membre de l'Arabidopsis cyto-protectrice de Bcl-2 Associated athanoGene (SAC) de la famille. Nous avons co-infiltrées N. benthamiana laisse avec une cassette 35S SAC conduit expression et le vecteur de GUS pCAMBIA 2301 en utilisant la souche d'Agrobacterium LBA4404. Comme le montre la figure 2, une augmentation visible de la coloration GUS a été observée à la suite de cette infiltration. Inversement, lorsque l'connues pro-apoptotique de la famille Bcl-2 BAX a été utilisé, une réduction marquée de la coloration GUS a été observée (Fig. 2). Dans ces deux cas, l'expression de GUS était visiblement différent par rapport au témoin. Toutefois, lorsque la différence d'expression est moins évident, des dosages MUG fluorométrique peut être effectuée pour quanitate expression de GUS.

Figure 1. Exemple d'infiltration mélange d'Agrobacterium du côté abaxiale de N. benthamiana feuilles en utilisant un 1 ml sans aiguille de seringue.
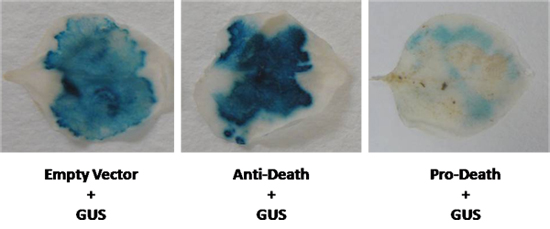
Figure 2. Un vecteur GUS a été co-exprimées dans N. benthamiana feuilles avec le gène anti-mort, et un inducteur connu de la mort cellulaire. Niveaux de GUS ont été comparés à un contrôle vecteur vide (GUS contrôle).
Discussion
Il est souvent difficile d'utiliser des techniques de détection dans la mort cellulaire des plantes qui sont courants dans les systèmes mammifères. En combinaison avec un système rapporteur GUS, nous présentons une base de plantes, méthode sensible pour la détection et l'analyse des joueurs de mort cellulaire. Cette méthode tire parti du simple fait que les cellules vivantes sont nécessaires pour l'expression de GUS de se produire. Afin de garantir des résultats significatifs et de répétabilit...
Déclarations de divulgation
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Rifampicine | VWR | IC19549001 | Stock de 25mg/ml dans le DMSO |
| 4'-hydroxy-3 ', 5'-diméthoxyacétophénone (acétosyringone) | VWR | TCD2666 | 0,981 g / mL dans le DMSO (1M stock) |
| 2 - (4-morpholino) monohydrate d'acide éthanesulfonique (MES) | VWR | EM-6110 | 1,92 g / L dans l'eau pour faire 1 litre de médias infiltrations |
| Bacto-tryptone | Fisher | BP1421-2 | 10g / L dans l'eau pour faire 1 litre de milieu LB |
| Bacto-extrait de levure | VWR | EM1.03753.0500 | 5g / L dans l'eau pour faire 1 litre de milieu LB |
| Le chlorure de sodium | VWR | EM-7710 | 10g / L dans l'eau pour faire 1 litre de milieu LB |
| Le phosphate de sodium monobasique monohydraté | VWR | MK-7868-12 | 2.5g / L dans l'eau pour faire 50 mM de tampon NaPi |
| Le phosphate de sodium dibasique heptahydraté | VWR | EMD-SX0715-1 | 5g / L dans l'eau pour faire 50 mM de tampon NaPi |
| Sulfate de magnésium heptahydraté | VWR | EM-MX0070-1 | 2,5 g / L dans l'eau pour faire 1 litre de médias infiltrations |
| N-Lauroylsarcosine | VWR | TCL0151-500G | 0,1% v / v dans du tampon GUS |
| 5-bromo-4-chloro-3-indoxyl-beta-D-glucuronide sel cyclohexylammonium (X-gluc) | Or la biotechnologie | G1281C | 1mg/100uL dans le méthanol à 100% |
| 4-méthyl-μ-D-glucuronide hydrate (MUG) | Sigma | M5664 | 2 mM dans 100 uL de tampon d'extraction GUS |
| Le potassium trihydraté ferrocyanure | VWR | EM-PX1460-1 | Stock de 100 mm pour une solution de substrat X-gluc |
| β-méthylumbelliférone (MU) | Sigma-Aldrich | M1381 | Pour MU tampon, utilisez courbe standard d'extraction GUS |
| Le carbonate de sodium | VWR | EM-SX0395-11 | 0,2 M dans de l'eau pour faire GUS butoir |
Références
- Jefferson, R. A. GUS fusions: , β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J. 6, 3901-3901 (1987).
- Nishihara, M. Expression of the β-Glucuronidase Gene in Pollen of Lily (Lilium longiflorum), Tobacco (Nicotiana tabacum), Nicotiana rustica, and Peony (Paeonia lactiflora) by Particle Bombardment. Plant Physiol. 102, 357-357 (1993).
- Hodal, L. . Plant Science. 87, 115-115 (1992).
- Kabbage, M. The BAG proteins: a ubiquitous family of chaperone regulators. Cell Mol. Life Sci. . 65, 1390-1390 (2008).
- Kang, C. H. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants. Cell Death Differ. 13 (1), 84-84 (2006).
- Yan, J. . Plant Science. 165 (1), 1-1 (2006).
- Takayama, S., Reed, J. C. Molecular chaperone targeting and regulation by BAG family proteins. Nat Cell Biol. 3 (10), 237-237 (2001).
- Takayama, S. Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity. Cell. 80 (2), 279-279 (1995).
- Vitha, S. Quantitative β-glucuronidase assay in transgenic plants. Biol. Plant. 35, 151-151 (1993).
- Otha, S. Construction and Expression in Tobacco of a β-Glucuronidase (GUS) Reporter Gene Containing an Intron Within the Coding Sequence. Plant Cell Physiol. 31, 805-805 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon