É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A β-glucuronidase (GUS) Ensaio Baseado Morte celular
Resumo
Ensaios de morte celular programada comumente usado em sistemas de mamíferos, tais como DNA laddering ou ensaios de TUNEL, muitas vezes são difíceis de reproduzir em plantas. Em combinação com um sistema de repórter GUS, propomos uma rápida, planta ensaio baseado transitória para analisar as propriedades morte potencial de genes específicos.
Resumo
Nós desenvolvemos um sistema de expressão transiente romance planta que ao mesmo tempo expressa o gene repórter, β-glucuronidase (GUS), com supostos reguladores positivos ou negativos de morte celular. Neste sistema, N. deixa benthamiana são co-infiltradas com uma cassete de expressão 35S impulsionado contendo o gene a ser analisado, eo GUS vector pCAMBIA 2301 usando Agrobacterium LBA4404 tensão como um veículo. Porque as células vivas são necessários para a expressão GUS a ocorrer, a perda da atividade GUS é esperada quando este gene marcador é co-expressa com os reguladores positivos da morte celular. Igualmente, o aumento da atividade GUS é observada quando anti-apoptóticos genes são usados em comparação com o controle de vetores. Como mostrado abaixo, temos utilizado com sucesso este sistema em nosso laboratório para analisar os dois jogadores pró e anti-morte. Estes incluem a planta anti-apoptótico Bcl-2 Associated athanoGene (BAG) da família, bem como, conhecidos indutores de morte celular de mamíferos, como BAX. Além disso, temos utilizado este sistema para analisar a função da morte de truncamentos específicos dentro de proteínas, o que poderia fornecer pistas sobre a modificação pós-translacional possível / ativação destas proteínas. Aqui, apresentamos um método rápido e sensível de plantas com base, como um passo inicial na investigação da morte de função de genes específicos.
Protocolo
Nicotiana benthamiana plantas são cultivadas em câmara de crescimento com temperatura controlada a 25 ° C. Totalmente expandido folhas saudáveis de 3-6 semanas de idade as plantas são utilizadas.
Dica: Melhores resultados são obtidos usando as folhas emergentes
1. Agrobacterium protocolo de infiltração transitória:
1 dia
- LB raia / rifampicina (25 mg / ml) / canamicina (100 mg / ml) placas de agar com ações de glicerol de Agrobacterium tumefaciens (estirpe LBA4404) contendo os vetores apropriados com o gene (s) a ser testada para a morte celular eo vetor contendo a cassete GUS sob um promotor constitutivo. Sempre incluir um controle do vetor vazio como controle negativo.
- Incubar a 28 ° C por 2 dias.
Dia 3
- Inocular 2 ml de LB contendo rifampicina (25 mg / ml) e canamicina (100 mg / ml), com uma única colônia de cada LB / rifampicina / canamicina placa previamente riscado.
- Incubar cada cultura por agitação a 28 ° C durante 24 horas a 200 rpm até a densidade máxima de crescimento é atingida.
Dica: A aglomeração é por vezes observada, caso em que as culturas precisam ser cuidadosamente ressuspendido (ou seja, pipetando para cima e para baixo) antes de prosseguir.
Dia 4
- Após a incubação, aumentar o volume total de 10 mL com LB fresco (contendo os antibióticos apropriados) e acetosyringone (final de concentração 25 mM).
- Incubar cada cultura por agitação a 28 ° C por mais 16 hrs.
Dia 5
- No dia seguinte, lave duas vezes cada cultura pela adição de 10 ml (não adicionar acetosyringone) médio de infiltração (10 mM MgSO 4 .7 H 2 O, 9 mM MES, pH 5,6) e centrifugar a 4000 xg por 10 min em temperatura ambiente.
- Após a etapa de centrifugação final, ressuspender cada cultura em 5 ml contendo meio de infiltração acetosyringone (100 mM).
- Medir a 600nm OD, medidas entre 0,1 e 0,9 são aceitáveis.
Dica: OD 600nm de tão baixo quanto 0,1 têm sido usados sem problema, no entanto, maior ODs pode produzir resultados mais consistentes. - Incubar as culturas de mais 3 horas para preparar as culturas Agrobacterium para a infecção.
- Mix culturas contendo o gene (s) para ser analisado e do controle negativo (Agrobacterium contendo o vetor vazio) na proporção de 1:1 com a cultura contendo o cassete de GUS.
- Infiltrar-se na lateral (sob) abaxial de folhas emergentes recém usando uma agulha de 1 ml menos seringa (Fig. 1).
Dica: Infiltrate tanto a mistura de controle negativo (vetor vazio + cassete GUS) ea mistura contendo o gene a ser testada (gene x + cassete GUS) em folhas opostas da mesma planta. Use plantas em triplicado para cada tratamento. - Três dias pós-consumo infiltração infiltrado folhas e ensaio para a expressão da proteína GUS.
2. Ensaio histoquímico GUS
Dia 8
- Vácuo se infiltrar no meio do substrato X-glic nas folhas excisadas.
- Incubar no escuro à temperatura ambiente durante a noite ou até coloração azul aparece distintas.
Dia 9
- Enxágüe em água destilada.
- Incubar em etanol 70% até a clorofila é removido, então a transferência para água destilada novamente. Visualmente avaliar os níveis de expressão GUS.
3. MUG ensaio fluorimétrico:
Dia 8
- Isolar proteína total por trituração discos de folhas infiltradas em um almofariz com nitrogênio líquido. Adicione 100 uL de tampão de extração GUS (50 mM pH 7,0 NAPI, 10 mM EDTA, 0,1% Triton X-100, 0,1% N-lauroylsarcosine sal de sódio, β-mercaptoetanol (0,7 mL / ml), mantendo a amostra em gelo.
- Centrifugar a 14.000 g de suspensão por 5 min a 4 ° C e tomar sobrenadante como proteína solúvel total.
- Medir a concentração usando um nanodrop de acordo com instruções do fabricante.
- Ajustar a concentração de proteína e 100 mg de proteína solúvel total para cada amostra usando GUS tampão de extração.
- Adicionar substrato MUG (4-metil-β-D-glicuronídeo hidratado) preparado em GUS tampão de extração para uma concentração final de 2 mM. Um volume total de 100 mL por amostra (proteína + substrato MUG) deve ser suficiente.
- Incubar as reações de 1 hora a 37 ° C.
- Parar reações adicionando 800 mL de GUS batente do amortecedor (0,2 M Na 2 CO 3).
- Medida de fluorescência usando um leitor de placas em um comprimento de onda de excitação de 365 nm e comprimento de onda de emissão de 455 nm e comparar os valores de uma curva padrão de MU. Níveis relatório de actividades do GUS como nmol total de MU / mg proteína solúvel / min.
4. Ações e Soluções:
- Acetosyringone (1 M) de estoque (FW = 196,2 g) - 0,981 g em 5 mL de DMSO
- Canamicina (100 mg / ml) de ações - preparar em dH 2 0 - filtro de esterilizar
- Rifampicina (25 mg / ml) de ações - preparar em DMSO
- Luria-Bertani (LB) líquido meios de cultura: (1L)
1% (w / v) Bacto-triptona, 10 g
0,5% (w / v) extrato de levedura-Bacto, 5 g
170 mM cloreto de sódio 10 g
pH - 7 - Acetosyringone (25 mM) = 25 mL de um estoque M 1 em um volume final de 1 ml
- Médias de infiltração: (1L)
10 mM MgSO 4 0,7 dH 2 0 (FW = 246,48 g), 2,4648 g
9 mM MES (PF = 213,25 g), 1,91925 g
pH - 5.6 - Acetosyringone (100 M) = 100 mL de um estoque 1M em um volume final de 1 ml
- GUS Extração de buffer
50 mM NAPI pH 7,0, 10 mM EDTA, 0,1% Triton X-100, 0,1% N-lauroylsarcosine sal de sódio, β-mercaptoetanol (0,7 mL / ml) - 2x tampão fosfato
0.2M NaH 2 PO 4 e 0,2 M Na 2 HPO 4 pH 7 - X-Glic solução de substrato
Dissolver 1 mg de 5-bromo-4-cloro-3-indolil bD-glicuronídeo (X-Glic) em 0,1 ml de metanol. Adicionar 1 ml de tampão fosfato 2x, 20 de potássio 0,1 M mL de ferricianeto, 10μl Triton X-100 10% e 850 mL de água destilada.
5. Resultados representativos:
Na sequência deste protocolo, perda de expressão GUS é esperada quando ocorre a morte celular. Temos, simultaneamente, expressa o gene repórter, β-glucuronidase (GUS) com um membro da Arabidopsis cito-protetora Bcl-2 Associated athanoGene (BAG) da família. Nós co-infiltradas N. benthamiana folhas com um cassete de expressão impulsionado BAG 35S eo GUS vector pCAMBIA 2301 usando Agrobacterium LBA4404 tensão. Como mostrado na figura 2, um aumento visível de coloração GUS foi observada após essa infiltração. Inversamente, quando o conhecido membro pró-apoptótico da família Bcl-2 BAX foi usado, uma redução acentuada de coloração GUS foi observada (Fig. 2). Em ambos os casos, a expressão de GUS foi visivelmente diferente se comparado ao controle. No entanto, quando a diferença de expressão é menos evidente, ensaios MUG fluorimétricos pode ser realizada para quanitate expressão GUS.

Figura 1. Exemplo de Agrobacterium infiltração mistura do lado abaxial de N. benthamiana folhas usando uma seringa de 1 ml com agulha menor.
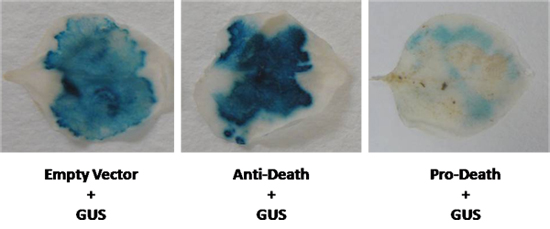
Figura 2. Um vetor GUS foi co-expresso em N. benthamiana folhas com o gene anti-morte, e um conhecido indutor de morte celular. Níveis de GUS foram comparados com um controle do vetor vazio (GUS controle).
Discussão
Muitas vezes, é difícil de usar técnicas de detecção de células morte em plantas que são comuns em sistemas de mamíferos. Em combinação com um sistema de repórter GUS, apresentamos uma planta de método, com base sensível para a detecção e análise de jogadores morte celular. Este método aproveita o simples fato de que as células vivas são necessários para o GUS expressão a ocorrer. Para garantir resultados significativos e repetibilidade, é fundamental que as culturas abrigar a cassete GUS eo gen...
Divulgações
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Rifampicina | VWR | IC19549001 | 25mg/ml estoque em DMSO |
| 4'-hidroxi-3 ', 5'-dimethoxyacetophenone (Acetosyringone) | VWR | TCD2666 | 0,981 g / mL em DMSO (1M estoque) |
| Monohidrato do ácido (4-morfolino) ethanesulfonic (MES) - 2 | VWR | EM-6110 | 1,92 g / L na água para fazer um L de mídia infiltração |
| Bacto-triptona | Pescador | BP1421-2 | 10g / L na água para fazer 1 L de meio LB |
| Bacto levedura-extrato de | VWR | EM1.03753.0500 | 5g / L na água para fazer 1 L de meio LB |
| Cloreto de sódio | VWR | EM-7710 | 10g / L na água para fazer 1 L de meio LB |
| Fosfato de sódio monobásico | VWR | MK-7868-12 | 2,5 g / L em água para fazer 50mM de tampão NAPI |
| Fosfato de sódio dibásico hepta | VWR | EMD-SX0715-1 | 5g / L na água para fazer 50mM de tampão NAPI |
| Sulfato de magnésio hepta-hidratado | VWR | EM-MX0070-1 | 2,5 g / L na água para fazer um L de mídia infiltração |
| N-Lauroylsarcosine | VWR | TCL0151-500G | 0,1% v / v em tampão GUS |
| 5-Bromo-4-cloro-3-indoxil-beta-D-glicuronídeo sal cyclohexylammonium (X-glic) | Biotecnologia ouro | G1281C | 1mg/100uL em metanol 100% |
| 4-metil-D-μ-glicuronídeo hidratado (MUG) | Sigma | M5664 | 2 mM em 100 uL de tampão de extração GUS |
| Trihidrato de ferrocianeto de potássio | VWR | EM-PX1460-1 | Ações 100mM para X-glic solução de substrato |
| β-Methylumbelliferone (MU) | Sigma-Aldrich | M1381 | Para a curva MU tampão uso padrão de extração GUS |
| Carbonato de sódio | VWR | EM-SX0395-11 | 0,2 M em água para fazer GUS tampão parar |
Referências
- Jefferson, R. A. GUS fusions: , β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J. 6, 3901-3901 (1987).
- Nishihara, M. Expression of the β-Glucuronidase Gene in Pollen of Lily (Lilium longiflorum), Tobacco (Nicotiana tabacum), Nicotiana rustica, and Peony (Paeonia lactiflora) by Particle Bombardment. Plant Physiol. 102, 357-357 (1993).
- Hodal, L. . Plant Science. 87, 115-115 (1992).
- Kabbage, M. The BAG proteins: a ubiquitous family of chaperone regulators. Cell Mol. Life Sci. . 65, 1390-1390 (2008).
- Kang, C. H. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants. Cell Death Differ. 13 (1), 84-84 (2006).
- Yan, J. . Plant Science. 165 (1), 1-1 (2006).
- Takayama, S., Reed, J. C. Molecular chaperone targeting and regulation by BAG family proteins. Nat Cell Biol. 3 (10), 237-237 (2001).
- Takayama, S. Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity. Cell. 80 (2), 279-279 (1995).
- Vitha, S. Quantitative β-glucuronidase assay in transgenic plants. Biol. Plant. 35, 151-151 (1993).
- Otha, S. Construction and Expression in Tobacco of a β-Glucuronidase (GUS) Reporter Gene Containing an Intron Within the Coding Sequence. Plant Cell Physiol. 31, 805-805 (1990).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados