Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine β-Glucuronidase (GUS) Basierend Cell Death Assay
In diesem Artikel
Zusammenfassung
Der programmierte Zelltod-Assays häufig in Säugetier-Systemen wie DNA laddering oder TUNEL-Assays, sind oft nur schwer in Pflanzen zu reproduzieren. In Kombination mit einem GUS-Reporter-Systems, schlagen wir eine schnelle, auf pflanzlicher Basis transienten Assay, um das Potenzial der Tod Eigenschaften bestimmter Gene zu analysieren.
Zusammenfassung
Wir haben eine neue vorübergehende Anlage Ausdruck System, das gleichzeitig Ausdruck der Reportergen β-Glucuronidase (GUS), mit vermeintlichen positive oder negative Regulatoren des Zelltods entwickelt. In diesem System, N. benthamiana Blätter sind mit einer 35S angetrieben Expressionskassette enthält das Gen analysiert werden co-infiltriert, und die GUS-Vektor pCAMBIA 2301 unter Verwendung von Agrobacterium LBA4404 als Vehikel. Da lebende Zellen benötigt werden für die GUS-Expression auftritt, ist der Verlust der GUS-Aktivität zu erwarten, wenn dieses Markergen wird mit positiven Regulatoren des Zelltods co-exprimiert. Ebenso erhöhte GUS-Aktivität beobachtet wird, wenn anti-apoptotischen Gene im Vergleich zu den Vektor-Steuerung verwendet werden. Wie unten gezeigt, haben wir erfolgreich dieses System in unserem Labor verwendet, um sowohl pro-und anti-death-Spieler zu analysieren. Dazu gehören die Anlage anti-apoptotischen Bcl-2 assoziierte athanoGene (BAG) Familie, sowie bekannte Säugetier-Induktoren von Zelltod, wie BAX. Darüber hinaus haben wir dieses System verwendet, um den Tod in Abhängigkeit von bestimmten Verkürzungen innerhalb Proteinen, die Hinweise auf die mögliche posttranslationale Modifikation / Aktivierung dieser Proteine könnte zu analysieren. Hier präsentieren wir eine schnelle und empfindliche Pflanzen basierende Methode, als einen ersten Schritt bei der Untersuchung des Todes Funktion bestimmter Gene.
Protokoll
Nicotiana benthamiana Pflanzen werden in einem temperierten Klimakammer bei 25 ° C gewachsen. Voll ausgebaut gesunde Blätter von 3-6 Wochen alten Pflanzen verwendet werden.
Tipp: Bessere Ergebnisse werden mit neu entstehenden Blättern gewonnen
1. Agrobacterium vorübergehende Infiltration Protokoll:
Tag 1
- Streak LB / Rifampicin (25 ug / ml) / Kanamycin (100 ug / ml) Agarplatten mit Glycerin Aktien von Agrobacterium tumefaciens (Stamm LBA4404) mit den entsprechenden Vektoren mit dem Gen (s) zum Zelltod untersucht werden und der Vektor mit den GUS-Kassette unter einem konstitutiven Promotor. Enthalten immer eine leere Vektor-Regelung als negative Kontrolle.
- Inkubation bei 28 ° C für 2 Tage.
Tag 3
- Inoculate 2 ml LB mit Rifampicin (25 ug / ml) und Kanamycin (100 ug / ml) mit einer einzelnen Kolonie von jeder LB / Rifampicin / Kanamycin Platte zuvor gestreift.
- Inkubieren jede Kultur durch Schütteln bei 28 ° C für 24 Stunden bei 200 Umdrehungen pro Minute, bis ein maximales Wachstum Dichte erreicht ist.
Tipp: Horstig ist manchmal zu beobachten, in welchem Fall Kulturen gründlich resuspendiert werden (dh Auf-und Abpipettieren), bevor Sie fortfahren müssen.
Tag 4
- Nach der Inkubation erhöht das Gesamtvolumen auf 10 ml mit frischem LB (mit den entsprechenden Antibiotika) und Acetosyringon (Endkonzentration 25 uM).
- Inkubieren jede Kultur durch Schütteln bei 28 ° C für weitere 16 Stunden.
Tag 5
- Am nächsten Tag waschen jede Kultur zweimal durch Zugabe von 10 ml (fügen Sie keine Acetosyringon) Infiltration Medium (10 mM MgSO 4 .7 H 2 O, 9 mM MES, pH 5,6) und zentrifugieren bei 4000 xg für 10 min bei Raumtemperatur.
- Nach dem letzten Zentrifugationsschritt resuspendieren jede Kultur in 5 ml Medium mit Infiltration Acetosyringon (100 uM).
- Messen Sie die OD 600nm, werden die Messungen zwischen 0,1 und 0,9 zulässig.
Tipp: OD 600nm von nur 0,1 ohne Probleme verwendet wurden, können jedoch auch höhere OD produzieren mehr konsistente Ergebnisse. - Inkubieren Sie die Kulturen weitere 3 Stunden auf die Agrobacterium Kulturen zur Infektion vorzubereiten.
- Mix Kulturen, die das Gen (s) zu analysieren und die Negativ-Kontrolle (Agrobacterium mit dem leeren Vektor) in einem Verhältnis von 1:1 mit der Kultur, die das GUS-Kassette.
- Infiltrate der abaxialen (unter-) Seite neu entstehenden Blätter mit einer 1 ml nadellose Spritze (Abb. 1).
Tipp: Infiltrate sowohl die Negativ-Kontrolle-Gemisch (Leervektor + GUS-Kassette) und die Mischung, die das Gen zu untersuchenden (Gen x + GUS-Kassette) auf gegenüberliegenden Blätter der gleichen Pflanze. Verwenden Sie dreifach Pflanzen für jede Behandlung. - 3 Tage nach Infiltration Verbrauchsteuern infiltriert Blätter und Assay für GUS-Protein-Expression.
2. Histochemische GUS-Test
Tag 8
- Vacuum infiltrieren die X-Gluc Trägermedium in die ausgeschnittene Blätter.
- Inkubieren im Dunkeln über Nacht bei Raumtemperatur oder bis deutliche Blau-Färbung erscheint.
Tag 9
- Spülen in destilliertem Wasser.
- Inkubieren in 70% Ethanol bis Chlorophyll entfernt wird, dann Transfer zum destilliertem Wasser wieder. Optisch bewerten GUS-Expression Ebenen.
3. Fluorometric MUG-Assay:
Tag 8
- Isolieren gesamten Proteins durch Schleifen infiltriert Blattscheiben in einem Mörser mit flüssigem Stickstoff. Add 100 uL der GUS-Extraktionspuffer (50 mM NaPi pH 7,0, 10 mM EDTA, 0,1% Triton X-100, 0,1% N-Lauroylsarcosin Natriumsalz, β-Mercaptoethanol (0,7 ul / ml), während die Probe auf Eis.
- Centrifuge Suspension bei 14.000 g für 5 min bei 4 ° C und nehmen Überstand als Gesamt-lösliches Protein.
- Measure-Konzentration mit Hilfe eines NanoDrop nach den Anweisungen des Herstellers.
- Passen Sie die Protein-Konzentration auf 100 ug Gesamt-lösliches Protein für jede Probe mit GUS-Extraktionspuffer.
- Add MUG Substrat (4-Methylumbelliferyl-β-D-Glucuronid Trihydrat) in GUS-Extraktionspuffer zu einer Endkonzentration von 2 mM hergestellt. Ein Gesamtvolumen von 100 mL pro Probe (Protein + MUG Substrat) sollte ausreichend sein.
- Inkubieren Sie die Reaktionen für 1 Stunde bei 37 ° C.
- Stop-Reaktionen durch Zugabe von 800 ul GUS Stop Puffer (0,2 M Na 2 CO 3).
- Messen Sie mit einem Fluoreszenz-Reader bei einer Anregungswellenlänge von 365 nm und Emissionswellenlänge von 455 nm und Werte vergleichen zu einem MU Standardkurve. Bericht Ebenen der GUS-Aktivität als nmol MU / ug gesamte lösliche Protein / min.
4. Stocks and Solutions:
- Acetosyringon (1 M) Aktie (FW = 196,2 g) - 0,981 g in 5 ml DMSO
- Kanamycin (100 mg / ml) auf Lager - in dH vorbereiten 2 0 - Filter sterilisieren
- Rifampicin (25 mg / ml) auf Lager - in DMSO vorbereiten
- Luria-Bertani (LB) flüssige Nährmedien: (1L)
1% (w / v) Bacto-Trypton, 10 g
0,5% (w / v) Bacto-Hefeextrakt, 5 g
170 mM Natriumchlorid 10 g
pH - 7 - Acetosyringon (25 nM) = 25 ul einer 1 M Stammlösung in einem Endvolumen von 1 ml
- Infiltration Medium: (1L)
10 mM MgSO 4 .7 dH 2 0 (FW = 246,48 g), 2,4648 g
9 mM MES (FW = 213,25 g), 1,91925 g
pH - 5,6 - Acetosyringon (100 uM) = 100 ul einer 1M Lager in einem Endvolumen von 1 ml
- GUS-Extraktionspuffer
50 mM NaPi pH 7,0, 10 mM EDTA, 0,1% Triton X-100, 0,1% N-Lauroylsarcosin Natriumsalz, β-Mercaptoethanol (0,7 ul / ml) - 2x Phosphatpuffer
0,2 M NaH 2 PO 4 und 0,2 M Na 2 HPO 4 pH 7 - X-Gluc Substrat-Lösung
1 mg 5-Brom-4-Chlor-3-Indolyl bD-Glucuronid (X-Gluc) in 0,1 ml Methanol. 1 ml 2x Phosphat-Puffer, 20 ul 0,1 M Kaliumferricyanid, 10 &mgr; l Triton X-100 10% und 850 ul destilliertes Wasser.
5. Repräsentative Ergebnisse:
Nach diesem Protokoll ist der Verlust der GUS-Expression zu erwarten, wenn Zelltod eintritt. Wir haben gleichzeitig das Reporter-Gen, β-Glucuronidase (GUS) mit einem Mitglied des Zyto-Schutz Arabidopsis Bcl-2 assoziierte athanoGene (BAG) Familie zum Ausdruck gebracht. Wir co-infiltriert N. benthamiana Blätter mit einem 35S angetrieben BAG Expressionskassette und die GUS-Vektor pCAMBIA 2301 unter Verwendung von Agrobacterium LBA4404. Wie in Abbildung 2 gezeigt, wurde eine sichtbare Steigerung der GUS-Färbung nach dieser Infiltration beobachtet. Umgekehrt, wenn die bekannten pro-apoptotischen Mitglied der Bcl-2 Familie BAX verwendet wurde, war eine deutliche Reduktion der GUS-Färbung beobachtet werden (Abb. 2). In beiden Fällen wurde GUS-Expression sichtbar anders im Vergleich zur Kontrollgruppe. Allerdings, wenn der Unterschied im Ausdruck weniger offensichtlich ist, kann fluorometrische MUG-Assays durchgeführt, um GUS-Expression quanitate werden.

Abbildung 1. Beispiel Agrobacterium Mischung Infiltration der abaxialen Seite des N. benthamiana Blätter mit einer 1 ml nadellose Spritze.
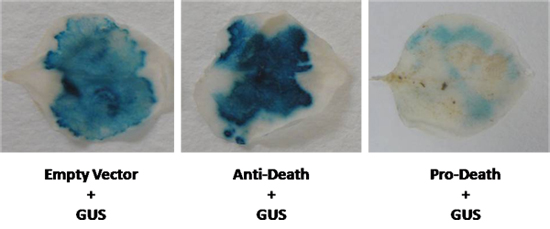
Abbildung 2. A GUS-Vektor wurde in N. co-exprimiert benthamiana Blätter mit dem Anti-Todes-Gen, und ein bekannter Induktor von Zelltod. GUS-Spiegel wurden in ein leeres Vector-Regelung (GUS Kontrolle) verglichen.
Diskussion
Es ist oft schwierig, den Zelltod Nachweisverfahren in Pflanzen, die häufig in Säugetier-Systemen verwenden. In Kombination mit einem GUS-Reporter-System präsentieren wir ein auf pflanzlicher Basis, empfindliche Methode zum Nachweis und zur Analyse von Zelltod Spieler. Diese Methode nutzt die Tatsache, dass lebende Zellen für GUS-Expression auftreten, sind erforderlich. Um sicherzustellen, aussagekräftige Ergebnisse und Wiederholbarkeit, ist es entscheidend, dass die Kulturen beherbergen die GUS-Kassette und das...
Offenlegungen
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| Rifampicin | VWR | IC19549001 | 25mg/ml Lager in DMSO |
| 4'-Hydroxy-3 ', 5'-Dimethoxyacetophenon (Acetosyringon) | VWR | TCD2666 | 0,981 g / mL in DMSO (1M Lager) |
| 2 - (4-Morpholino) ethansulfonsäure Monohydrat (MES) | VWR | EM-6110 | 1,92 g / L in Wasser zur Herstellung von 1 L der Infiltration Medien |
| Bacto-Trypton | Fischer | BP1421-2 | 10g / L in Wasser zur Herstellung von 1 L LB-Medium |
| Bacto-Hefeextrakt | VWR | EM1.03753.0500 | 5g / L in Wasser zur Herstellung von 1 L LB-Medium |
| Kochsalz | VWR | EM-7710 | 10g / L in Wasser zur Herstellung von 1 L LB-Medium |
| Mononatriumphosphat Monohydrat | VWR | MK-7868 bis 12 | 2,5 g / L in Wasser zur Herstellung von 50mm Puffer NaPi |
| Natriumdihydrogenphosphat Heptahydrat | VWR | EMD-SX0715-1 | 5g / L in Wasser zur Herstellung von 50mm Puffer NaPi |
| Magnesiumsulfatheptahydrat | VWR | EM-MX0070-1 | 2,5 g / L in Wasser zur Herstellung von 1 L der Infiltration Medien |
| N-Lauroylsarcosin | VWR | TCL0151-500G | 0,1% v / v in GUS-Puffer |
| 5-Bromo-4-Chlor-3-Indoxyl-beta-D-Glucuronid Cyclohexylammoniumsalz (X-Gluc) | Gold-Biotechnologie | G1281C | 1mg/100uL in Methanol 100% |
| 4-Methyl-μ-D-Glucuronid-Hydrat (MUG) | Sigma | M5664 | 2 mM in 100 uL der GUS-Extraktionspuffer |
| Kaliumferrocyanid Trihydrat | VWR | EM-PX1460-1 | 100 mM Stammlösung für X-Gluc Substrat-Lösung |
| β-Methylumbelliferon (MU) | Sigma-Aldrich | M1381 | Für MU Standardkurve verwenden GUS-Extraktionspuffer |
| Natriumcarbonat | VWR | EM-SX0395-11 | 0,2 M in Wasser zur Herstellung von GUS Anschlagpuffer |
Referenzen
- Jefferson, R. A. GUS fusions: , β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J. 6, 3901-3901 (1987).
- Nishihara, M. Expression of the β-Glucuronidase Gene in Pollen of Lily (Lilium longiflorum), Tobacco (Nicotiana tabacum), Nicotiana rustica, and Peony (Paeonia lactiflora) by Particle Bombardment. Plant Physiol. 102, 357-357 (1993).
- Hodal, L. . Plant Science. 87, 115-115 (1992).
- Kabbage, M. The BAG proteins: a ubiquitous family of chaperone regulators. Cell Mol. Life Sci. . 65, 1390-1390 (2008).
- Kang, C. H. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants. Cell Death Differ. 13 (1), 84-84 (2006).
- Yan, J. . Plant Science. 165 (1), 1-1 (2006).
- Takayama, S., Reed, J. C. Molecular chaperone targeting and regulation by BAG family proteins. Nat Cell Biol. 3 (10), 237-237 (2001).
- Takayama, S. Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity. Cell. 80 (2), 279-279 (1995).
- Vitha, S. Quantitative β-glucuronidase assay in transgenic plants. Biol. Plant. 35, 151-151 (1993).
- Otha, S. Construction and Expression in Tobacco of a β-Glucuronidase (GUS) Reporter Gene Containing an Intron Within the Coding Sequence. Plant Cell Physiol. 31, 805-805 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten