Method Article
の定量と自動ハイスループットゲノムワイドRNAiスクリーニング C.エレガンス
要約
我々は、使用してプロトコルを記述する C.エレガンスとRNAiはそのような集団内の個々のワームの蛍光、サイズや不透明度などの複数のパラメータの自動測定を可能にするライブラリを供給する。私達は中の抗真菌自然免疫に関与する遺伝子を識別するために画面の一例を与える C.エレガンス。
要約
RNA干渉は、全ゲノム規模でかつ定量的文脈で実施する場合は特に、遺伝子の機能を理解するための強力な方法です。 C.で虫 、遺伝子の機能は、特定の遺伝子の1に対応するdsRNAを発現する細菌で、ワームを供給することにより、簡単かつ効率的にノックダウンすることができます。 RNAiのクローンのライブラリの作成は 、Cの大部分をカバーしながら、 elegansのゲノム2,3(例4-7参照)真の機能ゲノム研究のために道を開いた、最も確立された方法は面倒です。モイらは、ゲノムワイドな画面8を容易にする半自動化されたプロトコルを開発しました。アプローチは、顕微鏡イメージングと画像解析に依存しています。
ここでは、細菌のRNAiのクローンのロボットハンドリング、COPAS Biosort(ユニオンBiometrica(UBI))を用いた定量分析などに基づいて、ハイスループットのゲノムワイドな画面の代替プロトコルを記述する統合ソフトウェア:MBioLIMS(MODULバイオからラボ情報管理システム)のデータ管理とサンプルを追跡するための高いスループットを実現する技術。メソッドは、画面が固形培地プレート上で実施することができます。これは、C言語でそれらのアドレッシング宿主-病原体相互作用などいくつかの研究のために特に重要です。 線虫は、特定の微生物を効率的に培養液でワームに感染していないので。
我々は、メソッドがCの抗真菌自然免疫の遺伝子の重要性を定量化するために使用することができる方法を示していますエレガンス 。このケースでは、このアプローチは、抗菌ペプチド遺伝子NLP 29とで構成的に発現される赤色蛍光レポーターのプロモーターの制御下にGFPを、表皮感染誘導蛍光レポーター遺伝子をトランスジェニック株の使用に依存しています表皮。後者は、表皮の機能の整合性が内部統制を提供していますと非特異的な遺伝子サイレンシング9。コントロールワームは真菌に感染しているとき、彼らは緑色蛍光を発する。 RNAiにより感染した後に減少した蛍光のNLP 29式の結果を得るために必要な遺伝子をノックダウン。現在、このプロトコルは、3,000以上のRNAiのクローンは2ヶ月以内にゲノム全体をスクリーニングの可能性を開いて、週ごとにテストし、分析することができます。
プロトコル
後述するようにプロトコルは、5日間連続した(図1)の手順に分かれています。前述のように、特定の手順は、別の日に行うことができます。各ステップの期間と同様に、必要な材料の量は、(例えば、ワーム、バクテリア、メディア)は、実験ごとに処理された96ウェルプレートの数に依存します。
1日目
1。 96ウェルNGMのRNAiプレートの準備
次のプロトコルは、さまざまなソリューションのための殺菌技術の詳細を含む10ワーム培養プレートを作るための標準的な方法から構成されている。
- 1.7グラムBactoAgar、0.29グラムのNaCl、0.25グラムペプトン、100μLコレステロール(EtOH中5 mg / mLの):10-12、96ウェルプレートの場合は、脱イオンH 2 Oで線虫の増殖培地100 mLの(NGM)を準備します。
- オートクレーブNGM(121℃で5分間C 100 mLに対して、121℃で30分間4 LのC)は約50°C(単にクールENOになるまで、そしてそれが冷ます)を保持するためにぐふっ。それはNGMは、それが固化しないように十分に暖かいとどまることが重要です。
- 100mLのために追加:2.5 mLのリン酸緩衝液pH6で(1M)、100μLのMgSO 4(1M)、100μLのCaCl 2(1M)、400μLIPTG(1M)、100μLアンピシリン(100 mg / mL)は、100μLテトラサイクリン(エタノール12.5 mg / mL)を。
- 96ウェル平底プレートの各ウェルにNGMの75μLを配布します。媒体の凝固を避けるために、それが急速に分配する必要があり、それは反復的なディスペンサー(例えばRepeatman、エッペンドルフ)を使用すると便利です。井戸の中に存在しない空気の泡が存在しないことを確認してください。
- 4℃で多湿の室(例えば、下部に濡れたペーパータオルでタッパーウェアボックス)ですぐにプレートを保存
注:プレートを事前に週まで準備し、4℃で保存することができます°C、これは以降の手順の組織が容易になります。
2。 96ディープウェルのLBプレートの自動作成
- 100μg/mlのアンピシリンおよび2 mL /ウェルの最大容量を持つ96ディープウェルプレートの各ウェルにテトラサイクリン12.5μg/ mLのを含む1.5 mLのLBを準備し、配布しています。ディストリビューションは、ロボット液体ハンドリングシステム(例えば、TECAN)を使用して最適化されているだけでなく、必要に応じて手動で実行することができます。
- 4℃で各プレートや店舗にカバーを追加します。各96ウェルプレートを追跡するためには、ユニークなラベルやバーコードは、この段階で、またはその後、追加する必要があります。
注:プレートは、事前に2〜3日を調製し、4℃で保存することができます°C、これは以降の手順の組織が容易になります。
3。 96ディープウェルのLBプレート(一晩培養)におけるRNAi細菌クローンを育てる
- オリジナルのRNAiライブラリークローンは384ウェルフォーマットは、最初の配布ラベルにクローンまたは100μg/ mLのアンプおよび12.5μg/ mLでTとLBを含むバーコード標準的な96ウェルプレートである処理の後続の使いやすさ、のためにらは、グリセロール(10%最終濃度)を添加した。オリジナルの384ウェルプレートは、全てのウェルのクローンを持っていない場合は、最も一般的に使用される "Ahringer"ライブラリの場合と同様、ドータープレートを整理するためのいくつかのオプションがあります。クローンは、娘板には空の井戸が存在しないように再配布することができます。この画面にプレートの数を最小限に抑えることができます。理想的には、しかしながら、複製時に、それぞれの娘のプレートには、いくつかの井戸が、これらはその後、全体のプレートの比較を容易にする標準的な制御クローン(正および負)を充填することができるように、空のままにする必要があります。これらの96ウェルの娘次いで、プレートを一晩(ON)文化のための種子を96ディープウェルのLBプレートに使用されます。
すべての液体処理ステップは最高のロボット液体ハンドリングシステム(例えば、テカン)で行われていますが、使用して手動で実行することができ、例えば、96ピンレプリケーター。 RNAiライブラリーのクローンを96ウェルフォーマットで既にある場合は3.5に進みます。
2日目
4。 96ウェルNGMのRNAiプレートにシードRNAiの細菌クローンを
この手順は、ON培養後、午前中に行われる必要があります。
- 4から96ウェルNGMプレートを取る°C、それらを無菌層流キャビネットの下に5〜15分間ウォームアップし、乾燥しましょう。そうでなければNGMその後割れる可能性があるので、長すぎるフード(最大30分)の下に板を放置しないでください。各プレートに適切なラベル/バーコードを追加します。
- 37℃から培養プレート上で96ディープウェルを取得します。任意の空井戸(空井戸が完全に透明である)の位置を記録し、これらは以降の分析から除外されます。
- 96遠心分離·ディープウェルプレートを4000rpmで5分。
- 逆さまに急激に板を回して、上清から転倒し、ペーパータオル上で急速にプレートの端を乾燥させます。文化は組換え細菌であるように、上清は地域の規制(例えば、オートクレーブ処理したもの)に従って処理する必要があります。
- 各プレートは正確に同じ治療を受けるように理想的には、専用の攪拌器(例えば、テカン)を使用して、ボルテックスで残液(約50μL)の細菌ペレットを再懸濁します。それは正確に次のステップのために細菌の接種を標準化するために各ウェルのOD 600を測定することが可能ですが、これは必須ではありません、我々はそのようなチェックを実行しないでください。
- 8または12チャンネルマルチピペットを用いて96ウェルNGMプレートに再懸濁した細菌の5μLを転送します。 NGMに触れたり、浸透しないように注意してください。このステップを手動で実行されていますが、そのようなことができますLiquidator96(レイニン)などのロボットを使用して最適化することができますワンステップで96のRNAiクローンのディストリビューション。
- NGMが乾燥しすぎてなることを避けるために定期的にチェックし、無菌層流キャビネットの下の細菌は乾燥させます。このステップでは、約2時間を取る必要があります。
- 湿ったチャンバー内で37℃で96ウェルのRNAi-NGMプレートをインキュベートします。
5。ワームの同期人口を準備します。
このステップでは、我々は、関心のあるレポーター遺伝子(s)を(感染誘導性のp NLP-29 :: GFPコンストラクトを、例えばと、内部コントロールとして、構成的なP COL-12 :: DsRedをトランスジーンコンストラクト)トランスジェニックのワームを使用。ので、時間とともに導入遺伝子の発現の観測減少から、我々は、ワーム、6週間ごとの新鮮なバッチを解凍します。我々は、使用前に少なくとも2世代の文化ワーム、ワームは、アッセイ前に餓死したことがないことを確認してください。プロトコルの2日目が火曜日の場合は、我々は、OP50細菌で広がる9cmのNGMプレート上で30若い成人ワームを配置することによって、金曜日にワームを準備(20℃)、彼らは火曜日の漂白剤(表1を参照)できるようになります。
- 標準プロトコル10次の漂白剤のワーム。
- 卵L1幼虫の同期人口を取得するために攪拌しながら25℃でM9で孵化しましょう。
3日目
6。給餌とRNAiのための96ウェルのRNAi-NGMプレート上にワームを配布
この手順は、午前中に行われる必要があります。 L1-ステージ同期ワームは餌とRNAiのための各96ウェル細菌のクローンに分散されています。
- 37°Cから96ウェルのRNAi-NGMプレートを取得し、冷却し、室温のままにします。
- 25℃から漂白されたワームを取得します。 2μLあたりのワームの数を見積もると2μLあたり約100から120までのワームを(およそ一滴)を持っているM9で調整します。
- 手動で反復的なディスペンサーを用いて各ウェル中のL1段ワームの2μLを配布します。ワームの各ウェルを確認してください(あなたが液体の中を泳いでワームを参照する必要があります)。
- 無菌層流キャビネット(最大1時間)の下にプレートは乾燥させます。定期的にプレートをチェックします。ワームは、クロールや水泳ませんする必要があります。慎重に、NGMは、それ以外の場合はクラックされ、あまりにも乾燥してはいけません。
- 湿ったチャンバー内で25℃でプレートを配置します。
7。効果的な感染Drechmeria coniospora胞子をテストします。
このステップでは、現在の画面に固有のものです。それは非常に感染性のものを選択して胞子の異なるバッチのテストで構成されています。したがって、それは4日、感染症の日前にできるだけ近く行われる必要があります。それはこれらのテスト(表1)を事前に十分なL3-L4ワームを準備する必要があります。 D.するために必要な詳細な方法coniospora文化は他の11に記載されている。
- M9の小さなボリューム内の各真菌培養のサンプルから胞子を収集します。
- OP50を接種した35 mmのNGMプレート上の各胞子懸濁液のドロップを置いて、乾燥させます。
- 興味のあるレポーター遺伝子を運ぶ30から40、L3-L4ワーム(例えば、p NLP-29 :: GFP)を追加します。
- 25℃で感染したプレートを配置します。
- 翌日、GFPの誘導のためにワームをチェックし、緑色蛍光の明るい、最も広範かつ均質な誘導を与える菌のバッチを選択します。
4日目
8。 D.とRNAiを露出したワームに感染coniospora胞子
ワームは、L3-L4の段階に達したときに、このステップは、30時間RNAiの給餌後に実行されます。
- ウェルあたり4μLを配布するために使用する胞子の量を決定します。
- 新鮮な収集D. M9バッファーで選択したバッチからconiospora胞子 。胞子の1つの9 cmのプレートでM9の8-10 mLを使用しています。
- 反復的なディスペンサーを各ウェルに胞子の4μLを配布します。胞子のために各ウェルを確認してください(あなたが液体の中を泳いでワームを見ることができます)。
- 無菌層流キャビネット(〜1時間)の下にプレートは乾燥させます。ワームは、クロールを開始するまで定期的にプレートを確認してください。慎重に、NGMは、それ以外の場合はクラックされ、あまりにも乾燥してはいけません。
- 湿ったチャンバー内で25℃で感染したプレート°Cを配置します。
5日目
9。自動化された定量分析の前にプレートの観察とストレージ
このステップでは、感染後18時間を開始し、5日中に実行されます。ワームは卵を産み始めた若い成人であることが期待されています。このステップの間に表現型は、視覚的に得点されています。どちらのワームは、通常の状況は、次の感染症に対応する緑色の蛍光を発する、またはGFPの誘導は沈黙遺伝子は、感染に対する応答を変更することを意味します与えられた井戸に変更されます。
- 急速に蛍光解剖顕微鏡下でプレートを観察します。プレートは優れた一般的なGFPの誘導を示す場合は、次のステップに進み、そうでない限り、ワーム放置食べ物が残っているとして、より良い誘導のために午後まで待機します。
- 視覚的には、すべてのプレートを獲得し、顕著な表現型(GFPは発現しないなど)で任意の整形に注意してください。追加されている可能性があり、任意のコントロールRNAiのクローンで得られた結果をチェックして、この最初の予備的な分析は、実験が成功したかどうかの指標を与える。
- には、NaClの50mM-トリトン0.05%の100μLで8または12チャンネルマルチピペット転送のワームを使用して、新しいそれに応じてラベル/ 96ウェル丸底プレートバーコード。分析まで-80℃でプレートを固定します。
- 分析の日に、室温でプレートを解凍し、COPAS Biosortを使用して自動分析に進みます。ソーターは22分に単板を分析します。プレートはすべきではない分析の前に一時間以上室温で放置し、それらを再び凍結することはできません。
- COPAS Biosortから得られる情報は、データの品質の大まかな検証用のExcelファイルに転写されています。 COPAS Biosort(3つの異なる検出器によって同時に光学密度(吸光)、軸方向の長さ(飛行時間)、蛍光発光、)で測定し、異なるパラメータを持つ生データは、その後、専用のLIMSパッケージ(MBio LIMSに格納されています。MODUL-その後の詳細な定量分析のためのバイオ)。
10。代表的な結果
ほとんどのウェルに、実験の最後に、上記のワームや細菌の量を使用して、動物は、すべての成人に開発している必要があり、まだ全てのウェルに残っていくつかの食品があるはずです。これらの条件下では、ほとんどの井戸がまた卵を含んでいる必要があります。よくそうBiosortデータはfを得られることをそれぞれの成人の十分な数があるはずまたは少なくとも50個のワーム。 RNAiは、効率的な場合一方、RNAiのクローンの多くは目に見える表現型を引き起こします。たとえば、ワームは、まとまりのない、またはそれ以上の明らかに、滅菌、またはそれらの開発で逮捕されたかもしれません。これは一般的に96ウェルプレートごとに少なくとも1つが明白なRNAi表現型ワームが含まれていますので、頻繁に発生する必要があります。関心の表現型は、GFPレポーター遺伝子の発現である場合、GFP(RNAi)をクローンした井戸はロバスト制御(図2)を提供します。このような大きさの変更など、その他の表現型は、容易にBiosort(図3A)で測定することができます。我々は井の中の食べ物が不足しなかったときにワームが非常に低い周波数(<1%、BS、未発表の結果)で、隣接するウェルに移行することができることを観察した。
遺伝子の異なるクラスの機能をノックダウンすると、Cの導入遺伝子の発現に影響を与える可能性がエレガンス 。いくつかは、非特異的組換え遺伝子の発現12に必要とされる。その他、このような組織特異的転写因子として、例えば、表皮GATA因子ELT-3 13は 、細胞の特定のサブセットに必要となります。これは、現在のプロトコルに使用する菌株の非関連および構成表皮細胞遺伝子レポーターコンストラクト(P COL-12 :: DsRed)を含めることの理由の一つです。これは、このような遺伝子が特異的に研究対象の遺伝子の規制プロセス(図3B&C)に関与するものと区別することができます。この遺伝子は、すべての幼虫の段階で表されます。アッセイは、胚で検出する遺伝子発現を伴う場合は、別のコントロールレポーター遺伝子が必要になります。
このプロトコルの技術革新の一つは、彼らの分析を延期する凍結プレートの使用です。凍結は、プレートが実質的に結果を変更せずに二週間にするため、最大保存することができます。測定した蛍光の絶対値が変更される場合がありますが、それらの相対的な比率は、(図4)類似したままになります。 OTで彼女の手、RNAiは、本質的に可変実験手順14である。堅牢な結果を取得し、多くの潜在的な偽陽性を排除するために、RNAiスクリーニングでは、少なくとも一度は、レプリケートする必要があります。実験が成功し実施されている場合は、別の日にテストを1プレートからの結果の間の合理的な相関関係があるはずです。特に、強力な効果を持つ遺伝子は、それらの正確な定量的な効果は重複したプレート(図5)間で同一でない場合でも、明確に識別可能でなければなりません。
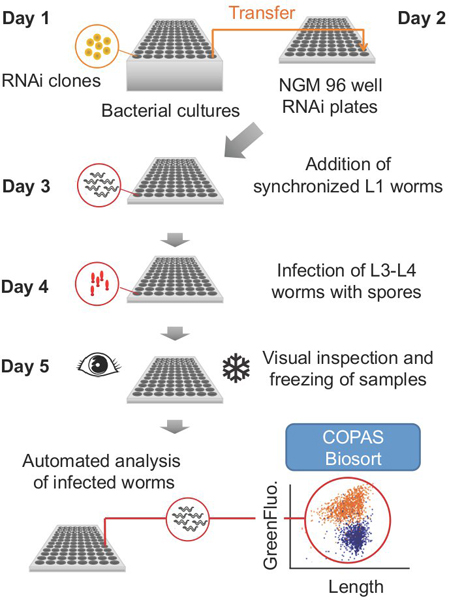
図1典型的な実験のための全体的なスキーム。

図2。GFP発現を標的クローンを用いてRNAiを制御します 。トランスジェニックワームexpressi96ウェルプレートに固形培地上でngの恒常AP COL-12 :: DsRedをレポーターおよび誘導P NLP 29 :: GFPレポーターは、赤と緑色蛍光の同時観察を可能にするフィルタが設定された顕微鏡解剖GFPを用いて可視化。ワームは、コントロール(上部パネル)または48時間GFP RNAiのクローン(下パネル)にさらされた。左側のパネルには、18時間D.感染した後に感染していないワーム、右のワームに関するものであるconiospora。スケールバーは1mmである。

図3。 96ウェルプレートの定量分析 。 COPAS Biosortは、分析ごとにワームの数値データを生成します。ワームは15のサイズは、赤色蛍光(B)およびトランスジェニックWOのTOFに緑色蛍光の比(X100)(C)に対応しています。グラフでは、飛行時間(TOF)の平均と標準偏差を示すRMSは、恒常的に発現しているAP COL-12 :: DsRedをレポーターおよび誘導P NLP 29 :: 18時間D.感染48時間後に別のRNAiのクローンを96ウェルプレートに固形培地上で培養されたGFPレポーター、 coniospora。このように矢印()で強調1、挑発の成長欠陥および/ またはp COL-12の発現に影響を及ぼす:: DsRedタンパク質などの特定のクローン。 (C)に矢印で強調されているように他のものは、具体的には、GFPの発現に影響を与えます。この特定のクローンは以前にNLP 29 13の調節に重要であることが示さ遺伝子NSY 1を対象としています。緑色、赤色蛍光とTOFは任意ですが、定数の単位で測定されます。
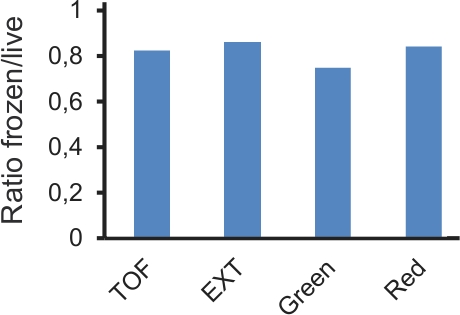
図4。コンプ同じ実験から、ライブと凍結サンプルで得られたデータのアリソン。 P NLP-29 :: GFPとp COL-12 :: DsRedを導入遺伝子を運ぶL4ワームのプレートはどちらD.に感染していたconiosporaかどうか。 18時間後、各プレートは約2に分割された。半分はすぐに分析し、解凍し、分析する前に半分、24時間-80℃で凍結した。平均TOF(ワームのサイズ)、EXT(光学密度)と、緑と赤の蛍光の値は、各サンプルについて計算した。グラフは、冷凍やライブサンプル(それぞれn = 7638と5096、および8634と3850、ワーム、)は、非感染サンプルで割った感染の平均の割合を示しています。

図5。重複した96ウェルプレートの比較分析 。各ウェルで割った正規化蛍光比(平均蛍光比(ここでは、100 *緑/ TOF)代表的な96ウェルプレートの重複した解析から、各ウェルについて( 第 25〜75 パーセンタイル )を各プレートの平均)トリミングされた。
| 材料 | 実験的なタイムライン |
| 木曜日
|
表1に30プレートを1サイクル実験の例。
ここに30枚の1サイクルの実験と9日に開催、ステップ12にステップ1から実験のためのタイムラインに必要な材料を提示しています。
線虫の増殖培地(NGM)、100 mLの:
| 0。3グラム | NaClを |
| 0.25グラム | バクトペプトン |
| 2グラム | BactoAgar |
| 100μL | EtOH中5 mg / mLのコレステロール |
| 100mLに脱イオン水を追加します。 | |
| 121°Cと冷ましで5分間オートクレーブしてから、追加します。 | |
| 100μL | 1 M MgSO 4で |
| 100μL | 1 M CaCl 2を |
| 2.5mLの | 1 M KPO 4 pH6.0の |
96ウェルプレート、100 mL中のRNAi治療のためにNGM:
| 0.29グラム | NaClを |
| 0.25グラム | バクトペプトン |
| 1.7グラム | BactoAgar |
| 100μL | EtOH中5 mg / mLのコレステロール |
| ドを追加します。脱イオン水100 mLを | |
| 121°Cと冷ましで5分間オートクレーブしてから、追加します。 | |
| 100μL | 1 M MgSO 4で |
| 100μL | 1 M CaCl 2を |
| 2.5mLの | 1 M KPO 4 pH6.0の |
| 400μL | 1 M IPTG |
| 100μL | は100 mg / mlのアンピシリン |
| 100μL | 12.5 mg / mLのテトラサイクリン |
漂白剤溶液を、5mLの:
2.5mLのH 2 O
2.3 mLのブリーチ
0.2mLのNaOHを50パーセント
水酸化ナトリウム50%、100 mLの:
50グラムのNaOH
100mLに脱イオン水を追加します。
NaClで50mMのトリトン-0.05%、400 mLの:
4 mLの5 M NaClを
1 mLのトリトン20パーセント
400 mlに脱イオン水を追加します。
2 mLのトリトンX-100
8 mLの脱イオン水
M9バッファー、1L
6グラムのNa 2 HPO 4(MW:178)
3グラムのKH 2 PO 4(MW:136)
5gのNaCl
1 Lの脱イオン水を追加します。
オートクレーブ
1 mLのMgSO 4を 1 Mを追加します。
ルリア培地(LB)、1L:
10グラムリプトン
20gの酵母エキス
10グラムのNaCl
1 Lの脱イオン水を追加します。
オートクレーブ
1 M MgSO 4で 、300 mLの:
73.95グラムのMgSO 4
300mLに脱イオン水を追加します。
室温でオートクレーブや店舗
5 mg / mLのコレステロール、200mLの:
1グラムコレステロール
200mLに100%EtOHを追加する
滅菌フィルタを適用し、室温で保存する
1 M CaCl 2を 、500 mLの:
27。75グラムのCaCl 2
500mLに脱イオン水を追加します。
滅菌フィルタを適用し、室温で保存する
1 M KPO 4 pH6.0で、4 L:
517グラムのKH 2 PO 4(MW:136)
207グラムK 2 HPO 4(MW:174)
4 Lに脱イオン水を追加します。
は100 mg / mLのアンピシリン(Amp)、10 mLの:
1グラムアンピシリン
10mLに脱イオン水を追加します。
-20℃で保存
1 Mイソプロピルβ-D-チオガラクトピラノシド(IPTG)、10 mLの:
2.38グラムIPTG
10mLに脱イオン水を追加します。
-20℃で保存
12.5 mg / mLのテトラサイクリン、100 mLの
1.25グラムテトラサイクリン
100 mLに100%EtOHを追加する
表2。ソリューション。
ディスカッション
現在のプロトコルは、大規模なRNAiスクリーニングでできます。 C.エレガンス読み出しとして蛍光レポーター遺伝子の発現レベルを使用する固体培地上で。それは、効率的で信頼性と再現可能な方法で、多数のサンプルを簡単かつ高速処理を可能にする、ハイスループットアッセイを容易にする自動化ツールで最適化されています。他の方法は、自動液体試料の取り扱い上のように大きく依存していないことが記載されている 8。
プロトコルの1つの重要な組織的な側面は、企業のModulBioと共同でRNAiスクリーニング手順に商用MBioLIMSソフトウェアを適応させることによって、サンプルトラッキングの堅牢な方法の開発がされています。手続きのあらゆる段階で、プレートは今LIMS内で生成されたバーコードによって識別されます。 LIMSまた、各プレートに各ウェルのクローンのIDを記録するように、ウェルから推定される遺伝子に行くのは簡単です。そして、これを越えて、コミュニティデータベースWormBaseへLIMSのリンクは、任意の遺伝子についての分子的および機能的なデータへの直接アクセスを可能にします。 LIMSはまた、プレート、あるいは染色体と全ゲノムレベルで実施する分析を容易にします。これらの分析は、データはそのようなCOPAmulti前述したようにツールと完全に互換性のある方法で格納されている 16。
メソッドの1つの重要な実験点は、ワームの数に比例し、食品の量の調整です。多くのアッセイのために、それはワームは実験の最後に餓死しないことが不可欠であるが、それは開始時にあまりにも多くの食べ物を持っていないようにすることも重要です。我々は、食品の高密度は、pを運ぶ虫を用いたプロトコルで蛍光誘導を減少させることを観察した NLP-29 :: GFPレポーター。これは、ワームはあまりにも多くの細菌(BS、未発表の結果)で培養され減少した感染効率を反映するかもしれません。これは、dsRNAは最適なレベルで生産されているかどうかを決定するので、同時に、RNAiの細菌の培養条件は、も重要です。大規模なRNAiのためのいくつかのプロトコルは、液体培養物を播種する前に、寒天プレート上でのRNAiクローンの培養を必要とする 8。我々はこのステップを省略して堅牢な遺伝子サイレンシングを得た。我々は、同種の結果を確実にするためにそれぞれの文化の過剰成長を選んだ。事実で説明されたプロトコルは、並列に2つまたは3つのスクリーンを行うのに十分な材料を提供する。最も堅牢な結果を得るの利益のために、我々は、ワーム、RNAiの細菌や真菌胞子の独立した培養物を使用して複製の画面を行って、しかし、支持している。
もう一つの重要なステップは、あまりにも高温多湿でも乾燥しすぎでもない媒体を使用してに関連しています。プレートは十分に乾燥されていない場合は、RNAiの細菌が適切に乾燥させないため、ワームは、アッセイ中に泳ぐことになります。これは問題を引き起こす可能性があります。たとえば、ワームは効率的に感染されていません D. coniospora(C. Couillault、未発表結果)。一方、乾燥したプレートに、培地の浸透圧が増加する。これは、ワームの生理に直接影響を持っている 17など、いくつかの抗菌ペプチド遺伝子の誘導など、 NLP 29 18。ワームや胞子を分配するために使用されるボリュームは、効果的かつ迅速な乾燥を可能にすることが重要です。液体以上の10μLを新鮮プレートに添加されている場合は、井戸が乾燥するために多くの時間を取ることができます。これは、プレートにワームを追加するには、ロボットのメソッドを使用することは困難であることを意味します。たとえば、各ワームは、液体の約1μLでBiosortによって分配される。それはまた、私たちは堆積物の溶液中でのワームの傾向を克服することができますように我々は現在、手動でワームを配布しています。
我々は以前に1つの96ウェルプレートを36分で分析することが許可されてBiosortの調整を報告 19。マシンのメーカーUBIは現在さらに分析時間を短縮するBiosortの修正を提供しています。 "FastReFlex"で、試料を直接、バブルトラップフィルタをバイパスして、分析用フローセルを介してルーティングされます。データ収集のための時間の大幅な削減この結果、全体のプレートは、1日あたり処理すべき20枚の周りにできるように22分で解析することができます。プレートは凍結されていない場合は、しかし、最初と最後のものの間で8時間の間隔があるでしょう。わずか18時間持続感染実験の比較的短い期間、与えられた、これは板を越えて受け入れられない変数を導入する。分析前に凍結プレートは、この問題を解決するが、2人は簡単に50プレート週まで処理することができ、現在のプロトコルおよび標準液体ハンドリングロボットとして、それはまた、ハイスループット分析のコンテキストで不可欠であるだけでなく。現在、我々は定期的に全ゲノムの画面を可能にする30枚の週を、画面未満の2ヶ月に一度実施することができます。
一つの興味深い機能は、液体培養では実行できませんアッセイを可能にする、固形寒天を使用している事実である。ワームの生理学では、培養条件に応じて異なりますので 20,21、固体培地上でアッセイを行うことができることは、またいつもの液体ベースの画面を補完することができます。特定の表現型(例えば運動)の場合、解析は96ウェル固体培地プレートで直接行うことができます。現在の画面は、しかし、Biosortのような固体培地プレートからのサンプルができない、ワームが最初に凍結する前に、液体に転送されます。一方、COPAS Biosortは多くの異なった表現型の測定との互換性multiparametric定量分析を可能にします。それは、任意の画面にすべての測定パラメータは、プライマリ読み出しされる可能性がある。それにもかかわらず、これらの測定は、いくつかの理由で役立ちます。彼らは1つがアッセイが正しく実行されたかどうかを判断することができます。例えば、一つは、各ウェル中のワームの数とサイズを確認することができます。 RNAiのクローンは、成長や繁殖を阻止すべき唯一の場所が期待値からの偏差である必要があります。 20未満のワームおよび/または30%小型動物(TOF)とウェルズは、標準に比べて成長に影響はありません標準コントロール(例えば、GFP(RNAi実験))は、以降の分析から除外することができます。それらの開発がうまく進んでいる後にこれらのクローンの機能は、ワームがRNAiの細菌にさらされている請求項代替プロトコルを使用して対処することができます 15。別のパラメータはまた、唯一の緑色蛍光が赤色ではなく影響を及ぼしているものにヒットを制限するたとえば、候補遺伝子(ヒット)選択を絞り込むために使用することができます。ヒットを選択するために選ばれた正確な方法は、画面の種類とその正確な読み出しに依存します。定量的なゲノムワイドな画面から生成されたデータの複雑さを考えると、統計学者とのコラボレーションが必要な場合があります。
我々が記述するプロトコルは、容易にアッセイの他のタイプに適合させることができます。たとえば、感染段階で D. coniospora固体培地に感染することができ、他の病原体によって置き換えることができます。我々は液体培養でセラチア感染の重要な病原因子の多くは、固形培地(E. Pradel、私信)に感染時に役割を果たしていないことを発見したので、これは潜在的に有用である。プロトコルはまた、化学化合物のテストと完全に互換性があります 22から24、または細菌の異なるライブラリを使用して生物活性を有する化合物を識別するために 25そうでは一般的なユーティリティを見つける必要があります C.エレガンス研究コミュニティ。
開示事項
ユーバンクラボでは、連合BiometricaとMODULバイオと協力しています。
謝辞
我々は彼らの貢献のためにD. Braendle、CLクルツとF.Montañana·サンチスに感謝します。このプロジェクトは、ANRとConseilの地域PACAと、INSERMおよびCNRSからの制度資金からの補助金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| BactoAgar | BD診断システム | 214010 | |
| アンピシリン | Sigma-Aldrich社 | A9518 | |
| バクトペプトン | BD診断システム | 211677 | |
| CaCl 2を | すべてのサプライヤー | ||
| AeraSeal接着フィルム | Dutscher | 760214 | |
| イソプロピルβ-D-チオガラクトピラノシド(IPTG) | サーモフィッシャーサイエンティフィック | AB-0481 | |
| K 2 HPO 4 | すべてのサプライヤー | ||
| KH 2 PO 4 | すべてのサプライヤー | ||
| MgSO 4で | すべてのサプライヤー | ||
| NaClを | すべてのサプライヤー | ||
| のNa 2 HPO 4 | すべてのサプライヤー | ||
| NaOHで | すべてのサプライヤー | ||
| 96ディープウェルプレート | サーモフィッシャーサイエンティフィック | AB-0932 | |
| 96ウェル平板 | FALCON | 353072 | |
| 96ウェル丸プレート | FALCON | 353077 | |
| テトラサイクリン | Sigma-Aldrich社 | T8032 | |
| トリトンX-100 | すべてのサプライヤー | ||
| TECANロボット | TECAN | ||
| Liquidator96 TM | レイニン | ||
| COPAS Biosort | 組合Biometrica | ||
| LIMS | MODULバイオ |
参考文献
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854-854 (1998).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14, 2162-2168 (2004).
- Lee, S. S. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nat. Genet. 33, 40-48 (2003).
- Hamilton, B. A systematic RNAi screen for longevity genes in C. elegans. Genes Dev. 19, 1544-1555 (2005).
- Frand, A. R., Russel, S., Ruvkun, G. Functional genomic analysis of C. elegans molting. PLoS Biol. 3, e312-e312 (2005).
- Parry, D. H., Xu, J., Ruvkun, G. A whole-genome RNAi Screen for C. elegans miRNA pathway genes. Curr. Biol. 17, 2013-2022 (2007).
- O'Rourke, E. J., Conery, A. L., Moy, T. I. Whole-animal high-throughput screens: the C elegans model. Methods Mol. Biol. 486, 57-75 (2009).
- Pujol, N. Distinct innate immune responses to infection and wounding in the C. elegans epidermis. Curr. Biol. 18, 481-489 (2008).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1551-8507 (2006).
- Powell, J. R., Ausubel, F. M., Ewbank, J., Vivier, E. Models of Caenorhabditis elegans Infection by Bacterial and Fungal Pathogens. Methods Mol Biol. 415, 403-427 (2008).
- Cardoso, C. XNP-1/ATR-X acts with RB, HP1 and the NuRD complex during larval development in C. elegans. Dev. Biol. 278, 49-59 (2005).
- Pujol, N. Anti-fungal innate immunity in C. elegans is enhanced by evolutionary diversification of antimicrobial peptides. PLoS Pathog. 4, e1000105-e1000105 (2008).
- Simmer, F. Genome-Wide RNAi of C. elegans Using the Hypersensitive rrf-3 Strain Reveals Novel Gene Functions. PLoS Biol. 1, e12-e12 (2003).
- Couillault, C. TLR-independent control of innate immunity in Caenorhabditis elegans by the TIR domain adaptor protein TIR-1, an ortholog of human SARM. Nat Immunol. 5, 488-494 (2004).
- Morton, E., Lamitina, T. A suite of MATLAB-based computational tools for automated analysis of COPAS Biosort data. Biotechniques. 48, xxv-xxx (2010).
- Rohlfing, A. K., Miteva, Y., Hannenhalli, S., Lamitina, T. Genetic and physiological activation of osmosensitive gene expression mimics transcriptional signatures of pathogen infection in C. elegans. PLoS One. 5, e9010-e9010 (2010).
- Lee, K. Z., Kniazeva, M., Han, M., Pujol, N., Ewbank, J. J. The fatty acid synthase fasn-1 acts upstream of WNK and Ste20/GCK-VI kinases to modulate antimicrobial peptide expression in C. elegans epidermis. Virulence. 1, 113-122 (2010).
- Duverger, Y. A semi-automated high-throughput approach to the generation of transposon insertion mutants in the nematode Caenorhabditis elegans. Nucleic Acids Res. 35, e11-e11 (2007).
- Pierce-Shimomura, J. T. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc. Natl. Acad. Sci. U.S.A. 105, 20982-20987 (2008).
- Ruzanov, P., Riddle, D. L. Deep SAGE analysis of the Caenorhabditis elegans transcriptome. Nucleic Acids Res. 38, 3252-3262 (2010).
- Kurz, C. L., Ewbank, J. J. Infection in a dish: high-throughput analyses of bacterial pathogenesis. Curr. Opin. Microbiol. 10, 10-16 (2007).
- Okoli, I. Identification of antifungal compounds active against Candida albicans using an improved high-throughput Caenorhabditis elegans assay. PLoS One. 4, e7025-e7025 (2009).
- Moy, T. I. Identification of novel antimicrobials using a live-animal infection model. Proc. Natl. Acad. Sci. U. S. A. 103, 10414-10419 (2006).
- Ballestriero, F., Thomas, T., Burke, C., Egan, S., Kjelleberg, S. Identification of compounds with bioactivity against the nematode Caenorhabditis elegans by a screen based on the functional genomics of the marine bacterium Pseudoalteromonas tunicata D2. Appl. Environ. Microbiol. 76, 5710-5717 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved