Method Article
의 정량 및 자동화된 고속 처리량 게놈 전체의 RNAi 화면 C. elegans
요약
우리가 사용하는 프로토콜을 설명 C. elegans과 RNAi 먹이 라이브러리. 우리의 안티 - 에게선 타고난 면역에 관여 유전자를 식별하는 화면 중 하나를 예를 들면요 C. elegans.
초록
RNA 간섭은 전체를 게놈 규모와 양적 맥락에서 실시한 특히 유전자 기능을 이해하는 강력한 방법입니다. C로 elegans은 유전자 기능은 특정 유전자 하나에 해당하는 dsRNA을 표현 세균과 벌레를 먹이로 간단하고 효율적으로 무너뜨렸다 수 있습니다. RNAi의 클론의 라이브러리의 생성 C.의 대부분을 커버하면서 elegans 게놈 2,3 진정한 기능적 게놈 연구 (예 : 4-7에 대한 참조)를 위해 길을 열었습니다, 대부분의 설립 방법 힘드는 있습니다. Moy와 동료들은 게놈 - 와이드 스크린에게 8을 용이하게 세미 자동화된 프로토콜을 개발했습니다. 접근 방식은 미세한 이미징 및 이미지 분석에 의존합니다.
여기서 우리는 대안 세균성 RNAi 클론, COPAS Biosort (연합 Biometrica (유비)을)를 사용하여 정량 분석의 로봇 핸들링을 바탕으로 높은 처리량 게놈 - 와이드 스크린을위한 프로토콜, 그리고을 설명통합 소프트웨어 : MBioLIMS (Modul-바이오의 실험실 정보 관리 시스템) 데이터 관리 및 샘플 추적을위한 향상된 처리량을 제공하는 기술입니다. 방법은 화면이 고체 배지 플레이트에 실시 할 수 있습니다. 이것은 C.에 해당 주소 호스트 병원체 상호 작용과 같은 몇 가지 연구를 위해 특히 중요 elegans, 특정 미생물을 효율적 액체 문화 웜 감염되지 않습니다 때문입니다.
우리는 메서드가 C.의 안티 - 에게선 타고난 면역에 유전자의 중요성을 계량하는 데 사용할 수있는 방법을 보여 elegans. 이 경우, 접근 방식에 constitutively 표현된다 항균 펩타이드 유전자 nlp 29 발기인과 빨간색 형광 기자의 통제하에 GFP으로 표피 감염-inducible 형광 리포터 유전자를 나르는 유전자 변형 변형의 사용에 의존 표피. 후자는 표피의 기능 무결성을위한 내부 통제를 제공그리고 특이 현상 transgene은 9 입을. 제어 웜은 균류에 감염되면 그들은 녹색 형광. RNAi 감염 후 감소된 형광의 nlp 29 표현 결과에 필요한 유전자에 의해 아래로 들렸습니다. 현재이 프로토콜은 3,000 명이 넘는 RNAi의 클론이 덜보다 2 개월 만에 전체 게놈을 분석해의 가능성을 열어, 주당 테스트 및 분석 수 있습니다.
프로토콜
아래 설명된 프로토콜 다섯 연속 일 (그림 1)의 단계로 나뉘어져 있습니다. 말씀 드린 바와 같이, 특정 단계는 다른 요일에 할 수 있습니다. 각 단계뿐만 아니라 소재의 수량의 기간은 필수 (예 : 웜, 박테리아, 미디어)는 실험마다 치료를 96도 접시의 수에 따라 달라집니다.
1 일
1. 96 - 웰 NGM RNAi 플레이트의 작성
다음 프로토콜은 서로 다른 솔루션에 대한 살균 기술의 세부 사항을 포함 웜 문화 플레이트 10 달러를 만들기위한 표준 방법에서 적응하고 있습니다.
- 1.7 g BactoAgar, 0.29 g NaCl, 0.25 g 펩톤, 100 μL 콜레스테롤 (EtOH에 5 밀리그램 / ML) : 10-12 96 - 웰 플레이트 들어, deionized H 2 O의 선충류 성장 미디어의 100 ML (NGM)를 준비합니다.
- 압력솥 NGM (121에서 5 분 ° C ~ 100 ML에 대한, 121에서 30 분 ° 4 패위한 C)가 약 50 ° C (그냥 잘만 이노에 있습니다 전까지는 식지) 개최 윽. 그것은 NGM 그것이 응고하지 않도록 충분히 따뜻하게 유지하는 것이 중요합니다.
- 100 ML에 대한 추가 : 2.5 ML 인산 버퍼 pH6 (1M), 100 μL MgSO 4 (1M), 100 μL CaCl 2 (1M), 400 μL IPTG (1M), 100 μL 암피실린 (100 밀리그램 / ML), 100 μL 테트라 싸이클린 (EtOH에있는 12.5 밀리그램 / ML).
- 96 - 웰 평판 바닥 플레이트의 각도에 NGM의 75 μL를 배포합니다. 매체의 응고를 방지하기 위해서는 신속하게 적절하게 사용해야합니다, 그것은 반복적인 디스펜서 (예 Repeatman, Eppendorf)를 사용하시면 편리합니다. 우물에 존재하는 기포가 없는지 확인하십시오.
- 4 ° C.에 습기 챔버 (예 : 하단에 젖은 종이 타월과 유리 섬유 복합 재질의 상자)에 즉시 접시를 저장
참고 : 접시는 미리 주일까지 준비 및 4에 저장할 수 ° C, 이것은 후속 단계의 조직을 쉽게 만들 수 있습니다.
2. 96 DeepWell의 LB 플레이트의 자동 작성
- 암피실린 100μg/mL 및 테트라 싸이클린 12.5 2 ML / 우물의 최대 용량이 96 DeepWell 플레이트의 각도에 μg / ML을 포함하는 1.5 ML의 LB를 준비하고 배포할 수 있습니다. 배포는 로봇 액체 처리 시스템 (예 : TECAN)를 사용하여 최적화된뿐만 아니라 수동으로 필요한 경우 수행할 수 있습니다.
- 4 ° C.에 각 플레이트와 저장소에 커버를 추가 각 96 - 웰 플레이트를 추적하기 위해서는 고유의 라벨 또는 바코드는이 단계에서 또는 이후에, 추가한다.
참고 : 접시는 사전에 2~3일 준비 및 4에 저장할 수 ° C, 이것은 후속 단계의 조직을 쉽게 만들 수 있습니다.
3. 96 DeepWell의 LB 플레이트 (야간 문화)에 RNAi 세균성 클론을 성장
- 원래 RNAi 라이브러리 클론은 라벨이나 표준을 바 - 코딩 96 - 웰 100 μg / ML 앰프와 LB를 포함하는 접시와 12.5 μg / ML T로 384도 형식, 우선 재배포 클론에 처리 이후의 용이성에 대한동부 표준시는 글리세롤 (10 % 최종 농도)로 보충. 원래 384도 접시는 모든 우물의 클론이없는 경우 등 가장 일반적으로 사용되는 "Ahringer"라이브러리의 경우, 딸 판을 구성하는 몇 가지 옵션이 있습니다. 클론은 딸을 판에는 빈 우물이 없을 정도로 다시 배포할 수 있습니다. 이것은 화면으로 접시의 수를 최소화합니다. 이상적으로, 그러나 복제하는 동안, 각 딸 플레이트에 몇 우물은 이러한가 연속적으로 건너 - 플레이트 비교를 용이하게 표준 제어 클론 (긍정과 부정)으로 가득 수 있도록 비워해야합니다. 이러한 96 - 웰 플레이트 딸이 그런 다음 하룻밤 (ON) 문화의 씨앗 96 DeepWell의 LB 플레이트를하는 데 사용됩니다.
모든 액체 처리 단계가 최고의 로봇 액체 처리 시스템 (예 : Tecan) 다되지만, 사용하여 수동으로 수행할 수 있습니다 예를 들어, 96 - 핀 복제. RNAi 라이브러리 클론은 96 - 웰 형식으로 이미있는 경우 3.5 단계로 이동합니다.
날 2
4. 96 - 웰 NGM RNAi 플레이트쪽으로 종자 RNAi 세균성 클론을
이 단계 ON 문화에 따라 아침에 수행되어야한다.
- 4에서 96 - 웰 NGM 번호판을 가지고 ° C와 그들 무균 층류 캐비닛 아래에서 5-15 분 동안 워밍업 말리면. 그렇지 않으면 NGM 그 후 크랙 수 있으므로 너무 오래 후드 (최대 30 분) 아래 번호판을 두지 마십시오. 각 플레이트에 적절한 라벨 / 바코드를 추가합니다.
- 37 ° C.에서 배양 접시에 96 DeepWell를 검색 빈 우물 (빈 우물이 완전히 투명입니다)의 위치를 기록, 이들은 이후의 분석에서 제외됩니다.
- 96 원심 분리기- DeepWell 접시 4,000 rpm으로 5 분 거리에 있습니다.
- 급격히 거꾸로 접시를 돌려 종이 타월에 급속하게 접시의 가장자리를 건조하여 표면에 뜨는 오프 팁. 문화가 재조합 박테리아의 위치로 뜨는는 현지 법규 (예 : autoclaved)에 따라 취급해야합니다.
- 이상적으로 각 플레이트가 정확히 같은 대우를받는 있도록 전용 교반기 (예 Tecan)를 사용, vortexing하여 잔류 액체 (약 50 μL)에서 세균 펠렛을 Resuspend. 그것은 이후의 단계에 대한 정확 세균성 inoculum을 표준화하여 각 무사히 OD 600을 측정할 수도 있지만 이것은 필수 아닌, 우리는 이러한 검사를 수행하지 않습니다.
- 8 또는 12 채널 멀티 피펫을 사용하여 96 - 웰 플레이트에 NGM resuspended 박테리아의 5 μL를 전송합니다. NGM을 만지거나 침투하지 않도록주의하십시오. 이 단계를 수동으로 수행되지만 같은 Liquidator96 (비가)로 로봇을 사용하여 최적화할 수 있도록 그한 번에 96 RNAi 클론의 분포.
- NGM가 너무 건조되기 피하기 위해 정기적으로 점검, 무균 층류 캐비닛 아래 박테리아가 건조하자. 이 단계는 2 시간 정도 소요됩니다.
- 습기 챔버 안에 37 ° C에서 96 잘 RNAi-NGM 번호판을 품어.
5. 벌레의 동기 인구를 준비
이 단계에 대해서는 관심 리포터 유전자 (들) (감염-inducible P nlp-29 :: GFP 구조를 예를 들어 있으며, 내부 통제로 제정 P 중령-12 :: dsRed transgene은 건설) 운반 유전자 변형 웜을 사용 . 때문에 시간이 transgene 표현의 관찰된 감소에 대해, 우리는 벌레 매 6 주간의 신선한 배치를 녹여. 우리는 문화를 사용하기 전에 최소한 2 세대에 대한 웜 및 웜는 분석하기 전에 굶어 죽었 적이 있는지 확인하십시오. 프로토콜의 제 2 일 화요일이라면, 우리는 OP50 박테리아 확산 9cm의 NGM 플레이트 30 젊은 성인 벌레를 배치하여 금요일에 벌레를 준비20 ° C에서, 그들은 화요일 (표 1 참조)에 표백제에 준비가 될 것입니다.
- 표준 프로토콜 10 다음 표백 웜.
- 계란은 L1의 애벌레의 동기 인구를 위해 동요와 25 ° C에서 M9에서 부화하자.
3 일
6. 수유와 RNAi를위한 96 - 웰 RNAi-NGM 플레이트에 벌레를 배포
이 단계는 아침에 수행되어야한다. L1 단계 동기 벌레는 먹이와 RNAi 각 96도 세균성 클론에 배포됩니다.
- 37 ° C에서 96 잘 RNAi-NGM 플레이트를 검색하고 다운 냉각 실내 온도에서 그들을 두십시오.
- 25 ° C.에서 표백된 벌레를 검색 2 μL 당 벌레의 수를 산정 2 μL 당 주위 100-120 벌레를 (대략 한 방울)해야 M9로 조정합니다.
- 수동 반복 디스펜서를 사용하여 각 우물에 L1 단 웜 2 μL를 배포합니다. 웜 (당신이 액체에서 수영 벌레를 볼 수)에 대한 각 우물을 확인합니다.
- 멸균 층류 캐비닛 (최대 1 시간) 아래에있는 번호판을 말리면. 정기적으로 번호판을 확인하고, 벌레가 기어와 수영을 안해야합니다. 조심해, NGM가 너무 건조해서는, 그렇지 않으면 그것은 균열 것입니다.
- 습기 챔버에서 25 ° C에서 접시를 놓습니다.
7. 효과적인 감염 Drechmeria coniospora의 포자를 테스트
이 단계는 현재의 화면에만 적용됩니다. 그것은 고도로 infective의 것들을 선택 포자의 다양한 배치를 테스트로 구성되어 있습니다. 따라서는 하루에 4, 감염의 전날, 가장 가까운 가능한 일을해야합니다. 그것은이 테스트 (표 1)에 대해 사전에 충분한 L3-L4 웜을 준비가 필요합니다. D.에 필요한 세부적인 방법 coniospora 문화는 다른 11 설명되어있다.
<마셨다>4 일
8. D.과 RNAi 노출된 웜 감염 coniospora의 포자
이 단계 30시간 RNAi 벌레가 L3-L4 단계에 도달했을 때 수유 이후에 수행됩니다.
- 당도 4 μL를 배포하는 데 사용할 수있는 포자의 볼륨을 결정합니다.
- 신선한 시각을 수집 M9 버퍼로 선택한 배치에서 coniospora의 포자. 포자의 하나 9cm 판 위해 M9의 8-10 ML을 사용합니다. <리> 반복 디스펜서 각도에 포자의 4 μL를 배포합니다. 포자 (당신이 액체에서 벌레 수영장을 볼 수)에 대한 각 우물을 확인합니다.
- 멸균 층류 캐비닛 (~ 1 시간) 아래에있는 번호판을 말리면. 벌레가 크롤 링을 시작하기 전까지 정기적으로 번호판을 확인합니다. 조심해, NGM가 너무 건조해서는, 그렇지 않으면 그것은 균열 것입니다.
- 습기 챔버에서 25 감염된 접시 ° C를 놓습니다.
5 일
9. 자동 정량 분석하기 전에 접시의 관측 및 저장
이 단계는 감염 후 18 시간이 시작되고 5 일 동안 수행됩니다. 벌레가 알을 낳기 시작한 젊은 성인이 될 것으로 예상된다. 이 단계 동안 표현형는 시각 득점됩니다 중 웜은 일반적인 상황에 따라 감염에 해당하는 녹색 형광, 또는 GFP의 유도는 즉 주어진 우물로 변경되어 침묵 유전자 변화 감염에 대한 응답.
- <리> 신속 형광 해부 현미경으로 번호판을 관찰합니다. 접시가 좋은 일반 GFP 유도 보여주면 다음 단계로 진행, 그렇지 않으면 한 벌레 만도 남은 음식이 여전히 존재로, 더 유도를 위해 오후 때까지 기다립니다.
- 시각마다 접시 점수 및 표시 표현형 (GFP에 대한 표현 예 없음)으로 모든 잘 적어 둡니다. 추가되었을 수있는 컨트롤 RNAi의 클론으로 얻은 결과를 확인함으로써,이 첫 번째 예비 분석 실험 성공 여부의 표시를 제공합니다.
- 로, NaCl 50 MM-트리톤 0.05 %의 100 μL와 8 또는 12 채널 멀티 피펫 송금에게 벌레를 사용하여 새로운 correspondingly 라벨 / 96 잘 둥근 바닥 플레이트 barcoded. -80에서 번호판을 고정 ° C에서 분석까지.
- 분석의 날, 상온에서 번호판을 녹여하고 COPAS Biosort를 사용하여 자동화된 분석을 수행합니다. 분류기는 22 분 안에 하나의 접시를 분석합니다. 접시는 안분석하기 전에 한 시간 이상 상온에서 왼쪽으로, 그들은 다시 냉동 수 없습니다.
- COPAS Biosort에서 얻은 정보는 데이터 품질의 간단한 검증을위한 엑셀 파일에 베꼈는데됩니다. COPAS Biosort (세 가지 다른 감지기에 의해 동시에 광학 밀도 (멸종), 축방향 길이 (비행 시간), 형광 방출)에 의해 측정하는 여러 매개 변수를 원시 데이터는 전용 LIMS 패키지 (MBio LIMS에 저장됩니다 Modul- 이후 상세한 정량 분석을위한 바이오).
10. 대표 결과
대부분의 우물에서 실험 끝에, 위에 주어진 웜 및 박테리아의 수량을 이용하여 동물은 모든 성체로 개발해야하며 여전히 우물에 남은 음식이 있어야합니다. 이러한 조건에서 가장 웰스는 또한 계란을 포함해야합니다. 그럼 잘 Biosort 데이터 f를 구할 것을 각각 성인의 충분한 숫자가 있어야합니다또는 적어도 50 개인 웜. RNAi가 효과적인 경우 반면에, RNAi의 클론 많은 수의 보이는 표현형을 자극합니다. 예를 들어, 웜은 uncoordinated, 또는 좀 더 확실히, 멸균, 또는 자신의 발전에 체포 될 수도 있습니다. 이것은 일반적으로 잘 96 - 웰 플레이트마다 적어도 하나는 분명 RNAi의 표현형와 웜을 포함하고 있으므로, 자주 발생한다. 관심 표현형는 GFP 리포터 유전자의 표현되면, GFP (RNAi) 클론있는 우물은 강력한 컨트롤 (그림 2)를 제공합니다. 같은 크기의 변화와 같은 다른 phenotypes는 쉽게 Biosort (그림 3A)로 측정할 수 있습니다. 우리는 잘있는 음식이 밖으로 대조해 보니 벌레가 매우 낮은 주파수 (<1 %, 학사되지 않은 결과)에 인접한 우물로 마이 그 레이션 있다고 보여집니다.
유전자의 다른 클래스의 함수를 쓰러뜨린 것은 C.에서 transgenes 표현에 영향을 미칠 수 elegans. 일부가 아닌 구체적 transgenes 표현 12 필요합니다. 기타 등조직 특정 전사 인자로서, 예를 들면 표피 GATA 계수 ELT-3 13, 세포의 특정 하위 집합에 필요합니다. 이것은 현재 프로토콜에 사용되는 변형의 비 관련 및 구성적인 표피 세포 transgene 기자 구문 (P 중령-12 :: dsRed)에 포함하는 이유 중 하나입니다. 여기에는 유전자가 특별히 연구 미만 유전자 규제 프로세스 (그림 3B & C)에 관련된 분들 구분할 수 있습니다. 이것은 transgene은 모든 애벌레 단계 동안 표시됩니다. 검정은 배아에서 감지 유전자 발현과 관련된 경우 다른 제어 리포터 유전자가 필요됩니다.
이 프로토콜의 혁신 중 하나는 그들의 분석을 연기하기 위해 냉동 플레이트의 사용이다. 동결은 번호판이 실질적으로 결과를 변경하지 않고도 2 주가에 저장할 수 있습니다. 측정된 형광의 절대 값이 변경될 수 있지만, 그들의 상대적인 비율은 (그림 4)와 유사한 남아 있습니다. 에게도에그녀의 손이, RNAi는 본질적으로 변수 실험 절차 14입니다. 강력한 결과를 얻을 수 있으며 많은 잠재 잘못된 반응을 제거하기 위해 RNAi 스크린은 최소 한 번 복제해야합니다. 실험이 성공적으로 실시하는 경우, 다른 날짜에 검사를 한 접시의 결과 사이에 합리적인 상관 관계가 있어야합니다. 특히, 강한 효과를 유전자들의 정확한 양적 효과가 중복 플레이트 (그림 5) 사이에 동일하지 않더라도 명확하게 식별해야합니다.
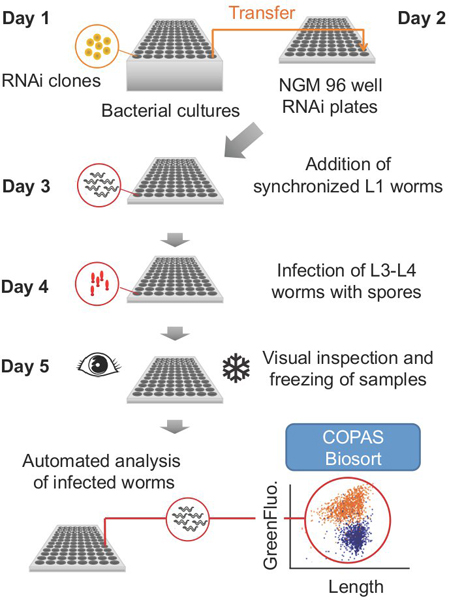
그림 1. 전형적인 실험을위한 종합 계획.

그림 2. 제어 RNAi는 GFP 발현을 대상으로 클론을 사용합니다. 유전자 변형 웜 expressiNG constitutively AP 열-12 :: dsRed 기자와 inducible P nlp 29 :: 96 - 웰 플레이트에서 고체 중간에 GFP 기자는 적색과 녹색의 형광을 동시에 관찰을 허용 필터 세트와 함께 현미경을 해부 GFP를 사용하는 시각. 웜는 제어 (상단 패널) 또는 48 H를위한 GFP RNAi 클론 (하단 패널)에 노출되었다. 왼쪽 패널은 18 시간 D.과 감염 후 감염되지 않은 웜, 웜 오른쪽에있는 사람입니다 coniospora. 눈금 막대는 1mm입니다.

그림 3. 96 - 웰 플레이트의 정량 분석. COPAS Biosort는 분석 각각의 벌레에 대해 수치 데이터를 생성합니다. 웜 15, 적색 형광 (B) 및 유전자 변형 하고요의 TOF에 녹색 형광의 비율 (X100) (C)의 크기에 해당합니다; 그래프 비행 시간에 대한 평균 및 표준 편차 (TOF)를 표시RMS는 constitutively 표현 AP 열-12 :: dsRed 기자와 inducible P nlp 29 :: 18시간 D.과 감염 후 48 H에 대해 서로 다른 RNAi 클론과 함께 96 - 웰 플레이트에 고체 배지에 배양해 있었다 GFP 기자, coniospora. 예 (), 자극의 성장 결함 및 / 또는 P 중령-12 :: dsRed의 표현에 영향을 미칠에서 화살표로 강조 하나로서 특정 클론. (C)에서 화살표로 강조 표시된대로 기타 구체적으로, GFP 발현에 영향을 미칩니다. 이 특정 클론은 이전 nlp 29 13 조절에 중요한 것으로 표시된 유전자 nsy 1을 대상으로하고 있습니다. 녹색, 적색 형광 및 TOF는 임의하지만 일정한 단위로 측정됩니다.
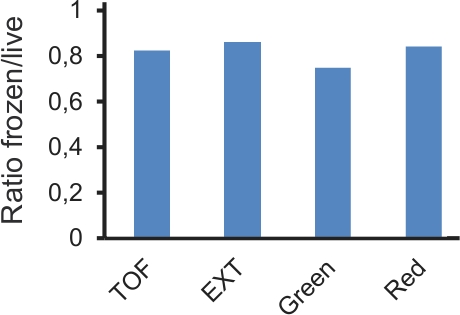
4 그림. 검색같은 실험에서 라이브 및 냉동 샘플로 얻은 데이터 arison. P nlp-29 :: GFP 및 P 열-12 :: dsRed transgenes 들고 L4 웜의 플레이트는 하나 라에 감염되었다 coniospora 여부. 18H 후, 각각의 플레이트는 대략 2 나뉘어되었다; 절반 즉시 분석과 해동 및 분석하기 전에 절반 24 시간 동안 -80 ° C에서 냉동되었다. 평균 TOF (벌레의 크기), EXT (광학 밀도) 및 녹색과 빨간색 형광 값은 각 샘플에 대해 계산되었습니다. 그래프는 평균의 비율을 표시하지 않은 감염된 샘플로 나눈 감염, 냉동 및 라이브 샘플 (각각 n은 = 7638와 5096와 8634와 3850 웜).

그림 5. 중복 96 - 웰 플레이트의 비교 분석. 정규화된 형광 비율 (평균 형광 비율 (여기서, 100 각각 잘 수로 나눈위한 * 녹색 / TOF)대표 96 - 웰 플레이트의 중복 분석에서 각 잘 대해 (25 일 ~ 75 번째 백분 위수) 각 플레이트에 대해 의미) 손질.
| 자료 | 실험 타임 라인 |
| 목요일
|
표 1. 30 접시와 한 사이클 실험의 예.
여기는 구일에 조직된 12 단계로 1 단계의 실험 30 접시의 한 사이클 실험 및 타임 라인에 필요한 자료를 제시하고 있습니다.
선충류 성장 미디어 (NGM), 100 ML :
| 0.3g | NaCl |
| 0.25 g | BactoPeptone |
| 2g | BactoAgar |
| 100 μL | EtOH에 5 밀리그램 / ML 콜레스테롤 |
| 100 ML에 탈이온수 추가 | |
| 121에서 5 분간 압력솥은 ° C와 추가 후, 식지 : | |
| 100 μL | 1 M MgSO 4 |
| 100 μL | 1 M CaCl 2 |
| 2.5 ML | 1 M KPO 4 산도 6.0 |
96 - 웰 플레이트, 100 ML의 RNAi 치료를위한 NGM :
| 0.29 g | NaCl |
| 0.25 g | BactoPeptone |
| 1.7 g | BactoAgar |
| 100 μL | EtOH에 5 밀리그램 / ML 콜레스테롤 |
| 드 추가 이온화된 물 100 ML | |
| 121에서 5 분간 압력솥은 ° C와 추가 후, 식지 : | |
| 100 μL | 1 M MgSO 4 |
| 100 μL | 1 M CaCl 2 |
| 2.5 ML | 1 M KPO 4 산도 6.0 |
| 400 μL | 1 M IPTG |
| 100 μL | 100 MG / ML 암피실린 |
| 100 μL | 12.5 MG / ML 테트라 싸이클린 |
블리치 솔루션, 5mL :
2.5 ML H 2 O
2.3 ML의 블리치
0.2 ML NaOH 50%
NaOH 50 %, 100 ML :
50g NaOH
100 ML에 탈이온수 추가
NaCl 50mM-트리톤 0.05 %, 400 ML :
4 ML NaCl 5 M
한 ML 트리톤 20%
400 ML에 탈이온수 추가
이 ML 트리톤 X-100
8 ML 탈이온수
M9 버퍼, 1L
6g 나 2 HPO 4 (MW : 178)
3g KH 2 PO 4 (MW : 136)
5g NaCl
한 패로 탈이온수 추가
압력솥
한 ML MgSO 4 1 M 추가
Luria 국물 (LB) 1L :
10g BactoTryptone
20g의 효모 추출물
10g NaCl
한 패로 탈이온수 추가
압력솥
1 M MgSO 4, 300 ML :
73.95 g MgSO 4
300 ML에 탈이온수 추가
상온에서 압력솥 및 매장
5 MG / ML의 콜레스테롤, 200 ML :
1g의 콜레스테롤
200 ML에 100 % EtOH 추가
소독 필터링하고 실온에서 보관
1 M CaCl 2, 500 ML :
27.75g CaCl 2
500 ML에 탈이온수 추가
소독 필터링하고 실온에서 보관
1 M KPO 4 산도 6.0, 4 패 :
517g KH 2 PO 4 (MW : 136)
207g K 2 HPO 4 (MW : 174)
4 패로 탈이온수 추가
100 MG / ML 암피실린 (앰프), 10 ML :
1g 암피실린
10 ML에 탈이온수 추가
-20 ° C에서 저장
1 M 이소 프로필 β-D-Thiogalactopyranoside (IPTG), 10 ML :
2.38 g IPTG
10 ML에 탈이온수 추가
-20 ° C에서 저장
12.5 MG / ML 테트라 싸이클린, 100 ML
1.25 g 테트라 싸이클린
100 ML에 100 % EtOH 추가
표 2. 솔루션.
토론
현재의 프로토콜은 대규모 RNAi 심사에 허용 C. elegans 형광 리포터 유전자의 표현의 수준을 같이 읽고 아웃 이용한 고체 매체에. 그것은, 효율적인 신뢰성과 재현성 방식으로, 샘플 다수의 쉽고 빠른 처리를 허용하는 높은 처리량 assays를 촉진하기 위해 자동화된 도구에 최적화되었습니다. 다른 방법은 자동화된 액체 시료 처리에 너무 크게 의존하지 않는 것이 설명되었습니다 8.
프로토콜에 대한 하나의 중요한 조직 양상은 회사 ModulBio와 협력 RNAi 화면 프로 시저로 상용 MBioLIMS 소프트웨어를 채택하여 샘플 추적의 강력한 방법의 개발되었습니다. 절차의 모든 단계에서, 접시는 이제 LIMS 내에 생성된 바코드에 의해 식별됩니다. LIMS는 또한 각각의 접시에 각각 우물에 클론의 신원을 기록으로 우물에서 putative 유전자에가는 것은 간단합니다. 그리고이 넘어, 커뮤니티 데이터베이스 WormBase에 LIMS 링크는 특정 유전자에 대한 분자 및 기능적 데이터에 직접 액세스할 수 있도록합니다. LIMS는 분석이 판 또는 염색체와 전체를 게놈 수준에서 실시하기 용이하게합니다. 이러한 분석은 데이터 등 COPAmulti와 같은 이전에 설명된 도구와 완전히 호환되는 방식으로 저장됩니다 16.
메서드에 하나의 중요한 실험적 포인트는 벌레의 숫자에 상대적인 음식의 수량의 조정이다. 많은 assays 들어, 웜은 실험 끝에 굶어하지 않는 것이 중요하지만 그것은 시작에 너무 많은 음식을 필요하지 않는 것도 중요합니다. 우리는 음식의 높은 밀도는 P를 옮기는 벌레를 사용하여 프로토콜에 형광 유도를 감소 것을 관찰했습니다 nlp-29 :: GFP 기자. 벌레가 (학사되지 않은 결과) 너무 많은 박테리아에서 배양해 때이 줄었 감염 효율이 반영됩니다. 이 dsRNA가 최적의 수준에서 생산 여부를 결정 이후 동시에 RNAi 박테리아의 문화 조건도 중요합니다. 대규모 RNAi에 대한 몇 가지 프로토콜은 액체 배양을 퍼뜨리고하기 전에 한천 플레이트에 RNAi 클론의 문화를 필요로 8. 우리는이 단계를 생략 강력한 유전자 입을를 취득. 우리는 동질적인 결과를 보장하기 위해 각 문화의 과잉 성장을위한하기로했다. 사실에서 설명한 프로토콜은 병렬로 2 개 또는 3 개의 화면을 수행할 수 있도록 충분한 자료를 제공합니다. 가장 강력한 결과를 얻기의 관심에서 우리의 스크린을 실시하지만, 선호 웜, RNAi 박테리아 및 곰팡이 포자의 독립적인 문화를 사용하여 중복.
또 다른 중요한 단계는 너무 습해도 너무 건조하지도 매체를 사용하는 것에 관련이있다. 접시가 충분히 건조되지 않으면 RNAi 박테리아가 제대로 건조되지 않고 웜은 분석 중에 수영 것입니다. 이것은 문제가 발생할 수 있습니다. 예를 들어, 웜이 효과적으로 감염되지 않습니다 디 coniospora 액체의 (C. Couillault, 게시되지 않은 결과). 한편, 건조 접시에 배지 증가 osmolarity. 이것은 웜 생리 기능에 직접적인 영향을 가지고 17, 등 일부 항균 펩타이드 유전자의 유도를 포함 nlp 29 18. 웜 및 포자를 분배하는 데 사용되는 볼륨은 효과적이고 신속한 건조를 허용하는 것이 중요합니다. 액체 중 10 개 이상 μL가 신선한 접시에 추가되면, 우물은 건조 많은 시간이 걸릴 수 있습니다. 이것은 접시에 벌레를 추가하는 로봇 방법을 사용하기 어렵다는 것을 의미합니다. 예를 들어, 각각의 벌레는 액체의 주위에 1 μL의 Biosort에 의해 적절합니다. 그것은 또한 우리가 침전에 대한 솔루션 웜의 경향을 극복할 수있는대로 저희는 현재 수동으로 벌레를 배포합니다.
우리는 이전에 한 96 - 웰 플레이트가 36분에서 분석을 할 수 있도록 Biosort의 조정보고 19. 기계 제조 업체 유비는 이제 더 이상 분석 시간을 줄일 수있는 Biosort의 수정을 제공합니다. "FastReFlex"로 샘플을 직접 버블 트랩 필터를 거치지 않고 분석을위한 흐름 전지를 통해 라우트됩니다. 데이터 수집을위한 시간을 크게 감소의이 결과는, 전체 플레이트가 하루에 치료할 수 있도록 20 접시 주위에있게 22 분 안에 분석할 수 있습니다. 접시는 냉동하지 않은 경우 단, 처음이자 마지막 사람 사이의 8 시간 간격이있을 것입니다. 단지 18 시간 지속되는 감염 실험의 비교적 짧은 기간을 감안할 때, 이것은 번호판에 걸쳐 허용되지 않는 변수를 소개합니다. 냉동 번호판은이 문제를 해결 분석을 이전하지,하지만, 2 사람이 쉽게 50 접시 주일까지 처리할 수있는 현재의 프로토콜 및 표준 액체 처리 로봇과로 그것은 또한 높은 처리량 분석의 맥락에서 중요하다뿐만 아니라. 현재 우리가 일상적으로 화면을 30 접시 주 전체를 게놈 스크린에게 있습니다이하보다 2 개월 만에 한 번 실시합니다.
하나 재미있는 기능은 액체 문화에서 수행할 수없는 assays 수 있도록, 고체 한천을 사용한다는 사실입니다. 웜 생리학은 문화 조건에 따라 다릅니다로서 20,21, 고체 배지에 assays는 또한 일반적인 액체 기반의 화면을 보완 수행할 수있는. 특정 phenotypes (예 : 운동) 내용 분석 96 - 웰 고체 배지 플레이트와 직접 진행하실 수 있습니다. 현재 화면의 경우 그러나, Biosort으로 고체 배지 플레이트에서 맛볼 수없는, 웜 먼저 동결되기 전에 액체로 전송됩니다. 한편, COPAS Biosort는 여러 phenotypes의 측정과 호환 multiparametric 정량 분석이 이루어질 수 있습니다. 그것은 특정 화면에 대한 모든 측정 매개 변수가 기본 읽기있을 가능성이 높습니다. 그럼에도 불구하고, 이러한 측정치는 여러 가지 이유로 유용할 수 있습니다. 그들은 하나가 검정이 올바르게 실행 여부를 확인할 수 있습니다. 예를 들어, 하나는 각 우물에 벌레의 숫자와 크기를 확인하실 수 있습니다. RNAi의 클론 성장 또는 복제를 차단해야만이 곳 예상 값의 편차가 있어야합니다. 20 명 미만 웜 또는 / 30 % 더 작은 동물 (TOF)와 웰스 스탄에 비해dard 성장에 취지만 제어 ( 예 GFP (RNAi))는 이후 분석에서 제외시킬 수 있습니다. 그들의 개발은 물론 고급 후 이러한 클론 기능은 웜은 RNAi 세균에 노출되는 어떤 점에서 다른 프로토콜을 사용하여 해결할 수 15. 다른 매개 변수는 오직 녹색 형광지만 빨간색이 아니라 영향을 미치는 사람을 히트곡을 제한, 예를 들어 후보 유전자 (조회수)을 선택, 수정하는 데 사용할 수 있습니다. 안타를 선택 선택한 정확한 방법은 화면의 종류와 정확한 읽기 아웃에 따라 달라집니다. 양적 게놈 - 와이드 스크린에서 생성된 데이터의 복잡성을 감안할 때, 통계와의 협력이 필요할 수 있습니다.
우리가 설명하는 프로토콜은 쉽게 assays 다른 유형의 적응하실 수 있습니다. 예를 들어, 감염 단계에서 디 coniospora 고체 미디어에 감염될 수있는 다른 병원균에 의해 대체될 수 있습니다. 우리가 액체 문화 Serratia marcescens 감염에 중요한 독성 요소의 많은 고체 매체 (E. Pradel, 개인 통신)에 감염하는 동안 역할을하지 않는 것으로 나타났습니다로서 이것은 잠재적으로 유용합니다. 프로토콜은 또한 화학 화합물의 시험과 완벽하게 호환 22-24 또는 박테리아의 다른 라이브러리를 사용 bioactivity와 화합물을 식별하는 방법 25 그래서의 일반 유틸리티를 발견해야 C. elegans 연구 커뮤니티입니다.
공개
Ewbank 연구실 연합 Biometrica 및 Modul-바이오와 협력.
감사의 말
우리는 그들의 공헌에 대해 D. Braendle, CL Kurz와 F. Montañana-Sanchis 감사드립니다. 이 프로젝트 ANR과 Conseil 지역 PACA와 INSERM과 CNRS의 기관 자금 지원에서 교부금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| BactoAgar | BD 진단 시스템 | 214,010 | |
| 암피실린 | 시그마 - 올드 리치 | A9518 | |
| BactoPeptone | BD 진단 시스템 | 211,677 | |
| CaCl 2 | 모든 공급 업체 | ||
| AeraSeal 접착 필름 | Dutscher | 760,214 | |
| 이소 프로필 β-D-Thiogalactopyranoside (IPTG) | 써모 과학 | AB-0481 | |
| K 2 HPO 4 | 모든 공급 업체 | ||
| KH 2 PO 4 | 모든 공급 업체 | ||
| MgSO 4 | 모든 공급 업체 | ||
| NaCl | 모든 공급 업체 | ||
| 나 2 HPO 4 | 모든 공급 업체 | ||
| NaOH | 모든 공급 업체 | ||
| 96 깊은 우물을 판 | 써모 과학 | AB-0932 | |
| 96 잘 플랫 플레이트 | 매 | 353,072 | |
| 96도 회전 플레이트 | 매 | 353,077 | |
| 테트라 싸이클린 | 시그마 - 올드 리치 | T8032 | |
| 트리톤 X-100 | 모든 공급 업체 | ||
| TECAN 로봇 | TECAN | ||
| Liquidator96 TM | 비가 | ||
| COPAS Biosort | 연합 Biometrica | ||
| LIMS | Modul - 바이오 |
참고문헌
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854-854 (1998).
- Kamath, R. S., Ahringer, J. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30, 313-321 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14, 2162-2168 (2004).
- Lee, S. S. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nat. Genet. 33, 40-48 (2003).
- Hamilton, B. A systematic RNAi screen for longevity genes in C. elegans. Genes Dev. 19, 1544-1555 (2005).
- Frand, A. R., Russel, S., Ruvkun, G. Functional genomic analysis of C. elegans molting. PLoS Biol. 3, e312-e312 (2005).
- Parry, D. H., Xu, J., Ruvkun, G. A whole-genome RNAi Screen for C. elegans miRNA pathway genes. Curr. Biol. 17, 2013-2022 (2007).
- O'Rourke, E. J., Conery, A. L., Moy, T. I. Whole-animal high-throughput screens: the C elegans model. Methods Mol. Biol. 486, 57-75 (2009).
- Pujol, N. Distinct innate immune responses to infection and wounding in the C. elegans epidermis. Curr. Biol. 18, 481-489 (2008).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1551-8507 (2006).
- Powell, J. R., Ausubel, F. M., Ewbank, J., Vivier, E. Models of Caenorhabditis elegans Infection by Bacterial and Fungal Pathogens. Methods Mol Biol. 415, 403-427 (2008).
- Cardoso, C. XNP-1/ATR-X acts with RB, HP1 and the NuRD complex during larval development in C. elegans. Dev. Biol. 278, 49-59 (2005).
- Pujol, N. Anti-fungal innate immunity in C. elegans is enhanced by evolutionary diversification of antimicrobial peptides. PLoS Pathog. 4, e1000105-e1000105 (2008).
- Simmer, F. Genome-Wide RNAi of C. elegans Using the Hypersensitive rrf-3 Strain Reveals Novel Gene Functions. PLoS Biol. 1, e12-e12 (2003).
- Couillault, C. TLR-independent control of innate immunity in Caenorhabditis elegans by the TIR domain adaptor protein TIR-1, an ortholog of human SARM. Nat Immunol. 5, 488-494 (2004).
- Morton, E., Lamitina, T. A suite of MATLAB-based computational tools for automated analysis of COPAS Biosort data. Biotechniques. 48, xxv-xxx (2010).
- Rohlfing, A. K., Miteva, Y., Hannenhalli, S., Lamitina, T. Genetic and physiological activation of osmosensitive gene expression mimics transcriptional signatures of pathogen infection in C. elegans. PLoS One. 5, e9010-e9010 (2010).
- Lee, K. Z., Kniazeva, M., Han, M., Pujol, N., Ewbank, J. J. The fatty acid synthase fasn-1 acts upstream of WNK and Ste20/GCK-VI kinases to modulate antimicrobial peptide expression in C. elegans epidermis. Virulence. 1, 113-122 (2010).
- Duverger, Y. A semi-automated high-throughput approach to the generation of transposon insertion mutants in the nematode Caenorhabditis elegans. Nucleic Acids Res. 35, e11-e11 (2007).
- Pierce-Shimomura, J. T. Genetic analysis of crawling and swimming locomotory patterns in C. elegans. Proc. Natl. Acad. Sci. U.S.A. 105, 20982-20987 (2008).
- Ruzanov, P., Riddle, D. L. Deep SAGE analysis of the Caenorhabditis elegans transcriptome. Nucleic Acids Res. 38, 3252-3262 (2010).
- Kurz, C. L., Ewbank, J. J. Infection in a dish: high-throughput analyses of bacterial pathogenesis. Curr. Opin. Microbiol. 10, 10-16 (2007).
- Okoli, I. Identification of antifungal compounds active against Candida albicans using an improved high-throughput Caenorhabditis elegans assay. PLoS One. 4, e7025-e7025 (2009).
- Moy, T. I. Identification of novel antimicrobials using a live-animal infection model. Proc. Natl. Acad. Sci. U. S. A. 103, 10414-10419 (2006).
- Ballestriero, F., Thomas, T., Burke, C., Egan, S., Kjelleberg, S. Identification of compounds with bioactivity against the nematode Caenorhabditis elegans by a screen based on the functional genomics of the marine bacterium Pseudoalteromonas tunicata D2. Appl. Environ. Microbiol. 76, 5710-5717 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유