このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
心筋虚血再灌流障害のマウスクローズド胸モデル
要約
外科手術による外傷、炎症反応を誘導する。サイトカイン、内因性リガンドは、虚血再灌流後に心筋梗塞サイズを調節することが知られています。我々は、開胸の影響を最小限に抑えるためにぶら下がって重みを使用してマウスの虚血再灌流の変更されたクローズド·胸のモデルを提示します。
要約
冠状動脈結紮の開胸モデルにおける開胸による外科手術による外傷、虚血再灌流に関与するさまざまなメカニズムを変更する免疫応答を誘導する。免疫応答は、自然免疫受容体の内因性リガンドのサイトカイン発現および放出または分泌が含まれています。自然免疫の活性化は、潜在的に梗塞サイズを調節することができる。我々は、心筋プリpostconditioningと心筋虚血再灌流における自然免疫の役割を研究するための役に立つかもしれませんぶら下がって重みを使用して、既存のマウスクローズド胸モデルを変更しました。このモデルでは、動物は心筋虚血の発症前に外科手術による外傷から回復することができます。
揮発性麻酔薬は、熱心に研究されており、虚血性心のために彼らの前処理効果はよく知られています。しかし、この保護効果は、冠動脈結紮の開胸モデルにおけるその使用を排除します。したがって、別の利点は番目の利用可能性慢性閉胸モデルの計測のためのeうまく制御揮発性麻酔薬は、その前処理の効果は72時間まで持続するからである。間欠的な虚血と複数のヒットモデルと慢性心疾患は、このモデルの他の可能なアプリケーションです。
慢性閉胸モデルでは、気管内挿管と換気のマウスは、第四肋間を介して横方向の鈍胸を受けています。字を左前次の識別は、容器の下に渡され、両方の縫合糸の端は、オクルーダ通しています。その後、両方の縫合糸の端がループを形成するために結ばれ、胸壁を通過して皮下組織に残されます。胸閉鎖と5日間の回復後、マウスを再度麻酔ですが、胸の皮膚が再開され、絞首刑の重みはECG制御下にあるループにフックアップされています。
虚血/再灌流プロトコルの終わりに、心は脳梗塞のためにTTCで染色することができますサイズは、アセスメントや組織学および免疫組織化学に加えて形態学的研究を可能にするために灌流固定を受けています。
プロトコル
1。麻酔導入
- イソフルランと誘導するために、3.0体積%および0.5 L / minの酸素流量に蒸気·セットに接続されているインダクションボックスにマウスを置きます。
- 無意識が応答しないという前肢や後肢ペダル撤退反射を誘発するために失敗した触覚刺激によって達成された後、仰臥位で温度制御された手術台の上にマウスを置きます。インダクションボックスを経由して蒸気に接続されている鼻の円錐の上に麻酔を維持しています。挿管を容易にするために、5から0ナイロン縫合糸で上顎を固定して頭を倒し。
- 37℃で体内深部の温度を維持するために直腸の温度プローブを挿入℃にテープで四肢を固定します。左胸を開いて、より良い心臓を露出させ、右脚上の左下の足を渡ります。
- 首と左胸に脱毛クリームを適用します。 1分後にクリームを拭き取ってください。局所的な皮膚のためにポビドンヨードを適用します。消毒。皮下に痛みの軽減のためのブプレノルフィンは0.05 mg / kg体重を注入します。
- 小さなはさみと正中線の首の皮膚切開を行います。気管を覆う腺、筋肉を解剖鈍らせる。人工呼吸器の電源をオンにします。人工呼吸器の設定は、生理的パラメータを調整する必要があります。我々はMinivent、ヒューゴサックスElektronik社、105/minの呼吸数と200μlの一回換気量とハーバード装置を使用しています。鉗子で舌を引っ張り、穏やかに22 Gの金属管を挿入します。気管や胸の動き内部管の直接可視化によって挿管を確認します。
- 実験空間の汚染を防ぐためにガスチューブを無駄に切り替えることにより、インダクションボックスをバイパスします。 2.0体積%に蒸気を調整します。
2。開胸術
- 左鎖骨中央線の皮膚切開を行います。腋窩に向かって皮下組織を解剖鈍らせる。主要な胸筋の境界を識別し、マイナーpからそれを分析鈍らせるectoralis筋肉の下に。右にマイナー胸筋を引き出します。あなたは、胸郭の直接的なビューを得ることができます。
- 識別し、ぶっきらぼうに鉗子で第4肋間スペースをpentetrate。鉗子の先端が自分で操作テーブルに取り付けられたゴムバンドで調整されているトラクターを挿入できるように肋間スペースにまたがってみましょう。あなたは、左心耳を含む心臓の明確な見解を持っている必要があります。このアクセスは通常、電気凝固を必要とせずにこのように任意の血液を失うことなく達成されています。
3。心の準備
- 優しく心を傷つけることなく心をやってのける。
- 左心室の前壁から左心耳上に持ち上げて、左前下行枝(LAD)を識別します。 LADは、ぼやけた境界線と静脈に比べて、鮮やかな赤色の短い直線コースで見られます。
4。冠動脈計装
- U字型にそれを形成することにより、テーパーニードルチップで8から0プロレン縫合糸を準備します。 LADの下に十分な深心筋を通して針を渡します。
- それぞれの側で縫合の1cmを持つ縫合針の端を切り落とした。
- 任意の鋭角を防ぐ遮蔽として1ミリメートルPE-10チューブセクションを切った。オクルーダは、アルコールdesinfectionにつかると、使用する前にタップすることができます注 :チューブが適切に4を滅菌するために24時間100%エタノールに浸漬する必要があります。
- 遮蔽の両方を通じて縫合糸の端を通します。
- 両方の縫合糸は、上部肋間領域が不足して終了し導くためにサイズ3 Kaltの縫合針を使用しています。
5。胸の閉鎖
- 6から0プロレン縫合糸と一緒に開かれた肋間の上部と下部の肋骨を結ぶ。あなたは胸を閉じる前には5.2に進んでください。
- 開くにはいくつかの呼吸サイクルの間肺を超インフレにする呼気チューブをクランプすることによって無気肺をバックアップします。この操作でも使用する人工呼吸器のタイプによって異なります。胸が閉じられるまで、一回換気量を300μlに設定します。
- 戻って200μlに人工呼吸器換気量を設定します。
- 彼らがループを形成しているように8から0 LAD結紮縫合糸の両端を接続します。
- ECGを添付してください。
- 8から0ループに重みをフックアップし、重みは慎重にハングアップしてみましょう。あなたは、いくつかのハートの中にST上昇著しいが表示されます。重みを解放します 。 注 :これらの実験は、体重の5.5グラムの合計を使用していますが、重量はひずみとマウスの体重に基づいて異なる可能性があります。
- 皮下ポケットにループを配置し、6から0まで、単一の結び目縫合糸で皮膚を閉じます。
- マウスが温暖化のランプの下に抜管後に回復しましょう。
6。心筋虚血再灌流障害
- 少なくとも5日間の回復期間は、ケタミン、キシラジンの混合物で麻酔を誘導した後とアトロピン(4ミリリットル/ kg体重、ケタミン10 mg / mlの、キシラジン2 mg / mlの、アトロピン0.06 mg / mlと、1。
- 挿管および虚血再灌流実験のために部屋の空気を換気する。
- 胸の縫合、皮膚を開きます。 8から0縫合糸ループを準備します。 ECGを添付してください。
- 重みをフックアップし、それらがハングアップしましょう。あなたの血のプロトコルに従ってください。 ST上昇2の潜在的な溶解のために心電図を監視します。
- 虚血の終わりに重みを解放します。皮膚を閉じるには、マウスを抜管し、それが回復しましょう。
7。最大3日まで再灌流時の梗塞サイズの評価
- 希望する再灌流時間の終わりに、マウスを麻酔し、挿管。
- xyphoidに正中線で胸の皮膚を切り取ります。腹部を開き、胸郭下に横隔膜を切った。鎖骨中線の両側の開胸をカットします。
- 心臓への遮るもののないアクセスを得るために縫合したフラップ前胸壁を修正します。
- 慎重に8から0縫合糸ループを準備します。ループをカットし、LADを閉塞するために結び目を作る。
- 左心房に10パーセントフタロブルーを注入します。心臓の容量負荷を防ぐために、徐々に染めると、時々吸引し注入します。
- 左心房に塩化カリウムを注入します。これは、同じ梗塞サイズの評価のための拡張期に心を逮捕します。
- 心を切断容易にするために、できるだけ心臓外の組織のほどを残して、心臓を切り取ります。
- リン酸緩衝液中で心を洗う。
- イソペンタン、液体窒素中で心をフリーズします。軽く凍結するまで、あるいは、心が冷凍庫に配置することができます。
- 1mmのスライスの心臓を切り取ります。私たちは、均等なスライス( 図4)心臓を切るためにかみそりの刃で作られたスライスのデバイスを持っています。心臓が正常に心臓の長軸に対して垂直に切断するように配置されていることを確認してください。
- 20分間37℃で1.5%TTCのスライスをインキュベートします。ここで、我々は、96ウェルプレートを使用各スライスは、1つのウェルに配置されます。これはTTCを保存し、あなたのアーティファクトを防ぐために、ワットマンフィルタの使用を惜しまれます。
- 一晩、4%ホルムアルデヒドでスライスを修正します。これは、スライスを縮小しますが、染料のコントラストを向上させます。
- 顕微鏡スライド上にスライスを入れてください。別のスライドでカバーしています。スライドの各端に1 mmの金属製のスペーサを使用して、ペーパークリップと一緒にスライドを保持します。
- 各スライスの両面からデジタル画像を取る。常に同じ設定を使用して、より小さなスライスにズームインされません。
- 面積測定用のソフトウェアを使用しています。我々は、NIHでImageJを使用しています。常に梗塞の領域で同じ基準を使用して、例えば、唯一の白の領域が梗塞されています。ピンクがかった白の領域が梗塞されていません。我々は同様の介入と面積測定のために調査官を盲目にしています。
8。組織学のための代替ハートの準備
- 7.2手順7.1に従います。および8.2に進んでください。 TTC染色で信頼性の高い梗塞の評価は7内で行うことができます再灌流のため瘢痕収縮の2時間。
- すべての心臓外の組織をオフに準備し、大動脈基部をカバーする胸腺の解剖鈍らせる。
- ピンセットで上行大動脈を取得し、できるだけ少ない心外組織と心臓を切り取ってください。
- 心筋保護液で穏やかに心を洗って絞る。
- 心筋保護液で満たされたp35の皿に心を置きます。
- 上行大動脈を準備します。
- ホルムアルデヒドが事前に入力されたカニューレと上行大動脈にカニューレを挿入。我々は、亜鉛-ホルマリン固定し、24 G IVの3行を使用しています 。
- 左耳と左心房の間に穴を開けます。
- それに接続されている16センチメートル長いチューブで左心房に26 Gカテーテルを挿入します。また、PE50チューブを使用することができます。
- ホルマリン固定した10分間の心を灌流。
- 7℃で24時間の最大値のために固定で満たされたチューブに心を置く
- 準備を続行組織学/免疫組織化学のためのaration。
9。代表的な結果
慢性冠動脈結紮では、複数の落とし穴を持つ複雑なテクニックです。それが習得されると、しかし、それは非常に低い死亡率と信頼性の高い結果で行うことができます。マウスや心臓へのアクセスの最適なポジショニングは、LADの成功識別や計測のために極めて重要である。ライゲーションの位置は明らかにこのように標準化された連結部位を持つことを要求、梗塞サイズに影響を与えます。中隔枝が影響を受ける場合にも、これが脚ブロックの代わりにST上昇につながる可能性があります。 epimyocardial静脈から、または心室からの出血、結紮が深すぎる場合、発生する可能性があり、出血が過剰であればマウスは除外する必要があります。 Pericardは、できるだけ完全に削除する必要があります。 pericardのままにしておくと、ライゲーションmyocardに針を押して悪化します。また、最終的には、心膜炎の原因になります癒着を誘発し、組織学的検査が困難になります。 PE-オクルーダはmyocardに外傷を最小限に抑えるために、任意の鋭角なく、できるだけ短くしてください。肺の過膨張は、胸の閉鎖後、緊張性気胸を防ぐために不可欠です。胸腔ドレナージの必要はありません。引っ張ってテンションを制御することは困難であるため、縫合糸の端部が省略されなければなりません引いて開胸でライゲーションの正しい位置のテスト。 LADの計測が失敗した場合、これが心筋に外傷や浮腫が追加されますので、さらなる試みは避けるべきである。
信頼性の高い結果を達成するために、プロトコルパラメータは、標準化すべきである。したがって、マウスは、気管内挿管と換気室内の空気と、体温がしっかりとフィードバックシステムで制御されています。ぶら下がって重みの使用は、既に強調されています。他の引きのデバイスは、緊張の損失や非標準引っ張ってテンションの欠点を持っています。虚血性の再灌流と閉塞の複数のサイクルの前とpostconditioningプロトコルは、より簡単に彼らは解除する必要があります( 図1)ハングアップさせるために重みを掛けて行われます。
梗塞領域(白)はリスクの領域(赤)とリスク(青)( 図2A-B)で非領域から区別する必要があります。梗塞サイズは、虚血の持続時間に依存しています。再灌流時間は、成功したTTC染色( 図1および2)を可能にするために少なくとも2時間でなければなりません。最も重要なのは、サイトカインRNAの発現は、心筋梗塞( 図3A-C)を受けた動物に比べて虚血再灌流を除くすべての外科手術を持っていた偽手術動物で低くなっています。
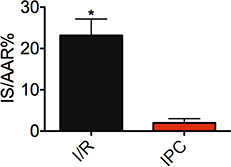
図1は、。リスク(IS / AAR%)で領域の割合でサイズを梗塞。マウスは、1に続いて30分の虚血を受けた再灌流の20分(I / Rは、n = 10)。 IPC:虚血性postconditioning、マウスは再灌流/閉塞の3サイクル20秒ごとに続いて虚血の30分を受けた(n = 6、* P <0.05を示す)。

図2A。代表的なTTC染色した心臓のスライス。ホワイト:梗塞領域、赤:リスク領域、青:非閉塞部位。

図2B。梗塞(白)地域の代表的スライス。頂点に左心室の近くの円錐形のために、epimyocardが平面領域として表示され、地物の測定(青/ピンク外側の領域)のために考慮すべきではないことに注意してください。赤= TTC染色された実行可能なmyocard。
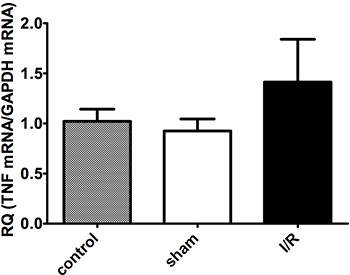
図3A。私に有意差ocardial 30分虚血後のTNF-αmRNAの発現と再灌流120分。 N =グループあたり4-6。
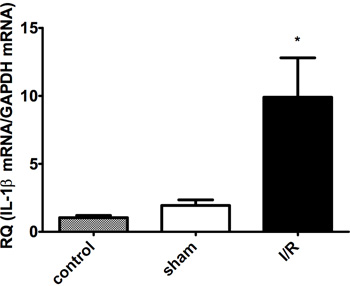
図3B。心筋30分虚血後のIL-1βmRNA発現と120分の再灌流(I / R)。コントロール(無手術)と偽手術(非虚血/再潅流)は、グループ間に有意差はありません。 nはグループごとに= 4-6、*はp <0.05を示しています。
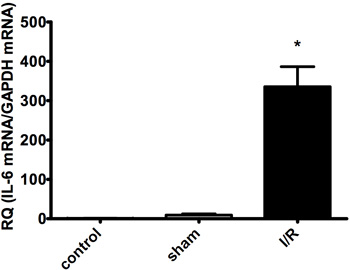
30分虚血後の図3C。心筋IL-6 mRNAの発現と120分の再灌流(I / R)。コントロール(無手術)と偽手術(非虚血/再潅流)は、グループ間に有意差はありません。 nはグループごとに= 4-6、*はp <0.05を示しています。

図4A-C。聞くtは、デバイスを切断する。 :カット位置にカミソリの刃を閉じた。 B:オープンで、サイドビュー。 C:オープン、フロントビュー。心はかみそりの刃(矢印)に、その長軸に垂直に白いプラスチック製の床の溝に整列されます。
ディスカッション
我々は左側臥肋間開胸を介して心臓にアクセスし、左鎖骨中央線で胸部にLAD縫合糸を導くことによってマウスクローズド胸モデルを変更しました。骨胸郭はそのままにして、外傷を最小限に抑えるため鎮痛剤、手術部位感染に必要な、したがって、回復を促進します。左内哺乳類動脈を維持することで電気焼灼器は必要ありません。我々は、後で簡単にアクセスするための皮下組織の縫合糸?...
開示事項
利害の衝突が宣言されません。
謝辞
我々は、灌流固定技術に関する彼のアドバイスをダニエルDuerrに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| 蒸気 | DrägerwerkAG | Isoflo | |
| 顕微鏡 | ライカ | M80 | |
| 光源 | ショット | KL 1500 LCD | |
| 恒温毛布·コントロール·ユニット | ハーバード装置 | ||
| MiniVentタイプ845 | ヒューゴサックスElektronik社 | ||
| 8から0プロレン | エチコン | BV130-5 6.5ミリメートル3/8c | |
| 6から0プロレン | エチコン | BV-1 9.3ミリメートル3/8c | |
| Kalt縫合針のサイズ3 | FST | 12050から03 | |
| トリフェニルテトラゾリウム | シグマアルドリッチ | 93145 | |
| フタロブルー | Heucotech LTD | ||
| PowerLab | ADInstruments |
参考文献
- Lim, S. Y., Davidson, S. M., Hausenloy, D. J., Yellon, D. M. Preconditioning and postconditioning: the essential role of the mitochondrial permeability transition pore. Cardiovasc. Res. 75, 530-535 (2007).
- Eckle, T., Koeppen, M., Eltzschig, H. Use of a Hanging Weight System for Coronary Artery Occlusion in Mice. J. Vis. Exp. (50), e2526 (2011).
- Michael, L. H. Myocardial infarction and remodeling in mice: effect of reperfusion. Am. J. Physiol. 277, H660-H668 (1999).
- Nossuli, T. O. A chronic mouse model of myocardial ischemia-reperfusion: essential in cytokine studies 52. Am. J. Physiol. Heart Circ. Physiol. 278, H1049-H1055 (2000).
- Irwin, M. W. Tissue expression and immunolocalization of tumor necrosis factor-alpha in postinfarction dysfunctional myocardium 846. Circulation. 99, 1492-1498 (1999).
- Michael, L. H. Creatine kinase and phosphorylase in cardiac lymph: coronary occlusion and reperfusion. Am. J. Physiol. 248, 350-359 (1985).
- Tonkovic-Capin, M. Delayed cardioprotection by isoflurane: role of K(ATP) channels 765. Am. J. Physiol. Heart Circ. Physiol. 283, H61-H68 (2002).
- Tsutsumi, Y. M. Role of caveolin-3 and glucose transporter-4 in isoflurane-induced delayed cardiac protection. Anesthesiology. 112, 1136-1145 (2010).
- Benedict, P. E., Benedict, M. B., Su, T. P., Bolling, S. F. Opiate drugs and delta-receptor-mediated myocardial protection. Circulation. 100, II357-II360 (1999).
- Ren, X., Wang, Y., Jones, W. K. TNF-alpha is required for late ischemic preconditioning but not for remote preconditioning of trauma. J. Surg. Res. 121, 120-129 (2004).
- Andrassy, M. High-mobility group box-1 in ischemia-reperfusion injury of the heart. Circulation. 117, 3216-3226 (2008).
- Kim, S. C. Extracellular heat shock protein 60, cardiac myocytes, and apoptosis. Circ. Res. 105, 1186-1195 (2009).
- Lin, L. HSP60 in heart failure: abnormal distribution and role in cardiac myocyte apoptosis. Am. J. Physiol. Heart Circ. Physiol. 293, 2238-2247 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved