このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ソート幹細胞アッセイおよびフローの原発性脳腫瘍組織の処理
要約
脳腫瘍開始細胞(BTICs)、幹細胞特性を有する異種腫瘍内の希少な細胞の同定は、ヒトの脳の腫瘍の病因に新たな洞察を提供しています。我々はBTICsを濃縮するために、特定の培養条件を改良しており、我々は日常的に、さらに、これらの集団を豊かにするためにフローサイトメトリーを使用しています。単一細胞RT-PCR法による自己再生アッセイおよび転写産物の解析が続いてこれらの単離された細胞で行うことができます。
要約
脳腫瘍は、通常、神経系マーカーの多様な表現形態学的に多様な細胞で構成されています。幹細胞の特性を備えた腫瘍内の細胞の唯一の比較的小さな部分と呼ばれる脳の腫瘍開始細胞(BTICs)は、複数の系統に沿って分化、自己複製、及びin vivoで腫瘍を開始する能力を持っています。私たちは、もともと人間の脳の腫瘍の様に通常の神経幹細胞(NSC)のために使用され、この培養方法は、具体的に幹細胞様集団を選択することがわかった培養条件を適用しています。無血清培地(NSC)は未分化幹細胞状態の維持を可能にし、bFGFおよびEGFの添加は、マルチ強力な増殖を可能にする、自己再生、拡張可能tumorspheres。
さらに各腫瘍のBTIC人口を特徴付けるために、我々は、フローサイトメトリーにより細胞表面マーカーを評価します。我々はまた、より具体的なcharacterizため興味のある集団を並べ替えることもできation。自己再生アッセイは、96ウェルプレートにソート単一BTICs上で実行されます。tumorspheresの形成は37℃インキュベーションに続いて℃で幹細胞または前駆細胞の存在を示しています。特定の集団の複数のセル番号は、自己再生能力を分析するために、希釈分析を制限するための異なるウェルに並べ替えることができます。我々はまた、単一細胞RT-PCR法を使用して、特定の細胞集団内で異なる遺伝子発現を調べることができます。
次のプロトコルはBTIC集団、ならびにtumorspheresの解離のために豊かにするために、プライマリヒト試料の解離および培養のための私達の手順について説明します。また、フローサイトメトリー分析やソート、自己複製アッセイ、および単一細胞RT-PCRのために染色するためのプロトコルも含まれています。
概要
脳腫瘍は、ヒトでは知られている最も積極的かつ異種の癌の一つです。彼らの早期発見と診断が現代のニューロイメージング技術によって促進されてきたが、我々はまだ、特にびまん性、侵襲性のもの、あるいは脳の奥深くに位置するもののために、多くの脳腫瘍の治癒を目指した治療法を欠いている。
脳腫瘍は、彼らの非常に積極的かつ頻繁に不治の性質に起因する小児におけるがん死亡の主要な原因を表す。神経膠芽腫(GBM)の、大人の中で最も一般的な原発性脳腫瘍は、その一様に致命的な予後1の恐れ、最も積極的なヒトの癌の一つです。この高度悪性星細胞腫(WHOグレード4)は、通常成人の大脳半球に発生し、また、幼い子供や乳児に発生する可能性があります。その成長は、迅速かつ浸潤であり、診断病理学的特徴は、核多形性、微小血管の増殖、壊死2,3が含まれています。 adul用新たに診断されたGBMのtsは、生存期間の中央値はほとんどすべての治療法に一般的に貧しい応答で、12ヶ月の1を超えて拡張しません。私たちは、体性幹細胞とがん細胞が共有する多くの機能と遺伝的類似性があることに留意し、正常な脳の発達を調節する分子経路はしばしば癌で異常調節されていること。脳腫瘍の研究に幹細胞生物学のパラダイムを適用することで、我々は将来に向かってin vitroで4とで増殖、自己再生および分化の幹細胞の特性を示した人間性GBMからの細胞の亜集団を特定し、浄化した最初の研究者であった生体内 5。私たちは、もともと複数の小児および成人の脳腫瘍にインビトロ 6,7 で正常な神経幹細胞(NSC)を特徴づけるために使用される培養条件およびアッセイを適用、及びCD133 8神経前駆細胞表面マーカーのために細胞選別によって、これらの幹細胞様細胞が濃縮さ、9。 CD133 +脳腫瘍率は、NOD-SCIDマウスの脳の5,10のCD133-フラクションよりも腫瘍の開始のはるかに高い周波数を持っていた細胞を含んでいた。これは、正式に名前を付け、 "脳腫瘍開始細胞"または "BTICs"を獲得し、幹細胞の性質を有する脳腫瘍細胞の唯一の珍しいサブセットが腫瘍開始されていることを確立した。 BTICsの新規同定は多くの固形腫瘍の基礎としての癌幹細胞仮説10月13日のための強力なサポートを与えて、人間の脳の腫瘍形成に新たな洞察を提供し、より効果的ながん治療14から20のための新規細胞標的を確立します。腫瘍の大部分を殺すことに焦点を当て、腫瘍が成長し続けることができ、珍しい幹様分数を見逃す可能性がある治療法。がん幹細胞を死滅させるに焦点を当てた脳腫瘍患者のためのより良い治療と予後を提供することができることを治療。
BTIC集団を研究するために、我々は我々cultuを洗練しました特に幹細胞の特性を有するヒト脳腫瘍内の細胞集団を選択するためのプロトコルを再。無血清、神経幹細胞(NSC)の媒体が未分化の幹細胞状態の維持を可能にし、塩基性線維芽細胞増殖因子(bFGF)、上皮増殖因子(EGF)を添加すること、および白血病抑制因子(LIF)が可能にマルチ強力な増殖、自己再生、そして拡張可能な人間tumorspheres。ここでは、原発性脳腫瘍とBTIC集団を豊かにするためのNSC培地で培養しての処理に関与する方法を説明します我々は、我々の実験モデル系、これらの細胞は最小限しか幹の下で培養されているという事実を強調するために"BTIC患者分離株"と呼ばれています幹細胞集団を選択するためのセル条件。キーなど、CD133やCD15などの幹細胞マーカーおよびフローサイトメトリー分析のためBTIC集団のその後の免疫標識も記載されている。次に、限界希釈法を議論これはBTICsの自己再生の可能性を研究することにも役立ちます。最後に、我々はAmpliGridスライド上に単一細胞を選別し、単一細胞RT-PCRを行うことにより、これらの希少細胞の遺伝子発現解析を探る。これらの技術はまた、髄芽腫、上衣腫と小児神経膠腫などの他の脳腫瘍に適用されます。
プロトコル
1。脳腫瘍組織の文化
- 37℃の水浴中に15 mlの人工CSF(ACSF- 表1参照)と場所に200μlの解凍リベラーゼ(ロシュ·ダイアグノスティックス)を追加します。リベラーゼTMは、一次組織サンプルと同様に、培養tumorspheresを解離させるために使用されるタンパク質分解酵素の混合物である。トリプシン-EDTAとは異なり、リベラーゼ法は表面抗原CD133を保持します。約0.5cm 3の組織サンプルのために、私たちはリベの200μlを使用しています。組織が小さい場合には、我々は100 ulを使用しています。
- 室温に塩化アンモニウム溶液(幹細胞技術)を持参。塩化アンモニウム溶液は優しく、他の細胞への影響を最小限に抑えながら赤血球を溶解する。これは、固定液を含んでいません。
- 無菌の生物学的安全キャビネットでは、オフピペットその後、組織を洗浄する検体容器、渦巻きにACSF 5mlを加える。このステップでは、赤血球(RBC)を除去するのに役立ちます。
- 無菌100mmペトリdiと脳腫瘍組織を転送SH。
- 細かいハサミやメスや鉗子を使用して、スラリーの整合性に組織を分解。
- リベで予め温めACSFを含むチューブに10ミリリットルの正規ピペットまたは鉗子および転送の断片を使用してサンプルを収集します。
- インキュベーターシェーカー上に置いてください(30 rpm)と℃、15分間、37に設定されています。
- 50mlのFalconチューブには70μmセルストレイナーで組織ライセートをフィルタリングします。
- 5分間280 xgでろ液をスピンダウンします。
- 慎重に上清を除去し、得られた細胞ペレットの大きさと色を評価する:ピンクや赤になっているペレットは、赤血球数の増加を示している。
- 1mlのPBSでペレットを再懸濁します。
- ペレットサイズおよび赤血球汚染に基づく塩化アンモニウム溶液(4-12 ml)の適切な量を追加(塩化アンモニウム溶液は非常に穏やかであり、増加量は、赤血球以外の細胞に有害ではありません)。
- 室温で5分間インキュベートします。
- スピン細胞5分間、280×gでダウン。
- 滅菌した10mlのPBSで1回洗浄します。
- 5ミリリットルNSC完全培地( 表2)と超低結合60mmの組織培養プレート(Corning)に転送で再懸濁する。我々は、細胞付着媒介分化を最小限に抑えるために、親水性と中立的に充電され、共有結合し、ハイドロゲルの表面で超低結合培養プレートを使用しています。
文化の中で最初の数日は、メディアを変更しない :メディアの色はわずかに黄色になったときにトップアップのみ 、必要に応じて1-2 mLのメディアでは、文化とメディアの変化を観察し続ける。
2。フローサイトメトリー用Tumorsphere解離
- 顕微鏡下でtumorspheresを評価する:球のサイズは> 100程度であれば、より大きな球が中央に壊死する可能性があるので、解離することをお勧めします。
- 15 mlコニカルチューブに文化を転送します。
- 2〜3ミリリットル滅菌Pを追加BSは徹底的にプレートを洗浄し、コニカルチューブに追加します。
- 5分間280×gで遠心分離します。
- 上清を除去し、1に再懸濁する - 2ミリリットル滅菌PBS。
- 10μlのリベラーゼを追加します。
- 3分間37℃の水浴中でインキュベートする。複数の塊が見られた場合は、削除して、視覚的にサスペンションを評価し、1000μlのピペットチップを用いて静かにひいて粉にする。
- 凝集が解消されない場合は、さらに1〜2分間インキュベーションを継続します。
- 5ミリリットル滅菌PBSを添加し、5分間280×gで遠心分離して細胞を洗浄します。
- 上清を除去し、500〜1,000μlの滅菌PBS +2 mMのEDTA中に再懸濁します。
- トリパンブルーを用いて細胞数と生存率を評価する。
- PBSで2 mMのEDTAで100万/ mlになるように細胞数を調整します。
3。表面染色
- 12x75 mmの流管にテストあたり1×10 6 / mlの細胞懸濁液100μlを移す。
- 抗体の適切な量を追加します。マッチアイソタイプコントロールがそれぞれに使用されるべきである抗体( 表3を参照)。
- 氷上で30分間インキュベートする。
- 各流管に2mlのPBS 2 mM EDTAを追加します。
- 4分、デカントし、ブロットのために200×gで遠心分離します。
- 300μlのPBSで2 mMのEDTAでペレットを再懸濁します。
- 各チューブに10μl7AAD生存性染料を加え、氷上で少なくとも15分間インキュベートする。
- フローサイトメトリーによって分析します。
4。フローサイトメトリーの収集と解析
フローデータの取得と分析の仕様は、本器に依存しています。代表的な負のサンプルが実行され、測定器の設定は、フォワード(サイズ)とサイド(粒度)散布のために確立されています。この散乱パターンは、エンドユーザが破片を含め、サンプル内のすべてのセルを表示することができます。領域は、通常、目的の細胞の周囲に描画されます。 ( 図4a)の設定は、その後、AFの最初の十年の中で陰性細胞を配置するために必要なすべての蛍光検出のために確立されluorescence強度プロット。複数の染料または蛍光色素が使用されている場合、単一ステンドコントロールは色補正値(蛍光発光を干渉するの減算)を確立するために実行する必要があります。生きた細胞を実行しているときに、そのような,7-AAD(7 -アミノアクチノマイシンD -励起488/emission 655)として生存能力染料が使用され、第二の領域は死んだ細胞( 図4b)を除外するように描かれている。これらの領域の両方がサンプルのいずれさらなる分析に適用されます。
5。自己再生アッセイ
大幅クローン球の成長によって促進される主要なアッセイは、自己再生能力、限界希釈アッセイのin vitroでの試験である。 Tumorspheresは解離し、ウェルあたり単一のセルに希釈でダウンして分布しており、文化の中で7日間以降の球形成の速度が計算されます。 7日目に、各細胞播種密度の球を(F0)を含まないウェルの割合を計算してプロットされているウェルあたり細胞(x)の数に対して。各ウェル内の少なくとも1つのtumorsphereを形成するために必要な細胞の数は、行が0.37レベル(F 0 =のe-x)と交差する点から決定されます。細胞のポアソン分布では、この計算では、(37%が交差する)全体の細胞集団( 図5)のクローン幹細胞の頻度を反映するように、ウェル当たり1細胞の希釈、F 0 = 0.37に相当する。
6。単一セルのRT-PCR
異なる集団からの単一細胞はAmpliGridスライド(ベックマン·コールター社の猫#AG480F)上の反応部位にベックマン·コールターMoFlo XDPによって並べ替えられています。単一細胞RT-PCRは、製造業者の仕様書に従ってAmpliGridシングルワンステップRT-PCRシステム(ベックマン·コールター社の猫#OAX04515)を用いて行われる。簡単に言えば、単一のセルはAmpliGridスライドの各反応部位に堆積され、それぞれの単一のセルの存在を顕微鏡により確認反応部位。逆転写(RT)は、危険にさらされるからサンプルを防止するために選別した直後に実行されます。 RTマスターミックスはキットの説明( 表4)によると、新たに調製されています。我々は、反応あたり、25μMランダムプライマー(Promega)の0.03μlを使用し、マスターミックス1μlを各反応部位の中央に追加されます。これは直ちに密封溶液(ベックマン·コールター社猫#OAX04503)5μlので被覆されている。 AmpliSpeedスライドサイクラー(ベックマン·コールター、猫#OAX04101)を使用して、スライドを25℃でインキュベートする10分間、42℃で10分間、45分間、55°CのCを。逆転写反応の後には、DNase / RNaseフリー水3μlの各反応サイトに追加され、全体の混合物は、PCRチューブ(1チューブ/サイト)に移した。 8μlの定量PCRマスターミックス(5μlのSYBRグリーン(クアンタ)、1μlの水、10フォワードμMおよびリバースプライマーミックスを1μl)を加えて2&:PCRプレートに、10μlの反応容量を定量PCRに使用されムー、RT混合物のリットル。リアルタイム定量では、サンプルは、次のプログラムを使用してバイオラッドサイクラー上で実行されます:60秒、60秒、72℃30秒間、95℃10分のために、95℃の45サイクル、60℃、続いて72℃で10分℃、融解曲線解析。 Ct値はOPTICONモニタ3(BioRad)を用いて決定した。三遺伝子はハウスキーピング遺伝子としてGAPDHを含めて、セルごとに評価することができる。遺伝子発現は、2ΔCTによると、GAPDH発現に正規化されます。生物学的には技術的レプリケートの不足を補うために複製として同じ種類の同じ人口の少なくともダース単一細胞を用いることができる。
7。代表的な結果
図1は、GBMの代表的な患者の磁気共鳴イメージング(MRI)スキャンを示します。ハミルトン·ヘルス·サイエンス/マクマスター健康Sによって承認された脳腫瘍のサンプルは、手術直後の患者から同意が得られるciences研究倫理審査会。各試料の一部は、日常的な臨床診断のための神経病理学者に与えられます。 図2に示すように、残りの試料が処理されます。 図3に示すように、一度成長因子、フォームtumorspheresとの完全な神経幹細胞培地に播種し、腫瘍細胞。
図4に示すように、腫瘍細胞は神経表面幹細胞マーカーCD133およびCD15で標識し、フローサイトメトリーによって分析される。
例えば 、CD15 + / CD133のための異なる集団から単一細胞+、CD15 + / CD133-、CD15-/CD133 + CD15-/CD133-その後96ウェルプレート( 図5a)にまたはAmpliGridスライド( 図6a)にソートされています。
96ウェルプレート、自己再生能力( 例えば、CD133 +細胞)、( 図5b)を有する単一細胞では、インキュベーション後にtumorspheres( 図5c)を形成することができるbation。自己再生グラフがよく当たりに形成さ球の数を数えることによって、(5D図 )にプロットすることができる。単一細胞はAmpligridスライド( 図6a)の反応部位に分類。単一の細胞から抽出したRNAを逆Advalytix AmpliSpeed( 図6b)を用いて転写することができます。得られたcDNAはリアルタイムRT-PCR( 図6c)を実行するために使用されます。
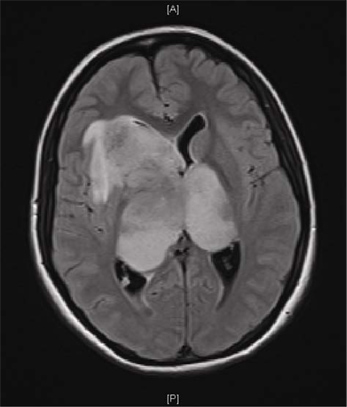
図1。患者GBMの磁気共鳴画像(MRI)。頭痛の一カ月間の歴史や嘔吐、嗜眠、視覚のぼやけの1週間の歴史を持つ16歳の少女の脳のMRIスキャン。軸FLAIRシーケンスは大型双半球( "バタフライ")GBMを示しています。
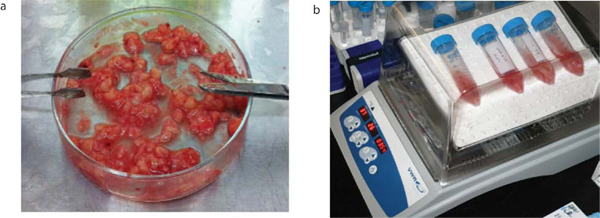
図2。脳腫瘍処理。脳の腫瘍サンプルはobtaアール手術直後の患者の同意からined。彼らは、(a)に示すように機械的に解離していると15分(b)に37℃で30回転ロッキングインキュベーター内でインキュベートすることによりリベラーゼとACSFで次に酵素的に解離する。

図3。 BTIC集団は、培養中のtumorspheresを形成している。成長因子と完全な神経幹細胞培地に播種解離脳腫瘍細胞がtumorspheresを形成している。
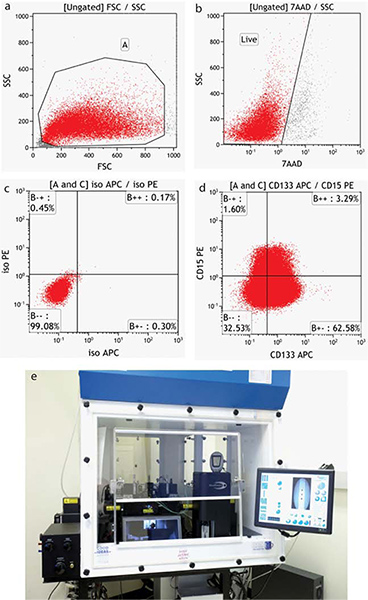
図4。 BTIC集団のフローサイトメトリー分析は、(a)は前方側方散乱特性に対し、(b)の生存率色素7-AADで染色細胞を分析から除外されている破片を含むすべての細胞の画像を提供します。 (C)統計象限の位置は、(d)は、腫瘍細胞が表面ミリアンペアで染色された適切なアイソタイプコントロールを使用して決定されるrkers CD15-PEおよびCD133-APC。 (d)はMofloのXDPセルソーター。 拡大図を表示するには、ここをクリックしてください 。
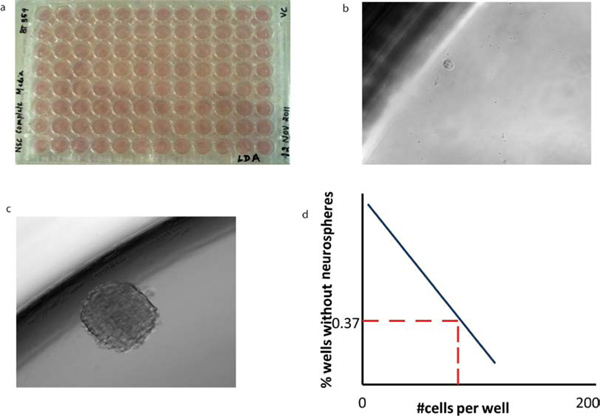
図5。 BTICsの希釈分析を制限することで、彼らの自己再生能力を明らかにします (a)の様々な希釈の細胞をウェル当たり(b)単一セルにNSCの200μlを含む96ウェルにソートされています。 (c)は7日の潜伏期間の後、tumorsphereが形成される。二次tumorspheresの形態は一次tumorspheresのものと同じです。 (d)の平均x切片の値は、ウェルあたり少なくとも1 tumorsphereを形成するために必要な細胞数を明らかにするために各々の腫瘍サブタイプ用に希釈分析を制限から計算することができます。

図6。シングルBTIC細胞の遺伝子発現解析可能性は、単一細胞RT-PCRの技術を使用しています(a)はBTIC人口からの単一細胞はAmpliGridスライド上に並べ替えることができます。 (b)のcDNA合成はAdvalytix AmpliSpeedを使用AmpliGridスライド上の単一細胞で行われています。 (c)の定量的リアルタイムPCRはBTIC単一細胞からcDNAを合成した上で行われる。
| 2MのNaCl | 62ミリリットル |
| 1MのKCl | 5ミリリットル |
| 1M MgCl 2を | 3.2ミリリットル |
| 155 MMのNaHCO 3 | 169ミリリットル |
| 1Mグルコース | 10ミリリットル |
| 108 mMのCaCl 2 | 0.9256ミリリットル |
| PURELABウルトラH 2 O | 749.84ミリリットル |
表1人工脳脊髄液(ACSF) -千ミリリットル。
| 株式基本培地 | 500ミリリットル |
| 午前1時01 DMEM:F12 | 480ミリリットル |
| N2サプリメント | 5ミリリットル |
| 1M HEPES | 5ミリリットル |
| グルコース | 3.0グラム |
| N-アセチルシステイン(60μg/ ml)を | 1ミリリットル |
| 神経生存因子-1(NSF-1) | 10ミリリットル |
表2神経幹細胞培地。
NSCの完全培地 (使用前に新鮮なもの):
NSCの基礎培地+20 ng / mlのEGF(上皮成長因子)+ 20 ng / mlのbFGF(塩基性線維芽細胞増殖因子)+ 10 ng / mlのLIF(白血病抑制因子)* + 10ミリリットル/μlの抗生物質抗真菌剤
*白血病阻害因子(LIF):ミリポアからこの試薬 は、インターロイキン6クラスサイトカイン、PRが含まれています幹細胞培養物の長期的な維持管理を推進して幹細胞の自発的な分化を抑制otein。
| 抗体 | サプライヤー/ CAT# | μL/テスト(100μl中) |
| CD133 / 2 APC(293C3) | ミルテニーBiotec/130-090-854 | 5 |
| IgG2bでAPC(アイソタイプコントロール) | ミルテニーBiotec/130-092-217 | 5 |
| CD15PE | ベックマンCoulter/IM1954U | 5 |
| IgG2aのPE(アイソタイプコントロール) | ベックマンCoulter/A09141 | 5 |
| 7AAD | ベックマンCoulter/A07704 | 10 |
表3。フロー抗体。
| コンポーネント | ボリューム(1反応) | ボリューム(48反応) |
| 単一細胞RT反応バッファーを2倍 | 0.50μlの | 30.0μlの |
| RNase阻害剤(10 U /μl)を | 0.02μlの | 1.2μL |
| 5X単一細胞RTエンハンサー | 0.15μlの | 9.00μlの |
| 単一セルのRT酵素ミックス | 0.04μlの | 2.4μL |
| Advablue(OAX04227) | 0.1μL | 6.00μlの |
| ヌクレアーゼフリー水 | 1μlに作る | 60μlに作る |
表4。シングルセルRTPCR(猫#OAX04515)に対するRTマスターミックスの組成。
ディスカッション
白血病21内の作業に基づいて、がん幹細胞仮説10、乳癌11、脳腫瘍4,5、腫瘍内の細胞の唯一の比較的小さな部分と呼ばれるがん幹細胞は、広範囲に増殖する能力と自己を持っていることを示唆している - 新たにする。腫瘍細胞のほとんどは、彼らは、腫瘍の表現型の署名になる細胞に分化するように増殖し、自己複製する能力を失う。腫瘍を維持することがで?...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、がん研究のオンタリオ研究所(OICR)、テリー·フォックス財団と脳神経外科協会によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | |
| 午前1時01 DMEM:F12 | インビトロジェン | 11320-082 | |
| N2サプリメント | インビトロジェン | 17502-048 | |
| 1M HEPES | Wisent | 330から050-EL | |
| グルコース | インビトロジェン | 15023-021 | |
| N-アセチルシステイン | シグマアルドリッチ | A9165-25G | |
| 神経生存因子-1(NSF-1) | ロンザClonetics社 | CC-4323 | |
| 上皮成長因子(EGF) | シグマアルドリッチ | E9644 | |
| 塩基性線維芽細胞増殖因子(bFGF) | インビトロジェン | PHG0261 | |
| 白血病阻害因子(LIF) | ミリポア | LIF1010 | |
| 真菌性抗生物質/ | Wisent | 450から115-EL | |
| リベラーゼTM | ロッシュ | 05 401 119 001 | |
| 塩化アンモニウム溶液 | 電池技術を食い止める | 07850 |
参考文献
- Ohgaki, H., Kleihues, P. Epidemiology and etiology of gliomas. Acta Neuropathol. 109, 93 (2005).
- Huse, J. T., Holland, E. C. Targeting brain cancer: advances in the molecular pathology of malignant glioma. 10, 319 (2010).
- Wechsler-Reya, R., Scott, M. P. The developmental biology of brain tumors. Annu. Rev. Neurosci. 24, 385 (2001).
- Singh, S. K. Identification of a cancer stem cell in human brain tumors. Cancer Res. 63, 5821 (2003).
- Singh, S. K. Identification of human brain tumour initiating cells. Nature. 432, 396 (2004).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1 (1996).
- Tropepe, V. Distinct neural stem cells proliferate in response to EGF and FGF in the developing mouse telencephalon. Dev. Biol. 208, 166 (1999).
- Yin, A. H. AC133, a novel marker for human hematopoietic stem and progenitor cells. Blood. 90, 5002 (1997).
- Yu, Y., Flint, A., Dvorin, E. L., Bischoff, J. AC133-2, a novel isoform of human AC133 stem cell antigen. J. Biol. Chem. 277, 20711 (2002).
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414, 105 (2001).
- Al-Hajj, M. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U. S. A. 100, 3983 (2003).
- Bonnet, D., Dick, J. E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med. 3, 730 (1997).
- Matsui, W. Characterization of clonogenic multiple myeloma cells. Blood. 103, 2332 (2004).
- Bao, S. Targeting cancer stem cells through L1CAM suppresses glioma growth. Cancer Res. 68, 6043 (2008).
- Bao, S. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444, 756 (2006).
- Bao, S. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor. Cancer Res. 66, 7843 (2006).
- Beier, D. Temozolomide preferentially depletes cancer stem cells in glioblastoma. Cancer Res. 68, 5706 (2008).
- Piccirillo, S. G. Distinct pools of cancer stem-like cells coexist within human glioblastomas and display different tumorigenicity and independent genomic evolution. Oncogene. 28, 1807 (2009).
- Piccirillo, S. G. morphogenetic proteins inhibit the tumorigenic potential of human brain tumour-initiating cells. Nature. 444, 761 (2006).
- Rich, J. N., Bao, S. Chemotherapy and cancer stem cells. Cell Stem Cell. 1, 353 (2007).
- Lapidot, T. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645 (1994).
- Reya, T., Morrison, S. J., Clarke, M. F., Weissman, I. L. Stem cells, cancer, and cancer stem cells. Nature. 414, 105 (2001).
- Fuchs, E., Segre, J. A. Stem cells: a new lease on life. Cell. 100, 143 (2000).
- Weissman, I. L. Stem cells: units of development, units of regeneration, and units in evolution. Cell. 100, 157 (2000).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707 (1992).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565 (1992).
- Hulett, H. R., Bonner, W. A., Barrett, J., Herzenberg, L. A. Cell sorting: automated separation of mammalian cells as a function of intracellular fluorescence. Science. 166, 747 (1969).
- Kohler, G., Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 256, 495 (1975).
- Barrett, L. E. Self-renewal does not predict tumor growth potential in mouse models of high-grade glioma. Cancer Cell. 21, 11 (2012).
- Venugopal, C. Bmi1 marks intermediate precursors during differentiation of human brain tumor initiating cells. Stem Cell Res. 8, 141 (2012).
- Gerlinger, M. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N. Engl. J. Med. 366, 883 (2012).
- Gilbertson, R. J. Medulloblastoma: signalling a change in treatment. Lancet. Oncol. 5, 209 (2004).
- Zhu, Y., Parada, L. F. The molecular and genetic basis of neurological tumours. Nat. Rev. Cancer. 2, 616 (2002).
- Maher, E. A. Malignant glioma: genetics and biology of a grave matter. Genes Dev. 15, 1311 (2001).
- Blake, W. J., KAErn, M., Cantor, C. R., Collins, J. J. Noise in eukaryotic gene expression. Nature. 422, 633 (2003).
- Elowitz, M. B., Levine, A. J., Siggia, E. D., Swain, P. S. Stochastic gene expression in a single cell. Science. 297, 1183 (2002).
- Maheshri, N., O'Shea, E. K. Living with noisy genes: how cells function reliably with inherent variability in gene expression. Annu. Rev. Biophys. Biomol. Struct. 36, 413 (2007).
- Raj, A. Stochastic mRNA synthesis in mammalian cells. PLoS Biol. 4, e309 (2006).
- Ross, I. L., Browne, C. M., Hume, D. A. Transcription of individual genes in eukaryotic cells occurs randomly and infrequently. Immunol. Cell Biol. 72, 177 (1994).
- Kubista, M. The real-time polymerase chain reaction. Mol. Aspects Med. 27, 95 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1, 1559 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved