Method Article
器官型脳スライスと癌細胞の3Dスフェロイドとの共培養システム
* これらの著者は同等に貢献しました
要約
癌細胞との器官型脳切片の共培養は、脳組織の癌細胞浸潤の過程で蛍光だけでなく、明視野(ビデオ)顕微鏡によって形態学的変化を可視化することができます。このモデル系は、細胞の交換や補充的なアプローチを可能にし、操作及び分析を幅広く提供しています。
要約
癌の脳転移を有する患者は予後不良である。しかし、転移部位の処理はほとんど、特に、居住者(間質)細胞の役割を調べた。原発癌の研究でも、予後1,2に、転移に対する微小環境の影響を示しています。特に腫瘍関連マクロファージ(TAM)のサポート移動、浸潤や増殖3。興味深いことに、転移の主要な標的部位は、CNSにおける肝臓やミクログリアにおけるクッパー細胞などの組織特異的マクロファージを保有。また、転移部位も、星状細胞のような他の組織特異的細胞を有する。最近では、アストロサイト、癌細胞4,5の増殖および持続性を促進することが示された。したがって、これらの組織特異的な細胞型の機能は、脳転移6,7の過程で非常に重要であると思われる。
これらの観察にもかかわらず、しかし、これまで生体内で/直接明視野顕微鏡で、特に脳転移形成の際にグリアの反応を可視化するために利用可能なin vitroモデルには適しているのはありません。癌細胞の生体ライブイメージングにおける最近は彼らの脳の植民地化の動作8を示 した。しかし、この方法は非常に手間がかかりコストがかかり、技術的に複雑である。また、動物実験のこれらの種類は、小さな直列に制限されている実質的な(ガラス板の注入により、腫瘍細胞の注射、繰り返し麻酔と長期固定の)動物のためのストレスが付属しています。常在細胞との相互作用はまだ示されていないのに対し、また、in vivoイメージングは、これまでに、癌細胞の可視化に限定される。最後に、免疫担当動物内ヒト癌細胞の調査は8不可能です。
これらの理由から、我々は、共培養システムを確立しconsiマトリゲル(3Dセル球)に埋め込まれた器官型マウス脳スライスや上皮細胞のスティング。 3D癌細胞球体は、隣接する脳組織の浸潤を調べるために、脳切片縁部に直接隣接して配置した。これは蛍光であっても、明視野顕微鏡法によってグリア細胞と癌細胞との間の形態学的変化との相互作用を視覚化することを可能にします。共培養実験の後、脳組織または3Dスフェロイドは、さらに、分子分析( 例えば、定量RT-PCR、IHC、または免疫ブロット)のため、ならびに共焦点顕微鏡による調査のために回収し、使用することができる。この方法は、脳切片に対して有害な影響なし日間生体脳組織内のイベントを監視するために適用することができる。モデルはまた、ドナー組織からの細胞による選択的抑制、住民細胞の置換は、与えられた遺伝子型の明確な影響を判断することができます。最後に、共培養モデルが実行可能な選択肢である目標と薬理操作をテストするときに、生体内へのアプローチ。
プロトコル
この新しいモデルは、以前に公開された器官型海馬脳スライスアプローチ9月12日を適応したものです。修正および追加が癌細胞の脳組織の相互作用を最適化し、再現性を保証するために導入した。調査は見直され、地元の倫理委員会によって承認された。動物は、大学医学部ゲッティンゲンでの動物のケアのためのガイドラインに従って、慎重に処理した。器官型脳切片の共培養は、2つのステップに分けることができる。第一段階は、器官型脳切片の調製である。ステップ二つの共培養モデルにおける腫瘍細胞調製物および堆積を含む。
1。器官脳スライス
- 0.2 mMグルタミン、100 U / mlペニシリン、100 mg / mlのストレプトマイシン、およびグルコースの4.5 mg / mlのを補足した最小必須培地(MEM)、からなる解剖媒体を準備します。
- 生後間の任意のマウス系統からマウスを刎ねる6と8(P6-8)。
- 無菌状態で頭蓋骨から急速に脳を取り出して、氷のように冷たい解剖媒体に転送することができます。
- 前頭極と全脳セクションから小脳を除去します。
- クライオのりと5%のアガロースでステージに脳を固定して安定させる。
- ビブラトームを使用して水平方向に350ミクロンの厚さに脳切片をスライス。
- 種や年齢に応じて、単一のマウスの脳から五時五十六全脳スライスを収集します。
- 50%MEMからなる培地を調製し、25%ハンクス平衡塩溶液(HBSS)、25%正常ウマ血清(NHS)、0.2 mMグルタミン、100 U / mlペニシリン、100 mg / mlのストレプトマイシン(シグマ社、ミュンヘン、ドイツ)、および4.5 mg / mlのグルコース。
- 下部ウェルに培養培地の1ミリリットルを6ウェルプレートに0.4ミクロンポリカーボネートトランスウェル膜インサート上の各器官の脳スライスを置く。
- 一晩humidifieにおける培養器官型脳切片37℃のインキュベーター中で5%のCO 2とdの雰囲気。
2。スライス共培養モデル
- GFP-トランスフェクトされた腫瘍細胞または他の細胞を15%RPMI培地および85%のECMゲルからなる20μlのゲルマトリックス( 例えば MCF-7-GFP細胞)、10 5を埋め込 む。
- 器官型脳切片の皮質領域に直接隣接無菌金属スペーサ(3.8ミリメートル径)に、MCF-7-ゲルマトリックスミックスを置き、2時間インキュベート。
- スペーサーを外し、3D腫瘍スフェロイドが24〜96時間のための器官のスライスと共培養することができます。
- 一日おきに培養液を変更します。
3。器官型脳スライス共培養アストロサイトやミクログリアの免疫蛍光染色
- 4℃で8時間、4%パラホルムアルデヒドで器官型脳切片共培養を修正しました。
- 5分間のPBST(0.5%トリトンX-100を含むPBS)でスライス共培養を洗う。
- Sをブロック1時間室温でPBST中正常ヤギ血清(1:20)でamples。
- ヤギ抗マウスTRITC(PBST中1:100)染色、続いて4℃で36時間、抗グリア線維性酸性タンパク質モノクローナル抗体(GFAP、PBST中で1:200)を用いて脳切片の共培養をインキュベートすることにより星状細胞を染色室温で1時間。
- 5分間PBSTで3回のサンプルを洗浄します。
- 室温で1時間、ILB 4 -アレクサフルーア647(PBST中1:100)とミクログリア細胞を染色する。
- 室温で3分間DAPIで脳切片共培養(1:1,000)を対比染色。
- マウントとDAKO蛍光封入剤で脳切片共培養をカバースリップ。
- 第+ + +≥2/3浸潤した細胞(の; - ; + <1/3、2/3 + + = 1/3細胞の0 =なし、次のスコアリングシステムに基づいて、腫瘍浸潤の程度を評価する腫瘍プラグとスライスとの間の接触部の長さを測定し、測定fractio)浸潤細胞で検出可能な連絡先のN。
4。グリアと腫瘍細胞との間の相互作用のライブイメージング
- ライカの下で実験を行うには、10倍の倍率のレンズとライカDFC 350 FX CCDカメラでDMI 6000B顕微鏡を反転。
結果
最初に、すべての使用癌細胞(ヒト:MCF-7およびマウス:410.4)は器官型マウス脳スライスに侵入した。浸潤は、種に依存しない方法で広範囲の用途を示しているので、種に依存しない( 図1A)であった。さらに、ミクログリアだけでなく、これまで生体内および患者サンプル13で説明したように界面に蓄積アストロサイト。長期間にわたるタイムラプスイメージングは、スライスの実行可能性を明らかにしただけでなく、細胞間相互作用を観察するための良いプラットフォームを提供するだけでなく。次に、癌細胞はまた、脳切片( 図1B1-B2)に侵入し、つつ、時間経過実験により、小グリア細胞は、3Dセル球体を入力して記録した。また、我々は、以前はそれにより癌の浸潤を補助するために、依然として謎の機構によって癌細胞を輸送するミクログリアの能力を示した。免疫蛍光標識技術を使用して、我々侵入プロセスの間、これらの細胞間の緊密な相互作用を示唆し、脳組織および腫瘍細胞プラグ( 図1C-D)の両方において、腫瘍細胞および間質細胞の同時局在( 例えば、ミクログリアおよびアストロサイト)に記載。異なる種の遺伝子型および株からの細胞を研究するための用途の広い範囲を示す-マウスの脳切片は、ヒト( 図1C1-C3)またはマウス( 図1D1-D3)癌細胞のいずれかで培養した場合に匹敵する結果が得られた。
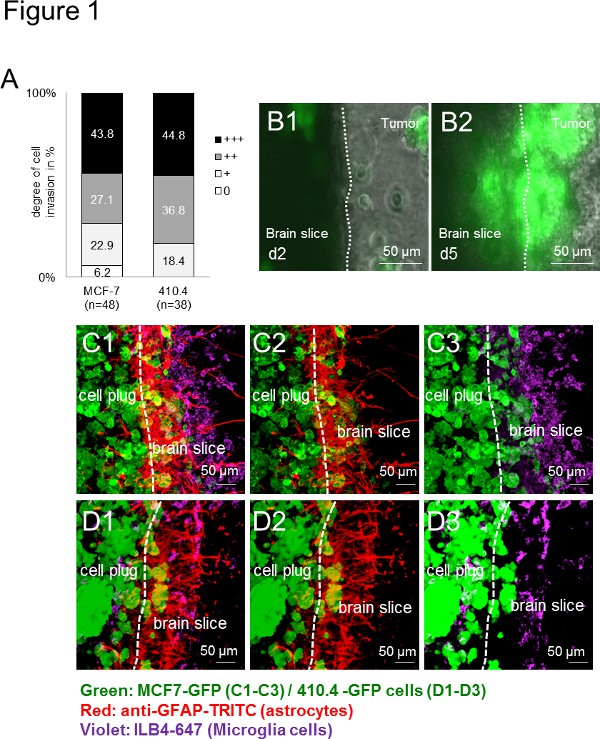
図1。マウスとヒト癌細胞の3次元回転楕円体と脳切片共培養モデル。マウス乳癌器官全脳スライス共培養中の癌細胞の浸潤のA)の定量化細胞株410.4またはヒト乳癌細胞株MCF-7。データは、n≥38と、各グループ内の脳切片に細胞浸潤の程度の割合を表す。これら二つのグループ(クラスカルウォリス検定)の間に有意差は認められなかった。日2(B1)と5日目(B2)から、MCF-7-GFP細胞と代表画像との器官型全脳スライス共培養のB)タイムラプス画像がされました示す。CD)共焦点顕微鏡画像は、癌腫、アストロサイトとミクログリアのコホートを示した。二重星状細胞の染色(抗GFAP-TRITC、赤)とミクログリア350ミクロンの厚さの器官型脳切片およびGFP-トランスフェクトされた腫瘍細胞プラグ(緑色)と全体の共培養(ILB4-アレクサフルーア647、紫):3D- MCF-7-GFP(C1-C3)および3D-410.4-GFP(D1-D3)。白いダッシュは脳切片と腫瘍の浸潤前線の端を示した。スケールバーは50μmで表す。ミクログリア、アストロサイトAをNDの腫瘍の共局在(C1およびD1)、アストロサイト-の腫瘍共局在(C2およびD2)とスライス共培養におけるミクログリア腫瘍共局在(C3とD3)。 拡大画像を表示するには、ここをクリックしてください
ディスカッション
脳転移の以前の組織学的研究は、特にアストロサイトやミクログリア13の居住グリア細胞の迅速かつ劇的な変化を明らかにした。癌細胞によるこれらの変化及び相互作用を研究するために、この新規な共培養システムが適している。他の研究分野は、すでに器官海馬脳スライスと長年の経験を持っています。一つの利点は、器官型海馬脳スライス培養は、長期実験に適して、週に生存可能かつ効果日間保存されていることである。 1991年の器官型海馬スライスシステムのStoppiniの導入以来、それは広く変性疾患の研究のために使用されてきた。このように、このイノベート共培養システムは、腫瘍生物学9,11内のアプリケーションの範囲が十分に確立されたアプローチの変更を表しています。修正は、腫瘍の浸潤AFのグレードを評価するために、私たちに再現可能なモデルを提供界面法で成長terwards、培養物は、理想的には、三次元構造を必要とする実験のために適している。いくつかの技術が他の細胞と器官型海馬切片を共培養するために使用されている。これらは、マクロファージ細胞や器官型脳切片14と、海馬領域15から2異なるスライスの直接共培養の間に間接的なシステムを含む。神経膠腫凝集体は、脳切片16と共培養されてきた。これらのモデルは、脳切片における細胞および分子事象を分析するために使用することができるが、腫瘍細胞、ミクログリアおよび脳実質との間の直接的な生理学的な接触を可能にしない。さらに、この方法は、骨髄由来の末梢単球/マクロファージの汚染なしミクログリアの観察を可能にする。 CCR2およびCX3CR1のトランスジェニックマウスモデルの使用は、それが単球に侵入常駐ミクログリアを区別することは困難であるという事実に重要な改善である彼らの同様の特性17,18,19に基づく。癌細胞の脳内注入は、腫瘍の進行を調査できますが、それは囲まマクロファージ様細胞が脳常駐ミクログリア集団から、または骨髄由来末梢単球/マクロファージ17から発信かどうかについて多くを伝えることはできません。 Kettenmannのチームは、マイクロマニピュレータ20を脳スライスに神経膠腫細胞を接種することに関与器官脳切片モデルを導入しました。しかし、原発性悪性神経膠腫、転移性がんから多くの点で異なっている。まず、悪性神経膠腫は、間葉系由来のもので、腫瘍と脳組織との間の境界線なしの場合と同様に、単一の細胞に侵入/神経系の外に転移して、移行されません。これとは対照的に、浸潤性増殖は、典型的な病理学的特徴であり、そのような癌は通常、移行/コホートとして侵入する。グリア細胞つつ、第2、がんは、多くの場合、脳内の上皮構造を再構築しよう(擬似)カプセルによって脳組織から腫瘍を分離してみてください。生物学的および形態学的特徴を考慮し、悪性神経膠腫および癌腫の転移は実際に比較することはできません。これらの理由から、我々は、我々は修正された脳切片に隣接する癌細胞プラグを注入しかし共存しない共培養システムを開発した。さらに、本発明者らは、小膠細胞が腫瘍プラグを入力して、容易に、明視野顕微鏡法によって検出され、共焦点顕微鏡によって後で確認することができたことを意味し、腫瘍プラグの境界でミクログリア及び星状細胞の蓄積を観察した。癌細胞は、生体内の状況で実際に、脳は21の転移を有する剖検例の63%に浸透ゾーンを見つけBaumertらによって作ら観測に匹敵する脳切片の中に侵入する。
がないため血液灌流のために、この文化の中で唯一の常在マクロファージ/ミクログリアがあります。また、理由のM従って、T細胞を同理事と、アロ反応性は存在しない、ヒト癌細胞であっても免疫応答性マウス又はラットの脳切片(NMRI、B6、又はWistar系)を用いて共培養を使用することができる。これはヌードマウスモデルの代替となりうる。四時五十六のスライスが各マウスから得ることができるので、動物の数が有意に減少し、既存の注射モデルに比べて、必要とされる。また、動物は、転移性疾患を長期間受けない、それらは繰り返し22手術手順を受けない。
この共培養系では、我々は癌細胞によるミクログリアの活性化および癌細胞浸潤を促進する能力を実証した。さらに、これは初めてである、我々の知る限り、ミクログリアが活発癌細胞23を輸送することが見出された。
すべてのこれらの利点にもかかわらず、共培養システムは、確かに、また限界がある。それはまだ試験管内で前植民地化への転移のステップが欠落してモデル化する。なぜなら灌流の不足するのではなく、血管外漏出を勉強することはできません。したがって、溢出を研究する別の方法は、血液脳関門22,24を模倣するインビボ注入モデルまたは修飾Boydenチャンバーシステム外マトリックスと、HUVECおよびアストロサイトのいずれかを使用することである。脳切片の共培養法は、まだ多くの利点とそのような常在細胞の役割に焦点を当て、特に植民地化の分析などのアプリケーションのさまざまな可能性を有する信頼性と再現性のモデルです。 (このような免疫組織化学、共焦点顕微鏡およびタイムラプス顕微鏡のような)他の確立された技術との組み合わせは、直接的な細胞間相互作用の研究をサポートしています。それは簡単な代替及び他の技術の補完であり、転移性微小環境によって課されるようにキューと効果の調査へのアクセスを提供しています。
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、共焦点とタイムラプス顕微鏡に関する技術的助言のための彼の優れた技術支援のためのハリッドGhadban、アンドレアスWodarzとステファンHeermannに感謝します。著者のいずれかのための特別の利害関係はありません。この作品は、のDresにより、Forschergruppe 942のプロジェクト2(FOR942 BI 703/3-1)にドイツの研究評議会(DFG)によって資金を供給される。ベイヤー財団(バーデンWürttembergischerKrebspreis、ドイツ)と医学部の研究プログラム、ゲオルク·アウグスト大学ゲッティンゲン、ドイツ。
資料
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
参考文献
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved