Method Article
Co-Kultur-System mit einer Scheibe Organotypische Gehirn-und 3D-Sphäroid von Karzinomzellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die organotypischen Hirnschnitt Co-Kultur mit Karzinomzellen ermöglicht die Visualisierung morphologische Veränderungen durch Fluoreszenz sowie Hellfeld-(Video)-Mikroskopie während des Prozesses der Karzinomzellinvasion von Hirngewebe. Dieses Modellsystem ermöglicht auch für die Zellaustausch und die Wiederauffüllung Ansätze und bietet eine Vielzahl von Manipulationen und Analysen.
Zusammenfassung
Patienten mit zerebralen Metastasierung von Karzinomen haben eine schlechte Prognose. Allerdings hat das Verfahren bei der metastatischen Website kaum untersucht worden, insbesondere die Rolle der Wohn (Stroma-Zellen). Studien in der Primärkarzinome zeigen den Einfluss der Mikroumgebung auf Metastasen, auch auf die Prognose 1,2. Vor allem die Tumor-assoziierten Makrophagen (TAM) Unterstützung Migration, Invasion und Proliferation 3. Interessanterweise sind die Hauptzielstellen von Metastasen besitzen gewebespezifischen Makrophagen, wie Kupffer-Zellen der Leber oder Mikroglia im ZNS. Darüber hinaus sind die Metastasen besitzen auch andere gewebespezifischen Zellen, wie Astrozyten. Kürzlich wurden Astrozyten gezeigt, um die Proliferation und Persistenz von Krebszellen 4,5 fördern. Daher Funktionen dieser Gewebe-spezifischen Zelltypen scheinen sehr wichtig im Prozess der Hirnmetastasen 6,7 sein.
Trotz dieser Beobachtungenaber bis jetzt gibt es keine geeigneten in vivo / in vitro-Modell zur Verfügung, um Glia-Reaktionen während der Hirnmetastasenbildung, insbesondere durch Hellfeldmikroskopie direkt sichtbar zu machen. Aktuelle Live-Bildgebung in vivo von Karzinomzellen zeigten ihre Hirn Kolonisation Verhalten 8. Jedoch ist dieses Verfahren sehr aufwendig, kostenintensiv und technisch komplex. Darüber hinaus sind diese Arten von Tierversuchen auf den Kleinserien beschränkt und kommen mit einem erheblichen Stress für die Tiere (durch Implantation der Glasplatte, Injektion von Tumorzellen, sich wiederholende Anästhesie-und langfristige Fixierung). Weiterhin wird in vivo Bildgebung bislang auf die Visualisierung der Karzinomzellen beschränkt, während Wechselwirkungen mit residenten Zellen noch nicht dargestellt worden. Schließlich sind Untersuchungen der menschlichen Karzinomzellen in immunkompetenten Tieren unmöglich 8.
Aus diesen Gründen haben wir ein Co-Kultur-System consiStachel eines organotypischen Hirnschnitt Maus und epithelialen Zellen in Matrigel (3D-Zell Kugel) eingebettet. Die 3D-Karzinomzellkugeln wurden direkt neben der Hirnschnittkante, um die Invasion des benachbarten Hirngewebe zu untersuchen platziert. Dies ermöglicht es uns, morphologische Veränderungen und Wechselwirkungen zwischen den Gliazellen und Karzinomzellen durch Fluoreszenz und sogar von hellen Feldmikroskopie sichtbar zu machen. Nach der Co-Experiment kann das Hirngewebe oder die 3D-Zellkügelchen gesammelt und für die weitere molekulare Analysen (z. B. qRT-PCR, IHC oder Immunoblot) sowie für Untersuchungen durch konfokale Mikroskopie verwendet werden. Dieses Verfahren kann angewendet werden, um die Ereignisse in einem lebenden Gehirn Gewebe Tagen ohne schädliche Wirkungen auf die Hirnschnitten überwachen. Das Modell ermöglicht auch selektive Unterdrückung und Ersatz von residenten Zellen von Zellen aus einem Spendergewebe, um die unterschiedlichen Auswirkungen einer bestimmten Genotyp zu bestimmen. Schließlich ist die Co-Kultur-Modell eine praktikable AlternativeIn-vivo-Ansätze bei der Prüfung gezielte pharmakologische Manipulationen.
Protokoll
Dieses neue Modell ist eine Adaption eines bereits veröffentlichten organotypischen hippocampalen Hirnschnitt Ansatz 9-12. Änderungen und Ergänzungen wurden eingeführt, um die Gewebe-Wechselwirkungen Krebszellen Gehirn zu optimieren und um die Reproduzierbarkeit zu gewährleisten. Die Studie wurde überprüft und von der lokalen Ethikkommission genehmigt. Die Tiere wurden sorgfältig nach den Richtlinien für die Tierpflege an der Universitätsmedizin Göttingen behandelt. Die organotypischen Hirnschnitt Co-Kultur kann in zwei Schritte unterteilt werden. Schritt eins ist die Herstellung der organotypischen Hirnschnitt. Schritt zwei besteht aus der Tumorzelle Vorbereitung und Ablagerung in der Co-Kultur-Modell.
1. Organotypische Hirnschnitt
- Vorbereitung der Dissektion Medium, bestehend aus Minimum Essential Medium (MEM), mit 0,2 mM Glutamin, 100 U / ml Penicillin, 100 mg / ml Streptomycin und 4,5 mg / ml Glucose.
- Enthaupten die Mäuse aus jeder Maus-Stamm zwischen postnatalen Tagsechs und acht (P6-8).
- Entfernen Sie das Gehirn schnell aus dem Schädel unter aseptischen Bedingungen und überträgt es auf eiskalte Dissektion Medium.
- Entfernen Sie die Frontstange und das Kleinhirn von der Ganzhirnschnitt.
- Fix und stabilisieren das Gehirn auf einer Bühne mit Kryo Leim und 5% Agarose.
- Schneiden Sie die Gehirnschnitte horizontal zu einer Dicke von 350 um mit einem Vibratom.
- Sammeln Sie vier Minuten vor sechs ganze Hirnschnitten von einem einzigen Gehirn der Maus, je nach Art und Alter.
- Vorbereitung des Kulturmediums, bestehend aus 50% MEM, 25% Hanks 'ausgewogener Salzlösung (HBSS), 25% normalem Pferdeserum (NHS), 0,2 mM Glutamin, 100 U / ml Penicillin, 100 mg / ml Streptomycin (Sigma, München, Deutschland) und 4,5 mg / ml Glucose.
- Setzen Sie jede organotypischen Hirnschnitt auf einem 0,4 um Polycarbonat Transwell Membraneinsatz in einem Sechs-Well-Platte mit 1 ml Kulturmedium in der unteren auch.
- Kultur organotypischen Hirnschnitten über Nacht in einem humidified Atmosphäre mit 5% CO 2 bei 37 ° C Inkubator.
2. Die Scheibe Cokultur Modell
- Embed 10 5 von GFP-transfizierten Tumor oder anderen Zellen (zB MCF-7-GFP-Zellen) in 20 ul Gel-Matrix, bestehend aus 15% RPMI-Medium und 85% ECM-Gel.
- Platzieren Sie den MCF-7-Gelmatrix Mischung in einem sterilen metallischen Abstandshalter (3,8 mm Durchmesser) unmittelbar neben dem kortikalen Bereich der organotypischen Hirnschnitt und Inkubation für 2 Stunden.
- Entfernen Sie die Abstandshalter und ermöglichen die 3D-Tumor Sphäroid mit der organotypischen 24-96 h Kokultur.
- Ändern Sie jeden zweiten Tag das Kulturmedium.
3. Immunfluoreszenz-Färbung von Astrozyten und Mikroglia im Gehirn Organotypische Scheibe Cokultur
- Befestigen Sie den organotypischen Hirnschnitt Co-Kultur mit 4% Paraformaldehyd für 8 h bei 4 ° C
- 5 min waschen die Scheibe Kokultur mit PBST (PBS mit 0,5% Triton X-100).
- Blockieren Sie die sBeispiele mit normalem Ziegenserum in PBST (1:20) bei Raumtemperatur für 1 Stunde.
- Färben die Astrozyten durch Inkubation der Kokultur mit Hirnschnitt anti-saure Gliafaserprotein monoklonalen Antikörper (GFAP, 1:200 in PBST) für 36 h bei 4 ° C, gefolgt von Ziege-Anti-Maus-TRITC (1:100 in PBST)-Färbung 1 h bei Raumtemperatur.
- Dreimal mit PBST für 5 min Waschen der Proben.
- Färben die Mikroglia-Zellen mit ILB 4-Alexa Fluor 647 (1:100 in PBST) für 1 h bei Raumtemperatur.
- Gegenfärbung der Hirnschnitt Co-Kultur mit DAPI (1:1000) für 3 min bei Raumtemperatur.
- Berg-und Deckglas den Hirnschnitt Co-Kultur mit DAKO-Leuchtstoffmontagemedium.
- Bewertung der Grad der Tumorinvasion der Basis der folgenden Bewertungssystem: 0 = keine der Zellen; + <1/3, + + = 1/3 - 2/3, + + + ≥ 2/3 der Zellen eingedrungen (erster messen Sie die Länge der Kontaktbereich zwischen Tumor-Stecker und in Scheiben schneiden, dann messen Sie die fraction Kontakt nachweisbar durch die eindringenden Zellen).
4. Live-Imaging von der Interaktion zwischen Glia-und Tumorzellen
- Führen Sie das Experiment unter einem umgekehrten Leica DMI 6000B Mikroskop bei 10-facher Vergrößerung und einem Objektiv Leica DFC 350 FX CCD-Kamera.
Ergebnisse
Erstens, alle verwendeten Karzinomzellen (human: MCF-7-und Maus: 410,4) drangen in die Maus organotypischen Hirnschnitt. Die Invasion war daher artenunabhängig (1A), die eine breite Palette von Anwendungen in einer Art unabhängig angibt. Zusätzlich Mikroglia und Astrozyten an der Grenzfläche angesammelt, wie zuvor in vivo und in Patientenproben 13 beschrieben. Zeitraffer-Bildgebung über einen längeren Zeitraum nicht nur ergeben, die Lebensfähigkeit der Scheibe, sondern bot auch eine gute Plattform, um die zellulären Wechselwirkungen zu beobachten. Mit Zeitraffer-Experimente wurden die Mikroglia-Zellen aufgenommen, um die 3D-Zellbereich eingeben, während wiederum fallen Krebszellen auch die Hirnschnitt (Abb. 1B1-B2). Darüber hinaus haben wir bereits die Fähigkeit der Mikrogliazellen auf Karzinomzellen transportieren von einem immer noch rätselhaften Mechanismus, um dadurch im Karzinom Invasion zu unterstützen gezeigt haben. Mit Immunfluoreszenzmarkierungstechniken, die wirbeschriebenen Co-Lokalisation von Tumorzellen und Stromazellen (zB Mikroglia und Astrozyten), die beide in dem Hirngewebe und in die Tumorzelle Stecker (Fig. 1C-D), was auf eine enge Wechselwirkung zwischen den Zellen während der Invasionsprozess. Vergleichbare Ergebnisse wurden erzielt, wenn Maus Hirnschnitten wurden entweder mit menschlichen (Abbildungen 1C1-C3) oder Maus (Abbildungen 1D1-D3)-Karzinom-Zellen kokultiviert - zeigt die breite Palette von Anwendungen für das Studium Zellen von verschiedenen Arten, Genotypen und Sorten.
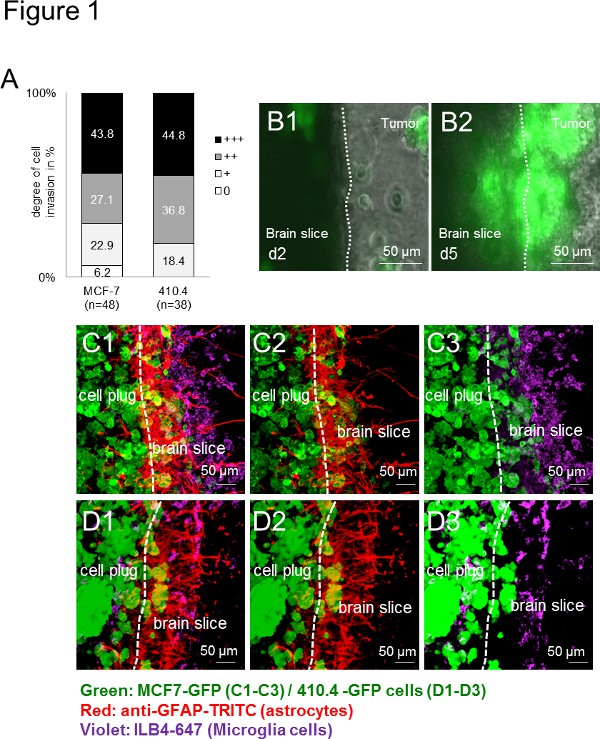
Fig. 1 ist. Hirnschnitt Kokultur-Modell mit einem 3D-Sphäroid von Maus und Mensch Karzinomzellen. A) Quantifizierung der Invasion von Krebszellen in organotypischen Hirnschnitt ganze Kokulturen mit einer Maus BrustkrebsZelllinie 410,4 oder eine menschliche Brustkrebs-Zelllinie MCF-7. Die Daten stellen den Prozentsatz der Grad der Zellinvasion in Hirnschnitten in jeder Gruppe mit n ≥ 38. Es gab keinen signifikanten Unterschied zwischen den beiden Gruppen (Kruskal-Wallis-Test). B) Zeitraffer-Bilder der organotypischen Hirnschnitt ganze Kokulturen mit MCF-7-GFP-Zellen und repräsentative Bilder von Tag 2 (B1) und Tag 5 (B2) waren gezeigt. CD) konfokale Mikroskopie-Bilder zeigten Kohorten von Karzinomen, Astrozyten und Mikroglia. Doppelfärbung von Astrozyten (anti-GFAP-TRITC, rot) und Mikroglia (ILB4-Alexa Fluor 647, violett) des gesamten Co-Kultur mit der 350 um dicken organotypischen Hirnschnitt und dem GFP-transfizierten Tumorzell Stecker (grün): 3D- MCF-7-GFP-(C1-C3) und 3D-410.4-GFP (D1-D3). Weiße Striche zeigte den Rand des Hirnschnitt und dem Tumorinvasionsfront. Maßstabsbalken repräsentieren 50 um. Mikroglia, Astrozyten einnd Tumoren Kolokalisationen (C1 und D1), Astrozyten-Tumoren Kolokalisationen (C2 und D2) und Mikroglia-Tumor-Kolokalisationen (C3 und D3) in der Scheibe Co-Kultur. Klicken Sie hier für eine größere Ansicht
Diskussion
Zurück histologische Untersuchungen der zerebralen Metastasierung zeigten schnelle und drastische Veränderungen der ansässigen Gliazellen, vor allem von Astrozyten und Mikroglia 13. Um diese Veränderungen und Wechselwirkungen mit den Karzinomzellen zu studieren, ist diese neue Co-Kultur-System gut geeignet. Weitere Forschungsfelder haben bereits langjährige Erfahrung mit organotypischen hippokampalen Hirnschnitten. Ein Vorteil ist, dass die organotypischen hippocampalen Hirnschnittkulturen sind lebensfähig und effektiv Wochen für Tag erhalten, so dass es für Langzeitexperimente geeignet. Da Stoppini Die Einführung der organotypischen hippocampalen Schnitt-System 1991 ist es weit verbreitet, beispielsweise in der Forschung von degenerativen Erkrankungen. Somit stellt diese innovativen Co-Kultur-System eine Modifikation einer etablierten Ansatz mit einer Reihe von Anwendungen in der Tumorbiologie 9,11. Die Modifikation bot uns ein reproduzierbares Modell, um den Grad der Tumorinvasion af bewertenterwards und Kulturen durch das Interface-Verfahren gewachsen sind ideal für Experimente, die eine dreidimensionale Struktur erfordern. Verschiedene Techniken sind verwendet worden, um organotypischen hippocampalen Schnitten Kokultur mit anderen Zellen. Dazu gehören ein indirektes System zwischen Makrophagen-Zellen und der organotypischen Hirnschnitt 14 und eine direkte Co-Kultur von zwei verschiedenen Scheiben aus der Region des Hippocampus 15. Gliom-Aggregate sind auch mit Hirnschnitten 16 kokultiviert worden. Diese Modelle können verwendet werden, um zelluläre und molekulare Ereignisse in den Gehirnschnitten zu analysieren, aber nicht direkt, physiologische Kontakt zwischen Tumorzellen, Mikroglia und das Hirnparenchym ermöglichen. Darüber hinaus ermöglicht dieses Verfahren die Beobachtung der Mikroglia ohne Kontamination von Knochenmark abgeleiteten peripheren Monozyten / Makrophagen. Die Verwendung von CCR2 und CX3CR1 transgenen Mausmodell ist ein kritischer Verbesserung aufgrund der Tatsache, dass es schwierig ist, den Bewohner von Mikroglia eindringenden Monozyten zu unterscheidenauf der Grundlage ihrer ähnlichen Eigenschaften 17,18,19. Obwohl intrazerebrale Injektion von Krebszellen erlaubt die Untersuchung der Tumorprogression, nicht sagen kann wesentlich, ob die umgeben Makrophagen-ähnlichen Zellen von Gehirn-residenten Mikroglia Population oder aus dem Knochenmark stammenden peripheren Monozyten / Makrophagen 17. Das Team von Kettenmann führte eine organotypischen Hirnschnittmodell, das Impfen von Gliom-Zellen in Gehirnschnitten mit einem Mikromanipulator 20 beteiligt. Allerdings unterscheiden sich primäre maligne Gliome in vieler Hinsicht von metastasierten Karzinome. Erstens sind mesenchymalen Ursprungs malignen Gliomen, nicht außerhalb des Nervensystems metastasieren, und wandern / einzufallen als Einzelzellen ohne Grenze zwischen Tumor und Hirngewebe. Im Gegensatz dazu ist infiltrative Wachstum eine typische pathologische Merkmal, und solche Karzinome in der Regel wandern / einzufallen als Kohorten. Zweitens versuchen Karzinome oft epithelialen Strukturen im Gehirn wieder aufzubauen, während Gliazellenversuchen, den Tumor aus dem Hirngewebe von einer (pseudo-) Kapsel trennen. Unter Berücksichtigung der biologischen und morphologischen Eigenschaften, malignes Gliom und Metastasierung von Karzinomen sind nicht wirklich vergleichbar. Aus diesen Gründen, modifiziert und eine Co-Kultur-System, wo wir nicht spritzen, sondern eine Co-Kultur-Karzinom-Zell Stecker neben dem Hirnschnitt entwickelten wir. Darüber hinaus beobachteten wir Mikroglia und Astrozyten Akkumulation an der Grenze des Tumors Stecker, was bedeutet, dass Mikroglia geben Sie die Tumor-Stecker und könnte leicht durch Hellfeldmikroskopie erkannt und anschließend durch konfokale Mikroskopie bestätigt werden. Die Krebszellen dringen in das Gehirn in Scheiben schneiden, die vergleichbar mit der realen Situation in vivo und einer Beobachtung von Baumert und Kollegen, die in 63% der Fälle eine Autopsie Infiltration Zone gefunden mit Hirnmetastasen 21 gemacht ist.
Aufgrund der fehlenden Durchblutung, gibt es nur Makrophagen / Mikroglia in dieser Kultur. Darüber hinaus kann aufgrund der mIssing T-Zellen und daher fehlt allo-Reaktivität, menschliche Karzinomzellen könnte sogar Kokultur mit Gehirnschnitten von immunkompetenten Mäusen oder Ratten (NMRI, B6 oder Wistar) verwendet werden. Dies könnte als Alternative zum Nacktmausmodell zu dienen. Da vier vor fünf Scheiben kann von jeder Maus erhalten werden, deutlich reduziert die Anzahl der Tiere erforderlich ist, im Vergleich zu den bestehenden Pritzer. Hinzu kommt, dass die Tiere über einen längeren Zeitraum von Metastasen zu leiden und sie nicht operativen Verfahren 22 wiederholt durchlaufen.
Mit dieser Cokultur-System haben wir die Aktivierung der Mikroglia durch Krebszellen und die Fähigkeit zur Förderung der Invasion von Krebszellen nachgewiesen. Außerdem ist dies das erste Mal, nach unserer Kenntnis wurden Mikroglia gefunden, sich aktiv zu transportieren Karzinomzellen 23.
Trotz all dieser Vorteile weist das Kokultursystem zwar auch Einschränkungen. Es ist noch ein in vitroModell fehlt die Schritte der Metastasierung vor der Kolonisation. Wegen der fehlenden Perfusion, ist es nicht möglich, die Extravasation studieren. Somit ist die alternative Möglichkeit, um die Extravasation zu studieren, um entweder die in vivo-Injektion-Modell oder die modifizierten Boyden-Kammer-System mit der extrazellulären Matrix, HUVEC und Astrozyten, um die Blut-Hirn-Schranke 22,24 imitieren. Die Hirnschnitt Kokultur Verfahren ist noch ein zuverlässiges und reproduzierbares Modell mit vielen Vorteilen und ein Potential für eine breite Vielfalt von Anwendungen, wie beispielsweise Analyse der Besiedlung, insbesondere mit einem Fokus auf der Rolle der residenten Zellen. Die Kombination mit anderen etablierten Techniken (wie Immunhistochemie, konfokaler Mikroskopie und Zeitraffer-Mikroskopie) unterstützt die Untersuchung der direkten Zell-Zell-Interaktionen. Es ist eine einfache Alternative und Ergänzung anderer Techniken und bietet Zugang zu der Untersuchung der Signale und Effekte, wie von der Mikroumgebung metastasierendem auferlegt.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Chalid Ghadban für seine hervorragende technische Hilfe, Andreas Wodarz und Stephan Heermann für ihre technischen Beratung über die konfokale und Zeitraffer-Mikroskopie. Es gibt keinen Interessenkonflikt für einen der Autoren. Diese Arbeit wird von der Deutschen Forschungsgemeinschaft (DFG) in Project 2 von Forschergruppe 942 (FOR942 BI 703/3-1) gefördert, von den Dres.. Bayer-Stiftung (Baden Württembergischer Krebspreis, Deutschland) und durch das Forschungsprogramm der Medizinischen Fakultät der Georg-August-Universität Göttingen, Deutschland.
Materialien
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
Referenzen
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten