Method Article
Сокультивирования система с Органотипической мозга Slice и 3D Сфероид клеток карциномы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Органотипической мозг ломтик сокультивирования с клетками карциномы позволяет визуализировать морфологические изменения флуоресценции, а также светлом поле (видео) микроскопии в процессе инвазии клеток рака мозговой ткани. Эта модель Система также позволяет для обмена клеток и пополнения подходов и предлагает широкий спектр манипуляций и анализов.
Аннотация
Пациенты с церебральным метастазирования карциномы имеют плохой прогноз. Однако процесс в метастатическим сайта практически не исследованы, в частности, роль резидента (стромальных) клеток. Исследования, проведенные в первичных карцином демонстрируют влияние микросреды на метастаз, даже на прогноз 1,2. Особенно ассоциированные с опухолью макрофаги (ТАМ) поддержка миграции, инвазии и пролиферации 3. Интересно, что основные целевые участки метастазирования обладают тканеспецифические макрофаги, такие как клетки Купфера в печени или микроглии в ЦНС. Кроме того, метастатических сайты также обладают другими тканеспецифические клетки, как астроциты. Недавно астроциты были продемонстрированы, чтобы способствовать распространению и настойчивость раковых клеток 4,5. Таким образом, функции этих тканеспецифических типов клеток, кажется, очень важно в процессе мозг метастазов 6,7.
Несмотря на эти наблюдения,Однако, до сих пор нет подходит в естественных условиях пробирке модель / в доступной непосредственно визуализировать глиальных реакций при формировании головного метастазов, в частности, путем яркие микроскопии области. Последние в естественных условиях живого изображения клеток карциномы продемонстрировали свою мозговую поведение колонизации 8. Однако этот способ очень трудоемкий, дорогой и технически сложной. Кроме того, эти виды экспериментов на животных ограничены небольшими сериями и прийти с существенным стрессом для животных (по имплантации стеклянной пластины, инъекции опухолевых клеток, повторяющиеся анестезии и долгосрочной фиксации). Кроме того, в естественных изображений, таким образом, гораздо ограничивается визуализации клеток карциномы, тогда как взаимодействие с клетками-резидентами еще не были проиллюстрированы. Наконец, исследования клеток карциномы человека в иммунокомпетентных животных невозможны 8.
По этим причинам, мы создали систему совместного культивирования ConsiЖало органотипической мыши мозга срез и эпителиальных клеток, встроенного в матригеле (3D сферы клеток). 3D-сферы клеточной карциномы были размещены в непосредственной близости от головного мозга срез края с целью изучения вторжение в соседней ткани головного мозга. Это дает нам возможность визуализировать морфологические изменения и взаимодействия между глиальных клеток и клеток карциномы по флуоресценции и даже по яркие микроскопии области. После эксперимента сокультивирования, ткань головного мозга или 3D-сфероиды клеток может быть собрана и использована для дальнейших анализов молекул (например, Qrt-PCR, IHC, или иммуноблота), а также для исследований с помощью конфокальной микроскопии. Этот метод может быть применен для наблюдения за события в живой ткани головного мозга в течение нескольких дней без вредных эффектов на срезах головного мозга. Модель также позволяет избирательно подавление и замену резидентных клеток клетками из донорской ткани, чтобы определить четкую влияния данного генотипа. Наконец, модель совместного культивирования является практически альтернативойв естественных условиях подходы при тестировании целевых фармакологические манипуляции.
протокол
Эта новая модель является адаптацией ранее опубликованного органотипической гиппокампа мозга срез подхода 9-12. Были внесены изменения и дополнения, чтобы оптимизировать тканей взаимодействия раковых клеток-мозговые и гарантировать воспроизводимость. Исследование было рассмотрено и одобрено местным комитетом по этике. Животных обрабатывали тщательно в соответствии с руководящими принципами для ухода за животными в университете медицины Геттингене. Органотипической мозг ломтик сокультивирования можно разделить на два этапа. Первый шаг это подготовка органотипической срез головного мозга. Шаг второй включает получение опухолевых клеток и отложение в модели совместного культивирования.
1. Органотипической мозга Кусочек
- Подготовьте рассечение среду, состоящую из минимальной поддерживающей среде (MEM) с добавлением 0,2 мМ глютамина, 100 Ед / мл пенициллина, 100 мг / мл стрептомицина и 4,5 мг / мл глюкозы.
- Обезглавить мышей от любого штамма мыши между послеродовой деньшесть и восемь (P6-8).
- Снимите мозг быстро из черепа в асептических условиях и перенести его на ледяной рассечение среды.
- Снимите фронтальную полюс и мозжечок из раздела мозга всего.
- Fix и стабилизировать мозг на сцене с крио клея и 5% агарозы.
- Нарежьте срезы головного мозга горизонтально до толщины 350 мкм с помощью Vibratome.
- Сбор 5:56 целые срезах мозга от одного мозга мыши, в зависимости от вида и возраста.
- Подготовка культуральную среду, состоящую из 50% MEM, сбалансированный солевой раствор 25% Хэнкса (HBSS), 25% нормальной лошадиной сыворотки (NHS), 0,2 мМ глутамина, 100 ед / мл пенициллина, 100 мг / мл стрептомицина (Sigma, Munich, Германия) и 4,5 мг / мл глюкозы.
- Поместите каждый органотипической срез мозга на мкм поликарбонатный мембранный Transwell вставки 0,4 в течение шести-луночный планшет с 1 мл среды культивирования в нижней хорошо.
- Культура органотипической ломтики мозга в течение ночи в humidifieд атмосфера с 5% CO 2 при 37 ° С инкубатор.
2. Кусочек сокультивирования Модель
- Вставить 10 5 из GFP-трансфецировали опухоли или других клеток (например, MCF-7-GFP клеток) в 20 гель матрицы мкл, состоящие из 15% RPMI среде и 85% ECM геля.
- Поместите матрицу смесь MCF-7-гель в стерильный металлической распорки (диаметр 3,8 мм) непосредственно прилегающей к кортикальной области органотипической мозга срез и инкубируют в течение 2 часов.
- Снимите прокладку и позволяют 3D сфероид опухоль сокультивирования с органотипической срезе для 24-96 часов.
- Изменение культуральной среды через день.
3. Иммунофлуоресценции Окрашивание астроциты и микроглии в Органотипической мозга Slice сокультивирования
- Закрепите органотипической мозг ломтик сокультивирования 4% параформальдегидом в течение 8 часов при температуре 4 ° С.
- Промыть срез сокультивирования с PBST (PBS с 0,5% Triton X-100) в течение 5 мин.
- Блок Индекс Sные примеры с нормальной козьей сывороткой в PBST (1:20) при комнатной температуре в течение 1 часа.
- Пятно астроцитов путем инкубации срезов головного мозга сокультивирования с анти-глиальных фибриллярного кислого белка моноклонального антитела (GFAP, 1:200 в PBST) в течение 36 ч при 4 ° С с последующим козьего анти-мышь-TRITC (1:100 в PBST) окрашивающего в течение 1 часа при комнатной температуре.
- Вымойте образцы с PBST три раза в течение 5 мин.
- Пятно клетки микроглии с ILB 4-Alexa Fluor 647 (1:100 в PBST) в течение 1 часа при комнатной температуре.
- Контрастирующая мозга ломтик сокультивирования с DAPI (1:1000) в течение 3 мин при комнатной температуре.
- Гора и покровное мозга ломтик сокультивирования с ДАКО флуоресцентного монтажной среды.
- Оценить сорт опухолевой инвазии на основе следующей оценочной системе: 0 = ни одна из ячеек; + <1/3; + + = 1/3 - 2/3; + + + ≥ 2/3 из вторглись клеток (первый измерить длину контактной секции между вилкой опухоли и ломтик, затем измерить fractioн контакта обнаружению вторгшимися клеток).
4. Живая съемка взаимосвязи между глиальных и опухолевых клеток
- Выполните эксперимент под Leica перевернутый DMI 6000B микроскоп увеличением в 10 раз линзы и Leica DFC 350 FX ПЗС-камеры.
Результаты
Во-первых, все используемые клетки карциномы (человеческий: MCF-7 и мышиные: 410,4) вторглись в органотипической мыши мозга срез. Вторжение было поэтому виды-независимые (рис. 1А), что указывает на широкий спектр применения в видовом-независимым образом. Кроме того, микроглии, а также астроциты, накопленные на поверхности, как описано выше в естественных условиях и в образцах пациента 13. Покадровый изображений в течение продолжительного периода времени не только показал жизнеспособность срез, но и предложили хорошую платформу для наблюдения за клеточные взаимодействия. По покадровой экспериментов, клетки микроглии были записаны, чтобы войти в 3D шар клеток в то время как, в свою очередь, раковые клетки также захватили мозга срез (фиг. 1B1-B2). Более того, мы показали ранее способность микроглии для транспортировки клетки карциномы по-прежнему загадочной механизма, чтобы тем самым помочь в рака вторжения. Используя методы иммунофлуоресцентных маркировки, мыописаны со-локализаций опухолевых клеток и стромальных клеток (например, микроглии и астроциты) как в ткани мозга, так и в опухолевых клеток пробки (Фигуры 1С-D), что свидетельствует о жесткой взаимодействия этих клеток в процессе инвазии. Сопоставимые результаты были получены при ломтики мыши мозга были совместно культивировали либо с человека (показатели 1C1-C3) или мышиного (рис. 1D1-D3) клеток карциномы - показывая широкий спектр применения для изучения клеток из различных видов, генотипов и деформаций.
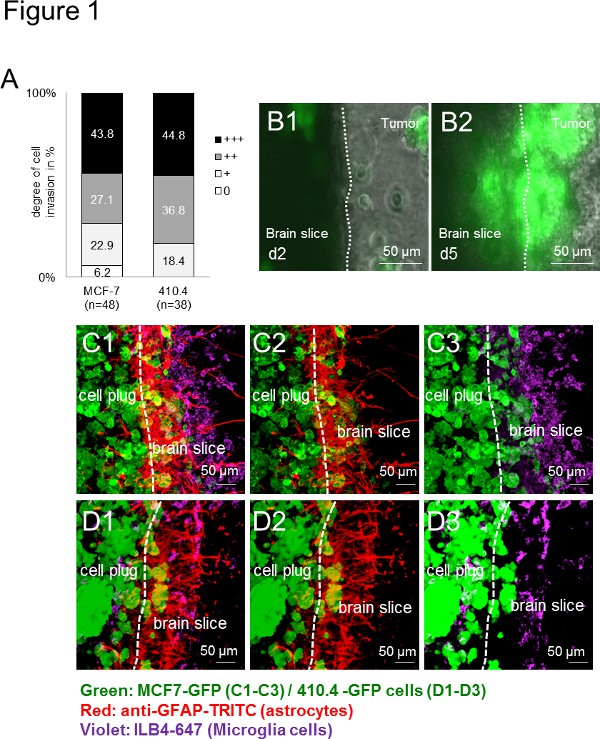
Рисунок 1. Мозг ломтик сокультивирования модель с 3D сфероида мыши и клетках карциномы человека. А) Количественная оценка инвазию раковых клеток в органотипических весь мозг срезов совместных культурах с раком груди мышиклеточная линия 410.4 или человек линию клеток рака молочной железы MCF-7. Данные представляют собой процент от степени инвазии клеток в мозг среза в каждой группе с п ≥ 38. Там не было никакого существенного различия между этими двумя группами (Крускала-Уоллиса). Б) покадровой изображения органотипических весь мозг срезов совместных культурах с MCF-7-GFP клеток и представительств изображений из день2 (B1) и день 5 (В2) были показано на рисунке. микроскопии изображений CD) Конфокальные показал когорты карцином, астроциты и микроглии. Двойное окрашивание астроцитов (анти-GFAP-TRITC, красный) и микроглии (ILB4-Alexa Fluor 647, фиалка) всего сокультивирования с толщиной среза органотипической 350 мкм мозга и GFP-трансфицированных вилки опухолевых клеток (зеленый): 3D- MCF-7-GFP (C1-C3) и 3D-410.4-GFP (D1-D3). Белые тире показал край среза головного мозга и инвазии опухоли фронта. Масштабные столбцы представляют 50 мкм. Микроглия, астроцитый опухоли colocalizations (C1 и D1), астроциты-опухоли colocalizations (C2 и D2) и микроглии-опухолевые colocalizations (C3 и D3) в ломтик сокультивирования. Нажмите здесь, чтобы увеличить изображение
Обсуждение
Предыдущие гистологические исследования мозгового метастазов продемонстрировал быстрые и радикальные изменения резидента глиальных клеток, особенно из астроцитов и микроглии 13. Для изучения этих изменений и взаимодействия с клетками карциномы, это новая система сокультивирования хорошо подходит. Другие исследовательские поля уже есть многолетний опыт с органотипических срезах гиппокампа головного мозга. Одним из преимуществ является то, что органотипической гиппокампа культур мозг ломтик жизнеспособны и эффективно сохраняется в течение нескольких дней до нескольких недель, что делает его пригодным для долгосрочных экспериментов. С введением Stoppini в части органотипической гиппокампа системы среза в 1991 году, он широко используется, например, в исследованиях дегенеративных заболеваний. Таким образом, этот Innovate система сокультивирования представляет собой модификацию устоявшихся подхода с диапазоном применения в биологии опухоли 9,11. Модификация предложил нам воспроизводимый модель для оценки класса опухолевой инвазии афЗатем производится и культуры, выращенные методом интерфейса идеально подходят для экспериментов, которые требуют трехмерную структуру. Некоторые методы были использованы для совместного культивирования органотипической срезах гиппокампа с другими клетками. К ним относятся косвенное системы между клеток макрофагов и органотипической мозга срез 14, и прямой сокультивирования двух различных срезов из гиппокампа области 15. Глиомы агрегаты были также совместно культивировали с срезах мозга 16. Эти модели могут быть использованы для анализа клеточных и молекулярных событий в срезах мозга, но не обеспечивают прямой, физиологический контакт между опухолевыми клетками микроглии, и паренхимы мозга. Кроме того, этот метод позволяет наблюдать микроглии без загрязнения костного мозга, полученных периферических моноцитов / макрофагов. Использование CCR2 и CX3CR1 трансгенных мышах является критическим улучшение обусловлено тем, что трудно отличить резидентную микроглии от вторжения моноцитына основе их аналогичными свойствами 17,18,19. Хотя Интрацеребральную инъекцию клеток карциномы позволяет исследовать развитие опухоли, он не может сказать, сколько в том окруженные макрофагами, как клетки происходят из мозга резидентом микроглии населения или из костного мозга, полученных периферийных моноциты / макрофаги 17. Команда Kettenmann представила органотипической мозга модель ломтик, который вовлекал прививки клеток глиомы в срезах мозга с микроманипулятора 20. Тем не менее, первичные злокачественные глиомы отличаются во многих отношениях от метастатических карцином. Во-первых, злокачественных глиом имеют мезенхимального происхождения, не метастазируют за пределами нервной системы, и мигрируют / вторжение в виде отдельных клеток, не границе между опухолью и мозговой ткани. Напротив, инфильтративный рост является типичным патологическим характерно, и такие карциномы обычно мигрируют / вторгнуться как когорт. Во-вторых, рак часто пытаются восстановить эпителиальные структуры в мозге, а глиальные клеткипопытаться отделить опухоль от мозговой ткани на (псевдо) капсулы. Учитывая биологические и морфологические особенности, злокачественные глиомы и метастазы рака на самом деле не сопоставимы. По этим причинам, мы изменили и разработал систему сокультивирования, где мы не придать но сокультивирования плагин-клеточная карцинома, прилегающей к мозга срез. Кроме того, мы наблюдали микроглии и астроцитов накопление на границе пробки опухоли, а это означает, что микроглии ввести вилку опухоли и могут быть легко обнаружены яркие микроскопии области и подтвердили впоследствии с помощью конфокальной микроскопии. Раковые клетки проникают в часть мозга, что сопоставимо с реальным в естественных условиях ситуации и наблюдение, сделанное Баумерта и коллег, которые нашли зону инфильтрации в 63% вскрытий с Метастазы в головной мозг 21.
Из-за пропавшего перфузии крови, есть только житель макрофаги / микроглия в этой культуре. Кроме того, из-за мIssing Т-клетки и, следовательно, отсутствует алло-реактивности, клетки карциномы человека могут быть использованы для совместного культивирования даже с срезах мозга мышей или крыс иммунокомпетентных (NMRI, В6, или Wistar). Это может служить альтернативой к обнаженной модели мыши. С 4:56 ломтики могут быть получены из каждой мыши, что значительно уменьшенные количества животных необходимы, по сравнению с существующими моделями инъекций. Кроме того, животные не страдают в течение длительного периода метастазов, и они не подвергаются оперативных процедур многократно 22.
С помощью этого совместного культивирования системы, мы продемонстрировали активацию микроглии раковыми клетками и потенциала продвижения вторжение раковых клеток. Кроме того, это первый раз, когда, по нашим данным, микроглии были найдены активно транспортировать клетки карциномы 23.
Несмотря на все эти преимущества, система совместного культивирования имеет, по сути, также ограничения. Он по-прежнему в пробиркемоделировать отсутствует этапы метастазирования до колонизации. Из-за отсутствия перфузии, это не возможно, чтобы изучить экстравазацию. Таким образом, альтернативный способ изучить экстравазацию является использование либо в естественных условиях модель впрыска или модифицированную систему камеры Бойдена с внеклеточного матрикса, HUVEC и астроциты, чтобы имитировать гематоэнцефалический барьер 22,24. Метод сокультивирования мозг ломтик еще надежные и воспроизводимые модели со многими преимуществами и потенциал для широкого спектра приложений, таких как анализ колонизации, в частности с акцентом на роли клеток-резидентов. Сочетание с другими установленными методами (например, иммуногистохимии, конфокальной микроскопии и покадровой микроскопии) поддерживает расследование прямых клетки к клетке взаимодействий. Это легкая альтернатива и комплементация других методов и предлагает доступ к исследованию киев и эффектов, наложенных метастатическим микросреды.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Авторы благодарят Chalid Ghadban за его отличную техническую помощь, Андреас Wodarz и Стефан Heermann для их технической консультации по конфокальной и покадровой микроскопии. Там нет никакого конфликта интересов для любого из авторов. Эта работа финансируется немецким научно-исследовательским советом (DFG) в проекте 2 Forschergruppe 942 (FOR942 BI 703/3-1), по Dres. Байер-Stiftung (Баден Вюрттемберг Krebspreis, Германия), а также программы научных исследований факультета медицины, Георга Августа университета Геттингена, Германия.
Материалы
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
Ссылки
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены