Method Article
뇌의 Organotypic 슬라이스와 암 세포의 3 차원 회전 타원체와 공 배양 시스템
* 이 저자들은 동등하게 기여했습니다
요약
암 세포와 뇌의 Organotypic 슬라이스 공 배양은 뇌 조직의 암 세포 침략의 과정에서 형광뿐만 아니라 시야 (비디오) 현미경으로 형태 학적 변화를 시각화 할 수 있습니다. 이 모델 시스템은 전지 교환 및 보충 접근이 가능하며 조작 및 분석의 다양한 제공합니다.
초록
암의 뇌 전이 환자는 예후가 있습니다. 그러나, 전이성 부위 프로세스 간신히 특히 상주 (기질) 세포의 역할을 조사하고있다. 차 암의 연구도 예후 1,2에, 전이의 미세 환경의 영향을 보여줍니다. 특히 종양 관련 대 식세포 (TAM) 마이그레이션을 지원, 침입 및 확산 3. 흥미롭게도, 전이의 주요 대상 사이트는 CNS에 간 또는 미세 아교 세포에있는 쿠퍼 세포와 같은 조직 특정 대식 세포를 가지고있다. 또한, 전이성 사이트도 성상 세포와 같은 다른 조직 특정 세포를 가지고있다. 최근, 성상 세포는 증식과 암세포 4,5의 지속성을 육성하기 위해 입증했다. 따라서, 이들 조직 특정 세포 유형의 기능은 뇌 전이의 6,7 과정에서 매우 중요한 것 같다.
이러한 관측에도 불구하고,그러나, 지금까지 직접 시야 현미경으로 특히 뇌 전이 형성 동안 아교 세포 반응을 시각화 할 수 생체 / 체외 모델에 적합하지 않습니다. 암 세포의 생체 내 실시간 영상 최근 자신의 뇌 식민지 동작 8을 보여 주었다. 그러나,이 방법은 매우 힘들고 비용이 많이 들고 기술적으로 복잡하다. 또, 동물 실험의 이러한 종류의 작은 시리즈로 제한되며 실질적인 (유리판의 주입에 의해, 종양 세포의 주입, 반복적 마취 및 장기 고정) 동물에 대한 스트레스와. 상주 세포와의 상호 작용이 아직 도시되지 않은 반면, 또한, 생체 내 이미징은 지금까지 암 세포의 시각화에 한정된다. 마지막으로, 면역 동물 내에서 인간의 암 세포의 조사는 8 불가능합니다.
이러한 이유로, 우리는 공 배양 시스템 consi 설립리겔 (3D 셀 영역)에 포함 된의 Organotypic 마우스 뇌 조각과 상피 세포의 고통. 3D 암종 세포 분야는 이웃하는 뇌 조직의 침입을 조사하기 위해 바로 옆 뇌 슬라이스 에지에 넣었다. 이 형광으로, 심지어 시야 현미경으로 glial 세포와 암 세포 사이의 형태 학적 변화와 상호 작용을 시각화하는 가능하게한다. 공 배양 실험 후 뇌 조직 또는 3D 세포 상체를 수집 할 수 있고, 또한 분자 분석 (예 : QRT-PCR, IHC, 또는 면역 블롯)뿐만 아니라, 공 초점 현미경으로 조사를 위해 사용됩니다. 이 방법은 뇌 조각에 대한 해로운 영향없이 일 살아있는 뇌 조직 내의 이벤트를 모니터링하는 데 적용될 수있다. 모델은 또한 선택적 억제 및 관련 유전자형의 뚜렷한 영향을 확인하기 위해 공여 조직으로부터 세포에 의해 상주 세포의 보충을 허용한다. 마지막으로, 공동 배양 모델은 실행 가능한 대안타겟 약리 조작을 테스트 할 때 생체 내 접근법.
프로토콜
이 새로운 모델은 이전에 출판의 Organotypic 해마의 뇌 조각의 접근 9-12의 적응이다. 변형 및 추가가 암세포 뇌 조직 상호 작용을 최적화하고 재현성을 보장하기 위해 도입되었다. 이 연구는 검토하고 지역 윤리위원회의 승인을 받았다. 동물은 의과 대학 괴팅겐에서 동물 보호에 대한 지침에 따라 신중하게 처리 하였다. 뇌의 Organotypic 슬라이스 공 배양은 두 단계로 세분화 할 수있다. 단계 하나의 Organotypic 뇌 조각의 준비입니다. 이 단계는 공동 배양 모델에서 종양 세포 준비 및 증착을 포함한다.
1. 뇌의 Organotypic 슬라이스
- 0.2 MM의 글루타민, 100 U / ㎖ 페니실린, 100 ㎎ / ㎖ 스트렙토 마이신, 포도당 4.5 ㎎ / ㎖로 보충 최소 필수 배지 (MEM)로 구성되는 해부 매체를 준비합니다.
- 출생 후 하루 사이에 마우스 변형에서 쥐를 목을 베다6 및 8 (P6-8).
- 무균 조건 하에서 두개골에서 빠르게 뇌를 제거하고 얼음처럼 차가운 해부 매체로 전송.
- 전체 뇌 섹션에서 정면 극과 소뇌를 제거합니다.
- 수정하고 알아내는 접착제와 5 % 아가로 오스와 함께 무대에 뇌를 안정.
- vibratome를 사용하여 350 ㎛의 두께로 가로로 뇌 단면을 조각.
- 종과 나이에 따라, 하나의 마우스의 뇌에서 4-6 전체 뇌 조각을 수집합니다.
- 50 % MEM 이루어진 배양액을 준비하고, 25 %의 행크 평형 염 용액 (HBSS), 25 % 정상 말 혈청 (NHS), 0.2 mM의 글루타민, 100 U / ㎖ 페니실린, 100 ㎎ / ㎖ 스트렙토 마이신 (시그마, 뮌헨 독일), 및 4.5 ㎎ / ㎖ 포도당.
- 하단에 잘 재배 배지 1 ㎖로 여섯 잘 플레이트에 0.4 μm의 폴리 카보네이트 (polycarbonate) 트랜스 웰 막 삽입에 각각의 Organotypic 뇌 조각을 넣어.
- humidifie에있는 문화의 Organotypic 뇌 조각의 하룻밤37 ° C의 배양기에서 5 % CO 2와 D의 분위기.
2. 조각 공 배양 모델
- GFP 형질 전환 된 종양 또는 다른 세포 15 % RPMI 배지와 85 %의 ECM 젤로 구성된 20 μL 젤 매트릭스 (예를 들어, MCF-7-GFP 세포)의 10 5를 포함합니다.
- 의 Organotypic 뇌 조각의 대뇌 피질의 영역에 직접 인접 멸균 금속 스페이서 (3.8 mm 직경)에 MCF-7-겔 매트릭스 믹스를 넣고 2 시간 동안 배양한다.
- 스페이서를 제거하고 3D 종양 구형은 24-96 시간 동안의 Organotypic 슬라이스 공 배양 할 수 있습니다.
- 매일 배지를 변경합니다.
3. 의 Organotypic 뇌 조각 공 배양의 성상 및 미세 아교의 면역 형광 염색법
- 4 ℃에서 8 시간 동안 4 % 파라 포름 알데히드와의 Organotypic 뇌 조각의 공 배양을 수정
- 5 분 (0.5 % 트리톤 X-100으로 PBS) PBST로 슬라이스 공 배양을 씻는다.
- 의 차단실온에서 1 시간 동안 PBST 정상 염소 혈청 (1:20)을 수행하여 amples.
- 염소 항 - 마우스 TRITC (PBST에서 1:100) 염색 후 4 ° C에서 36 시간 동안 반 아교 섬유 성 산성 단백질 단일 클론 항체 (GFAP, PBST에서 1:200)와 뇌 조각의 공 배양을 배양하여 성상 세포를 얼룩 실온에서 1 시간 동안.
- 5 분 PBST로 3 회 샘플을 씻으십시오.
- 실온에서 1 시간 동안 (PBST에서 1:100) ILB 4 알렉사 플 루어 647와 미세 아교 세포를 얼룩.
- 실온에서 3 분 동안 DAPI와 뇌 슬라이스 공 배양 (1:1,000) Counterstain.
- 마운트 및 DAKO 형광등 설치 매체와 뇌 조각의 공 배양을 커버 슬립.
- 다음과 같은 평가 시스템에 따라 종양 침윤의 등급 평가 : + + = 1 / 3 - 2 / 3,,, + <1 / 3 세포의 0 = 없음 침입 세포의 + + + ≥ 2 / 3를 (첫 번째 종양 플러그와 슬라이스 사이의 접촉 부분의 길이를 측정 한 후 측정을 fractio) 침입 세포에 의해 감지 접촉 명.
4. 폐해와 종양 세포 간의 상호 작용의 실시간 이미징
- 라이카에서 실험을 수행하는 10 배 배율의 렌즈와 라이카 DFC (350) FX CCD 카메라에서 DMI 6000B 현미경 반전.
결과
첫째, 모든 사용 암 세포 (인간 : MCF-7 및 쥐 : 410.4)은의 Organotypic 마우스의 뇌 조각을 침공. 침입 종의 독립적 인 방식으로 응용 프로그램의 넓은 범위를 나타내는, 따라서 종 - 독립 (그림 1A)이었다. 또한, 미세 아교 세포뿐만 아니라 이전에 생체 시료 및 환자 (13)에 설명 된 계면에 축적 성상. 오랜 기간 동안 시간 경과 영상은 조각의 가능성을 제시 할뿐만 아니라 세포의 상호 작용을 관찰 할 수있는 좋은 플랫폼을 제공뿐만 아니라. 시간 경과 실험에 의해, 미세 아교 세포는 다시 암 세포도 뇌 조각 (그림 1B1-B2)를 침공, 3D 세포 구 동안 입력 기록되었다. 또한, 우리는 이전함으로써 암의 침공을 지원하기 위해 여전히 수수께끼의 메커니즘에 의해 암 세포를 수송하는 미세 아교 세포의 능력을 보여 주었다. 면역 형광 라벨링 기술을 사용하여, 우리침입 프로세스 동안 이들 세포 간의 긴밀한 상호 작용을 제안하는 뇌 조직 및 종양 세포 플러그 (도 1C-D)에서 두 종양 세포 및 간질 세포의 공동 현지화 (예, 미세 아교 세포 및 성상 세포)를, 기재. 다른 종의 유전자형과 균주의 세포를 연구하는 응용 프로그램의 넓은 범위를 보여주는 - 마우스의 뇌 조각이 인간 (그림 1C1-C3) 또는 쥐 (그림 1D1-D3) 암 세포를 하나 공 배양했을 때 대등 한 결과를 얻었다.
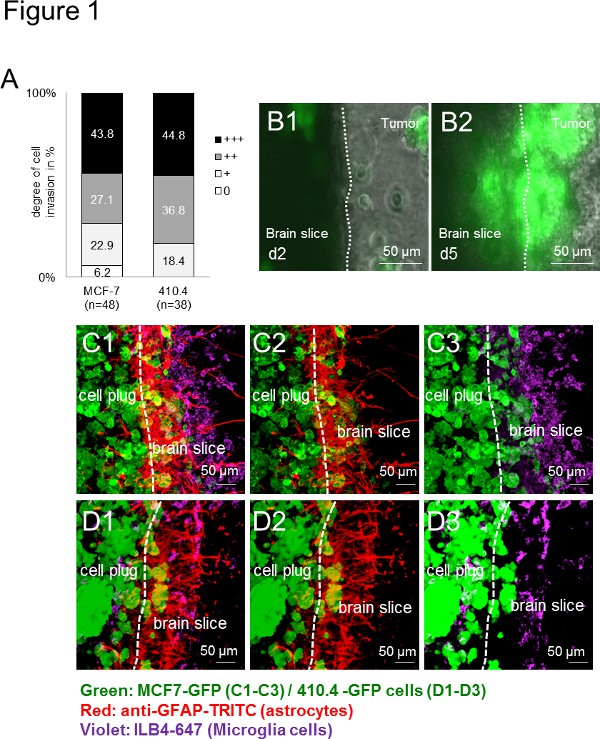
그림 1. 마우스와 인간의 암 세포의 3 차원 회전 타원체와 뇌 조각의 공동 배양 모델. 마우스 유방암의 Organotypic 전체 뇌 슬라이스 공 배양에 암 세포 침윤) 정량세포주 410.4 또는 인간 유방암 세포주 MCF-7. 데이터는 N의 ≥ 38 각 그룹의 뇌 조각으로 세포의 침윤 정도의 비율을 나타냅니다. 이 두 그룹 사이에 유의 한 차이 (크루스 칼 - 월리스 시험). B) MCF-7-GFP 세포와 DAY2 (B1 대표 이미지의 Organotypic 전체 뇌 슬라이스 공 배양의 시간 경과 이미지)과 5 일 (B2)했다가 없었다 표시. CD) 공 초점 현미경 이미지는 암, 성상 세포와 미세 아교 세포의 동료를 보여 주었다. 두 성상 세포의 염색 (안티 GFAP-TRITC, 빨간색)와 미세 아교 세포 350 μm의 두께의 Organotypic 뇌 조각과 GFP 형질 종양 세포 플러그 (녹색)와 전체 공 배양의 (ILB4 - 알렉사 플 루어 647, 보라) : 3D- MCF-7-GFP (C1-C3) 및 3D-410.4-GFP (D1-D3). 화이트 대시 뇌 조각과 종양의 침략 전면의 가장자리를 보여 주었다. 스케일 바는 50 μm의를 나타냅니다. 미세 아교 세포, 성상 세포의차 종양 colocalizations (C1 및 D1), 성상 세포 - 종양 colocalizations (C2와 D2)와 슬라이스 공 배양에있는 미세 아교 세포 종양 colocalizations (C3 및 D3). 더 큰 이미지를 보려면 여기를 클릭하십시오
토론
뇌 전이의 이전 조직 학적 조사는 특히 성상 세포와 미세 아교 세포 (13)의 거주자 glial 세포의 신속하고 과감한 변화를 보여 주었다. 암 세포와 이러한 변화와 상호 작용을 연구하기 위해,이 소설 공 배양 시스템은 매우 적합하다. 다른 연구 분야는 이미의 Organotypic 해마의 뇌 조각과 오랜 경험이 있습니다. 하나의 장점은 해마의 Organotypic 뇌 슬라이스 배양 장기 실험에 적합하다, 주에 실용적이고 효과적 일 동안 보존되어 있다는 점이다. 1991 년의 Organotypic 해마 슬라이스 시스템 Stoppini의 도입 이후, 폭넓게 퇴행성 질환의 연구, 예를 들어, 사용되어왔다. 따라서,이 혁신의 공 배양 시스템은 종양 생물학 9,11에있는 응용 프로그램의 범위와 잘 설립 접근 방식의 변경을 나타냅니다. 수정은 종양 침략 AF의 등급을 평가하는 우리에게 재현 모델을 제공인터페이스 방법에 의해 성장 terwards 문화 이상적 입체 구조를 필요로 실험에 적합하다. 몇 가지 기술은 다른 세포와의 Organotypic 해마 슬라이스를 공 배양하는 데 사용되었습니다. 이들은 대식 세포와 뇌의 Organotypic 슬라이스 (14) 사이의 간접적 인 시스템 및 해마 영역 (15)에서 두 개의 서로 다른 조각의 직접 공 배양이 (가) 있습니다. 신경 교종 집계는 뇌 조각 (16)와 공 배양되었다. 이러한 모델은 뇌 조각의 세포 및 분자 이벤트를 분석하는 데 사용될 수 있지만, 종양 세포, 미세 아교 세포 및 뇌 실질 간의 직접적인 생리적 접촉을 허용하지 않는다. 또한,이 방법은 골수 유래 주변 단핵구 / 대 식세포의 오염없이 미세 아교 세포의 관찰을 할 수 있습니다. CCR2 및 CX3CR1 트랜스 제닉 마우스 모델을 사용하기 때문에 그것이 단핵구 침입 상주 미세 아교 세포를 구별하기 어렵다는 사실에 중요한 개선자신의 유사한 특성 17,18,19에 따라. 암 세포의 뇌내 주입은 종양의 진행을 조사 할 수 있지만, 그것은 둘러싸여 대식 세포와 같은 세포가 뇌에 상주하는 미세 아교 세포 인구 또는 골수 유래 말초 단핵구 / 대 식세포 (17)에서 발생 여부에 많은 것을 말할 수 없습니다. Kettenmann의 팀은 미세 조작기 (20)와 뇌 조각으로 신경 교종 세포를 접종 관련의 Organotypic 뇌 조각 모델을 소개했다. 그러나, 주요 악성 신경 교종은 전이성 암에서 많은 관련이 다릅니다. 첫째, 악성 신경 교종은 중간 엽 기원하고, 종양 및 뇌 조직 사이에 경계와 같은 하나의 세포에 침입 / 신경계 이외의 전이 및 마이그레이션되지 않습니다. 반면 침윤성 성장은 일반적인 병적 특징, 그러한 암은 보통 마이그레이션 / 동료로서 침입. 세포를 아교 동안 두 번째로, 암은 종종 뇌의 상피 구조를 다시 시도(의사)에 의해 캡슐 뇌 조직에서 종양을 분리하려고. 생물학 및 형태 학적 특징을 고려하여, 악성 신경 교종 및 암의 전이 정말 비교할 수 없습니다. 이러한 이유로, 우리는 우리가 변경됨 뇌 슬라이스에 인접한 암종 세포 플러그를 주입하지만 공 배양하지 않는 공 배양 시스템을 개발 하였다. 더욱이, 우리는 미세 아교 세포가 종양 플러그를 입력하여 쉽게 명 시야 현미경에 의해 검출하고, 그 후 공 초점 현미경에 의해 확인 될 수 있음을 의미 소교 및 종양 플러그의 테두리에서 성상 세포의 축적을 관찰했다. 암 세포는 생체 내 상황에서 실물과 Baumert 뇌가 21 전이와 부검의 경우 63 %에 침투 영역을 발견 동료에 의해 관찰에 필적 뇌 슬라이스로 침입.
때문에 누락 된 혈액 관류,이 문화에만 상주 식세포 / 미세 아교 세포가 있습니다. 또한, 때문에 Missing T 세포는, 그러므로, 부재는 알로 반응성 인간 암종 세포에서도 면역 적격 마우스 또는 쥐의 뇌 조각 (NMRI, B6, 또는 스타 (Wistar))와 공동 배양에 사용될 수있다. 이 누드 마우스 모델에 대한 대안이 될 수 있습니다. 4-5 슬라이스는 각 마우스로부터 획득 될 수 있기 때문에, 동물의 수는 현저하게 감소 기존 사출 모델과 비교하여, 요구된다. 또한, 동물은 전이성 질환의 장기간 고생하지 않기 때문에 반복적 22 수술 절차를 거치지 않는다.
이 공 배양 시스템으로, 우리는 암 세포에 의한 미세 아교 세포의 활성 및 암세포의 침윤을 촉진하는 능력을 증명하고있다. 또한, 이것은 우리의 지식, 미세 아교 세포가 적극적으로 암 세포 23을 수송하기 위해 발견 된 것은 이번이 처음이다.
이러한 모든 장점에도 불구하고, 공동 배양 시스템은, 참으로, 또한 한계가있다. 아직 체외입니다이전의 식민지로 전이의 단계를 누락 모델. 때문에 관류의 부족, 그것이 혈관 외 유출을 연구하는 것은 불가능하다. 따라서, 혈관 외 유출을 연구하는 다른 방법은 혈액 - 뇌 장벽 (22, 24)를 모방하는 생체 주입 모델 또는 변형 된 보이 덴 챔버 시스템 세포 외 매트릭스, HUVEC 및 성상을 사용하는 것이다. 뇌 슬라이스 공 배양 방법은 아직 많은 장점과 함께 신뢰할 수 있고 재현성 모델과 같은 군체의 분석과 같은 다양한 애플리케이션에 대한 잠재적 인 상주 세포의 역할에 초점을 특히. (예 : 면역 조직 화학, 공 초점 현미경 및 시간 경과 현미경과 같은) 다른 설치 기술과의 조합은 직접 세포 간 상호 작용의 조사를 지원합니다. 그것은 쉬운 대안과 다른 기술의 보완과 전이성 미세 환경에 의해 부과로 신호와 효과 조사에 대한 액세스를 제공합니다.
공개
우리는 공개 아무것도 없어.
감사의 말
저자는 자신의 우수한 기술 지원, 공 초점 및 시간 경과 현미경에 대한 기술적 조언 안드레아스 Wodarz와 스테판 Heermann에 Chalid Ghadban 감사합니다. 저자의에 대한 관심의 충돌이 없습니다. 이 작품은 입는다하여 Forschergruppe 942 프로젝트 2 (FOR942 BI 703/3-1)에서 독일 연구 협회 (DFG)에 의해 투자된다. 바이엘 재단 (바덴 Württembergischer Krebspreis, 독일)와 의학부, 게오르그 8 월 - 대학 괴팅겐, 독일의 연구 프로그램에 의해.
자료
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
참고문헌
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유