Method Article
与器官型脑片和癌细胞的3D球体共培养系统
* 这些作者具有相同的贡献
摘要
在器官型脑切片的共培养与肿瘤细胞使肿瘤细胞侵袭的脑组织的过程中可视的形态变化用荧光以及明场(视频)显微镜。这个模型系统还允许细胞交换和补充的方法,并提供多种操作和分析。
摘要
患者癌脑转移的预后较差。但是,该方法在转移部位几乎没有被研究,特别是常驻(基质细胞)的作用。研究在原发癌展示微环境对转移的影响,甚至对预后1,2。尤其是肿瘤相关巨噬细胞(TAM)的支持迁移,侵袭和增殖3。有趣的是,转移的主要靶位点具有组织特异性巨噬细胞,如枯否氏细胞在CNS中的肝或小胶质细胞。此外,转移部位还具备其他组织特异性细胞,如星形胶质细胞。近日,被证实星形胶质细胞培养增殖和癌细胞4,5的持久性。因此,这些组织特异性细胞类型的功能似乎是非常重要的脑转移6,7的过程。
尽管这些观察,然而,到现在也没有合适的体内/体外模型可在脑转移的形成,特别是亮视野显微镜直接可视化胶质反应。最近在癌细胞体内实时成像展示了他们的脑殖民行为8。然而,这种方法是非常费力的,昂贵的和复杂的技术。此外,这些种类的动物实验被限制为小的串联,并设有为动物相当大的应力(由玻璃板的植入,注射肿瘤细胞,重复麻醉和长期固定)。此外, 体内成像是迄今限于癌细胞的可视化,而 用固有细胞的相互作用仍未示出。最后,免疫动物在人类癌细胞的调查是不可能的8。
基于这些原因,我们建立了共培养体系consi刺痛的器官小鼠脑片和嵌在基质胶(3D球体细胞)上皮细胞。三维癌细胞球被放置在为了调查浸润邻近脑组织直接相邻的脑切片的边缘。这使我们能够可视化的神经胶质细胞和肿瘤细胞的荧光,甚至通过亮视野显微镜之间的形态变化和相互作用。共培养实验后,脑组织或三维细胞球状体可以被收集并用于进一步的分子生物学分析( 例如定量RT-PCR,免疫组化,或免疫印迹),以及用于调查通过共聚焦显微镜。这个方法可以适用于监视天之内的活脑组织的事件,而不会有害影响的脑切片。该模型还允许选择性的抑制和更换常驻细胞通过从供体组织的细胞,以确定一个给定的基因型的不同的影响。最后,共培养模型是一个可行的替代在体内试验有针对性的药理操作时接近。
研究方案
这种新的模式是先前发布的器官型海马脑片方法9-12的适应。修改和增加被引入到优化癌细胞脑组织相互作用,并保证重复性。这项研究进行了审查,并经当地伦理委员会。动物根据在大学医学哥廷根的指引照顾动物慎重对待。在器官型脑切片共培养可分为两个步骤。步骤1是在器官型脑切片的制备方法。步骤2包括肿瘤细胞的制备和沉积在共培养模型。
1。器官型脑片
- 准备由最低必需培养基(MEM),补充有0.2mM的谷氨酰胺,100 U / ml青霉素,100毫克/毫升链霉素和葡萄糖的4.5毫克/毫升的夹层介质。
- 从出生后一天之间的任何小鼠品系杀头的小鼠6和8(P6-8)。
- 从头骨迅速取出大脑在无菌条件下,并将其转移到冰冷的夹层介质。
- 除去额极和小脑从全脑部分。
- 修复和稳定脑与低温胶和5%琼脂糖一个阶段。
- 通过使用vibratome切片的脑切片水平至350微米的厚度。
- 收集四个到六个全脑切片从单个小鼠脑,取决于物种和年龄。
- 准备由50%的MEM培养液中,25%Hanks平衡盐溶液(HBSS),25%正常马血清(NHS),0.2毫米谷氨酰胺,100 U / ml青霉素,100 mg / ml的链霉素(Sigma公司,慕尼黑德国),和4.5毫克/毫升的葡萄糖。
- 把各器官型脑切片在0.4微米的聚碳酸酯膜的transwell插入物在6孔板中,用1ml培养基中的在下部井。
- 在humidifie文化器官大脑切片过夜ð氛围,5%CO2,37℃培养箱中培养。
2。切片共培养模型
- 嵌入10 5的GFP转染的肿瘤细胞或其它细胞( 如 MCF-7-GFP细胞)在20μl的凝胶基质,其中包括15%的RPMI培养基和85%的细胞外基质凝胶中。
- 将MCF-7-凝胶基质混合入无菌金属隔板(3.8毫米直径)直接相邻的器官型脑切片的皮质区和孵育2小时。
- 拆下隔板,让3D球体瘤在共存与器官切片为24-96小时。
- 隔日更换培养基。
3。星形胶质细胞和小胶质细胞在器官型脑片共培养免疫荧光染色
- 修复器官型脑切片共培养,用4%多聚甲醛为8小时,在4℃下
- 用PBST(PBS中含有0.5%的Triton X-100),5分钟,洗片共培养。
- 阻塞的S用在PBST中的正常山羊血清(1:20)amples在室温下搅拌1小时。
- 孵育大脑切片共培养用抗胶质纤维酸性蛋白单克隆抗体(GFAP,在PBST中1:200)为36小时,在4℃,随后的山羊抗小鼠-TRITC(在PBST中1:100)染色染色的星形胶质细胞为1小时,在室温下进行。
- 洗样品用PBST 3次,每次5分钟。
- 弄脏的小胶质细胞与ILB 4 -的Alexa Fluor 647(1:100在PBST中)1小时,在室温下进行。
- 染液脑切片共培养用DAPI(1:1000)为3分钟,在室温下进行。
- 山和盖玻片的脑片共培养和DAKO的荧光封固剂。
- 评估肿瘤浸润基于以下评分系统上档次:0 =无细胞; + <1/3; + = 1/3 - 2/3;的入侵细胞+ + +≥2/3(第一测量肿瘤的插头和片之间的接触部分的长度,然后测量fractioN接点由侵入细胞检测)的。
4。胶质细胞和肿瘤细胞之间的相互作用的实时成像
- 根据徕卡进行实验倒置DMI 6000B显微镜10倍放大倍率的镜头和徕卡DFC 350 FX CCD摄像头。
结果
首先,所有用于肿瘤细胞(人:MCF-7和鼠:410.4)侵入器官小鼠大脑切片。因此入侵是物种无关( 图1A),这表明了广泛的物种无关的方式应用。此外,小胶质细胞以及在界面处积累如先前在体内和患者样品13中所述的星形胶质细胞。时间推移成像的多长时间,不仅揭示了切片的可行性,但也提供了一个很好的平台,以观察细胞相互作用。由延时实验,小胶质细胞,记录进入三维细胞球体同时,反过来,癌细胞也侵入脑切片( 图1B1-B2)。此外,我们先前的研究显示小胶质细胞的运输癌细胞由静止神秘的机制,从而协助肿瘤侵袭的能力。采用免疫荧光标记技术,我们描述共同的本地化肿瘤细胞和基质细胞( 如小胶质细胞和星形胶质细胞),两者在脑组织和肿瘤细胞中的插件( 图1C-D)中 ,在入侵过程表明这些细胞之间的紧密交互。示宽范围的研究从不同的物种,基因型和品系细胞应用-当小鼠脑片共培养要么与人类( 图1C1-C3)或鼠( 图1D1-D3)癌细胞比较的结果获得。
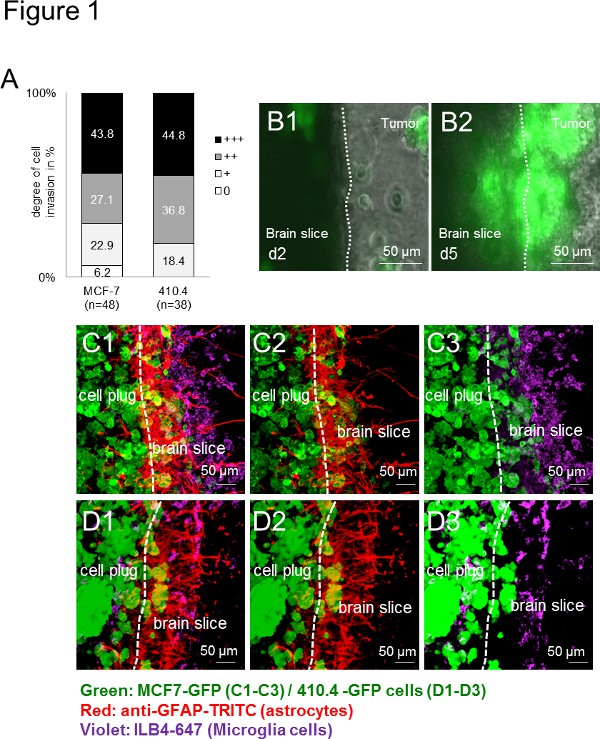
图1。脑片共培养模型的小鼠和人类肿瘤细胞三维球体。肿瘤细胞侵袭的器官全脑切片共培养了小鼠乳腺癌的)量化细胞株410.4或人乳腺癌细胞系MCF-7。数据代表细胞侵袭程度的百分比成每组具有n≥38的脑切片。有两组间无显著差异(Kruskal-Wallis检验)。 二)器官全脑切片与共同培养MCF-7-GFP细胞和代表性的图像从第2天(B1的延时图像)和第5天(B2)分别为如图所示。 光盘)共聚焦显微镜图像显示癌,星形胶质细胞和小胶质细胞的同伙。星形胶质细胞双重染色(抗GFAP-TRITC,红色)和小胶质细胞(ILB4-的Alexa Fluor 647,紫)全共培养与350微米厚的器官型脑片和GFP转染肿瘤细胞插头(绿色)的:3D- MCF-7-GFP(C1-C3)和3D-410.4-GFP(D1-D3)。白色虚线显示的脑切片,肿瘤浸润前面的边缘。刻度条表示50μm以下。小胶质细胞,星形胶质细胞ND肿瘤colocalizations(C1和D1),星形胶质细胞,肿瘤colocalizations(C2和D2)和小胶质细胞肿瘤colocalizations(C3和D3)在片共培养。 点击这里查看大图
讨论
脑转移的早期组织学研究证实了居民的神经胶质细胞的快速和急剧变化,特别是星形胶质细胞和小胶质细胞13。为了研究这些变化和相互作用与癌细胞,这种新颖的共培养系统非常适合。其他的研究领域已经有了长期的经验与海马器官型脑片。一个优点是,海马器官型脑片培养是可行的和有效的保存天至数周,使其适合长期实验。自1991年Stoppini的引进海马脑片系统,它已经被广泛使用,例如在退行性疾病的研究。因此,这种模式创新培养系统代表一个与一系列在肿瘤生物学9,11应用行之有效的方法的一种改进。修改为我们提供了一个可重复的模型来评估肿瘤的侵袭AF等级terwards和文化的接口方法生长非常适合于需要三维结构的实验。一些技术已经被用于在共存器官型海马切片与其他细胞。这些巨噬细胞和器官型脑切片14之间的间接系统,并从海马区15两个不同切片的直接共培养。神经胶质瘤的聚集也被用共培养脑片16。这些模型可以用来分析在脑切片的细胞和分子事件,但不允许肿瘤细胞,小胶质细胞和脑实质之间的直接的,生理的接触。此外,这种方法允许在观察小胶质细胞的无骨髓来源的外周血单核细胞/巨噬细胞的污染。使用CCR2和CX3CR1转基因小鼠模型是一个关键的改进是由于这样的事实,所以很难侵入单核细胞区分开驻地胶质根据他们的同类物业17,18,19。虽然脑内注射癌细胞允许调查肿瘤进展,它不能告诉之多,以包围巨噬细胞样的细胞是否从大脑驻留的小胶质细胞群体或从骨髓来源的外周血单核细胞/巨噬细胞17起源。 Kettenmann的团队介绍,涉及接种胶质瘤细胞进入大脑切片用显微操作器20的器官型脑片模型。然而,原发性恶性脑胶质瘤的区别转移性癌许多方面。首先,恶性胶质瘤是间充质来源的,不发生转移的神经系统外,并迁移/侵袭作为单细胞瘤和脑组织之间没有边界。相比之下,浸润性生长是一个典型的病理特征,而这种癌通常迁移/侵袭作为同伙。第二,癌经常尝试重建上皮结构在大脑中,而神经胶质细胞尝试将肿瘤从脑组织由(伪)胶囊分离。考虑到生物和形态特征,恶性胶质瘤和癌转移是不是真的具有可比性。出于这些原因,我们修改和开发了共培养系统中,我们不注入而是共存相邻的脑切片中癌细胞的插头。此外,我们观察到小神经胶质细胞和肿瘤插头的边框星形细胞堆积,这意味着小胶质细胞进入肿瘤插头,可以通过亮视野显微镜很容易地发现和共聚焦显微镜事后证实。癌细胞侵入大脑切片,这与体内情况真实,并通过BAUMERT和他的同事,谁发现了一个渗透区的尸检病例63%脑转移瘤21条提出的观察。
由于缺少血液灌流,只有居民的巨噬细胞/小胶质细胞在这种文化。由于此外,米伊辛T细胞,因此,不存在异体反应性,可用于人体癌症细胞共培养,即使免疫小鼠或大鼠的脑切片(NMRI,B6,或只Wistar)。这可以作为一种替代的裸鼠模型。自四到五片可以从每只小鼠获得,需要的动物的显著数目减少,相比于现有的喷射模型。此外,动物不患转移性疾病长时间的,他们不经过手术操作重复22。
与此共培养系统中,我们已经证明了小胶质细胞的活化由肿瘤细胞和促进癌细胞侵袭的能力。此外,这是第一次,就我们所知,小神经胶质细胞被认为积极输送癌细胞23。
尽管所有的这些优点,在共存系统有,实际上,还限制。它仍然是一种体外模型中丢失前殖民化的步骤转移。因为缺少灌注的,这是不可能研究外渗。因此,研究该外渗的替代方法是使用任一体内注射模型或改良的Boyden室系统与细胞外基质,内皮细胞和星形胶质细胞以模拟血脑屏障22,24。脑切片的共培养方法是另一种可靠的和可重现的模型具有许多优点,对于各种各样的应用,如定植的分析,一个潜在的,尤其侧重于驻地细胞的作用。与其它已建立的技术(如免疫组织化学,激光共聚焦显微镜和时间推移显微镜)的组合支持的直接细胞 - 细胞相互作用的研究。这是一个很不错的选择及其他技术互补,客人可作为征收转移微环境的线索和效果的调查。
披露声明
我们什么都没有透露。
致谢
作者感谢Chalid加德班为他出色的技术援助,安德烈亚斯Wodarz和斯蒂芬Heermann他们就共聚焦和时间推移显微镜技术咨询。没有任何作者的任何利益冲突。这项工作是由德国研究理事会(DFG)在项目Forschergruppe 942 2(FOR942 BI 703/3-1)资助,由德累斯顿。拜耳基金会(巴登符腾堡Krebspreis,德国)和由医学德国学院,乔治 - 奥古斯特大学哥廷根的研究计划。
材料
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
参考文献
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。