Method Article
Co-coltura di sistema con un Organotipica cervello Slice e 3D Spheroid delle cellule di carcinoma
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il organotipico coculture fetta cervello con cellule di carcinoma consente la visualizzazione cambiamenti morfologici mediante fluorescenza e campo chiaro (video) microscopia durante il processo di carcinoma invasione delle cellule del tessuto cerebrale. Questo modello di sistema permette anche approcci di scambio cellulare e di rifornimento e offre una vasta gamma di manipolazioni e analisi.
Abstract
I pazienti con metastasi cerebrali di carcinomi hanno una prognosi sfavorevole. Tuttavia, il processo nel sito metastatico è appena stata studiata, in particolare, il ruolo del (stromali) cellule residente. Studi in carcinomi primari dimostrano l'influenza del microambiente sulla metastasi, anche sulla prognosi 1,2. Soprattutto i macrofagi associati al tumore (TAM) migrazione di sostegno, l'invasione e la proliferazione 3. È interessante notare che i maggiori siti bersaglio di metastasi possiedono macrofagi tessuto-specifici, come le cellule di Kupffer nel fegato o microglia nel SNC. Inoltre, i siti metastatici possiedono anche altre cellule tessuto-specifici, come astrociti. Recentemente, gli astrociti sono state dimostrate per favorire la proliferazione e la persistenza di cellule tumorali 4,5. Pertanto, le funzioni di questi tipi di cellule tessuto-specifiche sembrano essere molto importante nel processo di metastasi cerebrali 6,7.
Nonostante queste osservazioni,Tuttavia, fino ad ora non c'è idoneo modello in vivo / in vitro disposizione di visualizzare direttamente reazioni gliali durante la formazione di metastasi cerebrale, in particolare mediante microscopia in campo chiaro. Recente in vivo imaging dal vivo delle cellule di carcinoma dimostrato il loro comportamento colonizzazione cerebrale 8. Tuttavia, questo metodo è molto laboriosa, costosa e tecnicamente complessa. Inoltre, questi tipi di esperimenti sugli animali sono limitate a piccole serie e sono dotati di una notevole sollecitazione per gli animali (per impiantazione della lastra di vetro, iniezione di cellule tumorali, anestesia ripetitivo e fissazione a lungo termine). Inoltre, l'imaging in vivo è finora limitata alla visualizzazione delle cellule di carcinoma, mentre non sono ancora stati illustrati interazioni con cellule residenti. Infine, ricerche di cellule di carcinoma umani all'interno animali immunocompetenti sono impossibili 8.
Per queste ragioni, abbiamo stabilito un sistema di co-coltura consipungiglione di una fetta cervello organotipica mouse e cellule epiteliali incorporato in matrigel (sfera di cellule 3D). Le sfere di cellule di carcinoma in 3D sono stati collocati direttamente accanto al bordo fetta cervello al fine di indagare l'invasione del tessuto cerebrale adiacente. Questo ci permette di visualizzare i cambiamenti morfologici e le interazioni tra le cellule gliali e cellule di carcinoma di fluorescenza e anche mediante microscopia in campo chiaro. Dopo l'esperimento di co-coltura, il tessuto cerebrale o sferoidi cellulari 3D possono essere raccolti e utilizzati per ulteriori analisi molecolari (ad es qRT-PCR, IHC, o immunoblot) nonché per indagini mediante microscopia confocale. Questo metodo può essere applicato per monitorare gli eventi all'interno di un tessuto cerebrale vivente per giorni senza effetti deleteri verso le sezioni di cervello. Il modello permette anche la soppressione selettiva e sostituzione di cellule residenti da cellule da un tessuto donatore per determinare l'impatto distinto di un dato genotipo. Infine, il modello di co-coltura è un'alternativa praticabilein vivo approcci durante il test manipolazioni farmacologiche mirate.
Protocollo
Questo nuovo modello è un adattamento di un approccio fetta cerebrale dell'ippocampo organotipica pubblicato in precedenza 9-12. Modifiche e aggiunte sono state introdotte per ottimizzare le interazioni cellula-tessuti tumorali cerebrali e garantire la riproducibilità. Lo studio è stato esaminato e approvato dal comitato etico locale. Gli animali sono stati trattati con cura secondo le linee guida per la cura degli animali presso l'Medicina dell'Università di Göttingen. Il organotipica fetta cervello co-coltura può essere suddivisa in due fasi. Primo passo è la preparazione della fetta cervello organotipica. Fase due comprende la preparazione delle cellule tumorali e deposizione nel modello di co-coltura.
1. Organotipica Cervello Slice
- Preparare il mezzo dissezione costituito mezzo minimo essenziale (MEM), supplementato con 0,2 mM glutammina, 100 U / ml di penicillina, 100 mg / ml di streptomicina, e 4,5 mg / ml di glucosio.
- Decapitare i topi da qualsiasi ceppo di topi tra giorno postnatalesei e otto (P6-8).
- Rimuovere il cervello rapidamente dal cranio in condizioni asettiche e trasferirlo medio dissezione ghiacciata.
- Rimuovere il polo frontale e cervelletto da tutta la sezione cervello.
- Fissare e stabilizzare il cervello su un palco con colla crio e il 5% agarosio.
- Tagliare sezioni cerebrali orizzontalmente per uno spessore di 350 micron utilizzando un vibratome.
- Raccogliere 4-6 intere sezioni di cervello da un unico cervello di topo, a seconda della specie e dell'età.
- Preparare il terreno di coltura costituito da 50% MEM, soluzione salina bilanciata di Hanks 25% '(HBSS), 25% siero di cavallo normale (NHS), glutammina 0,2 mM, 100 U / ml di penicillina, 100 mg / ml di streptomicina (Sigma, Monaco, Germania), e 4,5 mg / ml glucosio.
- Mettere ogni fetta cerebrale organotipica su un micron policarbonato transwell inserto membrana 0.4 in una piastra sei pozzetti con 1 ml di mezzo di coltura nel pozzo inferiore.
- Cultura organotipica fettine di cervello durante la notte in un humidified un'atmosfera con 5% di CO 2 a 37 ° C incubatore.
2. Il modello Slice coculture
- Incorporare 10 5 di tumore GFP-trasfettate o di altre cellule (ad esempio cellule MCF-7-GFP) in 20 microlitri matrice del gel, composto del 15% RPMI medie e l'85% gel ECM.
- Posizionare il mix matrice MCF-7-gel in un distanziatore metallico sterile (diametro 3,8 millimetri) direttamente adiacente alla regione corticale del cervello fetta organotipica e incubare per 2 ore.
- Rimuovere il distanziale e consentire al sferoide tumore 3D per co-coltura con la fetta organotipica per 24-96 ore.
- Cambiare il terreno di coltura ogni altro giorno.
3. Immunofluorescenza degli astrociti e microglia nel cervello Organotipica Slice coculture
- Fissare il organotipica fetta cervello co-coltura con paraformaldeide 4% per 8 ore a 4 ° C.
- Lavare la co-coltura fetta con PBST (PBS con 0,5% Triton X-100) per 5 min.
- Bloccare le samples con siero normale di capra in PBST (1,20) a temperatura ambiente per 1 ora.
- Macchiare gli astrociti incubando la co-coltura fetta cervello con fibrillare gliale anti-acido proteina monoclonale (GFAP, 1:200 in PBST) per 36 ore a 4 ° C, seguita da capra anti-topo-TRITC (1:100 in PBST) colorazione per 1 ora a temperatura ambiente.
- Lavare i campioni con PBST tre volte per 5 min.
- Colorare le cellule microgliali con ILB 4 Alexa Fluor 647 (1:100 in PBST) per 1 ora a temperatura ambiente.
- Controcolorare la fetta coculture cervello con DAPI (1:1.000) per 3 minuti a temperatura ambiente.
- Montare e coprioggetto la fetta coculture cervello con mezzo di montaggio DAKO fluorescente.
- Valutare il grado di invasione tumorale sulla base della seguente sistema di punteggio: 0 = nessuna delle celle; + <1/3; + + = 1/3 - 2/3; + + + ≥ 2/3 delle cellule invase (prima misurare la lunghezza della sezione di contatto tra la spina tumore e fetta, quindi misurare il frazionamenton di contatto rilevabile dalle cellule invasori).
4. Immagini dal vivo di interazione tra gliali e cellule tumorali
- Eseguire l'esperimento sotto un microscopio invertito Leica DMI 6000B a 10 volte più lente di ingrandimento e una camera CCD 350 FX Leica DFC.
Risultati
In primo luogo, tutte le cellule di carcinoma utilizzate (umane: MCF-7 e murine: 410,4) invasero la fetta cervello di topo organotipica. L'invasione era quindi specie-indipendenti (Figura 1A), che indica una vasta gamma di applicazioni in modo specie-indipendente. Inoltre, microglia e astrociti accumulati all'interfaccia come precedentemente descritto in vivo e in 13 campioni di pazienti. Time-lapse imaging per un periodo prolungato di tempo ha rivelato non solo la vitalità della fetta, ma anche offerto una buona piattaforma per osservare le interazioni cellulari. Con esperimenti di time-lapse, cellule microgliali sono stati registrati per entrare nella sfera cellulare, mentre in 3D, a sua volta, le cellule tumorali hanno invaso anche la fetta cervello (Figure 1B1-B2). Inoltre, abbiamo precedentemente dimostrato la capacità di microglia trasportare cellule di carcinoma da un meccanismo ancora enigmatico perciò aiutare nell'invasione carcinoma. Utilizzando tecniche di etichettatura immunofluorescenza, abbiamodescritto co-localizzazione delle cellule tumorali e cellule stromali (es microglia e astrociti), sia nel tessuto cerebrale e nella spina delle cellule tumorali (Figure 1C-D), suggerendo una stretta interazione tra queste cellule durante il processo di invasione. Risultati analoghi sono stati ottenuti quando fettine di cervello di topo sono state co-coltivate sia con umano (figure 1C1-C3) o murina (Figure 1D1-D3) cellule di carcinoma - mostra la vasta gamma di applicazioni per lo studio delle cellule provenienti da specie diverse, genotipi e ceppi.
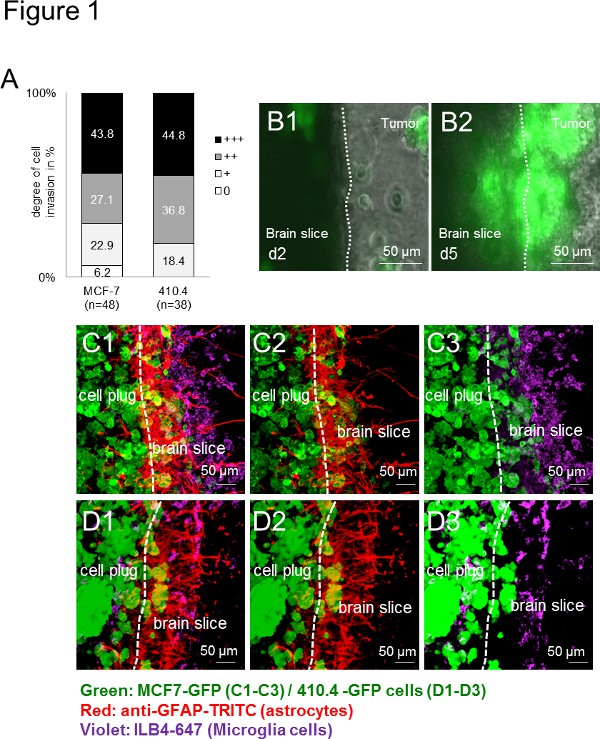
Figura 1. Cervello fetta modello di co-coltura con uno sferoide 3D di topo e cellule di carcinoma umano. A) Quantificazione del cancro invasione delle cellule in organotipica intere co-colture fetta cervello con il cancro al seno del mouse410.4 linea cellulare o una linea cellulare di carcinoma mammario umano MCF-7. I dati rappresentano la percentuale del grado di invasione cellulare in fetta cervello in ciascun gruppo con n ≥ 38. Non vi era alcuna differenza significativa tra i due gruppi (test di Kruskal-Wallis). B) time-lapse immagini di organotipica intere co-colture fetta cervello con le cellule MCF-7-GFP e immagini rappresentative di day2 (B1) e il giorno 5 (B2) sono stati mostrato. immagini di microscopia CD) confocale hanno mostrato coorti di carcinomi, astrociti e microglia. Doppia colorazione di astrociti (anti-GFAP-TRITC, rosso) e microglia (ILB4-Alexa Fluor 647, violetto) dell'intera co-coltura con la fetta cervello 350 micron di spessore organotipico e la spina cellula tumorale GFP-transfettate (verde): 3D- MCF-7-GFP (C1-C3) e 3D-410.4-GFP (D1-D3). Trattini bianchi che il bordo della fetta cervello e la parte anteriore invasione tumorale. Barre di scala rappresentano 50 micron. Microglia, astrociti unnd tumori colocalizations (C1 e D1), astrociti-tumori colocalizations (C2 e D2) e colocalizations microglia-tumorali (C3 e D3) nella co-coltura fetta. Clicca qui per vedere l'immagine ingrandita
Discussione
Precedenti indagini istologiche di metastasi cerebrali hanno dimostrato rapidi e drastici cambiamenti delle cellule gliali residenti, in particolare di astrociti e microglia 13. Per studiare questi cambiamenti e le interazioni con le cellule di carcinoma, questo sistema di co-coltura romanzo è adatto. Altri campi di ricerca già hanno esperienza di lunga data con organotipica fettine di cervello di ippocampo. Un vantaggio è che i organotipica culture fetta dell'ippocampo del cervello sono vitali ed effettivamente conservato per giorni o settimane, che lo rende adatto per esperimenti a lungo termine. Dall'introduzione di Stoppini del sistema fetta dell'ippocampo organotipica nel 1991, è stato ampiamente utilizzato, per esempio nella ricerca di malattie degenerative. Così, questo sistema di co-coltura innovare rappresenta una modifica di un approccio consolidata con una gamma di applicazioni in biologia tumorale 9,11. La modifica ci ha offerto un modello riproducibile per valutare il grado di invasione tumorale afterwards e colture cresciute dal metodo di interfaccia sono ideali per esperimenti che richiedono una struttura tridimensionale. Diverse tecniche sono state usate per coculture fettine ippocampali organotipiche con altre cellule. Questi includono un sistema indiretto tra macrofagi e la fetta cervello organotipica 14, e un co-coltura diretta di due sezioni diverse dalla regione dell'ippocampo 15. Aggregati di glioma sono stati co-coltivate con fettine di cervello di 16. Questi modelli possono essere utilizzati per analizzare gli eventi cellulari e molecolari delle fettine di cervello, ma non consentono, il contatto fisiologico diretto tra le cellule tumorali, microglia e il parenchima cerebrale. Inoltre, questo metodo consente l'osservazione di microglia, senza contaminazione di midollo osseo periferico monociti / macrofagi. L'uso di CCR2 e CX3CR1 modello di topo transgenico è un miglioramento critico dovuto al fatto che è difficile distinguere la microglia residente di invadere monocitiin base alle loro proprietà simili 17,18,19. Anche se l'iniezione intracerebrale di cellule di carcinoma permette di indagare la progressione del tumore, non si può dire molto sul fatto che le cellule macrofago-come circondate provengono dalla popolazione microglia cerebrale residenti o dal midollo osseo periferico monociti / macrofagi 17. Il team di Kettenmann introdotto un cervello modello fetta organotipica che ha coinvolto inoculando cellule di glioma in fettine di cervello con un micromanipolatore 20. Tuttavia, gliomi maligni primari differiscono per molti aspetti da carcinomi metastatici. In primo luogo, gliomi maligni sono di origine mesenchimale, non metastasi al di fuori del sistema nervoso, e migrano / invadere le cellule come singole senza confine tra tumore e tessuto cerebrale. Per contro, la crescita infiltrante è una caratteristica tipica patologico, e che tali carcinomi solito migrare / invadere come coorti. In secondo luogo, carcinomi spesso cercano di ricostruire le strutture epiteliali del cervello, mentre le cellule glialicercare di separare il tumore dal tessuto cerebrale da una (pseudo) capsula. Considerando le caratteristiche biologiche e morfologiche, glioma maligno e metastasi dei carcinomi non sono realmente comparabili. Per queste ragioni, abbiamo modificato e sviluppato un sistema di co-coltura dove non ci iniettiamo, ma co-coltura di una spina di cellule di carcinoma adiacente la fetta cervello. Inoltre, abbiamo osservato microglia e l'accumulo di astrociti al confine della spina tumore, il che significa che la microglia entrare la spina tumore e potrebbe essere facilmente individuata mediante microscopia in campo chiaro e confermato successivamente mediante microscopia confocale. Le cellule tumorali invadono nella fetta cervello, che è paragonabile alla reale situazione in vivo e ad un'osservazione di Baumert e colleghi, che hanno trovato una zona infiltrazione nel 63% dei casi autoptici con metastasi cerebrali 21.
A causa della mancanza di perfusione di sangue, ci sono solo residenti macrofagi / microglia in questa cultura. Inoltre, a causa della mcellule Issing T e, di conseguenza, assente allo-reattività, cellule di carcinoma umane potrebbero essere utilizzati per co-coltura anche con fettine di cervello di topi immunocompetenti o ratti (NMRI, B6, o Wistar). Questo potrebbe servire come alternativa al modello di topo nudo. Da 4-5 fette possono essere ottenuti da ciascun topo, sono richiesti significativamente ridotto numero di animali, in confronto ai modelli iniezione esistenti. Inoltre, gli animali non soffrono per un lungo periodo di malattia metastatica e non sottoposti a procedure operative ripetutamente 22.
Con questo sistema di co-coltura, abbiamo dimostrato l'attivazione della microglia dalle cellule tumorali e la capacità di promuovere l'invasione delle cellule del cancro. Inoltre, questa è la prima volta, a nostra conoscenza, sono stati trovati per trasportare attivamente cellule di carcinoma 23 microglia.
Nonostante tutti questi vantaggi, il sistema di co-coltura ha, infatti, anche limitazioni. E 'ancora in vitromodellare mancano le fasi di metastasi prima della colonizzazione. A causa della mancanza di perfusione, non è possibile studiare la stravaso. Così, il modo alternativo di studiare la stravaso è di utilizzare il modello in vivo iniezione o il sistema di camera di Boyden modificata con matrice extracellulare, HUVEC e astrociti per imitare la barriera emato-encefalica 22,24. Il metodo coculture fetta cervello è ancora un modello affidabile e riproducibile con molti vantaggi e un potenziale per un'ampia varietà di applicazioni, come l'analisi di colonizzazione, in particolare con un focus sul ruolo delle cellule residenti. La combinazione con altre tecniche consolidate (come l'immunoistochimica, microscopia confocale e microscopia time-lapse) sostiene la ricerca di interazioni dirette cellula-cellula. Si tratta di una alternativa semplice e complementazione di altre tecniche e offre l'accesso alla ricerca di spunti e gli effetti come imposte dal microambiente metastatico.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Gli autori ringraziano Chalid Ghadban per la sua eccellente assistenza tecnica, Andreas Wodarz e Stephan Heermann per la loro consulenza tecnica in materia confocale e microscopia time-lapse. Non c'è conflitto di interessi per qualsiasi degli autori. Questo lavoro è finanziato dal Consiglio di ricerca tedesco (DFG) in Project 2 Forschergruppe 942 (FOR942 BI 703/3-1), dai Dres. Bayer-Stiftung (Baden Württembergischer Krebspreis, Germania) e dal Programma di Ricerca della Facoltà di Medicina, Georg-August-Universität Göttingen, Germania.
Materiali
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
Riferimenti
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon