Method Article
Bir Organotipik Beyin Dilim ve kanser hücrelerinin 3D Sferoid ile Coculture Sistemi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Karsinom hücreleri ile Organotipik beyin kesit kokültürü beyin dokusu karsinoma hücre istilası sürecinde floresan gibi parlak saha (video) mikroskopisi ile görselleştirme morfolojik değişiklikler sağlar. Bu model sistem ayrıca hücre değişimi ve ikmal yaklaşımlar sağlar ve manipülasyonlar ve analizlerin bir yelpazede sunuyor.
Özet
Karsinom serebral metastazı olan hastalarda kötü prognoz. Bununla birlikte, metastatik yerinde işlem ancak, özellikle, ikamet (stromal) hücrelerinin rolü araştırılmıştır. Birincil karsinomlarda çalışmalar bile prognoz 1,2 üzerinde, metastaz üzerinde mikroçevresinin etkisini göstermektedir. Özellikle tümör ilişkili makrofajlar (TAM) desteği göç, istila ve çoğalması 3. İlginç bir şekilde, metastazının başlıca hedefi siteleri gibi CNS'deki karaciğer veya mikroglia Kupffer hücreleri gibi doku spesifik, makrofajları da sahiptirler. Ayrıca, metastatik siteleri de astrosit gibi diğer dokuya-özgü hücreleri sahiptirler. Son zamanlarda, astrositler ve kanser hücrelerinin çoğalmasını 4,5 kalıcılığı teşvik etmek için ortaya konmuştur. Bu nedenle, bu dokuya özel hücre tipleri fonksiyonları beyin metastazı, 6,7 sürecinde çok önemli olduğu görülmektedir.
Bu gözlemlere rağmen,Bununla birlikte, şu ana kadar, doğrudan parlak alan mikroskopi ile, özellikle de serebral metastaz oluşumu sırasında, glial reaksiyonları görselleştirmek için uygun in vivo / in vitro modelinde uygun bir yoktur. Karsinom hücrelerinin in vivo canlı görüntülemede son kendi serebral kolonizasyon davranışlarını 8. gösterdi. Ancak bu yöntem çok zahmetli, maliyetli ve teknik olarak karmaşıktır. Buna ek olarak, hayvan deneyleri bu tür küçük seri kısıtlanır ve önemli bir (cam levhanın implantasyon ile, tümör hücrelerinin enjeksiyonundan, tekrar anestezi ve uzun süreli tespit) hayvanlar için stres ile birlikte gelir. Yerleşik hücreleri ile etkileşimleri henüz tasvir edilmemiş ise Dahası, in vivo görüntüleme, şimdiye kadar, karsinoma hücrelerinin görselleştirilmesi ile sınırlıdır. Son olarak, bağışıklığı yeterli hayvanlara içinde insan karsinoma hücrelerinin araştırmalar 8 imkansızdır.
Bu nedenlerle, bir kokültürü sistemi consi kurulmuşmatrigel (3D hücre küre) gömülü bir organotipik fare beyin dilim ve epitel hücrelerinin sokması. 3D karsinom hücre küreleri komşu beyin dokusunun işgali araştırmak amacıyla doğrudan yanındaki beyin dilim kenarına yerleştirildi. Bu floresan ile ve daha parlak alan mikroskopi ile glial hücreleri ve kanserli hücreler arasında morfolojik değişiklikler ve etkileşimleri görselleştirmek için sağlamaktadır. Kokültürü Deney sonra beyin dokusu ya da 3B hücre küremsiler toplanabilir ve daha fazla moleküler analizler (ör. qRT-PCR, IHC veya immunoblot) hem de eş odaklı mikroskopi ile araştırmaları için kullanılmıştır. Bu yöntem, beyin dilimlerine zararlı etkiler olmadan gün boyunca canlı bir beyin dokusu içinde olayları izlemek için uygulanabilir. Bu model aynı zamanda, seçici bastırma ve belirli bir genotip ayrı etkisini belirlemek için verici bir dokudan hücrelerin yerleşik hücre değiştirilmesini sağlar. Son olarak, model, kokültürü uygulanabilir bir alternatifhedeflenen farmakolojik manipülasyonlar sınarken in vivo yaklaşımlar.
Protokol
Bu yeni model, daha önce yayınlanan organotipik hipokampal beyin dilim yaklaşımın 9-12 bir uyarlamasıdır. Değişiklikler ve ilave kanser hücresi-beyin dokusu etkileşimlerini optimize etmek ve garanti etmek için tekrarlanabilirlik tanıtıldı. Çalışma gözden ve yerel etik kurul tarafından onaylandı. Hayvanlar Üniversitesi Tıp Göttingen'de hayvan bakım kurallarına göre özenle tedavi edildi. Organotipik beyin dilim kokültürü iki adım ayrılabilir. Birinci adım Organotipik beyin dilim hazırlanmasıdır. İkinci adım kokültürü modelinde tümör hücre hazırlama ve birikmesini içerir.
1.. Organotipik Beyin Dilim
- 0.2 mM glutamin, 100 U / ml penisilin, 100 mg / ml streptomisin, ve glukoz 4.5 mg / ml ile takviye edilmiş minimum temel ortam (MEM), aşağıdakilerden oluşan diseksiyon orta hazırlayın.
- Doğum sonrası günler arasında herhangi bir fare suşundan fareler başını kesmekAltı ve sekiz (P6-8).
- Aseptik koşullar altında hızlı bir şekilde kafatası beyin çıkarın ve buz gibi soğuk diseksiyon ortamına aktarmak.
- Bütün beyin bölümünden ön kutup ve beyincik çıkarın.
- Düzeltmek ve kriyo tutkal ve 5% agaroz ile bir sahnede beyin stabilize.
- Bir Vibratome kullanarak 350 mikron kalınlığında yatay beyin bölümleri dilimleyin.
- Türler ve yaşına bağlı olarak, tek bir fare beyninden 05:56 tüm beyin dilimleri toplayın.
- % 50 MEM oluşan kültür ortamı hazırlanır,% 25 Hanks dengeli tuz çözeltisi (HBSS),% 25 normal at serumu (NHS), 0.2 mM glutamin, 100 U / ml penisilin, 100 mg / ml streptomisin (Sigma, Münih, Almanya) ve 4.5 mg / ml glükoz.
- Alt de kültür ortamı içinde 1 ml olan bir altı-çukurlu plaka içinde bir 0.4 um polikarbonat membran transwell uç üzerindeki her Organotipik beyin dilim koyun.
- Bir nemlendirilmiş Kültür organotipik beyin dilimleri gecede37 ° C inkübatör% 5 CO 2 ile d atmosfer.
2. Dilim Coculture Modeli
- GFP ile transfekte edilmiş tümör veya başka hücrelerden% 15 RPMI ortamı ve% 85 ECM jel oluşan 20 ul jel matrisi içinde (örneğin, MCF-7-hücreleri GFP), 10 5, katıştırma.
- Organotipik beyin dilim kortikal bölgede doğrudan bitişik steril bir metal ara parça (3.8 mm çap) MCF-7-jel matris karışımı koyun ve 2 saat boyunca inkübe edilir.
- Boşluk çıkarın ve 3D tümör sfero 24-96 saat organotipik dilim ile Coculture sağlar.
- Her gün kültür ortamı değiştirin.
3. Organotipik Beyin Dilim Coculture içinde Astrositler ve mikrogliyal immünflöresan boyanması
- 4 ° C 'de 8 saat boyunca% 4 paraformaldehit ile Organotipik beyin dilim kokültür saptamak
- 5 dakika boyunca (% 0,5 Triton X-100 içeren PBS) PBST ile kokültür dilim yıkayın.
- S blok1 saat boyunca oda sıcaklığında PBST içinde normal keçi serumu (01:20) ile depas'lar.
- Keçi anti-fare-TRITC (PBST içinde 1:100) boyama, ardından 4 ° C'de 36 saat boyunca anti-glial fibriler asidik protein monoklonal antikor (GFAP, PBST içinde 1:200) ile beyin dilim ortak kültürü ile enkübe astrositler Leke Oda sıcaklığında 1 saat karıştırıldı.
- 5 dakika boyunca üç kez PBST ile örnekleri yıkayın.
- Oda sıcaklığında 1 saat boyunca (PBST içinde 1:100) ILB 4-Alexa Fluor 647 ile mikroglial hücreleri boyamak.
- Oda sıcaklığında 3 dakika boyunca DAPI ile beyin dilim kokültür (1:1000) Counterstain.
- Dağı ve DAKO floresan montaj orta beyin dilim Coculture lamel.
- Aşağıdaki sisteme göre tümör istilasının değerlendirilmesi notu: + + = 1/3 - 2/3,,, + <1/3 hücrelerinin 0 = yok işgal hücrelerin + + + ≥ 2/3 (birinci Tümör göbek ve dilim arasındaki temas bölümünün uzunluğunu, daha sonra fractio ölçmek) İstilacı hücreler tarafından tespit temas n.
4. Glial ve Tümör Hücreleri arasındaki Etkileşim Canlı Görüntüleme
- Bir Leica altında deneyi gerçekleştirmek 10X büyütme lens ve bir Leica DFC 350 FX CCD kamera DMI 6000B mikroskop ters.
Sonuçlar
Öncelikle, kullanılan tüm kanser hücreleri (insan: MCF-7 ve kemirgen: 410.4) organotipik fare beyin dilim işgal etti. İstila türe bağımsız bir şekilde geniş bir uygulama yelpazesi gösterir, bu nedenle türe bağımsız (Şekil 1A) idi. Buna ek olarak, mikroglia hem de in vivo olarak daha önce ve hasta numuneleri 13 de tarif edildiği gibi, ara yüzeyde birikmiş astrositler. Uzun bir süre boyunca zaman atlamalı görüntüleme dilim canlılığı ortaya ama aynı zamanda hücresel etkileşimleri gözlemlemek için iyi bir platform sundu değil sadece. Time-lapse deneyleri ile, Mikroglial hücreleri sırayla, kanser hücrelerinin de beyin dilim (Şekil 1B1-B2) işgal, 3D cep küre süre girmek için kaydedildi. Ayrıca, daha önce bu şekilde karsinom işgali yardımcı olmak için bir mekanizma ile hâlâ anlaşılmaz karsinom hücreleri taşıma mikroglia yeteneğini göstermiştir. Immünofloresan etiketleme teknikleri kullanarak,işgali işlemi sırasında, bu hücreler arasında sıkı bir etkileşim olduğunu gösterir beyin dokusunda ve tümör hücresi fiş (Şekil 1 C-D) hem de tümör hücreleri ve stromal hücre ko-lokalizasyonunu (örneğin, mikroglia ve astrositler), tarif edildiği. Farklı türler, genotip ve cinslerinden hücreleri incelemek için uygulamaların geniş gösteren - Fare Beyin dilimleri bir insan için (Şekil 1C1-C3), ya murin (Şekil 1D1-D3) karsinoma hücreleri ile ya da kültüre zaman karşılaştırılabilir sonuçlar elde edilmiştir.
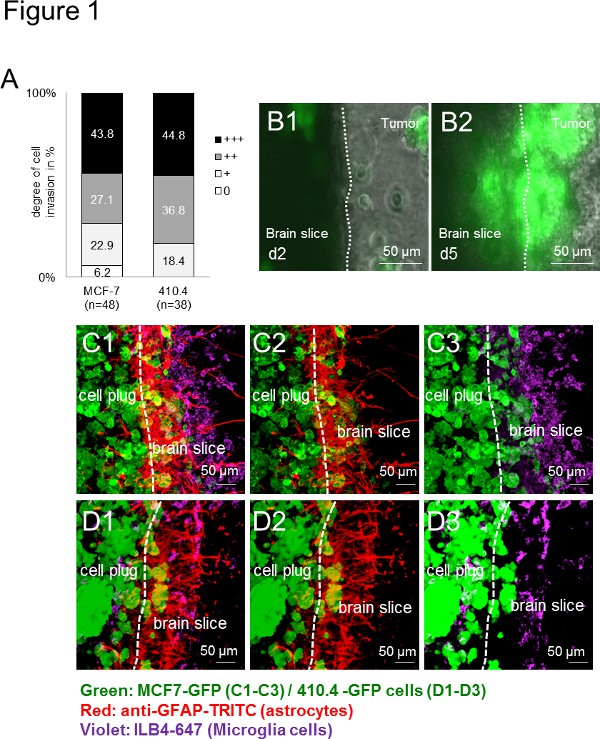
Şekil 1. Fare ve insan karsinoma hücrelerinin 3D sfero ile Brain dilim kokültürü modeli. Fare meme kanseri olan Organotipik bütün beyin dilim cocultures, kanser hücresi yayılımını A) miktarının belirlenmesihücre hattı 410,4 ya da bir insan göğüs kanseri hücre soyu MCF-7. Veriler n ≥ 38 ile her bir grupta beyin dilim içine cep istila derecesinin yüzdesini temsil eder. Bu iki grup arasında anlamlı bir fark (Kruskal-Wallis testi). B) MCF-7-GFP hücreleri ve gün2 (B1 temsili görüntüleri ile organotipik bütün beyin dilim cocultures Time-lapse görüntüleri) ve günde 5 (B2) idi vardı gösterilmiştir. CD) mikroskopisi görüntüleri karsinom, astrositlerde ve mikrogliya kohortlarını gösterdi. Çift astrositlerin boyama (anti-GFAP-TRITC, kırmızı) ve mikroglia 350 mikron kalınlığında Organotipik beyin dilim ve GFP-transfekte edilmiş tümör hücresi fişi (yeşil) ile bütün ko-kültürü (ILB4-Alexa Fluor 647 mor): 3D- MCF-7-GFP (C1-C3) ve 3D-410.4-GFP (D1-D3). Beyaz çizgiler beyin dilim ve tümör işgali ön kenarını gösterdi. Ölçek çubukları 50 um temsil eder. Mikroglia astrositler birnd tümörler colocalizations (C1 ve D1), astrocytes tümörler colocalizations (C2 ve D2) ve dilim kokültür mikroglia-tümör colocalizations (C3 ve D3). resmi büyütmek için buraya tıklayın
Tartışmalar
Serebral metastaz Önceki histolojik araştırmalar özellikle astrositlerde ve mikrogliya 13 yerleşik glial hücrelerin hızlı ve köklü değişiklikler göstermiştir. Karsinom hücreleri ile bu değişiklikleri ve etkileşimleri incelemek için, bu yeni kokültürü sistemi iyi uygundur. Diğer araştırmalar alanlar zaten organotipik hipokampal beyin dilimleri ile uzun yıllara dayanan bir deneyime sahip. Bir avantajı organotipik hipokampal beyin dilim kültürlerin uzun süreli deneyler için uygun hale, hafta canlı ve etkili bir gün boyunca korunmuş olmasıdır. 1991 yılında Organotipik hippocampal slice sistemi Stoppini en tanıtılmasından bu yana, yaygın dejeneratif hastalıkların araştırmada, örneğin kullanılmıştır. Bu nedenle, bu yenilik kokültürü sistemi tümörü 9,11 biyoloji uygulamaları bir dizi iyi kurulmuş bir yaklaşım bir modifikasyonunu ifade eder. Modifikasyon tümör yayılması af derecesini değerlendirmek için bize bir tekrarlanabilir bir model sunduArabirim yöntemiyle geliştirilmişlerdir terwards ve kültürler, ideal olarak, üç boyutlu bir yapı gerektiren deneyler için uygundur. Çeşitli teknikler diğer hücrelerle Organotipik hipokampal dilimler ortak kültürü için kullanılmıştır. Bunlar, makrofaj hücreleri ve Organotipik beyin dilim 14 arasında dolaylı sistemi ve hipokamp bölgesinin 15 iki farklı dilim doğrudan bir ortak kültürü içerir. Glioma agrega Ayrıca beyin dilimleri 16 ile kültüre edilmiştir. Bu modeller Beyin dilimleri hücresel ve moleküler olayları incelemek için kullanılabilir, ancak tümör hücreleri, mikroglia ve beyin parankiması arasındaki doğrudan temas fizyolojik izin vermez. Ayrıca, bu yöntem, kemik iliği kaynaklı periferal monositler / makrofajlar kirlenme olmadan mikroglia gözlem sağlar. CCR2 ve CX3CR1 transgenik fare modeli kullanılması nedeniyle monositler işgal yerleşik mikroglia ayırt etmek zor olduğu gerçeğinden için önemli bir gelişmedirOnların benzer özelliklere 17,18,19 dayanmaktadır. Karsinom hücrelerinin intraserebral enjeksiyonu tümör gelişimini araştıran sağlar rağmen, çevrili makrofaj benzeri hücreler beyin-yerleşik mikrogliya nüfus veya kemik iliğinden elde edilen periferal monositler / makrofajlar 17 kaynaklanan olmadığı kadar söyleyemem. Kettenmann ekibi bir micromanipulator 20 ile beyin dilimler halinde glioma hücrelerinin aşılanması dahil bir organotipik beyin dilim modelini tanıttı. Ancak primer kötü huylu gliyömların metastatik karsinom birçok bakımdan farklıdır. İlk olarak, malign gliomalar mezenkimal kökenli, tümör ve beyin dokusu arasında hiçbir sınır gibi tek hücreleri istila / sinir sistemi dışında metastaz ve göç yok. Buna karşılık, infiltratif büyüme tipik patolojik özelliğidir ve bu karsinomlar genellikle göç / kohortlarda olarak işgal. Hücreleri glial İkincisi, karsinom genellikle beyinde epitel yapıları yeniden deneyina (sözde) kapsül ile beyin doku tümörü ayırmak için deneyin. Biyolojik ve morfolojik özellikleri göz önüne alındığında, malign glioma ve karsinom metastazı gerçekten karşılaştırılabilir değildir. Bu nedenlerden dolayı, biz değiştirilmiş ve biz beyin dilim bitişik bir kanserli hücre fiş enjekte ama kokültürü olmayan bir kokültürü sistem geliştirdi. Ayrıca, mikroglia tümör fiş kolayca girip parlak alan mikroskopi ile tespit edilir ve daha sonra konfokal mikroskopi ile teyit edilebilir olabilir, yani, mikroglia ve tümör tıpanın sınırında astrositik birikimi gözlemlenmiştir. Kanser hücreleri in vivo durumda gerçek ve Baumert ve beyin metastazı 21 ile otopsi olgularının% 63 bir sızma bölgesi buldu meslektaşları tarafından yapılan bir gözlem karşılaştırılabilir beyin dilim içine işgal.
Çünkü kayıp kan perfüzyon, bu kültür sadece ikamet makrofaj / mikrogliya vardır. Ayrıca, çünkü mIssing T hücreleri ve bu nedenle, mevcut allo-tepkiselliğe göre insan karsinoma hücreleri da bağışıklığı fare veya sıçan beyin dilimlerindeki (NMRI, B6 veya Wistar) ile birlikte-kültür için kullanılabilir. Bu çıplak fare modelinde bir alternatif olarak hizmet verebilir. 4-5 dilim her bir fareden elde edilebildiğinden, hayvan sayısı önemli ölçüde azalır, mevcut enjeksiyon modellere kıyasla gereklidir. Buna ek olarak, hayvan metastatik hastalık uzun bir süre boyunca maruz kalmaz ve arka arkaya 22 ameliyat prosedürleri uğramaz.
Bu kokültürü sistemi ile, kanser hücreleri tarafından mikroglia aktivasyonunu ve kanser hücresi istilasını teşvik kapasitesini göstermiştir. Ayrıca, bu bizim bildiğimiz kadarıyla, mikrogliya aktif kanser hücrelerini 23 taşıma bulundu, ilk kez.
Tüm bu avantajlara rağmen, kokültürü sistem, gerçekten de sınırlılıkları vardır. Yine de, bir in vitro olduğuönce kolonizasyon metastaz adımlar eksik modeli. Çünkü perfüzyon eksikliği, bu ekstravazasyonu çalışma mümkün değildir. Bu nedenle, çalışma ekstravazasyonu için bir alternatif yol, kan-beyin bariyerini 22,24 taklit etmek için in vivo model veya enjeksiyon değiştirilmiş Boyden haznesi sistemi, hücre dışı matris ile, HUVEC ve astrositler ya kullanmaktır. Beyin dilim kokültürü yöntemi henüz birçok avantaj ile güvenilir ve tekrarlanabilir bir model ve bu kolonizasyon analizi gibi uygulamalar, geniş bir yelpazede, bir potansiyel yerleşik hücrelerin rolü üzerinde bir odaklanma ile özellikle. (Örneğin, immünohistokimya, konfokal mikroskopi ve zaman atlamalı mikroskopi gibi) diğer bilinen teknikler ile kombinasyon doğrudan hücre-hücre etkileşimleri soruşturma destekler. Bu kolay bir alternatif ve diğer tekniklerin tamamlama ve metastatik mikro dayattığı gibi ipuçları ve etkilerinin araştırılması erişim sunmaktadır.
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Yazarlar onun mükemmel teknik yardım, konfokal ve zaman atlamalı mikroskopi konularındaki teknik danışmanlık için Andreas Wodarz ve Stephan Heermann'ın için Chalid Ghadban teşekkür ederim. Yazarların herhangi için herhangi bir çıkar çatışması yoktur. Bu çalışma Dres tarafından, Forschergruppe 942 Proje 2 (FOR942 BI 703/3-1) Alman Araştırma Kurumu (DFG) tarafından finanse edilmektedir. Bayer-Stiftung (Baden Württembergischer Krebspreis, Almanya) ve Tıp Fakültesi, Georg-August-Üniversitesi Göttingen, Almanya Araştırma Programı tarafından.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hank's balanced salt solution (HBSS) | Gibco, Darmstadt,Germany | 24020 | |
| Minimum essential medium (MEM) | Gibco, Darmstadt , Germany | 32360 | |
| RPMI-1640 | PAA Laboratories Inc., Cölbe, Germany | E15-840 | |
| Dulbecco's phosphate buffered saline (PBS) | Pan Biotech, Aidenbach, Germany | P04-36500 | |
| Normal horse serum (NHS) | Invitrogen, Karlsruhe, Germany | 16050-122 | |
| Fetal calf serum (FCS) | Invitrogen, Karlsruhe, Germany | 10091148 | |
| Glucose | B. Braum, Melsungen, Germany | ||
| L-Glutamine-Penicillin-Streptomycin solution | Sigma, Steinheim, Germany | G1146 | |
| Vibratome | Leica, Wetzlar, Germany | Leica VT1200S | |
| Microtome | Leica, Wetzlar, Germany | Leica SM 2000R | |
| Polycarbonate membrane | BD Falcon, Heidelberg,Germany | 353090 | transwell membrane insert (0.4 μm pore size) |
| ECM gel | Trevigen, R&D, Wiesbaden-Nordenstadt, Germany | 3432-005-01 | Basement membrane extract |
| Metallic spacer | Kig GmbG, Kirkel, Germany | DIN 433 | |
| Confocal microscope | Zeiss, Göttingen, Germany | LSM 510 | |
| Time-lapse microscope and camera | Leica, Wetzlar, Germany | DMI 6000B microscope and a DFC 350 FX CCD camera | |
| Anatomy microscope | Zeiss, Göttingen, Germany | Stemi SV11 | |
| Paraformaldehyde | Merck, Darmstadt, Germany | 1.04005.1000 | |
| Mouse monoclonal anti-glial fibrillary acidic protein (GFAP) antibody | Sigma, Steinheim, Germany | G3893 | |
| Goat anti-mouse IgG, F(ab')2- TRITC | Santa Cruz, Heidelberg, Germany | SC3796 | |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 conjugate | Invitrogen, Karlsruhe, Germany | 132450 | |
| DAPI (4',6'-diamidino-2-phenylindole dihyfrochloride) | Sigma, Steinheim, Germany | D8417 | |
| Fluorescent mounting medium | DAKO, Glostrup, Denmark | S3023 |
Referanslar
- Langley, R. R., Fidler, I. J. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer. 128, 2527-2535 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat. Rev. Cancer. 9, 239-252 (2009).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454, 436-444 (2008).
- Fidler, I. J. The role of the organ microenvironment in brain metastasis. Semin. Cancer Biol. 21, 107-112 (2011).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PloS one. 8, e54752 (2013).
- Steeg, P. S. Tumor metastasis: mechanistic insights and clinical challenges. Nat. Med. 12, 895-904 (2006).
- Eichler, A. F., et al. The biology of brain metastases-translation to new therapies. Nat. Rev. Clin. Oncol. 8, 344-356 (2011).
- Winkler, F., et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peritumoral angiogenesis. Glia. 57, 1306-1315 (2009).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J. Neurosci. Methods. 37, 173-182 (1991).
- Kreutz, S., Koch, M., Ghadban, C., Korf, H. W., Dehghani, F. Cannabinoids and neuronal damage: differential effects of THC, AEA and 2-AG on activated microglial cells and degenerating neurons in excitotoxically lesioned rat organotypic hippocampal slice cultures. Exp. Neurol. 203, 246-257 (2007).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nat. Protoc. 1, 1439-1445 (2006).
- Fuller, L., Dailey, M. E. Preparation of rodent hippocampal slice cultures. CSH Protoc. 2007, pdb prot4848 (2007).
- Lorger, M., Felding-Habermann, B. Capturing changes in the brain microenvironment during initial steps of breast cancer brain metastasis. Am. J. Pathol. 176, 2958-2971 (2010).
- Brana, C., Biggs, T. E., Mann, D. A., Sundstrom, L. E. A macrophage hippocampal slice co-culture system: application to the study of HIV-induced brain damage. J. Neurosci. Methods. 90, 7-11 (1999).
- Kim, J. A., Yamada, M. K., Nishiyama, N., Matsuki, N., Ikegaya, Y. Mossy fiber pathfinding in multilayer organotypic cultures of rat hippocampal slices. Cell. Mol. Neurobiol. 23, 115-119 (2003).
- Matsumura, H., Ohnishi, T., Kanemura, Y., Maruno, M., Yoshimine, T. Quantitative analysis of glioma cell invasion by confocal laser scanning microscopy in a novel brain slice model. Biochem. Biophys. Res. Commun. 269, 513-520 (2000).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. , (2011).
- Mizutani, M., et al. The fractalkine receptor but not CCR2 is present on microglia from embryonic development throughout adulthood. J. Immunol. 188, 29-36 (2012).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of microglia. Physiol. Rev. 91, 461-553 (2011).
- Markovic, D. S., Glass, R., Synowitz, M., Rooijen, N., Kettenmann, H. Microglia stimulate the invasiveness of glioma cells by increasing the activity of metalloprotease-2. J. Neuropathol. Exp. Neurol. 64, 754-762 (2005).
- Baumert, B. G., et al. A pathology-based substrate for target definition in radiosurgery of brain metastases. Int. J. Radiat. Oncol. Biol. Phys. 66, 187-194 (2006).
- Palmieri, D., Chambers, A. F., Felding-Habermann, B., Huang, S., Steeg, P. S. The biology of metastasis to a sanctuary site. Clin. Cancer Res. 13, 1656-1662 (2007).
- Pukrop, T., et al. Microglia promote colonization of brain tissue by breast cancer cells in a Wnt-dependent way. Glia. 58, 1477-1489 (2010).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır