Method Article
ヒト白血球と血小板の単離と評価のためのプロトコル:生体エネルギーと酸化バースト
要約
血液白血球および血小板は、個体の全体的な生体エネルギー健康のマーカーとして使用されるので、病理学的プロセスと治療の影響を監視する可能性を有することができる。ここでは、ミトコンドリアの機能と、これらの細胞における酸化的バーストを分離し、測定する方法を記載している。
要約
ミトコンドリア機能障害は、アテローム性動脈硬化症、糖尿病、敗血症性ショック、神経変性疾患はなく挑戦している患者における生体エネルギー機能の変化を評価するような多くの病的状態において重要な役割を果たすことが知られている。特定の臓器障害を伴う糖尿病やアテローム性動脈硬化症などの疾患の臨床的に存在しますが、このような高血糖や炎症などの病態の全身のコンポーネントは、白血球や血小板の循環に生体エネルギー機能を変更することができます。この概念は、しばらくの間認識されてきたが、その広範な適用は生体エネルギー分析に必要な主要な多数の細胞によって制限されてきました。この技術的制限は、磁気ビーズ分離技術、細胞接着技術は、細胞はマイクロプレートへの活性化なしに取り付けることを可能にし、ハイスループットマイク用に設計された新しい技術の感度の特異性を組み合わせることによって克服されているroplate呼吸計測。この機器の一例は、細胞外フラックスアナライザーです。このような機器は、通常、その後代謝に関連することができ、接着性細胞では、これらのパラメータの変化率を測定するために、酸素とpH感受性プローブを使用しています。ここでは詳細にはヒトの血液、これらの細胞内のミトコンドリアの生体エネルギー機能の解析から、活性化することなく、単球、リンパ球、好中球や血小板の単離およびめっきのための方法を私たち。加えて、我々は、単球および好中球の酸化的バーストは、同じ試料中で測定することができる方法を実証する。これらの方法は唯一8〜20ミリリットルヒト血液を使用するので、それらは臨床現場で反応性酸素種の生成および生体エネルギーを監視するための可能性を有する。
概要
血液から免疫細胞(単球、リンパ球、好中球)および血小板の生体エネルギー状態を監視することは、個々の全体的な生体エネルギー状態を評価するために潜在的に有用な診断ツールとしてしばらくの間認識されている。癌、心血管疾患およびミトコンドリア機能障害の1,2への神経変性疾患などの疾患の数を帰属文学の新たなボディがあります。ミトコンドリア機能障害は、炎症誘発性シグナル伝達経路を促進または細胞死につながる細胞の一連のイベントを開始することができますので、これは臨床的に重要である。いくつかの研究は、線維筋痛、糖尿病、敗血症性ショック、およびアルツハイマー病などの条件3-7の末梢血単核細胞および血小板のミトコンドリア機能を特徴としている。例えば、最近の研究では、ミトコンドリア機能のマーカーとしての血小板の生体エネルギーを評価し、発見したタイプ2 diabetから血小板でIC患者は、ミトコンドリアの酸素消費を減少させた7,8。これらの知見およびその他から、それらは全身循環を調査し、ローカルおよびグローバルな代謝変化を反映することができるので、単球、リンパ球、好中球および血小板が病理学的条件下で生体エネルギーの変化の代理マーカーとして役立つことができることは明らかである。このアプローチは、分析のハイスループット方法を予後または診断値を有し、細胞調製のための一貫性のある方法が必要である。かどうかを決定するために
白血球と血小板におけるミトコンドリアの機能を測定する方法は、以前に無傷の細胞4,9における細胞生体エネルギーのミトコンドリアや評価の隔離を含んでいた。細胞外フラックス(XF)分析装置を用いて細胞の生体エネルギー評価の利点は、細胞内のミトコンドリアの機能は、プロトンリークと最大呼吸などの内因性基質および呼吸パラメータを確立することができるということである容量を決定することができる。我々は、他のヒト血液から単離された血小板、単球およびリンパ球における生体エネルギープロファイルは、細胞型8の間に成立し、比較することができることを示すためにこの技術を使用している。また、好中球および単球の両方がNAPDHオキシダーゼが活性化されている酸化的バースト能力を有し、スーパーオキシドを形成するために酸素を消費する。重要なことに、この経路は、先天性免疫の重要な構成要素であり、全身性炎症によって変調される。例えば、酸化的バースト容量の変化は、例えば、多発性硬化症、関節炎、および再発性感染の10,11のような種々の自己免疫疾患と関連していることが示されている。現在、臨床試料中の酸化的バーストを測定するために利用可能な高スループットの定量的アッセイがありません。好中球や単球の酸化的バースト能力を特徴づけることは、いくつかのpatholoための重要な診断ツールとして機能することができるので、これは重要ですGIES。
主要な技術的課題は、従来のポーラログラフィー技術を用いて酸素消費量の測定と、より敏感なマイクロプレート蛍光技術を用いたときに付着した細胞を使用する必要性のために低感度であった。この実用的なビデオでは、我々はこれらの問題に対する技術的な解決策について説明します。我詳細単球、リンパ球、好中球、および血小板と単球およびヒト血液から好中球の酸化的バーストの生体エネルギーの単離、めっき及び測定するための方法は 、この方法は、持っている研究者のための生体エネルギー論及び酸化的バーストの臨床評価に適している患者集団と、新鮮な血液サンプルを入手する機能へのアクセス。
プロトコル
採血、分離、分析のために、この原稿に記載されているすべてのプロトコルは、バーミンガムのアラバマ大学で見直され、治験審査委員会によって承認されている。
1。細胞単離(ヒストシグマアルドリッチプロトコル番号1119とミルテニーバイオテクマイクロビーズ正と負の選択プロトコルから変更)
- スイングバケットローター(加速度= 5-6、およびブレーキなし)で遠心機で15分間500×gで遠心分離器(ACDまたはEDTAチューブに回収)全血。
- 1センチメートルは細胞層(赤血球/軟膜)を超えたままになるまで転送ピペットを用いて多血小板血漿(PRP)が含まれている一番上の層を除去する。後で処理するために、室温でPRPを取っておく。
- 無菌50mlコニカルチューブにバフィーコートを転送、基礎RPMIで24ミリリットルに希釈するか、または少なくとも始まる軟膜量を4倍。
注:RBC層の上半分よい時間これは比例するRPMI体積を増加させることになりますが、含まれるべきAVE。 - 3 15ミリリットルコニカルチューブ(3ミリリットルずつ)の一番下の層には1.119の比重でトップ層と高密度のFicollのために1.077の比重の低密度フィコール(1077)を用いた密度勾配(1119)を準備します。この手順を実行するには、まず各管に1077を追加します。 5ミリリットル狭いピペットを使用して、1077の下にピペットチップを配置することによってチューブの底に1119を追加し、徐々に上部の勾配で混合することなく試薬を放出する。密度勾配メディアの6ミリリットルの合計は3ミリリットルマークの分離の目に見える相と、この段階では存在すべきである。
- 自動ピペットを用いて、傾斜層を乱すことを防止するために、低電力設定を使用して各勾配管を穏やかに(ステップ1.3)から希釈した血液を8mlを加える。総容積は、この段階で14ミリリットルにする必要があります。
- 室温で30分間、700×gで(ACCELEにおける遠心管比6、ブレーキなし)。
注:この段階では、3の異なる細胞バンドが明らかである( 図1A)。 (1077とプラズマとの間の)一番上のバンドが多形核白血球(PMN)と(1119下)下のバンドが含まれている単核細胞(多国籍企業)および血小板、および(1007と1119の間)中域が含まれているRBCは含まれています。 - 他の細胞のバンドを乱すことなく滅菌ガラスピペットを使用して、別々にMNCおよびPMNを収集します。無菌50mlコニカルチューブに各チューブからMNCの人口を兼ね備えています。同様に、PMNの人口のためにこれを繰り返します。
- 密度勾配を希釈するために、それぞれMNCおよびPMN画分を含む各チューブに、RPMIの4ボリュームを追加します。
- 室温で10分間、700×gで遠心分離チューブ。
- 1ミリリットルのRPMIに再懸濁MNC細胞ペレットとのPMN細胞ペレットを0.5%超高純度無脂肪酸BSA(RPMI-BSA)を含有し、1.5ミリリットルのチューブを無菌に転送。 30ベンチトップピコフュージを用いて細胞をペレット化秒。
- 上澄み液を捨て、80μlのRPMI-BSA中の各細胞ペレットを再懸濁します。
- 単球の正の選択のためのMNC画分を含む管に磁気ビーズ標識antiCD14抗体20μLを加える。 PMN細胞画分を含むチューブの場合は、好中球の正の選択のために磁気ビーズ標識antiCD15抗体20μLを加える。 4℃で15分間、各細胞懸濁液をインキュベート
- 1ミリリットルのRPMI-BSAメディアで各細胞懸濁液を洗浄し、以前のようにペレットを500μlのRPMI-BSA中に各ペレットを再懸濁。
- 標識された細胞(MACS)セパレーターを磁気活性化細胞ソーティングの磁界中で分離される。細胞懸濁液を添加する前にRPMI-BSA 3mlのMACS分離器及び洗浄カラムを配置することによってMACS LSのカラム(各細胞懸濁液のためのもの)を準備する。
- 細胞懸濁液を適用した後、メディアのDraIを聞かせてください(RPMI-BSA培地3mlで各列3回洗うN完全に洗浄の間)。滅菌チューブに細胞懸濁液のフロースルーとカラムの洗浄を集める。
- 単球および好中球を単離するために、最後の洗浄後、磁場から列を削除し、列のプランジャーを用いRPMI-BSAを5mlの滅菌チューブに積極的に選択したセルを溶出。
- リンパ球は 10分間300×gでステップ1.15からの多国籍企業のフロースルー·洗浄画分をペレット単離した。上澄み液を捨て、80μlのRPMI-BSA中で細胞ペレットを再懸濁します。 CD61およびCD235a抗体を20μlを加え、4℃で15分間、細胞懸濁液をインキュベート以前のようにMACS分離を繰り返し、リンパ球を含むものの流れを収集します。
- (ステップ1.9)、以前のように、単球、好中球、およびリンパ球画分、遠心分離機をペレット、上清を廃棄する。細胞ペレットを、カウントのために1ミリリットルの細胞外フラックスメディア(XF-DMEM)中に再懸濁する必要があります。
注:全血の8ミリリットルが1〜5×10 6単球/ mlであり、5〜20×10 6リンパ球および好中球/ mlに生じるはずである。 - 血小板 、室温で1500×gで8月10日分の遠心PRP(ステップ1.2)を単離する 。血漿を除去し、PBSで1μg/ mlののPGI 2、repelletを補足し、滅菌5ミリリットルで一回、細胞ペレットを洗浄し、PBS-PGI 2緩衝液1mlに最終ペレットを一時停止。
- Walkowiak らによって記載されているように、血小板を分光光度計で、PBS-PGI 2緩衝液に懸濁されると濁度により血小板数を決定し、次の式を使用して:[6.23 /(2.016 - ABS 800)] - 3.09×希釈係数=#X 10 8。血小板/ mlの12。
2。細胞のプレー
- 細胞-徳(細胞接着)の調製:180μlに90μlの細胞接着を追加するのdiH 2 0、0.1 Nナトリウムbiの540μL炭酸塩(pH8.0)に、1 N NaOHを用いて7.2〜7.8にpHを調整する。調製した細胞接着性の30μlの各ウェルをコーティングすることによりXFプレート(24ウェル、V7マイクロプレート)を準備します。
注意:細胞接着剤は使用するたびに新たに調製しなければならない。 - 細胞接着を吸引し、二回(1ミリリットル/ウェル)、PBSでウェルを洗った後、20〜30分間37℃で静置します。
- 孤立した単球、リンパ球、好中球や血小板に細胞数を行い、播種単球、リンパ球、および好中球のための250K細胞/ウェルの密度、および血小板のための25×10 6 /ウェルを許可するようにXF-DMEMを使用して、適切な音量にもたらす。あるいは、酸化的バースト応答を測定するために、好中球は125K細胞/ウェルで播種することができる。各細胞懸濁液の最終的な播種量は200μl/ウェルである必要があります。
- ブレーキなしで1秒間200×gでプレートを遠心分離する。 300×gでブレーキなしで再びプレートを180˚と遠心分離機を回転させます。
- 最終ウェル体積をもたらすUME XF-DMEMで660μLに前XFアッセイと30分間37℃でインキュベートする。注:播種した細胞の前と後のアッセイの顕微鏡写真は、十分なめっきを保証し、細胞剥離を除外するために使用することができる。
3。 24ウェル細胞外フラックスアッセイプレートの作製(XF24)
- 水和物XFはアッセイ前に2時間の最低キャリブラント溶液でプローブします。
- 上記の順序でカートリッジの注入口に0.5μg/ mlのオリゴマイシン、0.6μMFCCPの10倍株式、XF-DMEMおよび負荷の10μMのアンチマイシンAの原液75μlのを準備します。酸化的バーストの測定値が得られるのであれば、100 ng / mlのPMAの10×ストックの注射は、アンチマイシン-Aの後に注入することができる。
- 水和され、ロードされたカートリッジをキャリブレーションし、XFのアッセイを行う。分析および酸素消費量およびpH変化の両方を解釈するための詳細な方法は、以前の刊行物9,13,14に記載されており、dはされないここでは詳細にiscussed。
- アッセイプレートからの細胞の損失を防止し、50μlのRIPA細胞溶解緩衝液を追加し、正規化のためにタンパク質アッセイを実行するために後XFアッセイ後、XF-DMEMの最後の50μlが、すべてを吸引する。
結果
血液細胞の生体エネルギーを評価するために、全血をEDTAまたはACDバキュテナーコレクションチューブに静脈穿刺によりヒト被験体から採取される。採血以下の白血球および血小板の単離は、プロトコルに詳述されるように、図1Aに視覚化される。全血サンプルは、細胞死および活性化を避けるために、コレクションの8時間以内に処理される。 8時間よりも大きな拡張記憶時間がテストされていませんが、変更された生体エネルギーをもたらし、生理学的条件のあまりを表すことができる。クエン酸デキストロース(ACD-8 ml)およびEDTAバキュテナーチューブは、単離された細胞の生体エネルギー機能に無影響で細胞単離のために使用されている。血餅は、得られた細胞の数を減らすフィコール勾配遠心分離中に適切な相形成を妨害し、遠心分離し、血清で得られていない血小板をほとんどもたらすような抗凝固薬が必要である。すべての血液はBIOLOGを表しiCalの有害性と、適切な個人用保護具は、細胞集団が隔離されているか、細胞溶解物が生成された後でも、全体の手順全体に実装されなければならない。サンプルは、金融機関の人間の廃棄物処理基準に従って処分しなければならない。
全血バフィーコート白血球を含有するだけでパックされた赤血球前記白色層から多血小板血漿を分離するために遠心分離される。バフィーコートは、密度勾配に適用し、末梢血単核細胞(単球およびリンパ球)および多形核細胞(顆粒球)を得るために遠心分離する。個々のMNCおよびPMN細胞相の赤血球汚染は、この段階では一般的であり、MACS精製の間に解決しなければならない。種々の細胞型は、その後、純粋な画分を得るために、磁気抗体とのインキュベーションにより得られる。単球は、CD14、フロースルーからtでPBMC画分のインキュベーションによって収集される彼はその後、赤血球および血小板の枯渇しているリンパ球を、含まれている単球。好中球は、CD15抗体( 図1A)を有する多形核細胞層をインキュベートすることによって得られる。その後、血小板は、多血小板血漿の遠心分離によってペレット化し、他の血漿成分を除去するために洗浄することができる。これらの選択の後に血小板は、CD14 +単球、リンパ球は、CD15 +好中球は生体エネルギー及び酸化的バースト分析のための細胞接着媒体でコーティングされたXFのアナライザ·プレート上で計数し、めっきすることができる。
手順の各ステージは、無菌条件下で行われるべきであり、単球および好中球の酸化的バースト応答の早期活性化を防止することが奨励される。基礎条件で、酸素消費量にはほとんどを持っている好中球は、上昇したOCRの測定と細胞外フラックスアッセイを開始するときに、分離中に無菌条件未満の指標は明らかである徐々に増加またはアッセイ全体で減少となりました。私たちは、活性化の形態学的兆候は、アッセイの前に発生していないことを確実にするために200X以上に光学顕微鏡を用いて細胞を画像化することの重要性を強調している。 図1Bに示すように、例えば、好中球は、通常、顕著な細胞境界を有する不規則な形状に丸みを表示する。しかしながら、これらの細胞が活性化されると、プレートの表面に対して平坦化及びその別個の細胞形態を失うことになる。我々は以前、このプロトコルを使用して活性化白血球や血小板の形態変化を報告しているし、追加的な措置は、アクティベー8に遭遇した場合は、無菌状態を確保するために注意する必要があります。
プロトコルの単純化されたスキームは、細胞分離、XFプレート調製およびXFアッセイの主要なステップが詳述されたタイムテーブルとして図2に示されている。単離は、細胞型の密度勾配分離で構成され、磁気分離が続く。細胞分離工程に平行な、XF板製剤は、細胞又はめっきXFアッセイ開始の遅延を回避する必要がある。大幅な遅延が細胞の活性化と減少生体エネルギーのパラメータにつながる可能性があるため、これは非常に重要です。
単離後の不十分な細胞濃度は、一般的な問題は、各遠心分離プロセスの最適化は、細胞の損失を避けるために必要である。成功した単離は、血液のわずか6などの溶液に対して実施されたが、変化は、所望の細胞型の循環濃度に応じて行うことができる。密度勾配が不適切用意されている場合は、異なる細胞相が表示されない可能性があり、細胞の損失が発生する可能性があります(視覚的なデモンストレーション用のJoveの教育ビデオを見てください)。 PRPから単離された不十分な血小板はまれであるが、分離は室温以下で行われる場合、洗浄緩衝液は、PGI 2を含有しない場合、または発生している。血小板Aのリスク血小板を単離するための最後のセルである場合には、しばしばctivation防止され、血小板が長時間洗浄バッファーに残っている場合しかし、生体エネルギーが影響を受けることになる。 1500 XGの遠心分離中にペレット化しておらず、これらの細胞の生体エネルギーが広範に特徴付けられていない小さい血小板集団の事例があった。より完全なトラブルシューティングガイドについては、表2を参照してください。
白血球および血小板の生体エネルギープロファイルは、非侵襲的に細胞におけるリアルタイムのO 2消費量を測定するXF分析器を用いて決定することができる。 図3Aに示すように、各セルタイプは、5つの複製を有するXF24プレート上にメッキされる。 表1に示しウェルあたりアッセイおよび平均タンパク質濃度の間に細胞の種類によって期待される基礎および酸化バースト値。高いスループット技術は、が可能になりXF96として、ご利用いただけます図3Bに示すように、4人のドナーを同時に評価することができる。分析した後、データが適切なXFソフトウェアとMicrosoft Excelを使用して分析用のワークステーションコンピュータにエクスポートされます。 OCR値は、対応するウェル中の総タンパク質含有量に対して標準化し、ピコモル/分/ mgタンパク質として表した。各細胞型の代表的な生体エネルギー酸化的バーストプロファイルは、最近我々のグループ8で報告された。先に示した、 図8の下に記載のアッセイ(基底、ATP結合、プロトンリーク、最大、nonmitochondrial及び酸化的バースト)の生体エネルギーのパラメータのさらなる分析は、個々のウェルについて計算することができる。
図4Aに示すように、基礎酸素消費速度(OCR)は第3の測定によって確立される。オリゴマイシン(0.5μg/ mlの)は、ミトコンドリアのATP合成酵素の阻害剤は、OCRがATP合成的表現とに結合された推定するためにXF媒体中に注入する ATP-リンクとしてテッド。残留OCRマイナスnonmitochondrial OCRはプロトンリークに起因することができます。次いで、FCCP脱共役剤は、酸素消費nonmitochondrial源を決定するために、アンチマイシン-A、ミトコンドリア呼吸の阻害剤、続いて、最大のOCRを決定するために添加される。予備容量は、エネルギー需要の下で生産することができ、呼吸の最大速度と基礎との間の差として計算することができるATPの量の尺度である。酸化的バースト能力を決定するために、ホルボール12 -ミリステート13 -アセテート(PMA)PKCアゴニストは、NADPHオキシダーゼ活性を増加させるために注入され、PMA刺激後の酸素消費速度の増加は、XFアナライザーを用いて測定することができる。 図4Bミトコンドリア機能と酸化的バーストの異なるパラメータを計算する方法を示しています。
1301/51301fig1highres.jpg "SRC =" / files/ftp_upload/51301/51301fig1.jpg "/>
図1。全血から白血球や血小板の単離。 A)新たに採取した検体を遠心分離によりそれらの血漿および細胞成分に分離し、Ficoll密度勾配により精製し、血小板が高いにより単離している間に磁気活性化細胞は、正(単球及び好中球)又は陰性選択(リンパ球)によって(MACS)でソートされている一度XF DMEM中に再懸濁し、指示された細胞密度でプレーティング単離された細胞集団の高速多血小板血漿を遠心分離する。B)の画像が。 この図の拡大版を表示するには、こちらをクリックしてください。
ghres.jpg "SRC =" / files/ftp_upload/51301/51301fig2.jpg "/>
図2。白血球と血小板の生体エネルギー研究のためのXF24プレートの調製細胞の単離とメッキとカートリッジの潤いと噴射口の読み込み中XF24アッセイプレートを調製するための詳細な時系列。
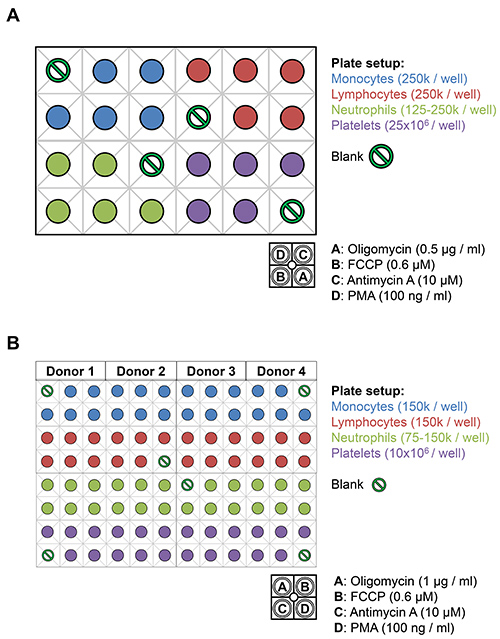
XF24およびXF96アナライザプレート。A)、白血球(125〜250,000細胞/ウェル)単一ドナーからの血小板(25×10 6細胞/ウェル) に白血球および血小板の図3のレイアウトは、背景のうち、XF24アッセイプレート上にプレーティングされているコントロール。オリゴマイシンの10倍の株式の75μL(0.5μg/ ml)を、FCCP(0.6μM)、アンチマイシンA(10μM)、およびPMA(100 ng / mlのは)XF培地で希釈がにロードされ指示された注入口へ。B)白血球(75-150K細胞/ウェル)、血小板(10×10 6細胞/ウェル)最大4つのドナーが180μlのXF-DMEMの総容量XF96にめっきすることができるから。オリゴマイシンの10倍の株式の20μL(1.0μg/ ml)を、FCCP(0.6μM)、アンチマイシンA(10μM)、およびPMA(100 ng / mlのは)XF-DMEM中で希釈され、示された注入口にロードされます。
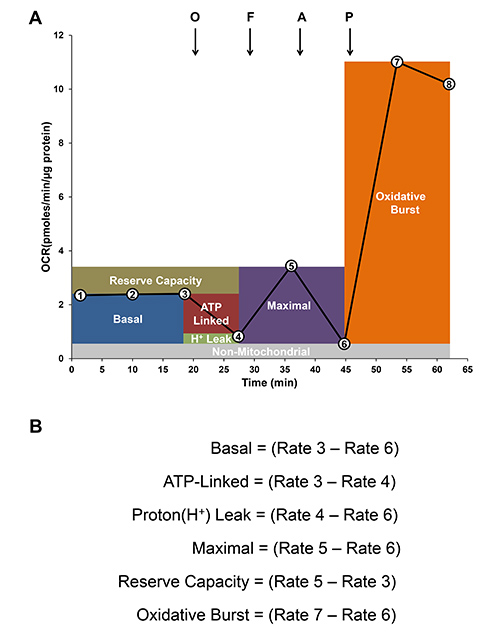
ミトコンドリアや単球における酸化的バーストによる酸素消費速度(OCR)の図4。生体エネルギー指標の分析。A)代表トレース。基礎OCRは(円内の数字で示す第3の料金)を設立している。オリゴマイシンのその後の順次追加(O; 0.5μg/ ml)を、FCCP(F; 0.6μM)および抗マイシンA(;10μM)ミトコンドリアおよび非活性化細胞のnonmitochondrial呼吸を決定するために注入される。最後に、PMA(100 ng / mlの)酸化的バーストを測定するために添加される。B)に示すようにモジュラミトコンドリア機能の分析および酸化的バーストは速度の差によって計算される。
| 最適な播種密度 | 平均。基礎OCR(ピコモルO 2 /分) | 平均。酸化的バーストのOCR(ピコモルO 2 /分) | 平均。タンパク質濃度(μg)/ウエル | |
| 単球 | 250K細胞/ウェル | 83.9(13.0±) | 300.3(58.8±) | 19.0(±2.4) |
| 好中球 | 250K細胞/ウェル | 6.1(2.2±) | 1411.8(233.3±) | 20.6(±2.7) |
| リンパ球 | 250K細胞/ウェル | 52.9(±7.7) | 15(±4.1) | 13.2(±2.1) |
| 血小板 | 25×10 6細胞/ウェル | 199.4(20.3±) | 24(±2.7) | 47.5(±3.1) |
表1。 XF24アッセイのための通常のパラメータ:平均基礎(レート3)および酸化的バースト(レート7)OCRはnonmitochondrial OCRまたはタンパク質に補正していないが、示された細胞密度で平板培養細胞の種類によって表示されます。 DC Lowryアッセイによって実行されるウェルあたりの平均タンパク質含有量が示されている。これらのデータは、平均値を表す±SEMを含む括弧で6-8健康なドナー。
| ステップ | 問題 | 考えられる理由 | ソリューション |
| 1.2 | 明確なプラズマ | 遠心分離中にペレット化した血小板 | 10分の遠心分離時間を短縮するか、400 XGに遅い |
| 乳白色のプラズマ | 過剰な脂質 | 食後のコレクションを避ける | |
| 1.6 | 不完全なセルのバンドが形成される | 小鬼ローパー勾配の準備、冷たい試薬 | ピペッティングの際に勾配を中断しないよう、常温試薬を使用 |
| セル帯で塊 | 血液の凝固が発生している可能性が | このようなACDまたはEDTAなどの抗凝固剤を用いて血液を収集 | |
| 1.10 | ない細胞ペレットん | ステップ1.6を参照してください。 | 上澄みはかすん以下を参照した場合 |
| かすん上清 | 重フィコール勾配汚染、血小板汚染 | 900 XGに遠心分離速度を増加させ、ジより多くのRPMIでリュート | |
| 1.16、1.17 | 白血球の低い収率 | 重いRBC汚染、十分ではない全血、凝固 | 二重抗体およびRPMI-BSAボリューム、抗凝固剤を追加し、より多くの血液を収集 |
| 1.19 | 血小板凝集 | PGI 2を省略し、冷たいメディア、血漿中の長期保管への暴露 | 血小板の洗浄緩衝液を使用し、室温試薬にPGI 2を追加 |
| 1.20 | 血小板数の低下 | 主な遠心分離、血小板凝集中の紛失 | 見る1.2と1.19ステップ |
| 2.3 | RBC汚染 | MACS分離を繰り返します |
表2。白血球と血小板の分離、トラブルシューティング。表には、全血およびトラブルシューティングのプロセスを使用してユーザーをガイドすることが解決策の白血球と血小板の細胞単離の間に遭遇する一般的な問題を示しています。
ディスカッション
このプロトコルは、生体エネルギー分析のための適切な方法で血球分離のためのいくつかの一般的に利用される技術のコンパイルを表す。連続的な提示技術は、単離された細胞上に配置された最小限のストレスに制御された培地条件下で多数の細胞を単離するそれらの能力のための他の単離方法( すなわち、FACS分析)に有利で ある。それも、最小限の中断との長いアイソレーションという欠点がある。このプロトコルは、臨床環境および翻訳の研究に外挿することができるヒト被験体からの一次血液細胞の単離のための基礎として機能する。
MACS分離は、全血から直接細胞を単離する可能性を提供する信頼性のある細胞分離技術であるが、この方法は、抗体のより大きな量を必要とし、この方法に記載の通り、すべての4つの異なる細胞型の単離のための最適ではない。 Bは、そこにあります私たちの分離プロトコルを使用して、活性化のMACS分離結果による白血球の正の選択ことを示す証拠はEENん。 MACSカラムは、50 nmの超常磁性粒子に結合させた抗体を用いて、磁場中で標識した細胞の隔離することによって機能する。標識された細胞をカラムから溶出される。正と負の選択が迅速な単離と純度を確実にするために、このプロトコルに実装されています。不十分な細胞数は、単離から得られるか、純度が問題になっている場合、より多くの抗体は、高い純度( 表2)をもたらし得るLSカラムに通して、ベンダーの指示及び第二の通路に従って試料に添加することができる。当研究室では、FACS分析8によって、最終的な細胞懸濁液を分析することによって、既存のプロトコルを用いて、高純度、メッキ効率を発見した。
細胞外フラックス分析器はオトの上に即座に酸素消費量およびメディア酸性化の両方を監視する機能を有する彼女の電極。 DPIの8による阻害によって示されるように、単球および好中球の酸化的バースト応答によって観察されるように酸素消費量は、NADPHオキシダーゼ依存しています。我々は長期のアイソレーションまたは拡張XFアッセイと酸化的バースト能力の時間依存性損失を見てきました。このプロトコルは、設計·開発XF24での使用のためではなく、ほぼ第三密度を播種XF24細胞( 図3)の半分にもXF96と互換性がありました。
このプロトコルの設計では、各技術のための既存のプロトコルへの準拠は、単に生体エネルギー分析用の培地条件を制御するために加えられた変更との最適なパフォーマンスを得るために必要とされた。そのようなプロトコルは、治療戦略の有効性または毒性を測定するための並進および研究用途の広い配列に使用することができる技術を習得した後、単球および中性子爆弾によって疾患、およびオキシダント産生の代謝特性を探る炎症状態にあるrophils。
開示事項
VDUはシーホース·バイオサイエンス科学諮問委員会のメンバーでもあります。
謝辞
著者は、グロリアAベナビデスの技術的貢献を認めるしたいと思います。この作品は、アメリカ心臓協会13PRE16390001(SR)、NIH T32HL07918(PAK)、NIH T32HL007457(TM)、P30DK056336(BKC)、NIDDK糖尿病合併症コンソーシアム(DiaComp、www.diacomp.org)助成金DK076169(subaward VDU)によってサポートされていましたとオブライエンセンターP30のDK079337(VDU)。
資料
| Name | Company | Catalog Number | Comments |
| QuadroMACS Starting Kit includes QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-094-833 | |
| CD235a (Glycophorin A) MicroBeads, human | Miltenyi Biotec | 130-050-501 | |
| CD61 MicroBeads, human for platelets | Miltenyi Biotec | 130-051-101 | |
| CD14 MicroBeads, human for monocytes | Miltenyi Biotec | 130-050-201 | |
| CD15 MicroBeads, human for granulocytes | Miltenyi Biotec | 130-046-601 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| BD Vacutainer ACD Blood collection tubes | Fisher | 02-684-26 | |
| RPMI 1640 | Gibco | 11835-030 | with L-glutamine and without phenol red |
| Prostaglandin I2, sodium salt | Cayman | 18220 | |
| 1.5 ml semi-micro cuvettes | Phenix Research Products | SC-2410 | |
| Histopaque density gradient, specific gravity 1.077 | Sigma | 10771 | |
| Histopaque density gradient, specific gravity 1.119 | Sigma | 11191 | |
| Bovine Serum Albumin Fraction V | Roche | 3117405001 | fatty-acid ultra-free |
| Phorbol 12-myristate 13-acetate | Sigma | P8139 | |
| XF24 FluxPak | Seahorse Biosciences | 100850-001 | |
| DMEM | Fisher | MT90113PB | w/o Glucose, L-Glutamine, Pyruvate, Phenol Red, and Bicarbonate |
| L-Glutamine, 200 mM (100x) | Invitrogen | 25030-081 | |
| D-Glucose | Sigma | G7528 | |
| Sodium Pyruvate | Sigma | P8574 | |
| Cell-Tak (cell adhesive) | BD Biosciences | CB-40242 | |
| Oligomycin | Sigma | O4876 | |
| Antimycin A | Sigma | A8674 | |
| (FCCP) Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma | C-2920 | |
| DC Protein Assay Reagent A | Bio-Rad | 500-0113 | |
| DC Protein Assay Reagent S | Bio-Rad | 500-0015 | |
| DC Protein Assay Reagent B | Bio-Rad | 500-0114 | |
| Seahorse | Seahorse Biosciences | ||
| QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-090-976 and 24039 | |
| Spectrophotometer |
参考文献
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int. J. Alzheimer's Dis. 2009, (2009).
- Jin, S. Autophagy, mitochondrial quality control, and oncogenesis. Autophagy. 2, 80-84 (2006).
- Cordero, M. D., et al. Mitochondrial dysfunction and mitophagy activation in blood mononuclear cells of fibromyalgia patients: implications in the pathogenesis of the disease. Arthritis Res. Ther. 12, R17 (2010).
- Japiassu, A. M., et al. Bioenergetic failure of human peripheral blood monocytes in patients with septic shock is mediated by reduced F1Fo adenosine-5'-triphosphate synthase activity. Crit. Med. 39, 1056-1063 (2011).
- Widlansky, M. E., et al. Altered mitochondrial membrane potential, mass, and morphology in the mononuclear cells of humans with type 2 diabetes. Transl. Res. 156, 15-25 (2010).
- Shi, C., et al. Effects of ageing and Alzheimer's disease on mitochondrial function of human platelets. Exp. Gerontol. 43, 589-594 (2008).
- Avila, C., et al. Platelet mitochondrial dysfunction is evident in type 2 diabetes in association with modifications of mitochondrial anti-oxidant stress proteins. Exp. Clin. Endocrinol. Diabetes. 120, 248-251 (2012).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab. Invest. 93, 690-700 (2013).
- Hill, B. G., et al. Integration of cellular bioenergetics with mitochondrial quality control and autophagy. Biol. Chem. 393, 1485-1512 (2012).
- Hultqvist, M., et al. Enhanced autoimmunity, arthritis, and encephalomyelitis in mice with a reduced oxidative burst due to a mutation in the Ncf1 gene. Proc. Natl. Acad. Sci. U.S.A. 101, 12646-12651 (2004).
- Rosa-Borges, A., et al. Glucose-6-phosphate dehydrogenase deficiency with recurrent infections: case report. J. Ped. 77, 331-336 (2001).
- Walkowiak, B., Kesy, A., Michalec, L. Microplate reader--a convenient tool in studies of blood coagulation. Thromb. Res. 87, 95-103 (1997).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radic. Biol. Med. 51, 1621-1635 (2011).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J. Vis. Exp.. (46), e2511 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved