Method Article
Bioenergética e os oxidativo estourou: Protocolos para o Isolamento e Avaliação de leucócitos humanos e plaquetas
Neste Artigo
Resumo
Leucócitos e plaquetas do sangue pode ser usado como um marcador de saúde bioenergética geral de um indivíduo e assim têm potencial para controlar processos patológicos e o impacto de tratamentos. Aqui nós descrevemos um método para isolar e medir a função mitocondrial e do burst oxidativo nestas células.
Resumo
Disfunção mitocondrial é conhecida por desempenhar um papel significativo num determinado número de condições patológicas tais como a aterosclerose, diabetes, choque séptico, e doenças neurodegenerativas mas avaliar as alterações na função bioenergética em pacientes é um desafio. Embora doenças como a diabetes ou a aterosclerose presente clinicamente com insuficiência órgão específico, os componentes sistêmicos da patologia, tais como hiperglicemia ou inflamação, pode alterar a função bioenergética em leucócitos e plaquetas circulantes. Este conceito tem sido reconhecida por algum tempo, mas a sua aplicação generalizada tem sido limitada pelo grande número de pilhas necessários para a análise bioenergética. Esta limitação técnica tem sido superado combinando a especificidade das técnicas de isolamento do grânulo magnéticas, as técnicas de adesão celular, as quais permitem que as células a serem ligados sem a activação de microplacas, e a sensibilidade de novas tecnologias concebidas para a produção elevada de microfonerespirometria roplate. Um exemplo deste equipamento é o analisador de fluxo extracelular. Tais instrumentos normalmente utiliza sondas sensíveis de oxigênio e pH para medir as taxas de mudança nesses parâmetros em células aderentes, que podem estar relacionados com o metabolismo. Aqui detalhamos os métodos para o isolamento e revestimento de monócitos, linfócitos, neutrófilos e plaquetas, sem ativação, a partir de sangue humano e de análise da função bioenergética mitocondrial nestas células. Além disso, é mostrado como o metabolismo oxidativo em monócitos e neutrófilos também pode ser medido nas mesmas amostras. Uma vez que estes métodos utilizam apenas 8-20 ml de sangue humano que eles têm potencial para monitoramento da geração de espécies reativas de oxigênio e bioenergética em um ambiente clínico.
Introdução
Monitoramento da saúde bioenergética de células imunes (monócitos, linfócitos, neutrófilos) e plaquetas do sangue tem sido reconhecido por algum tempo como uma ferramenta de diagnóstico potencialmente útil para avaliar a saúde bioenergética geral de um indivíduo. Há um conjunto emergente de literatura atribuindo uma série de doenças como câncer, doenças cardiovasculares e doenças neurodegenerativas para mitocondrial 1,2 disfunção. Isto é clinicamente importante uma vez que a disfunção mitocondrial pode iniciar uma série de eventos celulares que promovem vias de sinalização pró-inflamatórias ou de provocar a morte celular. Vários estudos têm caracterizado função mitocondrial de células mononucleares do sangue periférico e das plaquetas em condições, tais como fibromialgia, diabetes, choque séptico, e doença de Alzheimer 3-7. Por exemplo, um estudo recente avaliou a bioenergética de plaquetas como um marcador para a função mitocondrial e descobriram que as plaquetas de Tipo 2 diabetpacientes ic tinha diminuído 7,8 mitocondrial consumo de oxigênio. A partir desses resultados e outros, é claro que os monócitos, linfócitos, neutrófilos e plaquetas podem servir como marcadores substitutos de mudanças na bioenergética em condições patológicas, uma vez que o levantamento da circulação sistêmica e pode refletir alterações metabólicas locais e globais. Para determinar se esta abordagem tem um método de alto rendimento de análise e é necessário um método consistente para a preparação da célula valor prognóstico ou diagnóstico.
Os métodos para medir a função mitocondrial nos leucócitos e plaquetas já envolveu o isolamento de mitocôndrias ou avaliação da bioenergética celular em células intactas 4,9. A vantagem da avaliação do bioenergética celular utilizando um fluxo extracelular (XF) analisador é que a função mitocondrial em células pode ser estabelecida com os substratos endógenos e os parâmetros respiratórios, tais como vazamento de protões e respiratória máximacapacidade pode ser determinada. Nós e outros autores utilizaram este tecnologia para demonstrar que os perfis de bioenergéticos em plaquetas, monócitos e linfócitos isolados a partir de sangue humano pode ser determinada e comparada entre os vários tipos de células 8. Além disso, ambos os neutrófilos e monócitos possuem uma capacidade de explosão oxidativa em que as oxidases NAPDH são activados e consome oxigénio para formar superóxido. É importante ressaltar que este caminho é um componente chave da imunidade inata e é modulada pela inflamação sistêmica. Por exemplo, tem sido demonstrado que as alterações na capacidade de burst oxidativo está associado a várias doenças auto-imunes, tais como esclerose múltipla, artrite, e as infecções recorrentes 10,11. Actualmente não há alto rendimento ensaios quantitativos disponíveis para medir o burst oxidativo em amostras clínicas. Isso é importante porque a caracterização da capacidade de burst oxidativo de neutrófilos e monócitos também pode servir como uma importante ferramenta de diagnóstico para várias patologiasgias.
Os principais desafios técnicos têm sido baixa sensibilidade para medição do consumo de oxigénio utilizando técnicas polarográficas convencionais e a necessidade de utilizar células ligadas quando utilizando técnicas mais sensíveis de microplacas fluorométricos. Neste vídeo prática, descreve-se a solução técnica para estes problemas. Detalhamos os métodos para o isolamento, chapeamento e medição da bioenergética de monócitos, linfócitos, neutrófilos e plaquetas e burst oxidativo de monócitos e neutrófilos do sangue humano. Este método é adequado para a avaliação clínica da bioenergética e burst oxidativo para os pesquisadores que têm acesso a uma população de pacientes e a capacidade de obtenção de amostras de sangue fresco.
Protocolo
Todos os protocolos descritos neste manuscrito para coleta de sangue, o isolamento ea análise foram analisados e aprovados pelo Conselho de Revisão Institucional da Universidade de Alabama em Birmingham.
1. O isolamento celular (Modificado de Histopaque Sigma-Aldrich Protocolo N º 1119 e Miltenyi Biotec microbead Positivo e Protocolos seleção negativa)
- Centrifugar o sangue total (colhido em ACD ou tubos de EDTA) a 500 xg durante 15 minutos numa centrífuga com rotor de balde oscilante (aceleração = 5-6, e sem travão).
- Retirar a camada superior que contém o plasma rico em plaquetas (PRP) com uma pipeta de transferência até um centímetro permanece acima da camada de células (revestimento de eritrócitos / buffy). Separe o PRP à temperatura ambiente para posterior processamento.
- Transferir o creme leucocitário para uma estéril tubo de 50 ml, diluir para 24 ml com meio RPMI basal ou a, pelo menos, 4 vezes o volume de partida de creme leucocitário.
Nota: A metade superior da camada de glóbulos vermelhos pode have a ser incluído, embora isto resultará no aumento do volume de RPMI proporcionalmente. - Prepare o gradiente de densidade utilizando baixa densidade Ficoll com uma gravidade específica de 1,077 (1,077) para a camada superior e alta densidade Ficoll com uma gravidade específica de 1,119 (1,119) para a camada inferior, em três tubos cónicos de 15 ml (3 ml cada). Para executar este passo, primeiro adicione 1.077 a cada tubo. Usando uma pipeta de 5 ml estreito adicionar 1119 para o fundo do tubo pela colocação da ponta de pipeta por baixo 1077 e libertam lentamente o reagente sem se misturar com o gradiente superior. Um total de 6 ml de meio de gradiente de densidade deve estar presente, nesta fase, com uma fase de separação visível na marca de 3 ml.
- Usando uma pipeta automática, adicionar 8 ml de sangue diluído (do passo 1.3) suavemente a cada tubo de gradiente usando a configuração de baixo consumo de energia para evitar de perturbar as camadas degradê. O volume total deve ser de 14 ml neste passo.
- Tubos de centrifugação a 700 xg durante 30 min à temperatura ambiente (aceleração 6, sem freio).
Nota: Nesta fase, três bandas distintas de células deve ser evidente (Figura 1A). As faixas superiores (entre 1077 e plasma) contém células mononucleares (MNC) e plaquetas, ea faixa do meio (entre 1007 e 1119), contém células polimorfonucleares (PMN) e banda inferior (abaixo de 1119) contém hemácias. - Recolher o MNC e PMN separadamente usando pipetas de vidro estéreis, sem perturbar as outras bandas de celulares. Combinar a população MNC a partir de cada tubo dentro de um tubo de 50 ml estéril cónica. Repita este procedimento para a população PMN também.
- Adicionar 4 volumes de meio RPMI a cada tubo contendo as fracções MNC e PMN, respectivamente, para diluir o gradiente de densidade.
- Tubos de centrifugação a 700 xg durante 10 min à temperatura ambiente.
- Ressuspender o pellet celular e MNC PMN sedimento celular em 1 ml de RPMI contendo 0,5% de ultra-puro-ácido gordo livre de BSA (RPMI-BSA) e transferir para tubos de 1,5 ml estéril. Agregar as células usando um picofuge bancada para 30seg.
- Descartar o sobrenadante e ressuspender cada sedimento celular em 80 ul de meio RPMI-BSA.
- Adicionar 20 uL de esférulas magnéticas anticorpo marcado com antiCD14 para o tubo que contém a fracção de MNC para a selecção positiva de monócitos. Para o tubo que contém a fracção de células PMN, adicionar 20 ul de esférulas magnéticas anticorpo marcado com antiCD15 para a selecção positiva de neutrófilos. Incubar a cada suspensão de células durante 15 min a 4 º C.
- Lava-se cada suspensão de células com 1 ml de meio RPMI-BSA e sedimentar como antes e ressuspender o pellet em cada 500 ul de meio RPMI-BSA.
- As células marcadas são separadas no campo magnético da célula activada triagem magnética (MACS) separador. Preparar as colunas MACS LS (um para cada suspensão de células), colocando a coluna na separador MACS e lavagem com 3 ml de meio RPMI-BSA antes da adição da suspensão de células.
- Após a aplicação de suspensões de células, lavar cada coluna 3x com 3 ml de meio RPMI-BSA (certifique-se de deixar o drai mídian completamente entre as lavagens). Recolha a suspensão de células de fluxo e as lavagens da coluna em um tubo estéril.
- Para isolar os monócitos e neutrófilos, remover a coluna a partir do campo magnético após a última lavagem e eluição das células positivamente seleccionadas dentro de um tubo esterilizado, com 5 ml de meio RPMI-BSA utilizando o êmbolo da coluna.
- Para isolar linfócitos sedimentar a fracção de escoamento-lavagem das MNCs do passo 1.15 a 300 xg durante 10 min. Descartar o sobrenadante e ressuspender o sedimento celular em 80 ul de meio RPMI-BSA. Adicionar 20 ul de anticorpos CD61 e CD235a e incubar a suspensão de células durante 15 min a 4 º C. Repetir a separação MACS como antes e recolher o fluxo embora contendo os linfócitos.
- Para sedimentar monócitos, neutrófilos, linfócitos, e as fracções de centrifugação, como anteriormente (passo 1.9) e descartar os sobrenadantes. As pelotas de células deve ser ressuspendido em 1 ml extracelulares de fluxo de mídia (XF-DMEM) para a contagem.
Nota: 8 ml de sangue total deve resultar em 1-5 x 10 6 monócitos / ml, e de 5-20 x 10 6 linfócitos e neutrófilos / ml. - Para isolar plaquetas, PRP centrífuga (passo 1.2) para 8-10 min a 1500 xg à temperatura ambiente. Remover o plasma e lave o peletizado de células uma vez com 5 ml de PBS estéril suplementado com 1 ug / mL de PGI2, repellet e suspender sedimento final em 1 ml de tampão PBS 2-IGP.
- Determinar a contagem de plaquetas por turbidimetria, uma vez que as plaquetas são suspensos em tampão PBS 2-IGP por espectrofotómetro, tal como descrito por Walkowiak et ai usando a seguinte equação: [6,23 / (2,016 - Abs 800)] - 3,09 x factor de diluição = # 8 x 10. plaquetas / ml 12.
2. Galvanização das Células
- Preparação de Célula-Tak (adesivo célula): Adicionar adesiva célula 90 ul a 180 ul dih 2 0, 540 mL de 0,1 N de sódio bicarbonato (pH 8,0), e ajustar o pH a 7,2-7,8 utilizando NaOH 1 N. Prepare placas XF (24 poços, V7 microplacas) por revestimento de cada poço com 30 uL de células adesiva preparada.
Nota: O adesivo célula deve ser preparado para cada uso. - Incubar a placa a 37 º C durante 20-30 minutos e em seguida adesiva célula aspirado e lavar os poços duas vezes com PBS (1 ml / poço).
- Realizar uma contagem de células em monócitos isolados, linfócitos, neutrófilos e plaquetas e trazer para o volume apropriado com XF-DMEM para permitir uma densidade de sementeira de 250 mil células / poço para monócitos, linfócitos e neutrófilos, e 25 x 10 6 / po para as plaquetas. Alternativamente, para medir a resposta de explosão oxidativa, os neutrófilos podem ser semeadas a 125k células / poço. O volume final de sementeira para cada suspensão de células deve ser 200 ul / poço.
- Centrifugar a placa a 200 xg durante 1 seg sem travão. Gire a placa de 180 ˚ e centrifugar novamente sem freio a 300 x g.
- Traga bem final, volume de 660 mL com XF-DMEM e incubar a 37 º C por 30 min antes do ensaio XF. Nota: Fotomicrografias de células plaqueadas antes e após o ensaio pode ser usado para assegurar a adequada chapeamento e descarta destacamento celular.
3. Preparação de 24 poços Extracelular Fluxo Placa de Ensaio (XF24)
- Hidrato XF sonda com uma solução de calibração durante um mínimo de 2 horas antes do ensaio.
- Prepare 10x estoques de 0,5 mg / ml, 0,6 mM oligomicina FCCP, e 10 mM antimicina A em XF-DMEM e carga de 75 mL das soluções de reserva em portos de injeção do cartucho na ordem acima. Se as medições burst oxidativo devem ser obtidos, a injeção de 10x estoque de 100 ng / ml PMA pode ser injetado após antimicina-A.
- Calibrar o cartucho hidratado e carregado e realizar o ensaio XF. Os métodos detalhados para análise e interpretação de tanto consumo de oxigênio e pH mudanças foram descritos em publicações anteriores 9,13,14 e não são discussed em detalhes aqui.
- Após ensaio XF, aspirar todo, mas os últimos 50 ul de DMEM após XF-ensaio para impedir a perda de células a partir da placa e adicionar 50 ul de tampão de lise RIPA célula e realizar um ensaio de proteína de normalização.
Resultados
A fim de avaliar a bioenergética de células do sangue, o sangue total é coletado de seres humanos por punção venosa em um tubo de coleta de vacutainer EDTA ou ACD. O isolamento de leucócitos e plaquetas após a colheita de sangue é visualizado na Figura 1A, conforme descrito no protocolo. Amostras de sangue total são processados dentro de 8 horas da coleta, para evitar a morte celular e ativação. Tempos de armazenamento estendida superiores a 8 horas não foi testado, mas podem resultar em bioenergética alterados e ser menos representativos das condições fisiológicas. Ácido dextrose de citrato (ACD-8 ml) e EDTA vacutainer tubos foram utilizados para isolamento de células, sem qualquer efeito observável sobre a função das células isoladas bioenergética. Os anticoagulantes são necessárias como coágulos reduzir o número de células obtidas, interfere com a formação de fase adequada durante a centrifugação em gradiente de Ficoll, e resultar em pouco ou nenhum plaquetas obtidas no soro centrifugado. Todo o sangue representa um biologperigo iCal e equipamento de protecção individual adequado deve ser implementado durante todo o procedimento, mesmo depois de populações de células são isoladas ou lisados celulares são gerados. As amostras devem ser eliminados de acordo com as normas da instituição de eliminação de resíduos humanos.
Todo o sangue é centrifugado para separar o plasma rico em plaquetas a partir de buffy coat, a camada de branco logo acima dos eritrócitos que contém os leucócitos. O creme leucocitário é aplicado a gradientes de densidade e centrifugado para obter as células mononucleares do sangue periférico (monócitos e linfócitos) e células polimorfonucleares (granulócitos). RBC contaminação das fases de células individuais MNC e PMN é comum nesta fase e deve ser resolvido durante a purificação MACS. Os vários tipos de células são então obtidos por incubação com os anticorpos magnéticos para obter fracções puras. Os monócitos são recolhidos através de incubação da fracção de PBMC com CD14, o fluxo de passagem de tmonócitos ele conter os linfócitos, que são então desprovidas de RBC e plaquetas. Os neutrófilos são obtidos por incubação da camada de células polimorfonucleares com anticorpo CD15 (Figura 1A). Depois disso, as plaquetas podem ser peletizadas por centrifugação do plasma rico em plaquetas e lavada para remover outros componentes do plasma. Após estas seleções das plaquetas, monócitos CD14 +, linfócitos, CD15 + neutrófilos podem ser contadas e semeadas em uma placa XF analisador revestido de média adesão celular para bioenergética e análise de burst oxidativo.
Cada fase do processo devem ser realizados em condições estéreis e são encorajados a evitar a activação prematura da resposta do burst oxidativo em monócitos e neutrófilos. Um indicador de menos de condições estéreis durante o isolamento é evidente que os neutrófilos, que têm pouco ou nenhum consumo de oxigênio em condições basais, começar o ensaio fluxo extracelular com medidas elevadas de OCR quegradualmente aumentar ou diminuir ao longo do ensaio. Ressaltamos a importância da imagiologia células usando microscopia de luz em 200X ou maior para garantir que há sinais morfológicos de ativação ter ocorrido antes do ensaio. Por exemplo, os neutrófilos, normalmente exibem um arredondada com a forma irregular, com os limites da célula pronunciadas como pode ser visto na figura 1B. No entanto, estas células achatam contra a superfície da placa quando activado e perdem a sua morfologia celular distinto. Em estudo prévio, as alterações morfológicas de leucócitos e plaquetas ativadas usando este protocolo e devem ser tomadas medidas adicionais para garantir condições estéreis se encontrando ativação 8.
Um esquema simplificado do protocolo é visto na Figura 2, tal como uma tabela de tempo em que os passos principais do isolamento de células, XF placa preparação e ensaio XF são detalhadas. O isolamento consiste na separação por gradiente de densidade de tipos de células eé seguida de separação magnética. Paralelamente ao processo de isolamento celular, XF placa preparação é necessária para evitar atrasos na chaparia celular ou de iniciar o ensaio XF. Isto é crítico porque atrasos significativos pode levar a ativação celular e parâmetros bioenergéticos diminuíram.
As concentrações de células inadequada após isolamento são um problema e optimização de cada processo de centrifugação comum é necessária para evitar a perda de células. Isolamentos bem sucedidas foram realizadas em menos de 6 ml de sangue, mas que as alterações podem ser feitas em função da concentração do tipo de célula desejada de circulação. Se o gradiente de densidade é preparado de forma inadequada, fases de células distintas podem não ser visíveis e perda de células pode ocorrer (ver Jove vídeo instrutivo para uma demonstração visual). Plaquetas insuficiente, isolado a partir do PRP é raro, mas ocorreu se tampão de lavagem não contém PGI 2, ou se o isolamento ocorre abaixo da temperatura ambiente. O risco de uma plaquetactivation é muitas vezes evitado se as plaquetas estão as últimas células a serem isolados, porém, se as plaquetas permanecem em tampão de lavagem por longos períodos a bioenergética serão afetados. Houve casos de populações menores de plaquetas que não pellet durante a centrifugação de 1500 xg e bioenergética dessas células não tem sido extensivamente caracterizados. Ver Tabela 2 para um guia de solução de problemas mais completo.
Os perfis bioenergéticos de leucócitos e de plaquetas pode ser determinado utilizando o analisador de XF, que mede em tempo real o consumo de O2 em células de forma não invasiva. Cada tipo de célula é revestida na placa XF24 com cinco repetições, como mostrado na Figura 3A. Quadro 1 indica o esperados basal e burst oxidativo valores por tipo de célula durante o as concentrações médias de proteína ensaio e por poço. Tecnologias de produção mais elevada estão disponíveis, tais como o XF96, que permitequatro dadores a serem avaliados em simultâneo, como mostrado na Figura 3B. Após o ensaio, os dados são exportados para um computador da estação de trabalho para a análise utilizando o software XF apropriado e Microsoft Excel. Os valores foram normalizados OCR para o conteúdo de proteína total nos poços correspondentes e expressos em pmol / min / mg de proteína. Os perfis de ruptura bioenergéticos-oxidativo representativas de cada tipo de célula foram relatados recentemente por nosso grupo 8. Uma análise mais aprofundada de parâmetros bioenergéticos do ensaio (basal, ATP-ligada, vazamento de protões, máxima, nonmitochondrial e burst oxidativo) pode ser calculada para poços individuais como previamente mostrado e descrito abaixo de 8.
A taxa de consumo de oxigénio basal (OCR) é estabelecida pelos primeiros três medições, como mostrado na Figura 4A. A oligomicina (0,5 ug / ml), um inibidor de ATP-sintase mitocondrial é injectado no meio XF para estimar o OCR acoplado a síntese de ATP e repre ted como ATP-ligados. O OCR residual de menos do OCR nonmitochondrial pode ser atribuída a uma libertação de protões. Em seguida, um desacoplador FCCP é adicionado para determinar o OCR máxima, seguido por antimicina-A, um inibidor da respiração mitocondrial, para determinar as fontes nonmitochondrial de consumo de oxigénio. A capacidade de reserva é uma medida da quantidade de ATP que pode ser produzido sob demanda energética e pode ser calculada como a diferença entre a taxa máxima de respiração e basal. A fim de determinar a capacidade de explosão oxidativa, de forbol 12-miristato 13-acetato (PMA), um agonista de PKC é injectado para aumentar a actividade da NADPH-oxidase, e o aumento da taxa de consumo de oxigénio após a estimulação de PMA pode ser medida usando o analisador de XF. Figura 4B mostrar como calcular os diferentes parâmetros da função mitocondrial e burst oxidativo.
1301/51301fig1highres.jpg "src =" / files/ftp_upload/51301/51301fig1.jpg "/>
Figura 1. Isolamento de leucócitos e plaquetas do sangue total. A) amostras recolhidas recentemente são separados em seu plasma e os componentes celulares por centrifugação e purificados por gradiente de densidade de Ficoll, e magnética de células activadas Sorting (MACS) por positivo (monócitos e neutrófilos) ou selecção negativa (linfócitos), enquanto que as plaquetas são isolados por alta velocidade de centrifugação do plasma rico em plaquetas. B) Imagens das populações de células isoladas, uma vez ressuspendido em DMEM XF e banhado em densidades celulares indicados. Clique aqui para ver uma versão maior desta figura.
ghres.jpg "src =" / files/ftp_upload/51301/51301fig2.jpg "/>
Figura 2. Preparação das placas XF24 para estudos bioenergética de leucócitos e plaquetas. Cronograma detalhado para a preparação de uma placa de ensaio XF24 por isolamento de células e plaqueamento de hidratação e do cartucho de injecção e da porta de carga.
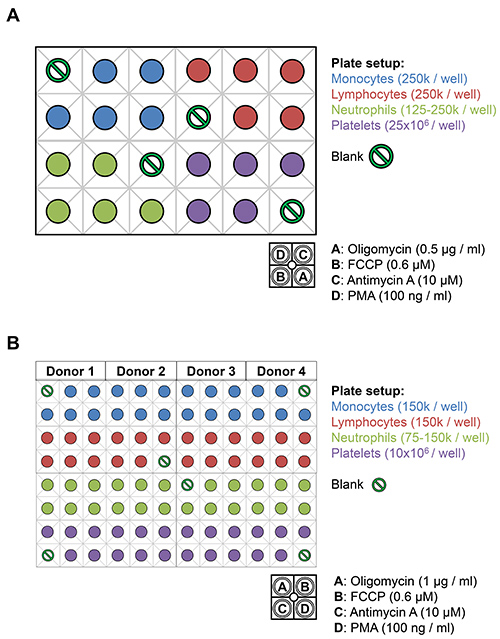
Figura 3. Disposição de leucócitos e de plaquetas no XF24 e XF96 placas analisador. UM) leucócitos (células 125-250K / poço) e as plaquetas (de 25 x 10 6 células / poço) a partir de um único dador são colocadas sobre a placa de ensaio de fundo entre XF24 controlos. 75 ul de 10x stocks de oligomicina (0,5 ug / ml), FCCP (0,6 uM), antimicina-A (10 fiM), e PMA (100 ng / ml) diluída em meio XF são carregados empara as aberturas de injecção indicados. B) Os leucócitos (células 75-150k / poço) e as plaquetas (de 10 x 10 6 células / poço) a partir de um máximo de quatro doadores podem ser plaqueadas no XF96, num volume total de 180 ul XF-DMEM. 20 l de 10x stocks de oligomicina (1,0 ug / ml), FCCP (0,6 uM), antimicina-A (10 fiM), e PMA (100 ng / ml) diluída em XF-DMEM são carregados para as aberturas de injecção indicados.
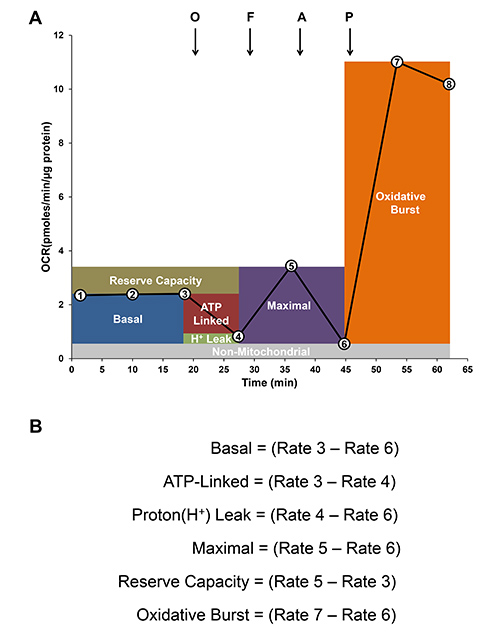
Figura 4. Análise de índices de Bioenergética. A) traço Representante da taxa de consumo de oxigênio (OCR) pela mitocôndria e burst oxidativo em monócitos. Basal OCR é estabelecido (3 primeiros taxas indicadas por números em círculos). Então adições sequenciais de oligomicina (S, 0,5 ug / ml), FCCP (F; 0,6 uM) e antimicina-A (A, 10 uM) são injectados para determinar mitocondrial e respiração nonmitochondrial de células não activados. Finalmente, PMA (100 ng / ml) é adicionado para medir o burst oxidativo. B) Análise de modular a função mitocondrial e do burst oxidativo são calculados pelas diferenças das taxas, tal como indicado.
| Optimal densidade de semeadura | Médio. Basal OCR (pmol O 2 / min) | Médio. Oxidativo Explosão OCR (pmol O 2 / min) | Médio. proteína (ug) / bem | |
| Os monócitos | 250k células / poço | 83,9 (± 13,0) | 300,3 (± 58,8) | 19,0 (± 2,4) |
| Os neutrófilos | 250k células / poço | 6,1 (± 2,2) | 1411,8 (± 233,3) | 20,6 (± 2,7) |
| Os linfócitos | 250k células / poço | 52,9 (± 7,7) | 15 (± 4,1) | 13,2 (± 2,1) |
| Plaquetas | 25 x 10 6 células / poço | 199,4 (± 20,3) | 24 (± 2,7) | 47,5 (± 3,1) |
Tabela 1. Parâmetros normais para o ensaio XF24: basal média (Rate 3) e burst oxidativo (Rate 7) OCR não corrigido para OCR nonmitochondrial ou proteína são apresentados por tipo de célula banhado nas densidades celulares indicados. O teor médio de proteína por poço é mostrado como é realizada por um ensaio de Lowry DC. Estes dados representam os valores médios de6-8 doadores saudáveis com parêntese contendo ± SEM.
| Passo | Problema | Possível motivo | Solução |
| 1.2 | plasma claro | plaquetas peletizadas durante a centrifugação | diminuir o tempo de centrifugação a 10 min ou lenta a 400 xg |
| plasma leitoso | lipídios em excesso | evitar coleta pós-prandial | |
| 1.6 | bandas da célula incompletos formado | diabinhopreparação gradiente roper, reagente frio | não perturbar gradiente durante a pipetagem, reagente à temperatura ambiente uso |
| aglomerados em bandas de celulares | coagulação do sangue pode ter ocorrido | Coletar sangue usando anticoagulantes como a ACD ou EDTA | |
| 1.10 | sem sedimento celular | veja o passo 1.6 | Se nebuloso sobrenadante veja abaixo |
| sobrenadante nebuloso | Gradiente de contaminação Ficoll pesado, a contaminação de plaquetas | Aumente a velocidade de centrifugação a 900 xg, dilute com mais RPMI | |
| 1,16, 1,17 | baixo rendimento de leucócitos | contaminação RBC pesado, não o suficiente sangue total, coagulação | Volumes de anticorpos duplo e RPMI-BSA, recolher mais sangue, adicione anticoagulante |
| 1.19 | agregação de plaquetas | PGI 2 omitido, a exposição à mídia frio, armazenamento prolongado no plasma | adicionar PGI 2 de tampão de lavagem de plaquetas, reagentes à temperatura ambiente uso |
| 1.20 | baixa contagem de plaquetas | perda durante a centrifugação primária, a agregação de plaquetas | Veros passos 1.2 e 1.19 |
| 2.3 | Contaminação RBC | Repita separação MACS |
Tabela 2. Leucócitos e plaquetas solução de problemas de isolamento. A tabela lista problemas comuns encontrados durante leucócitos e plaquetas isolamento de células do sangue e soluções que podem orientar os usuários através do processo de solução de problemas todo.
Discussão
Este protocolo representa a compilação de várias técnicas vulgarmente utilizados para o isolamento de células de sangue de uma forma adequada para análise bioenergética. As técnicas apresentadas contíguas são vantajosos para outros métodos de isolamento (ou seja, a análise FACS) para a sua capacidade para isolar um grande número de células, em condições controladas de comunicação com o mínimo de tensões colocadas sobre as células isoladas. Tem a desvantagem de longos isolamentos, mesmo com o mínimo de interrupções. Este protocolo serve como a base para o isolamento de células sanguíneas primárias a partir de seres humanos, os quais podem ser extrapolados em ambientes clínicos e de investigação translacional.
MACS separação é uma técnica de isolamento de células de confiança, que oferece a possibilidade de isolar as células directamente a partir de sangue total, no entanto, este método requer maiores quantidades de anticorpo e não é óptima para o isolamento de todos os quatro tipos de células diferentes, tal como descrito neste método. Não tem been nenhuma evidência para mostrar que a seleção positiva de leucócitos por MACS a separação resulta em ativação usando o nosso protocolo de isolamento. Colunas MACS funcionar por sequestro de células marcadas em um campo magnético, utilizando anticorpos conjugados com partículas superparamagnéticas 50 nm. As células marcadas são então eluído da coluna. Seleções positivas e negativas são implementadas neste protocolo para garantir o isolamento rápido e pureza. Se o número de células insuficientes são obtidas a partir de isolamento ou a pureza está em questão, mais anticorpos podem ser adicionados à amostra, conforme as instruções do fornecedor e segunda passagem através da coluna LS pode resultar numa maior pureza (Tabela 2). Nosso laboratório encontrado alta pureza e eficiência de plaqueamento utilizando o protocolo existente através da análise de suspensões de células finais pela análise FACS 8.
Analisadores de fluxo extracelulares têm a capacidade de monitorar o consumo de oxigênio ea acidificação mídia em tempo real sobre o de otseus eletrodos. O consumo de oxigênio, como observado pela resposta burst oxidativo em monócitos e neutrófilos é NADPH oxidase dependente como mostrado pela inibição com DPI 8. Vimos uma perda dependente do tempo na capacidade de burst oxidativo com isolamentos prolongados ou ensaios XF estendidos. Este protocolo foi concebido e desenvolvido para utilização na XF24, mas também é compatível com o XF96 em cerca de um terço a metade da célula XF24 semeando densidade (Figura 3).
Na concepção deste protocolo, a adesão aos protocolos existentes para cada técnica foi necessária para o melhor desempenho com as modificações feitas apenas para controlar as condições de mídia para análise bioenergética. Depois de técnicas de dominar, um tal protocolo pode ser utilizado numa vasta gama de aplicações de translação e de pesquisa para medir a toxicidade ou a eficácia de estratégias de tratamento, explorar as características metabólicas da doença e produção de oxidantes por monócitos e neutrophils em condições inflamatórias.
Divulgações
VDU é membro do Conselho Consultivo Científico Bioscience Seahorse.
Agradecimentos
Os autores gostariam de agradecer a contribuição técnica do Gloria A Benavides. Este trabalho foi financiado pela American Heart Association 13PRE16390001 (SR), NIH T32HL07918 (PAK), NIH T32HL007457 (TM), P30DK056336 (BKC), complicações diabéticas NIDDK Consortium (DiaComp, www.diacomp.org) DK076169 concessão (subaward VDU), e o DK079337 P30 O'Brien Center (VDU).
Materiais
| Name | Company | Catalog Number | Comments |
| QuadroMACS Starting Kit includes QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-094-833 | |
| CD235a (Glycophorin A) MicroBeads, human | Miltenyi Biotec | 130-050-501 | |
| CD61 MicroBeads, human for platelets | Miltenyi Biotec | 130-051-101 | |
| CD14 MicroBeads, human for monocytes | Miltenyi Biotec | 130-050-201 | |
| CD15 MicroBeads, human for granulocytes | Miltenyi Biotec | 130-046-601 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| BD Vacutainer ACD Blood collection tubes | Fisher | 02-684-26 | |
| RPMI 1640 | Gibco | 11835-030 | with L-glutamine and without phenol red |
| Prostaglandin I2, sodium salt | Cayman | 18220 | |
| 1.5 ml semi-micro cuvettes | Phenix Research Products | SC-2410 | |
| Histopaque density gradient, specific gravity 1.077 | Sigma | 10771 | |
| Histopaque density gradient, specific gravity 1.119 | Sigma | 11191 | |
| Bovine Serum Albumin Fraction V | Roche | 3117405001 | fatty-acid ultra-free |
| Phorbol 12-myristate 13-acetate | Sigma | P8139 | |
| XF24 FluxPak | Seahorse Biosciences | 100850-001 | |
| DMEM | Fisher | MT90113PB | w/o Glucose, L-Glutamine, Pyruvate, Phenol Red, and Bicarbonate |
| L-Glutamine, 200 mM (100x) | Invitrogen | 25030-081 | |
| D-Glucose | Sigma | G7528 | |
| Sodium Pyruvate | Sigma | P8574 | |
| Cell-Tak (cell adhesive) | BD Biosciences | CB-40242 | |
| Oligomycin | Sigma | O4876 | |
| Antimycin A | Sigma | A8674 | |
| (FCCP) Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma | C-2920 | |
| DC Protein Assay Reagent A | Bio-Rad | 500-0113 | |
| DC Protein Assay Reagent S | Bio-Rad | 500-0015 | |
| DC Protein Assay Reagent B | Bio-Rad | 500-0114 | |
| Seahorse | Seahorse Biosciences | ||
| QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-090-976 and 24039 | |
| Spectrophotometer |
Referências
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int. J. Alzheimer's Dis. 2009, (2009).
- Jin, S. Autophagy, mitochondrial quality control, and oncogenesis. Autophagy. 2, 80-84 (2006).
- Cordero, M. D., et al. Mitochondrial dysfunction and mitophagy activation in blood mononuclear cells of fibromyalgia patients: implications in the pathogenesis of the disease. Arthritis Res. Ther. 12, R17 (2010).
- Japiassu, A. M., et al. Bioenergetic failure of human peripheral blood monocytes in patients with septic shock is mediated by reduced F1Fo adenosine-5'-triphosphate synthase activity. Crit. Med. 39, 1056-1063 (2011).
- Widlansky, M. E., et al. Altered mitochondrial membrane potential, mass, and morphology in the mononuclear cells of humans with type 2 diabetes. Transl. Res. 156, 15-25 (2010).
- Shi, C., et al. Effects of ageing and Alzheimer's disease on mitochondrial function of human platelets. Exp. Gerontol. 43, 589-594 (2008).
- Avila, C., et al. Platelet mitochondrial dysfunction is evident in type 2 diabetes in association with modifications of mitochondrial anti-oxidant stress proteins. Exp. Clin. Endocrinol. Diabetes. 120, 248-251 (2012).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab. Invest. 93, 690-700 (2013).
- Hill, B. G., et al. Integration of cellular bioenergetics with mitochondrial quality control and autophagy. Biol. Chem. 393, 1485-1512 (2012).
- Hultqvist, M., et al. Enhanced autoimmunity, arthritis, and encephalomyelitis in mice with a reduced oxidative burst due to a mutation in the Ncf1 gene. Proc. Natl. Acad. Sci. U.S.A. 101, 12646-12651 (2004).
- Rosa-Borges, A., et al. Glucose-6-phosphate dehydrogenase deficiency with recurrent infections: case report. J. Ped. 77, 331-336 (2001).
- Walkowiak, B., Kesy, A., Michalec, L. Microplate reader--a convenient tool in studies of blood coagulation. Thromb. Res. 87, 95-103 (1997).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radic. Biol. Med. 51, 1621-1635 (2011).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J. Vis. Exp.. (46), e2511 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados