Method Article
Биоэнергетика и окислительного: протоколах выделения и оценки человека лейкоцитов и тромбоцитов
В этой статье
Резюме
Лейкоциты крови и тромбоцитов может быть использован в качестве маркера общего биоэнергетического здоровья человека и поэтому имеют потенциал для мониторинга патологических процессов и влияния лечения. Здесь мы опишем метод, чтобы изолировать и измерения функции митохондрий и окислительный взрыв в этих клетках.
Аннотация
Митохондриальной дисфункцией, как известно, играют важную роль во многих патологических состояниях, таких как атеросклероз, диабет, септический шок, и нейродегенеративных заболеваний, но оценки изменений в биоэнергетической функции у больных является сложной задачей. Хотя заболеваний, таких как диабет или атеросклероз настоящего клинически с конкретной нарушений органов, системные компоненты патологии, такие как гипергликемии или воспаления, могут изменить функцию биоэнергетической в циркулирующих лейкоцитов или тромбоцитов. Эта концепция была признана в течение некоторого времени, но его широкое применение сдерживается большим количеством первичных клеток, необходимых для биоэнергетического анализа. Это техническое ограничение было преодолено путем объединения специфику магнитных методов изоляции шарик, методов клеточной адгезии, которые позволяют клеткам быть присоединены без активации в микропланшеты, а чувствительность новых технологий предназначен для высокой пропускной микрофономroplate респирометрии. Примером такого оборудования является внеклеточный анализатор потока. Такая аппаратура, как правило, использует кислород и рН чувствительные датчики для измерения скорости изменения этих параметров в прилипшие клетки, которые затем могут быть связаны с обменом веществ. Здесь мы подробно методы для изоляции и обмуровки моноцитов, лимфоцитов, нейтрофилов и тромбоцитов, без активации, из крови человека и анализа митохондриальной биоэнергетической функции в этих клетках. Кроме того, показано, как окислительный взрыв в моноцитов и нейтрофилов может быть также измерена в тех же образцах. Так как эти методы используют только 8-20 мл человеческой крови у них есть потенциал для мониторинга поколения и биоэнергетику КИСЛОРОДА в клинических условиях.
Введение
Мониторинг биоэнергетический здоровье иммунных клеток (моноцитов, лимфоцитов, нейтрофилов) и тромбоцитов из крови был признан в течение некоторого времени в качестве потенциально полезного диагностического инструмента для оценки общего биоэнергетический здоровье человека. Существует возникающих количество литературы приписывая ряд заболеваний, таких как рак, сердечно-сосудистых заболеваний и нейродегенеративных заболеваний в митохондриальной дисфункции 1,2. Это клинически важно, так как митохондриальная дисфункция может инициировать серию клеточных событий, которые способствуют провоспалительных сигнальных путей или привести к гибели клеток. Несколько исследований характеризуется митохондриальную функцию мононуклеарных клеток периферической крови и тромбоцитов в условиях, таких как фибромиалгии, диабет, септического шока и болезни Альцгеймера 3-7. Например, недавнее исследование оценивали биоэнергетику тромбоцитов в качестве маркера для функции митохондрий и обнаружили, что тромбоциты Тип 2 диабетпациенты IC уменьшилась митохондриальную потребления кислорода 7,8. Исходя из этих данных и других, становится ясно, что моноциты, лимфоциты, нейтрофилы, и тромбоциты могут служить суррогатные маркеры изменений в биоэнергетике при патологических состояниях, так как они обследовать в системный кровоток и может отражать локальные и глобальные метаболические изменения. Чтобы определить, имеет ли такой подход прогностические или диагностическую ценность высокий метод пропускную способность анализа и последовательный метод для клеточного препарата не требуется.
Методы для измерения функции митохондрий в лейкоцитов и тромбоцитов ранее участие изоляцию митохондрий или оценки клеточных биоэнергетики в интактных клетках 4,9. Преимущество сотовой биоэнергетической оценки с использованием внеклеточного поток (XF) анализатора является то, что функции митохондрий в клетках могут быть установлены с эндогенных субстратов и дыхательных параметров, таких как протонного утечки и максимальной дыхательнойЕмкость может быть определена. Мы и другие использовали эту технологию, чтобы показать, что биоэнергетические профили в тромбоцитов, моноцитов и лимфоцитов, выделенных из крови человека может быть установлена и по сравнению среди типов клеток 8. Кроме того, оба нейтрофилы и моноциты обладают способность окислительного пакета, в котором активированный NAPDH оксидазы и поглощают кислород с образованием супероксида. Важно отметить, что этот путь является ключевым компонентом врожденного иммунитета и модулируется системного воспаления. Например, было показано, что изменения в мощности окислительного связаны с различными аутоиммунными заболеваниями, такими как рассеянный склероз, артрит и рецидивирующих инфекций 10,11. В настоящее время нет никаких высокой пропускной количественные анализы доступные для измерения окислительный взрыв в клинических образцах. Это важно, поскольку, характеризующий окислительного потенциала нейтрофилов и моноцитов может также служить в качестве важного диагностического инструмента для нескольких патологичегии.
Ключевые технические проблемы были низкая чувствительность для измерения потребления кислорода с использованием обычных полярографические методы и необходимости использовать присоединенные клетки при использовании более чувствительных методов микропланшет флуорометрические. В этом практическом видео, мы опишем техническое решение этих проблем. Мы подробно методы выделения, обшивки и измерения биоэнергетики моноцитов, лимфоцитов, нейтрофилов и тромбоцитов и окислительного моноцитов и нейтрофилов из крови человека. Этот метод подходит для клинической оценки биоэнергетики и окислительного для следователей, которые имеют доступ к популяции пациентов и возможностью получения свежих образцов крови.
протокол
Все протоколы, описанные в этой рукописи для сбора крови, выделения и анализа были рассмотрены и одобрены Institutional Review Board в в университете штата Алабама в Бирмингеме.
1. Выделение клеток (изменения от Histopaque Sigma-Aldrich Протокола № 1119 и Miltenyi Biotec Microbead положительных и отрицательных протоколов отбора)
- Центрифуга цельной крови (собраны в ACD или ЭДТА труб) при 500 мкг в течение 15 мин в центрифуге с ротором Бакет-(ускорения = 5-6, и без тормозов).
- Снимите верхний слой, содержащий плазмы, обогащенной тромбоцитами (PRP) с пипетки до 1 см не остается выше слоя клеток (эритроцитов / светлого сгустка крови). Отложите PRP при комнатной температуре для обработки позже.
- Перенести Баффи пальто в стерильную 50 мл коническую трубку, развести 24 мл базальной RPMI или, по крайней мере в 4 раза по начиная Баффи объем пальто.
Примечание: В верхней половине слоя РБК может чпр. должны быть включены хотя это приведет к увеличению объема RPMI пропорционально. - Подготовка градиента плотности с использованием низкой плотности Ficoll с удельным весом 1,077 (1077) для верхнего слоя и высокой плотности Ficoll с удельным весом 1,119 (1119) для нижнего слоя в три 15 мл конические пробирки (3 мл каждый). Для выполнения этого шага, сначала добавьте 1077 в каждую пробирку. Использование 5 мл пипетки добавить узкую 1119 в нижней части трубки, помещая наконечник пипетки под 1077 и медленно высвобождают реагента без смешивания с верхней градиента. В общей сложности 6 мл градиентных СМИ плотности должны присутствовать на данном этапе с видимой фазы разделения на мл отметки 3.
- Использование автоматизированной пипетки внести 8 мл разведенной крови (из шага 1.3) осторожно, чтобы каждого градиента трубки, используя настройки с низким энергопотреблением для предотвращения нарушения градиентные слои. Общий объем должен быть 14 мл на этом шаге.
- Пробирки центрифужные при 700 мкг в течение 30 мин при комнатной температуре (AcceleРацион 6, № тормоз).
Примечание: На этом этапе три различных групп клеток должно быть очевидно (рис. 1А). Самые верхние полосы (между 1077 и плазмы) содержит мононуклеарных клеток (МНК) и тромбоцитов, а также среднюю полосу (между 1007 и 1119) содержит полиморфноядерных клеток (PMNs) и нижнюю полосу (ниже 1119) содержит эритроциты. - Соберите MNC и ПМН отдельно с помощью стерильных стеклянных пипеток, не нарушая другие группы клеток. Смешайте население MNC из каждой пробирки в стерильный 50 мл коническую пробирку. Повторите эту процедуру для населения ПМН, а также.
- Добавить 4 тома RPMI в каждую пробирку, содержащую фракции MNC и ПМН соответственно разбавить градиент плотности.
- Пробирки центрифужные при 700 мкг в течение 10 минут при комнатной температуре.
- Ресуспендируют осадок клеток MNC и PMN осадок клеток в 1 мл среды RPMI, содержащей 0,5% сверхчистой не содержащего жирных кислот BSA (RPMI-BSA) и передать в стерильную 1,5 мл пробирки. Гранул клеток с помощью настольной picofuge на 30сек.
- Удалите супернатант и ресуспендирования каждый осадок клеток в 80 мкл RPMI-BSA.
- Добавить 20 мкл магнитной борта помечены-antiCD14 антител в пробирку фракции MNC для позитивной селекции моноцитов. Для пробирку с клеточной фракции ПМН, добавить 20 мкл магнитной борта помечены-antiCD15 антитела для позитивной селекции нейтрофилов. Инкубировать каждой клеточной суспензии в течение 15 мин при 4 ° С.
- Вымойте каждой клеточной суспензии с 1 мл RPMI-BSA СМИ и осаждения, как и раньше и ресуспендируйте каждый шарик в 500 мкл RPMI-BSA.
- Меченые клетки отделяют в магнитном поле магнитного Активированный сортировки клеток (MACS) сепаратор. Подготовьте MACS LS столбцы (один для каждой клеточной суспензии), поместив столбец на сепараторе MACS и промывают 3 мл RPMI-BSA перед добавлением суспензии клеток.
- После применения клеточных суспензий, мыть каждый столбец 3x 3 мл RPMI-BSA СМИ (убедитесь, чтобы средства массовой информации Драйн полностью между стирок). Сбор клеточной суспензии проточные и промывные столбцов в стерильную пробирку.
- Для выделения моноцитов и нейтрофилов, удалить столбец из магнитного поля после последней промывки и элюции положительно выбранные ячейки в стерильную пробирку с 5 мл RPMI-BSA с использованием колонки поршень.
- Для выделения лимфоцитов обстреливать проточный-мыть долю МНК с шага 1,15 при 300 мкг в течение 10 мин. Удалите супернатант и ресуспендируют осадок клеток в 80 мкл RPMI-BSA. Добавить 20 мкл CD61 и антител CD235a и инкубировать клеточной суспензии в течение 15 мин при 4 ° С. Повторите разделение MACS как раньше, и собрать поток, хотя содержащий лимфоциты.
- Для осаждения моноциты, нейтрофилы и лимфоциты фракции, центрифуги, как и раньше (шаг 1.9) и отбросить супернатантами. Клеточные осадки должны быть ресуспендировали в 1 мл внеклеточных потока среды (XF-DMEM) для подсчета. <бр /> Примечание: 8 мл цельной крови должен приводить к 1-5 × 10 6 моноцитов / мл и 5-20 × 10 6 лимфоцитов и нейтрофилов / мл.
- Для выделения тромбоцитов PRP, центрифуги (этап 1.2) при 8-10 мин при 1500 х г при комнатной температуре. Удаление плазмы и мыть осадок клеток один раз 5 мл стерильной PBS с добавлением 1 мкг / мл PGI 2, repellet и приостановить Конечный осадок в 1 мл PBS-буфера PGI 2.
- Определение количества тромбоцитов на турбидиметрии раз тромбоциты суспендируют в PBS-буфере PGI 2 спектрофотометрически, как описано Валковяк и др., используя следующее уравнение: [6,23 / (2,016 - ABS 800)] - 3,09 х коэффициент разбавления = # х 10 8. тромбоциты / мл 12.
2. Покрытие из клеток
- Подготовка Cell-Tak (клея клеток): Добавить клей 90 мкл клеток до 180 мкл DIH 2 0, 540 мкл 0,1 н би натриякарбонат (рН 8,0), и довести рН до 7,2-7,8 с помощью 1 N NaOH. Подготовка XF пластины (24-а, V7 Микропланшеты) путем нанесения каждую лунку 30 мкл клея подготовленной клеток.
Примечание: Клей клеток следует приготовить свежую для каждого использования. - Выдержите пластины при температуре 37 ° С в течение 20-30 мин, затем клей аспирации клеток и мыть скважин с PBS в два раза (1 мл / лунку).
- Выполните число клеток на изолированных моноцитов, лимфоцитов, нейтрофилов и тромбоцитов и довести до соответствующего объема с использованием XF-DMEM, чтобы плотность посева 250 тыс. клеток / лунку для моноцитов, лимфоцитов и нейтрофилов, и 25 х 10 6 / лунку для тромбоцитов. Кроме того, для измерения реакции взрывного окислительный, нейтрофилы могут быть посеяны на 125 тыс. клеток / лунку. Конечный объем посева для каждой клеточной суспензии должно быть 200 мкл / лунку.
- Центрифуга пластину при 200 мкг в течение 1 сек, без тормоза. Поверните пластину 180 ˚ и центрифуги снова без тормоза при 300 х г.
- Принесите окончательное а Volумэ до 660 мкл с XF-DMEM и инкубировать при температуре 37 ° С в течение 30 минут до XF анализа. Примечание: микрофотографии посеянных клеток до и после анализа могут быть использованы для обеспечения надлежащего покрытие и исключает открепления клеток.
3. Подготовка 24-и внеклеточной поток аналитический планшет (XF24)
- Гидрат XF зондов с калибрующего растворе в течение как минимум 2 ч до анализа.
- Подготовка 10x запасы 0,5 мкг / мл олигомицин, 0,6 мкм FCCP, до 10 мкм антимицин А в XF-DMEM и нагрузка 75 мкл растворов в нагнетательные картридж портов в указанном выше порядке. Если измерения окислительного должны быть получены, инъекция 10-кратным запасом 100 нг / мл РМА может быть введен после антимицина-A.
- Калибровка гашеной и заряженный патрон и выполнения анализа XF. Подробные методы анализа и интерпретации как потребления кислорода и рН изменений были описаны в предыдущих публикациях 9,13,14 и не дiscussed здесь подробно.
- После XF анализа, аспирация все, кроме последних 50 мкл XF-DMEM после анализа, чтобы предотвратить потерю клеток с пластинки и добавить 50 мкл RIPA буфера для лизиса клеток и выполнить анализа белка для нормализации.
Результаты
Для того чтобы оценить биоэнергетики клеток крови, цельной крови собирается из человеческих субъектов из вены в ЭДТА или ACD сбора Vacutainer трубки. Выделение лейкоцитов и тромбоцитов следующих сбора крови визуализируется на фиг.1А, как указано в протоколе. Образцы цельной крови обрабатываются в течение 8 часов сбора, чтобы избежать гибели клеток и активацию. Расширенные сроки хранения больше, чем 8 часов не были проверены, но может привести к изменению биоэнергетики и быть менее представитель физиологических условиях. Кислый цитрат декстрозы (ACD-8 мл) и ЭДТА Vacutainer трубки были использованы для клеточных выделений, не наблюдаемого эффекта на биоэнергетической функции изолированных клеток. Антикоагулянты необходимы как сгустки уменьшить количество клеток, полученных, препятствуют образованию собственно фазы во время Ficoll центрифугированием в градиенте, и в результате практически нет тромбоцитов, полученных в центрифугировали сыворотки. Вся кровь представляет собой Биологческих опасности и специальные средства защиты должны быть реализованы в течение всей процедуры даже после клеточные популяции изолированы или клеточные лизаты генерируются. Образцы должны быть утилизированы в соответствии со стандартами человека отходов данного учреждения.
Цельную кровь центрифугируют, чтобы отделить плазмы, обогащенной тромбоцитами из лейкоцитарной пленки, белый слой чуть выше уплотненных эритроцитов, который содержит лейкоциты. Лейкоцитарную пленку наносят на градиентах плотности и центрифугируют, чтобы получить мононуклеарные клетки периферической крови (моноциты и лимфоциты), и полиморфно-клетки (гранулоциты). РБК загрязнение отдельных фаз клеток МНК и ПМН является общим на данном этапе и должны быть решены во время очистки MACS. Различные типы клеток затем получают путем инкубации с магнитными антител для получения чистых фракций. Моноциты собраны путем инкубации фракции РВМС с CD14, проточные от тон моноциты содержат лимфоциты, которые затем истощенных эритроцитов и тромбоцитов. Нейтрофилы получают путем инкубации клеток полиморфно слоя с CD15 антителом (фигура 1А). После этого тромбоциты могут быть осаждали центрифугированием в богатой тромбоцитами плазме и промывают, чтобы удалить другие компоненты плазмы. После этих выборов тромбоциты, CD14 + моноциты, лимфоциты, CD15 + нейтрофилы могут быть подсчитаны и высевали на клеточной адгезии среднего покрытием XF анализатора пластины для биоэнергетика и анализа окислительный взрыв.
Каждый этап процедуры должны выполняться в стерильных условиях и поощряется, чтобы предотвратить преждевременное активацию ответ окислительный взрыв в моноцитов и нейтрофилов. Показателем менее стерильных условиях в течение изоляции очевидна, когда нейтрофилы, которые практически не имеют потребления кислорода под базальных условиях, начинают внеклеточный анализа потока с повышенными измерений OCR, чтопостепенно увеличивать или уменьшаться в течение всего теста. Мы подчеркиваем важность визуализации клеток с использованием световой микроскопии на 200X или больше, чтобы убедиться, что ни морфологические признаки активации не произошло перед анализом. Например, нейтрофилы обычно отображения округляется до неправильной формы с границами выраженными клеток, как показано на рисунке 1b. Однако, эти клетки будут выравниваться по отношению к поверхности пластины при активации и теряют свою отчетливую морфологию клеток. Ранее мы уже сообщали морфологические изменения активированных лейкоцитов и тромбоцитов, используя этот протокол и дополнительные меры должны быть приняты для обеспечения стерильных условий, если сталкиваются с активацию 8.
Упрощенная схема протокола видно на рисунке 2 в качестве временной таблицы, в которой первичные этапы выделения клеток, XF подготовки пластины, и XF анализа являются подробно. Выделение состоит из градиенте плотности разделения типов клеток иследуют магнитной сепарации. Параллельно с процессом выделения клеток, XF подготовка пластины необходимо, чтобы избежать задержек в обшивке клеток или начала анализа XF. Это очень важно, потому что значительные задержки может привести к активации клеток и уменьшилось биоэнергетических параметров.
Неадекватные концентрации клеток после выделения являются общей проблемой и оптимизация каждого процесса центрифугирования необходимо, чтобы избежать потерю клеток. Успешные изоляция были выполнены на качестве лишь 6 мл крови, но изменения могут быть сделаны в зависимости от концентрации циркулирующего желаемого типа клеток. Если градиент плотности неправильно подготовлены, фазы различных клеток может быть не видно и потеря клеток может происходить (см. Юпитера учебное видео для наглядной демонстрации). Недостаточно тромбоцитов изолированы от PRP редко, но имеет место, если стиральная буфер не содержит PGI 2 или если изоляция происходит при температуре ниже комнатной. Риск тромбоцитов аctivation часто предотвратить, если тромбоциты последние клетки должны быть изолированы, однако, если тромбоциты остаются в промывочном буфере в течение длительных периодов, что биоэнергетика будут затронуты. Там были случаи, меньших популяций тромбоцитов, что не окатышей в 1500 XG центрифугирования и биоэнергетика этих клеток не была широко охарактеризованы. См. Таблицу 2 для более полного руководство по устранению неполадок.
Биоэнергетической профили лейкоцитов и тромбоцитов может быть определена с использованием анализатора XF, который измеряет в реальном времени O 2 потребление в клетках неинвазивно. Каждый тип клеток высевали на XF24 пластины с пяти повторов, как показано на рисунке 3А. Таблица 1 показывает, что ожидаемые базальные и окислительного величины по типам клеток во время анализа и средних концентраций белка на лунку. Более высокие технологии пропускная доступны, например, XF96, что позволяетчетыре доноров оцениваться одновременно как показано на рисунке 3b. После анализа, данные экспортируются в рабочей станции компьютер для анализа с помощью соответствующего программного обеспечения XF и Microsoft Excel. Значения OCR были нормализованы к общему содержанию белка в соответствующие лунки и выражали в пмоль / мин / мг белка. Представительные биоэнергетические-окислительный взрыв профили каждого типа клеток были недавно сообщили нашей группы 8. Дальнейший анализ биоэнергетических параметров анализа (базальной, АТФ-связанной, утечки протонов, максимальной, nonmitochondrial и окислительного) можно рассчитать для отдельных скважин, как ранее показано и описано ниже 8.
Базальная скорость потребления кислорода (OCR) устанавливается первых 3 измерений, как показано на рисунке 4A. Олигомицин (0,5 мкг / мл), ингибитор митохондриальной АТФ-синтазы вводится в среде XF оценить OCR соединены с синтезом АТФ и представле Тед, как АТФ-связаны между собой. Остаточная OCR минус nonmitochondrial OCR можно отнести к утечке протонов. Тогда FCCP разобщающим добавляется для определения максимальной OCR, а затем антимицина-А, ингибитор митохондриального дыхания, определить nonmitochondrial источники потребления кислорода. Объем резервного является мерой количества АТФ который может быть получен при интенсивном спроса и может быть вычислена как разность между максимальной скорости дыхания и базальной. Для того чтобы определить способность окислительного разрыва, форбол 12-миристат-13-ацетата (РМА) агонист PKC впрыскивается для повышения активности НАДФН-оксидазы, а также увеличение скорости потребления кислорода следующей PMA стимуляции может быть измерена с использованием анализатора XF. Фиг.4В показать, как вычислить различные параметры функции митохондрий и окислительного.
1301/51301fig1highres.jpg "Первоначально" / files/ftp_upload/51301/51301fig1.jpg "/>
Рисунок 1. Выделение лейкоцитов и тромбоцитов из цельной крови. A) свежесобранных образцов разделены на их плазмы и клеточных компонентов центрифугированием и очищали с помощью градиенте плотности Ficoll, и магнитный Активированный сортировки клеток (MACS) с помощью положительной (моноциты и нейтрофилы) или негативной селекции (лимфоцитов), а тромбоциты выдел ют высокий -скорость центрифугирования из богатой тромбоцитами плазмы. B) Изображения населения изолированных клеток один раз ресуспендированных в XF DMEM и высевают при плотности указанных клеток. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
ghres.jpg "Первоначально" / files/ftp_upload/51301/51301fig2.jpg "/>
Рисунок 2. Подготовка XF24 пластин для биоэнергетических исследований лейкоцитов и тромбоцитов. Подробное сроки подготовки XF24 аналитический планшет по изоляции клеток и обшивкой и картриджа гидратации и впрыска порта погрузки.
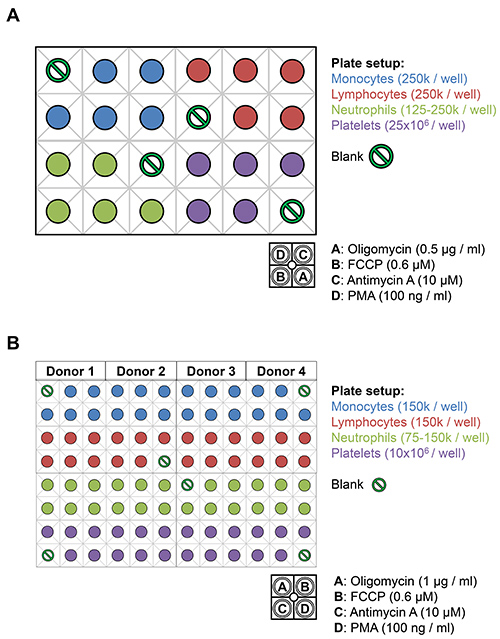
Рисунок 3. Схема лейкоцитов и тромбоцитов на XF24 и XF96 анализатора пластин.) Лейкоциты (125-250k клеток / лунку) и тромбоцитов (25 х 10 6 клеток / лунку) от одного донора высевают на XF24 аналитический планшет среди фоне управления. 75 мкл 10х запасов олигомицином (0,5 мкг / мл), FCCP (0,6 мкМ), антимицину-A (10 мкм) и PMA (100 нг / мл), разведенного в XF сред будут загружены вк указанным портам инъекций. B) Лейкоциты (75-150К клеток / лунку) и тромбоцитов (10 x10 6 клеток / лунку) из целых четыре доноров можно покрыть на XF96 в общем объеме 180 мкл DMEM-XF. 20 мкл 10х запасов олигомицином (1,0 мкг / мл), FCCP (0,6 мкМ), антимицину-A (10 мкМ), и PMA (100 нг / мл) разводили в DMEM XF-загружаются в указанных инжекционных отверстий.
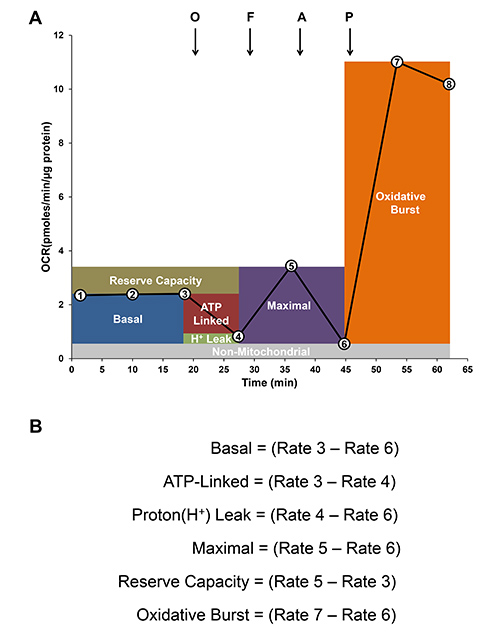
Рисунок 4. Анализ биоэнергетических показателей.) Представитель след скорости потребления кислорода (OCR) митохондриями и окислительного в моноцитов. Базальной OCR устанавливается (первые 3 ставки обозначены цифрами в кругах). Затем последовательные добавки олигомицином (O; 0,5 мкг / мл), FCCP (F; 0,6 мкМ) и антиMycin-(; 10 мкМ) вводят для определения митохондриальной и nonmitochondrial дыхание неактивированных клеток. Наконец, PMA (100 нг / мл) добавляют для измерения окислительного всплеска. B) Модульный анализ митохондриальной функции и окислительного всплеска рассчитывается путем различий в скоростях, как указано.
| Оптимальное Посев Плотность | Средняя. Базальной OCR (пмоль О 2 / мин) | Средняя. Окислительного OCR (пмоль О 2 / мин) | Средняя. белок (мкг) / лунку | |
| Моноциты | 250k клеток / лунку | 83,9 (± 13,0) | 300.3 (± 58,8) | 19.0 (± 2.4) |
| Нейтрофилы | 250k клеток / лунку | 6.1 (± 2.2) | 1411,8 (± 233,3) | 20.6 (± 2.7) |
| Лимфоциты | 250k клеток / лунку | 52.9 (± 7,7) | 15 (± 4,1) | 13.2 (± 2.1) |
| Тромбоциты | 25 х 10 6 клеток / а | 199.4 (± 20,3) | 24 (± 2,7) | 47,5 (± 3,1) |
Таблица 1. Нормальные параметры для анализа XF24: Средняя базальные (курс 3) и окислительного разрыва (курс 7) OCR не исправить, чтобы nonmitochondrial OCR или белка показаны типа клеток покрытием при плотностях указанных клеток. Среднее содержание белка на лунку показано как выполняется с помощью анализа DC Лоури. Эти данные представляют собой средние значения6-8 здоровых доноров с скобках, содержащей ± SEM.
| Шаг | Проблема | Возможная причина | Решение |
| 1.2 | ясно плазмы | осаждают тромбоциты во время центрифугирования | сократить время центрифугирования 10 мин или медленно до 400 мкг |
| молочно плазмы | избыточные липиды | избежать приема пищи коллекцию | |
| 1.6 | неполные группы клеток формируется | чертенокРопер подготовка градиент, холодный реагент | избежать нарушения градиент во пипетки, использование комнатной температуры реагента |
| сгустки в клеточных групп | свертывание крови может иметь место | Собрать кровь с помощью антикоагулянты, такие как ACD или ЭДТА | |
| 1.10 | нет Осадок клеток | см. шаг 1.6 | Если супернатант туманно см. ниже |
| туманно супернатант | Загрязнение тяжелыми фиколл градиент, загрязнение тромбоцитов | Увеличить скорость центрифугирования до 900 мкг, дилютня с более RPMI | |
| 1.16, 1.17 | низкий выход лейкоцитов | сильное загрязнение РБК, не достаточно цельная кровь, свертывания | Объемы Двухместный антител и RPMI-BSA, собирать больше крови, добавить антикоагулянт |
| 1.19 | агрегации тромбоцитов | PGI 2 опущен, воздействие холодной СМИ, длительном хранении в плазме | добавить PGI 2 к тромбоцитов промывочным буфером, использование комнатной температуры реагентов |
| 1.20 | низкий уровень тромбоцитов | потери при первичной центрифугирования, агрегации тромбоцитов | Посмотретьшаги 1,2 и 1,19 |
| 2.3 | Загрязнение РБК | Повторите разделение MACS |
Таблица 2. Лейкоцитов и тромбоцитов устранение неисправностей изоляции. Таблице перечислены общие проблемы, возникшие в ходе лейкоцитов и тромбоцитов выделения клеток из цельной крови и решений, которые могут направлять пользователей через процесс поиска и устранения неисправностей.
Обсуждение
Этот протокол представляет собой компиляцию из нескольких обычно используемых методов для выделения клеток крови в порядке, подходящем для анализа биоэнергетики. Смежные методы, представленные выгодны с другими методами изоляции (т.е. анализа FACS) в отношении их способности изолировать большое число клеток в контролируемых условиях медиа с минимальными напряжениями, размещенных на изолированных клетках. Это имеет тот недостаток, длительных выделений даже с минимальными перерывами. Этот протокол служит основой для выделения первичных клеток крови от человека предметов, которые могут быть экстраполированы в клинических условиях и трансляционных исследований.
Разделение MACS является надежным методом изолятор, что дает возможность изолировать клетки непосредственно из цельной крови, однако этот метод требует больших количеств антител и не является оптимальным для выделения всех четырех различных типов клеток, как описано в этом методе. Там есть бееп нет доказательств, чтобы показать, что положительный выбор лейкоцитов по MACS результатов разделения в активации с помощью нашего протокол изоляции. Колонны MACS функционировать по секвестрации меченых клеток в магнитном поле с помощью антител, конъюгированных с 50 нм суперпарамагнитных частиц. Меченые клетки затем элюируют с колонки. Положительные и отрицательные выборы реализованы в этом протоколе, чтобы обеспечить быстрое выделение и чистоту. Если недостаточное количество клеток получают из изоляции или чистота находится под вопросом, больше антител могут быть добавлены к пробе в соответствии с инструкцией поставщика и второго прохода через колонку LS может привести к большей чистотой (табл. 2). Наша лаборатория обнаружили высокую чистоту и эффективности посева с использованием существующего протокола, анализируя окончательные клеточные суспензии на FACS анализа 8.
Внеклеточные потока анализаторы имеют возможность контролировать как потребление кислорода и окисление СМИ в режиме реального времени по тому из OTее электроды. Потребление кислорода как заметил в ответ окислительный взрыв в моноцитов и нейтрофилов является НАДФН оксидазы зависит, как показано путем ингибирования с ДОИ 8. Мы видели, времени в зависимости потери в окислительной мощности взрыв со длительных выделений или расширенные XF анализов. Этот протокол был разработан и создан для использования на XF24 но также совместим с XF96 примерно от трети до половины ячейки XF24 посева плотности (рис. 3).
В дизайне этого протокола, соблюдение существующих протоколов для каждого метода было необходимо для оптимальной работы с изменений, внесенных исключительно для управления медиа-условия для биоэнергетического анализа. После освоения техники, такой протокол может быть использован в широком спектре поступательных и исследовательских приложений для измерения токсичности или эффективности стратегий лечения, изучить метаболические характеристики болезни, и производство окислитель по моноцитов и NEUTrophils в воспалительных состояний.
Раскрытие информации
ВДУ является членом Морской конек Bioscience Научно-консультативного совета.
Благодарности
Авторы хотели бы выразить признательность за техническую вклад Глории A Бенавидес. Эта работа была поддержана Американская Ассоциация Сердца 13PRE16390001 (SR), NIH T32HL07918 (ПАК), NIH T32HL007457 (TM), P30DK056336 (BKC), NIDDK диабетических осложнений консорциум (DiaComp, www.diacomp.org) грант DK076169 (subaward ВДУ), и P30 DK079337 О'Брайен центр (ВДУ).
Материалы
| Name | Company | Catalog Number | Comments |
| QuadroMACS Starting Kit includes QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-094-833 | |
| CD235a (Glycophorin A) MicroBeads, human | Miltenyi Biotec | 130-050-501 | |
| CD61 MicroBeads, human for platelets | Miltenyi Biotec | 130-051-101 | |
| CD14 MicroBeads, human for monocytes | Miltenyi Biotec | 130-050-201 | |
| CD15 MicroBeads, human for granulocytes | Miltenyi Biotec | 130-046-601 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| BD Vacutainer ACD Blood collection tubes | Fisher | 02-684-26 | |
| RPMI 1640 | Gibco | 11835-030 | with L-glutamine and without phenol red |
| Prostaglandin I2, sodium salt | Cayman | 18220 | |
| 1.5 ml semi-micro cuvettes | Phenix Research Products | SC-2410 | |
| Histopaque density gradient, specific gravity 1.077 | Sigma | 10771 | |
| Histopaque density gradient, specific gravity 1.119 | Sigma | 11191 | |
| Bovine Serum Albumin Fraction V | Roche | 3117405001 | fatty-acid ultra-free |
| Phorbol 12-myristate 13-acetate | Sigma | P8139 | |
| XF24 FluxPak | Seahorse Biosciences | 100850-001 | |
| DMEM | Fisher | MT90113PB | w/o Glucose, L-Glutamine, Pyruvate, Phenol Red, and Bicarbonate |
| L-Glutamine, 200 mM (100x) | Invitrogen | 25030-081 | |
| D-Glucose | Sigma | G7528 | |
| Sodium Pyruvate | Sigma | P8574 | |
| Cell-Tak (cell adhesive) | BD Biosciences | CB-40242 | |
| Oligomycin | Sigma | O4876 | |
| Antimycin A | Sigma | A8674 | |
| (FCCP) Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma | C-2920 | |
| DC Protein Assay Reagent A | Bio-Rad | 500-0113 | |
| DC Protein Assay Reagent S | Bio-Rad | 500-0015 | |
| DC Protein Assay Reagent B | Bio-Rad | 500-0114 | |
| Seahorse | Seahorse Biosciences | ||
| QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-090-976 and 24039 | |
| Spectrophotometer |
Ссылки
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int. J. Alzheimer's Dis. 2009, (2009).
- Jin, S. Autophagy, mitochondrial quality control, and oncogenesis. Autophagy. 2, 80-84 (2006).
- Cordero, M. D., et al. Mitochondrial dysfunction and mitophagy activation in blood mononuclear cells of fibromyalgia patients: implications in the pathogenesis of the disease. Arthritis Res. Ther. 12, R17 (2010).
- Japiassu, A. M., et al. Bioenergetic failure of human peripheral blood monocytes in patients with septic shock is mediated by reduced F1Fo adenosine-5'-triphosphate synthase activity. Crit. Med. 39, 1056-1063 (2011).
- Widlansky, M. E., et al. Altered mitochondrial membrane potential, mass, and morphology in the mononuclear cells of humans with type 2 diabetes. Transl. Res. 156, 15-25 (2010).
- Shi, C., et al. Effects of ageing and Alzheimer's disease on mitochondrial function of human platelets. Exp. Gerontol. 43, 589-594 (2008).
- Avila, C., et al. Platelet mitochondrial dysfunction is evident in type 2 diabetes in association with modifications of mitochondrial anti-oxidant stress proteins. Exp. Clin. Endocrinol. Diabetes. 120, 248-251 (2012).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab. Invest. 93, 690-700 (2013).
- Hill, B. G., et al. Integration of cellular bioenergetics with mitochondrial quality control and autophagy. Biol. Chem. 393, 1485-1512 (2012).
- Hultqvist, M., et al. Enhanced autoimmunity, arthritis, and encephalomyelitis in mice with a reduced oxidative burst due to a mutation in the Ncf1 gene. Proc. Natl. Acad. Sci. U.S.A. 101, 12646-12651 (2004).
- Rosa-Borges, A., et al. Glucose-6-phosphate dehydrogenase deficiency with recurrent infections: case report. J. Ped. 77, 331-336 (2001).
- Walkowiak, B., Kesy, A., Michalec, L. Microplate reader--a convenient tool in studies of blood coagulation. Thromb. Res. 87, 95-103 (1997).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radic. Biol. Med. 51, 1621-1635 (2011).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J. Vis. Exp.. (46), e2511 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены