Method Article
Bioenergetica e il burst ossidativo: Protocolli per l'isolamento e la valutazione dei leucociti umani e piastrine
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Leucociti e piastrine può essere utilizzato come marcatore bioenergetico di salute generale di un individuo e quindi hanno il potenziale per controllare i processi patologici e l'impatto dei trattamenti. Qui si descrive un metodo per isolare e misurare la funzione mitocondriale e il burst ossidativo in queste cellule.
Abstract
Disfunzione mitocondriale è conosciuto per svolgere un ruolo significativo in un certo numero di condizioni patologiche come l'aterosclerosi, diabete, shock settico, e malattie neurodegenerative ma valutare cambiamenti nella funzione bioenergetica nei pazienti è impegnativo. Anche se le malattie come il diabete o aterosclerosi presente clinicamente con insufficienza organo specifico, i componenti sistemici della patologia, come iperglicemia o infiammazione, possono alterare la funzione bioenergetica nei leucociti o piastrine circolanti. Questo concetto è stato riconosciuto da tempo, ma la sua applicazione diffusa è stata vincolata dal gran numero di cellule primarie necessarie per l'analisi bioenergetica. Questa limitazione tecnica è stata superata combinando la specificità delle tecniche di isolamento del branello magnetici, tecniche di adesione cellulare, che consentono alle cellule da allegare senza attivazione per micropiastre, e la sensibilità di nuove tecnologie progettata per elevate velocità micrespirometria roplate. Un esempio di questa apparecchiatura è l'analizzatore di flusso extracellulare. Tale strumentazione utilizza tipicamente ossigeno e pH sonde sensibili per misurare i tassi di variazione di tali parametri in cellule aderenti, che possono poi essere riportate metabolismo. Qui ci dettaglio i metodi per l'isolamento e la placcatura dei monociti, linfociti, neutrofili e delle piastrine, senza attivazione, dal sangue umano e l'analisi della funzione mitocondriale bioenergetica in queste cellule. Inoltre, si dimostra come il burst ossidativo nei monociti e neutrofili può essere misurato stessi campioni. Dal momento che questi metodi utilizzano solo 8-20 ml di sangue umano hanno il potenziale per monitorare la generazione di specie reattive dell'ossigeno e bioenergetica in un ambiente clinico.
Introduzione
Monitoraggio della salute bioenergetica di cellule immunitarie (monociti, linfociti, neutrofili) e delle piastrine da sangue è stato riconosciuto da tempo come strumento diagnostico potenzialmente utile per valutare la salute bioenergetico generale di un individuo. C'è una emergente di letteratura attribuire una serie di malattie come il cancro, malattie cardiovascolari e malattie neurodegenerative a disfunzione mitocondriale 1,2. Questo è clinicamente importante poiché disfunzione mitocondriale può avviare una serie di eventi cellulari che promuovono vie di segnalazione pro-infiammatorie o portano alla morte cellulare. Diversi studi hanno caratterizzato funzione mitocondriale di cellule mononucleate del sangue periferico e piastrine in condizioni come fibromialgia, diabete, shock settico, e il morbo di Alzheimer 3-7. Ad esempio, un recente studio ha valutato bioenergetica di piastrine come marker per la funzione mitocondriale e trovato che le piastrine di tipo 2 Diabetpazienti ic avevano diminuito il consumo di ossigeno mitocondriale 7,8. Da questi risultati e altri, è chiaro che i monociti, linfociti, neutrofili e piastrine possono servire come marcatori surrogati dei cambiamenti nella bioenergetica in condizioni patologiche, poiché sondaggio la circolazione sistemica e possono riflettere cambiamenti metabolici locali e globali. Per determinare se questo approccio ha un metodo elevato throughput di analisi e è necessario un metodo coerente per la preparazione di cellule valore prognostico e diagnostico.
I metodi per misurare la funzione mitocondriale nei leucociti e piastrine hanno già coinvolto l'isolamento dei mitocondri o la valutazione di bioenergetica cellulare in cellule intatte 4,9. Il vantaggio di valutazione bioenergetica cellulare utilizzando un flusso extracellulare (XF) analizzatore è che la funzione mitocondriale nelle cellule può essere stabilita con substrati endogeni e parametri respiratori come perdita protonica e respiratoria massimacapacità può essere determinato. Noi e altri abbiamo utilizzato questa tecnologia per mostrare che i profili bioenergetici in piastrine, linfociti e monociti isolati da sangue umano possono essere stabiliti e confrontati tra i tipi di cellule 8. Inoltre, entrambi i neutrofili e monociti possiedono una capacità ossidativa scoppio in cui ossidasi NADPH vengono attivati e consumano ossigeno per formare superossido. È importante sottolineare che questo percorso è un componente chiave dell'immunità innata ed è modulata da infiammazione sistemica. Ad esempio, è stato dimostrato che i cambiamenti nella capacità burst ossidativo sono associati a varie malattie autoimmuni come la sclerosi multipla, l'artrite e infezioni ricorrenti 10,11. Attualmente non ci sono high throughput analisi quantitative disponibili per misurare il burst ossidativo in campioni clinici. Questo è importante in quanto caratterizza la capacità ossidativa scoppio di neutrofili e monociti può anche servire come un importante strumento diagnostico per vari patologici eseguitiGies.
Le sfide tecniche sono bassa sensibilità per la misura del consumo di ossigeno utilizzando tecniche convenzionali polarografiche e la necessità di utilizzare cellule attaccate quando si utilizzano tecniche di micropiastre fluorimetrica più sensibili. In questo video pratico, descriviamo la soluzione tecnica a questi problemi. Abbiamo dettagliatamente i metodi per l'isolamento, la placcatura e la misura di bioenergetica di monociti, linfociti, neutrofili e piastrine e il burst ossidativo dei monociti e neutrofili dal sangue umano. Questo metodo è adatto per la valutazione clinica della bioenergetica e burst ossidativo per gli investigatori che hanno accesso a una popolazione di pazienti e la capacità di ottenere campioni di sangue fresco.
Protocollo
Tutti i protocolli descritti in questo manoscritto per la raccolta del sangue, l'isolamento e l'analisi sono stati esaminati e approvati dal Comitato Istituzionale presso l'Università di Alabama a Birmingham.
1. Isolamento delle cellule (Modificato da Histopaque Sigma-Aldrich Protocollo n ° 1119 e il Miltenyi Biotec microbead positivo e protocolli selezione negativa)
- Sangue intero centrifuga (raccolto in ACD o EDTA) a 500 xg per 15 min in una centrifuga con rotore oscillante-benna (accelerazione = 5-6, e in frenatura).
- Rimuovere lo strato superiore che contiene il plasma ricco di piastrine (PRP) con una pipetta di trasferimento fino a 1 centimetro rimane al di sopra dello strato di cellule (eritrociti coat / buffy). Annullare la PRP a temperatura ambiente per una successiva elaborazione.
- Trasferire il buffy coat ad un tubo da 50 ml sterile, diluire a 24 ml con RPMI basale o almeno 4 volte l'avvio del volume buffy coat.
Nota: La metà superiore dello strato di RBC può have essere inclusi anche se questo comporta l'aumento del volume RPMI proporzionalmente. - Preparare il gradiente di densità utilizzando bassa densità Ficoll con una densità di 1.077 (1077) per lo strato superiore e alta densità Ficoll con una densità di 1.119 (1119) per lo strato inferiore in tre provette coniche da 15 ml (3 ml ciascuna). Per effettuare questa operazione, aggiungere prima 1077 ad ogni provetta. Usando una pipetta 5 ml stretta aggiungere 1119 al fondo della provetta posizionando la punta della pipetta sotto 1077 e rilasciare lentamente il reagente senza mescolare con il gradiente superiore. Un totale di 6 ml di media gradiente di densità dovrebbe essere presente in questa fase con una fase visibile di separazione al ml mark 3.
- Utilizzando un pipetta automatizzata, aggiungere 8 ml di sangue diluito (dal punto 1.3) delicatamente ogni provetta gradiente utilizzando l'impostazione a bassa potenza per evitare di disturbare gli strati gradiente. Il volume totale dovrebbe essere di 14 ml di questo passo.
- Tubi centrifugare a 700 xg per 30 minuti a temperatura ambiente (accelerarazione 6, senza freno).
Nota: In questa fase, tre bande cellulari distinti dovrebbero essere evidenti (Figura 1A). Le bande più in alto (tra il 1077 e il plasma) contiene cellule mononucleate (MNC) e piastrine, e la banda centrale (tra il 1007 e il 1119) contiene le cellule polimorfonucleati (PMN) e di fascia inferiore (sotto 1119) contiene globuli rossi. - Raccogliere il MNC e PMN separatamente utilizzando pipette di vetro sterili senza disturbare le altre bande cellulari. Unire la popolazione MNC da ciascuna provetta in un tubo da 50 ml sterile. Ripetere questa operazione per la popolazione PMN pure.
- Aggiungere 4 volumi di RPMI a ciascuna provetta contenente frazioni MNC e PMN rispettivamente per diluire il gradiente di densità.
- Tubi centrifugare a 700 xg per 10 min a temperatura ambiente.
- Pellet Risospendere MNC cellulare e pellet di cellule PMN in 1 RPMI ml contenente 0,5% ultra-puri grassi liberi, acidi BSA (RPMI-BSA) e trasferimento in sterili provette da 1,5 ml. Agglomerare le cellule utilizzando un picofuge da banco per 30sec.
- Eliminare il surnatante e risospendere ogni pellet cellulare in 80 ml RPMI-BSA.
- Aggiungere 20 ml di perlina magnetica anticorpo marcato-antiCD14 alla provetta contenente la frazione MNC per selezione positiva dei monociti. Per la provetta contenente la frazione di cellule PMN, aggiungere 20 ml di perlina magnetica anticorpo marcato-antiCD15 per selezione positiva dei neutrofili. Incubare ogni sospensione cellulare per 15 min a 4 ° C.
- Lavare ogni sospensione cellulare di 1 ml di mezzi RPMI-BSA e pellet come prima e risospendere ogni pellet in 500 ml RPMI-BSA.
- Le cellule marcate sono separati nel campo magnetico della cella attivata magnetico classificare (MACS) separatore. Preparare le colonne MACS LS (uno per ogni sospensione cellulare) posizionando la colonna sul separatore MACS e lavaggio con 3 ml di RPMI-BSA prima dell'aggiunta della sospensione cellulare.
- Dopo l'applicazione di sospensioni cellulari, lavare ogni colonna 3x con 3 ml di RPMI-BSA supporti (assicuratevi di lasciare che il Drai supporton completamente tra lavaggi). Raccogliere la sospensione cellulare flow-through e lavaggi di colonna in una provetta sterile.
- Per isolare monociti e neutrofili, rimuovere la colonna dal campo magnetico dopo il lavaggio finale ed eluire le cellule selezionate positivamente in una provetta sterile con 5 ml di RPMI-BSA utilizzando lo stantuffo colonna.
- Per isolare i linfociti pellet la frazione di flusso passante lavaggio delle MNC da passo 1,15 a 300 xg per 10 min. Eliminare il surnatante e risospendere il pellet cellulare in 80 ml RPMI-BSA. Aggiungere 20 ml di anticorpi CD61 e CD235a e incubare sospensione cellulare per 15 min a 4 ° C. Ripetere la separazione MACS come prima e raccogliere il flusso pur contenendo i linfociti.
- Per pellet monociti, neutrofili e linfociti frazioni, centrifuga come prima (fase 1.9) ed eliminare surnatanti. Pellet cellulari dovrebbero essere risospese in 1 ml extracellulari flusso multimediale (XF-DMEM) per il conteggio.
Nota: 8 ml di sangue intero devono comportare 1-5 x 10 6 monociti / ml, e 5-20 x 10 6 linfociti e neutrofili / ml. - Per isolare le piastrine, centrifuga PRP (passo 1.2) per 8-10 min a 1500 xg a temperatura ambiente. Rimuovere il plasma e lavare pellet cellulare una volta con 5 ml di PBS sterile integrata con 1 mg / ml PGI 2, repellet e sospendere pellet finale in 1 ml di PBS-IGP tampone 2.
- Determinare conta piastrinica mediante turbidimetria una volta che le piastrine sono sospese in PBS-IGP tampone 2 da spettrofotometro come descritto da Walkowiak et al utilizzando la seguente equazione: [6.23 / (2.016 - Abs 800)] - 3.09 x fattore di diluizione = # x 10 8. piastrine / ml 12.
2. Placcatura delle Cellule
- Preparazione del Cell-Tak (adesivo cellulare): Aggiungere adesivo cella 90 ml a 180 ml diH 2 0, 540 ml di 0,1 N bi sodiocarbonato (pH 8,0), e aggiustare il pH a 7,2-7,8 usando 1 N NaOH. Preparare piatti XF (24-bene, V7 micropiastre) rivestendo ciascun bene con 30 ml di adesivo cellulare preparati.
Nota: L'adesivo cella deve essere preparato fresco per ogni uso. - Incubare la piastra a 37 ° C per 20-30 minuti poi adesivo cellulare aspirare e lavare i pozzetti con PBS due volte (1 ml / pozzetto).
- Eseguire una conta cellulare su monociti isolati, linfociti, neutrofili e piastrine e portare a volume appropriato utilizzando XF-DMEM per consentire una densità di semina di 250k cellule / pozzetto per i monociti, linfociti e neutrofili, e 25 x 10 6 / pozzetto per piastrine. In alternativa, per misurare ossidativo risposta scoppio, neutrofili possono essere seminati a 125k cellule / pozzetto. Il volume finale di semina per ogni sospensione cellulare dovrebbe essere 200 pl / pozzetto.
- Centrifugare la piastra a 200 xg per 1 sec senza freno. Ruotare la piastra di 180 ˚ e centrifugare di nuovo senza freni a 300 x g.
- Portare finale ben volume a 660 ml con XF-DMEM e incubare a 37 ° C per 30 minuti prima del dosaggio XF. Nota: microfotografie di cellule piastrate prima e dopo il test può essere utilizzato per assicurare un'adeguata placcatura e di escludere il distacco delle cellule.
3. Preparazione di un 24-ben extracellulare Flux Assay Piastra (XF24)
- Idratare XF sonda con la soluzione calibrante per un minimo di 2 ore prima del test.
- Preparare 10x scorte di 0,5 mg / ml oligomicina, 0,6 micron FCCP, e 10 micron antimicina A in XF-DMEM e carico di 75 ml di soluzione madre in fori di iniezione cartuccia nell'ordine di cui sopra. Se le misurazioni burst ossidativo si vogliono ottenere, iniezione di stock 10x di 100 ng / ml PMA può essere iniettato dopo antimicina-A.
- Calibrare la cartuccia idratata e caricato ed eseguire il saggio XF. I metodi dettagliati di analisi e l'interpretazione di entrambi consumo di ossigeno e pH cambiamenti sono stati descritti in precedenti pubblicazioni 9,13,14 e non sono discussed in dettaglio qui.
- Dopo il test XF, aspirare tutti, ma gli ultimi 50 ml di XF-DMEM dopo dosaggio per prevenire la perdita di cellule dal piatto e aggiungere 50 microlitri RIPA buffer di lisi cellulare ed eseguire un dosaggio di proteine per la normalizzazione.
Risultati
Al fine di valutare le bioenergetica di cellule del sangue, sangue intero viene raccolto da soggetti umani mediante prelievo venoso in una provetta di raccolta vacutainer EDTA o ACD. L'isolamento di leucociti e piastrine seguenti raccolta del sangue è visualizzato in Figura 1A come descritto nel protocollo. Campioni di sangue intero sono trattati entro 8 ore di raccolta per evitare la morte cellulare e l'attivazione. I tempi di conservazione prolungati superiori a 8 ore non sono stati testati, ma possono provocare bioenergetica alterati e di essere meno rappresentativo delle condizioni fisiologiche. Tubi acido citrato destrosio (ACD-8 ml) e EDTA vacutainer sono stati utilizzati per isolamenti cellulari senza effetti osservati sulla funzione bioenergetica di cellule isolate. Gli anticoagulanti sono necessari in quanto la formazione di coaguli di ridurre il numero di cellule ottenute, interferiscono con la formazione di fase adeguato durante Ficoll centrifugazione in gradiente, e producono poco o nessun piastrine ottenuti nel siero centrifugato. Tutto il sangue rappresenta un biologPericolo iCal e un equipaggiamento di protezione personale devono essere attuate durante tutta la procedura, anche dopo popolazioni cellulari sono isolati o lisati cellulari vengono generati. I campioni devono essere smaltiti in conformità con le norme di smaltimento dei rifiuti umani dell'istituzione.
Il sangue intero viene centrifugata per separare il plasma ricco di piastrine da buffy coat, lo strato bianco appena sopra i globuli rossi concentrati che contiene i leucociti. Il cappotto buffy viene applicato a gradienti di densità e centrifugato per ottenere le cellule mononucleari del sangue periferico (linfociti e monociti) e cellule polimorfonucleati (granulociti). Contaminazione RBC delle singole fasi di cellule MNC e PMN è comune in questa fase e dovrebbe essere risolto durante la purificazione MACS. I vari tipi di cellule vengono quindi ottenuti mediante incubazione con anticorpi magnetici per ottenere frazioni pure. I monociti sono raccolti mediante incubazione della frazione PBMC con CD14, il flusso continuo da tegli monociti contengono linfociti, che vengono poi esauriti di globuli rossi e piastrine. I neutrofili sono ottenuti mediante incubazione dello strato di cellule polimorfonucleati con anticorpo CD15 (Figura 1A). Successivamente, le piastrine possono essere pellet per centrifugazione del plasma ricco di piastrine e lavati per rimuovere altri componenti del plasma. Dopo queste selezioni le piastrine, monociti CD14 +, linfociti, neutrofili CD15 + possono essere contati e placcato su un piatto XF analizzatore medio rivestita di adesione delle cellule per l'analisi bioenergetica e burst ossidativo.
Ogni fase della procedura deve essere eseguita in condizioni sterili e viene incoraggiato a impedire l'attivazione precoce della risposta burst ossidativo nei monociti e neutrofili. Un indicatore di meno di condizioni di sterilità durante l'isolamento è evidente quando i neutrofili, che hanno poco o nessun consumo di ossigeno in condizioni basali, iniziano il saggio di flusso extracellulare con elevate misure OCR chegradualmente aumentare o diminuire durante tutta la seduta. Sottolineiamo l'importanza di imaging di cellule mediante microscopia ottica a 200X o superiore per garantire che non segni morfologici di attivazione si sono verificati prima del test. Ad esempio, i neutrofili normalmente mostrano una rotonda a forma irregolare, con bordi delle celle marcate come si vede in Figura 1B. Tuttavia, queste cellule si appiattiscono contro la superficie della piastra quando attivato e perdono la loro morfologia cellulare distinta. Abbiamo già segnalato le variazioni morfologiche di leucociti e piastrine attivate utilizzando questo protocollo e devono essere adottate misure supplementari per garantire condizioni di sterilità se incontrando l'attivazione 8.
Uno schema semplificato del protocollo è visto in figura 2 come una tabella di tempo in cui i passi principali del isolamento cellulare, XF piastra preparazione e dosaggio XF sono dettagliate. Isolamento consiste nella separazione gradiente di densità di tipi di cellule eè seguita da separazione magnetica. Parallelamente al processo di isolamento delle cellule, XF piastra preparazione è necessaria per evitare ritardi nella placcatura cella o di iniziare il saggio XF. Questo è fondamentale perché notevoli ritardi possono causare l'attivazione delle cellule e dei parametri bioenergetici diminuita.
Le concentrazioni di cellule inadeguata dopo l'isolamento sono un problema comune e l'ottimizzazione di ogni processo di centrifugazione è necessaria per evitare la perdita di cellule. Isolamenti successo sono stati effettuati su un minimo di 6 ml di sangue ma alterazioni possono essere fatte a seconda delle concentrazioni del tipo cellulare desiderato circolante. Se il gradiente di densità non è correttamente preparata, fasi cellulari distinti potrebbero non essere visibili e la perdita di cellule possono verificarsi (cfr. JoVE video didattico per una dimostrazione visiva). Piastrine insufficiente isolato dal PRP è rara, ma si è verificato se il tampone di lavaggio non contiene IGP 2 o se l'isolamento avviene sotto della temperatura ambiente. Il rischio di una piastrinactivation è spesso evitato se le piastrine sono le ultime celle da isolate, tuttavia, se le piastrine rimangono in tampone di lavaggio per lunghi periodi saranno interessati i bioenergetica. Ci sono stati casi di popolazioni piastrine più piccole che non pellet durante la centrifugazione 1.500 xg e bioenergetica di queste cellule non è stato ampiamente caratterizzato. Vedi Tabella 2 per una guida più completa risoluzione dei problemi.
I profili bioenergetiche di leucociti e piastrine possono essere determinate utilizzando l'analizzatore XF, che misura in tempo reale consumo di O 2 in cellule non invasivo. Ogni tipo cellulare è placcato sulla piastra XF24 con cinque repliche come mostrato nella Figura 3A. Tabella 1 indica la attesi basali e burst ossidativo valori di tipo cellulare durante il test e determinare le concentrazioni di proteine per bene. Throughput elevati sono disponibili, come il XF96, che consentequattro donatori da valutare contemporaneamente come mostrato in Figura 3B. Dopo il test, i dati vengono esportati in un computer stazione di lavoro per l'analisi utilizzando il software XF appropriato e Microsoft Excel. I valori OCR sono stati normalizzati per proteine totali nei rispettivi pozzetti ed espressi in pmol / min / mg di proteina. I profili rappresentativi bioenergetici-burst ossidativo di ogni tipo di cellula sono stati recentemente segnalati dal nostro gruppo 8. Ulteriori analisi dei parametri bioenergetiche del saggio (basale, ATP-linked, perdita protonica, massima, nonmitochondrial e burst ossidativo) può essere calcolato per i singoli pozzetti come precedentemente illustrato e descritto di seguito 8.
Il tasso di consumo di ossigeno basale (OCR) è determinata con i primi 3 misurazioni come mostrato in Figura 4A. Oligomicina (0,5 mcg / ml), un inibitore di mitocondriale ATP sintasi è iniettata nel mezzo XF per stimare l'OCR accoppiato alla sintesi di ATP e rappre ted come ATP-linked. L'OCR residuo meno il OCR nonmitochondrial può essere attribuito a perdita protonica. Poi viene aggiunto FCCP un disaccoppiatore per determinare la massima OCR, seguita da antimicina-A, un inibitore della respirazione mitocondriale, per determinare nonmitochondrial fonti di consumo di ossigeno. Capacità di riserva è una misura della quantità di ATP che può essere prodotto sotto fabbisogno energetico e può essere calcolato come la differenza tra il tasso massimo di respirazione e basale. Per determinare la capacità burst ossidativo, forbolo 12-miristato 13-acetato (PMA) un agonista PKC viene iniettato per aumentare l'attività NADPH ossidasi, e l'aumento del tasso di consumo di ossigeno dopo stimolazione PMA può essere misurata con l'analizzatore XF. Figura 4B mostra come calcolare i diversi parametri della funzione mitocondriale e burst ossidativo.
1301/51301fig1highres.jpg "src =" / files/ftp_upload/51301/51301fig1.jpg "/>
Figura 1. Isolamento di leucociti e piastrine da sangue intero. A) campioni appena prelevati sono separati nel loro plasma e componenti cellulari mediante centrifugazione e purificati mediante gradiente di densità Ficoll e magnetico cellulare Attivato discendente (MACS) da positivo (monociti e neutrofili) o selezione negativa (linfociti), mentre le piastrine sono isolati da alta velocità di centrifugazione del plasma ricco di piastrine. B) immagini delle popolazioni cellulari isolate una volta risospese in DMEM XF e placcati con densità di cella indicata. Cliccate qui per vedere una versione più grande di questa figura.
ghres.jpg "src =" / files/ftp_upload/51301/51301fig2.jpg "/>
Figura 2. Preparazione delle lastre XF24 per Studi bioenergetica di leucociti e piastrine. Calendario dettagliato per la preparazione di una piastra di saggio XF24 da isolamento cellulare e placcatura e cartuccia idratazione e iniezione orificio di caricamento.
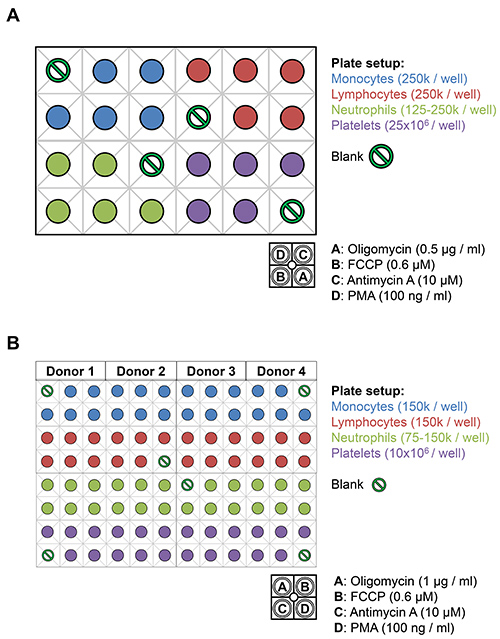
Figura 3. Disposizione dei leucociti e piastrine in XF24 e XF96 piatti dell'analizzatore. A) leucociti (cellule 125-250k / pozzetto) e piastrine (25 x 10 6 cellule / pozzetto) a partire da un singolo donatore vengono placcato sulla piastra di saggio XF24 tra sfondo controlli. 75 pl di 10x scorte di oligomicina (0,5 mcg / ml), FCCP (0,6 mM), antimicina-A (10 mM) e PMA (100 ng / ml) diluito in XF supporti siano caricatiai fori di iniezione indicati. B) leucociti (cellule 75-150k / pozzetto) e piastrine (10 x10 6 cellule / pozzetto) da ben quattro donatori può essere placcato sulla XF96 in un volume totale di 180 microlitri DMEM-XF. 20 pl di 10x scorte di oligomicina (1,0 mcg / ml), FCCP (0,6 mM), antimicina-A (10 mM), e PMA (100 ng / ml) diluito in XF-DMEM sono caricate nei fori di iniezione indicati.
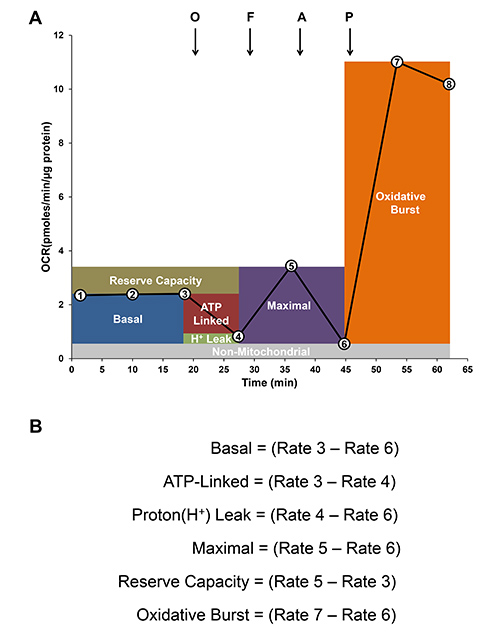
Figura 4. Analisi degli indici di bioenergetica. A) traccia Rappresentante di ossigeno tasso di consumo (OCR) dai mitocondri e burst ossidativo nei monociti. Basale OCR è stabilito (primi 3 aliquote indicate dai numeri nei cerchi). Poi aggiunte sequenziali di oligomicina (O, 0,5 mg / ml), FCCP (F; 0,6 micron) e antimycin-A (A; 10 mM) sono iniettati per determinare respirazione mitocondriale e nonmitochondrial di cellule non attivato. Infine, PMA (100 ng / ml) è aggiunto per misurare burst ossidativo. B) Analisi modulare di funzione mitocondriale e burst ossidativo sono calcolati dalle differenze nelle percentuali indicate.
| Ottimale Semina Densità | Avg. Basal OCR (O 2 pmol / min) | Avg. Ossidativo Burst OCR (pmol O 2 / min) | Avg. proteine (mg) / pozzetto | |
| I monociti | 250k cellule / pozzetto | 83,9 (± 13,0) | 300,3 (± 58.8) | 19.0 (± 2.4) |
| neutrofili | 250k cellule / pozzetto | 6.1 (± 2.2) | 1.411,8 (± 233,3) | 20.6 (± 2.7) |
| Linfociti | 250k cellule / pozzetto | 52,9 (± 7.7) | 15 (± 4.1) | 13.2 (± 2.1) |
| Piastrine | 25 x 10 6 cellule / pozzetto | 199,4 (± 20.3) | 24 (± 2.7) | 47,5 (± 3.1) |
Tabella 1. Normali parametri per il saggio XF24: Il basali media (Rate 3) e burst ossidativo (Voto 7) OCR non corretta a OCR nonmitochondrial o proteine sono indicati per tipo di cellule placcato le densità cellulari indicati. Il contenuto proteico medio per pozzetto è mostrato interpretato da un saggio DC Lowry. Questi dati rappresentano i valori medi dei6-8 donatori sani con parentesi contenente ± SEM.
| Passo | Problema | Possibile ragione | Soluzione |
| 1.2 | chiaro plasma | piastrine pellet durante la centrifugazione | diminuire il tempo di centrifugazione per 10 min o lento a 400 xg |
| plasma lattiginoso | lipidi in eccesso | evitare la raccolta post-prandiale | |
| 1.6 | bande cellulari incomplete formate | follettoRoper preparazione pendenza, reattivo freddo | evitare di interrompere gradiente durante il pipettaggio, uso sala reagente temperatura |
| grumi nelle bande cellulari | coagulazione del sangue potrebbe essersi verificato | Raccogliere il sangue con anticoagulanti come ACD o EDTA | |
| 1.10 | no pellet cellulare | vedere il punto 1.6 | Se nebuloso surnatante vedi sotto |
| surnatante nebuloso | Contaminazione gradiente Ficoll pesante, la contaminazione delle piastrine | Aumentare la velocità di centrifugazione a 900 xg, diliuto con più RPMI | |
| 1.16, 1.17 | bassa resa dei leucociti | contaminazione pesante RBC, non abbastanza sangue intero, coagulazione | Volumi a doppia anticorpi e RPMI-BSA, raccogliere più sangue, aggiungere anticoagulante |
| 1.19 | aggregazione piastrinica | PGI 2 omesso, esposizione ai media freddo, conservazione prolungata nel plasma | aggiungere PGI 2 a tampone di lavaggio delle piastrine, reagenti temperatura uso camera |
| 1.20 | bassa conta piastrinica | perdite durante la centrifugazione primaria, l'aggregazione piastrinica | Vederepassi 1.2 e 1.19 |
| 2.3 | Contaminazione RBC | Ripetere la separazione MACS |
Tabella 2. Leucociti e piastrine isolamento risoluzione dei problemi. La tabella elenca i problemi più comuni riscontrati durante leucociti e delle piastrine isolamento delle cellule da sangue e soluzioni che possono guidare gli utenti attraverso il processo di risoluzione dei problemi insieme.
Discussione
Questo protocollo rappresenta la compilazione di varie tecniche comunemente utilizzate per l'isolamento delle cellule del sangue in modo adeguato per l'analisi bioenergetica. Le tecniche presentate contigui sono vantaggiose per altri metodi di isolamento (cioè analisi FACS) per la loro capacità di isolare gran numero di cellule in condizioni controllate di media con sollecitazioni minime poste sulle cellule isolate. Ha lo svantaggio di isolamenti lunghi anche con interruzioni minime. Questo protocollo serve come base per l'isolamento di cellule del sangue primari da soggetti umani, che possono essere estrapolate in ambito clinico e ricerca traslazionale.
Separazione MACS è una tecnica di isolamento cellulare affidabile che offre la possibilità di isolare cellule direttamente dal sangue intero, tuttavia, questo metodo richiede una maggiore quantità di anticorpo e non è ottimale per l'isolamento di tutti e quattro i tipi cellulari distinti come descritto in questo metodo. Ci deve bEEN alcuna prova per dimostrare che la selezione positiva dei leucociti da MACS separazione è il risultato di attivazione utilizzando il nostro protocollo di isolamento. Colonne MACS funzione sequestro di cellule marcate in un campo magnetico utilizzando anticorpi coniugati a 50 particelle superparamagnetiche nm. Cellule marcate vengono poi eluiti largo della colonna. Selezioni positivi e negativi sono implementate in questo protocollo per garantire l'isolamento rapido e purezza. Se il numero di cellule inadeguati sono ottenuti dall'isolamento o purezza è in questione, più anticorpi possono essere aggiunti al campione secondo le istruzioni del fornitore e secondo passaggio attraverso la colonna LS può provocare una maggiore purezza (Tabella 2). Il nostro laboratorio pensa elevata purezza ed efficienza placcatura utilizzando il protocollo esistente analizzando sospensioni cellulari finali mediante analisi FACS 8.
Analizzatori di flusso extracellulari hanno la possibilità di monitorare sia il consumo di ossigeno e mezzi di acidificazione in tempo reale su quello di oti suoi elettrodi. Il consumo di ossigeno come osservato dalla risposta burst ossidativo nei monociti e neutrofili è NADPH ossidasi dipendente, come dimostrato da inibizione DPI 8. Abbiamo visto una perdita di tempo dipendente dalla capacità burst ossidativo con isolamenti prolungati o dosaggi XF estesi. Questo protocollo è stato progettato e sviluppato per l'uso sul XF24 ma è anche compatibile con il XF96 a circa un terzo alla metà della cella XF24 semina densità (Figura 3).
Nella progettazione di questo protocollo, l'aderenza ai protocolli esistenti per ogni tecnica è stato richiesto per prestazioni ottimali con le modifiche apportate unicamente a controllare le condizioni di media per l'analisi bioenergetica. Dopo tecniche di masterizzazione, un tale protocollo può essere utilizzato in una vasta gamma di applicazioni traslazionale e per misurare la tossicità o l'efficacia di strategie di trattamento, esplorare caratteristiche metaboliche della malattia, e la produzione ossidante da monociti e neutrophils in condizioni infiammatorie.
Divulgazioni
VDU è un membro della Seahorse Bioscience Scientific Advisory Board.
Riconoscimenti
Gli autori desiderano ringraziare per il contributo tecnico di Gloria A Benavides. Questo lavoro è stato sostenuto da American Heart Association 13PRE16390001 (SR), NIH T32HL07918 (PAK), NIH T32HL007457 (TM), P30DK056336 (BKC), Complicazioni NIDDK diabetici Consortium (DiaComp, www.diacomp.org) DK076169 concessione (subaward VDU), e il P30 DK079337 O'Brien Center (VDU).
Materiali
| Name | Company | Catalog Number | Comments |
| QuadroMACS Starting Kit includes QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-094-833 | |
| CD235a (Glycophorin A) MicroBeads, human | Miltenyi Biotec | 130-050-501 | |
| CD61 MicroBeads, human for platelets | Miltenyi Biotec | 130-051-101 | |
| CD14 MicroBeads, human for monocytes | Miltenyi Biotec | 130-050-201 | |
| CD15 MicroBeads, human for granulocytes | Miltenyi Biotec | 130-046-601 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | |
| BD Vacutainer ACD Blood collection tubes | Fisher | 02-684-26 | |
| RPMI 1640 | Gibco | 11835-030 | with L-glutamine and without phenol red |
| Prostaglandin I2, sodium salt | Cayman | 18220 | |
| 1.5 ml semi-micro cuvettes | Phenix Research Products | SC-2410 | |
| Histopaque density gradient, specific gravity 1.077 | Sigma | 10771 | |
| Histopaque density gradient, specific gravity 1.119 | Sigma | 11191 | |
| Bovine Serum Albumin Fraction V | Roche | 3117405001 | fatty-acid ultra-free |
| Phorbol 12-myristate 13-acetate | Sigma | P8139 | |
| XF24 FluxPak | Seahorse Biosciences | 100850-001 | |
| DMEM | Fisher | MT90113PB | w/o Glucose, L-Glutamine, Pyruvate, Phenol Red, and Bicarbonate |
| L-Glutamine, 200 mM (100x) | Invitrogen | 25030-081 | |
| D-Glucose | Sigma | G7528 | |
| Sodium Pyruvate | Sigma | P8574 | |
| Cell-Tak (cell adhesive) | BD Biosciences | CB-40242 | |
| Oligomycin | Sigma | O4876 | |
| Antimycin A | Sigma | A8674 | |
| (FCCP) Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma | C-2920 | |
| DC Protein Assay Reagent A | Bio-Rad | 500-0113 | |
| DC Protein Assay Reagent S | Bio-Rad | 500-0015 | |
| DC Protein Assay Reagent B | Bio-Rad | 500-0114 | |
| Seahorse | Seahorse Biosciences | ||
| QuadroMACS Separator and MACS MultiStand | Miltenyi Biotec | 130-090-976 and 24039 | |
| Spectrophotometer |
Riferimenti
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int. J. Alzheimer's Dis. 2009, (2009).
- Jin, S. Autophagy, mitochondrial quality control, and oncogenesis. Autophagy. 2, 80-84 (2006).
- Cordero, M. D., et al. Mitochondrial dysfunction and mitophagy activation in blood mononuclear cells of fibromyalgia patients: implications in the pathogenesis of the disease. Arthritis Res. Ther. 12, R17 (2010).
- Japiassu, A. M., et al. Bioenergetic failure of human peripheral blood monocytes in patients with septic shock is mediated by reduced F1Fo adenosine-5'-triphosphate synthase activity. Crit. Med. 39, 1056-1063 (2011).
- Widlansky, M. E., et al. Altered mitochondrial membrane potential, mass, and morphology in the mononuclear cells of humans with type 2 diabetes. Transl. Res. 156, 15-25 (2010).
- Shi, C., et al. Effects of ageing and Alzheimer's disease on mitochondrial function of human platelets. Exp. Gerontol. 43, 589-594 (2008).
- Avila, C., et al. Platelet mitochondrial dysfunction is evident in type 2 diabetes in association with modifications of mitochondrial anti-oxidant stress proteins. Exp. Clin. Endocrinol. Diabetes. 120, 248-251 (2012).
- Chacko, B. K., et al. Methods for defining distinct bioenergetic profiles in platelets, lymphocytes, monocytes, and neutrophils, and the oxidative burst from human blood. Lab. Invest. 93, 690-700 (2013).
- Hill, B. G., et al. Integration of cellular bioenergetics with mitochondrial quality control and autophagy. Biol. Chem. 393, 1485-1512 (2012).
- Hultqvist, M., et al. Enhanced autoimmunity, arthritis, and encephalomyelitis in mice with a reduced oxidative burst due to a mutation in the Ncf1 gene. Proc. Natl. Acad. Sci. U.S.A. 101, 12646-12651 (2004).
- Rosa-Borges, A., et al. Glucose-6-phosphate dehydrogenase deficiency with recurrent infections: case report. J. Ped. 77, 331-336 (2001).
- Walkowiak, B., Kesy, A., Michalec, L. Microplate reader--a convenient tool in studies of blood coagulation. Thromb. Res. 87, 95-103 (1997).
- Dranka, B. P., et al. Assessing bioenergetic function in response to oxidative stress by metabolic profiling. Free Radic. Biol. Med. 51, 1621-1635 (2011).
- Nicholls, D. G., et al. Bioenergetic profile experiment using C2C12 myoblast cells. J. Vis. Exp.. (46), e2511 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon