Method Article
RNA及びDNA抽出の両方のためのホルマリン固定パラフィン包埋組織コアの調製
要約
この修正された抽出プロトコルは、組織病理学的組織ブロックへの関心をより正確に対象地域からのRNAとDNA収量を向上させます。
要約
Formalin-fixed paraffin embedded tissue (FFPET) represents a valuable, well-annotated substrate for molecular investigations. The utility of FFPET in molecular analysis is complicated both by heterogeneous tissue composition and low yields when extracting nucleic acids. A literature search revealed a paucity of protocols addressing these issues, and none that showed a validated method for simultaneous extraction of RNA and DNA from regions of interest in FFPET. This method addresses both issues. Tissue specificity was achieved by mapping cancer areas of interest on microscope slides and transferring annotations onto FFPET blocks. Tissue cores were harvested from areas of interest using 0.6 mm microarray punches. Nucleic acid extraction was performed using a commercial FFPET extraction system, with modifications to homogenization, deparaffinization, and Proteinase K digestion steps to improve tissue digestion and increase nucleic acid yields. The modified protocol yields sufficient quantity and quality of nucleic acids for use in a number of downstream analyses, including a multi-analyte gene expression platform, as well as reverse transcriptase coupled real time PCR analysis of mRNA expression, and methylation-specific PCR (MSP) analysis of DNA methylation.
概要
ゲノムバイオマーカー研究は、正確かつ確実に病気の状態を反映しており、臨床的に有用な方法で行ってください。1バイオマーカーの開発は、よく注釈付き組織サンプルのレトロスペクティブ分析に依存している分子の相関を識別することを目指しています。患部と正常組織サンプルは、特殊なバイオバンクや臨床アーカイブ内のホルマリン固定パラフィン包埋組織(FFPET)ブロックなどのいずれかのような新鮮凍結組織保存されます。新鮮凍結組織は、高品質の核酸の抽出を可能にし、広くゲノムバイオマーカー探索研究に使用されています。2,3しかしながら 、少数の組織サンプルは、バイオバンクで利用可能であり、そのような組織を研究することは、より大きなサンプルの偏りを導入し、異例のカテゴリー銀行の組織へのより大きな能力を持つ専門施設で見られる疾患であり、患者の4は FFPET、対照的に、罹患したヒトおよび動物の組織のデフォルトの保存方法です。 FFPETブロックは、セルラーメートルを維持しながら、orphology、固定プロセスの核酸への相互リンクを他の細胞成分。架橋されたRNAとDNAが回収可能であるが、唯一劣化し、非常に断片化された形で。5,6しかしながら、これらのDNAとRNA断片は、mRNA発現、DNAの過剰メチル化、および標的とシーケンシングを含むアッセイの拡大配列によって分析に適しています。 7,8が大量や研究のために利用可能なFFPETの様々なこの機会を利用するために、効率的で信頼性の高い抽出プロトコルが必要とされています。
組織におけるバイオマーカー研究の大部分は、がんに焦点を当てています。病変組織の他のタイプと同様に、癌組織は、多くの場合、細胞保存および細胞型において重要な地域の不均一性を示しています。バイオマーカー研究は、分子の機能と病変組織の成分を相関させる能力に依存しているので、このプロセスの重要なステップは、よく日間保存され、濃縮されている組織の正確な収穫です研究中のisease。 FFPETでは、2濃縮技術がしばしば利用されている:レーザーキャプチャーマイクロダイセクション(LCM)、およびミクロトーム切片。 LCMは、高度に集束された組織の採取を可能にし、不均質な組織において特異的、よく保存された細胞型を単離するために使用することができる。9,10が、LCMは、高価な装置を必要とし、法外に時間多数の試料のためのかかります。ミクロトーム切片が薄い部分がFFPETブロックから切断され、より広く使用されるプロセスである。11,12ミクロトームカットのセクションでは、多くの場合、細胞の保存における不均一である組織を含む( 例えば 、壊死性対よく保存)および組成物( 例えば 、癌良性の実質対)、したがって、最高の別途調査した分子機能の均質化につながる可能性があります。このように、関心対象の細胞について濃縮するハイスループット方法が必要です。第三の方法、FFPETコアからの核酸の単離は、この富化を提供する高througするのに適していますhputプロトコル、別個の組織コアからRNAまたはDNAを単離するために他のユーザーによって使用されている。7,13,14
公開されたプロトコルの数はFFPET( 表1)から核酸を抽出する方法を指定します。しかし、RNAとDNAが同じ組織から抽出されたプロトコルはなく、組織コアのための、ミクロトーム組織切片用に最適化されている。組織特異性を向上させます15,16同様に、公開されたプロトコルを、いずれかの組織コアまたはスライドmicrodissectionsを通じて、手続きを指定しますRNA、DNAの抽出のためにではなく、ここで7,17、同じ組織コアからのDNAとRNAの両方の二重の抽出のための最適化されたプロトコルが実証されています。組織コアはFFPETブロックにマッピングされた関心領域に組織マイクロアレイ(TMA)のパンチを挿入することによって収穫されます。マッピングは、マーカーペンで顕微鏡スライドに注釈を付けると、対応するFFPEの表面に注釈を転送することによって行われますTブロック( 図1)。
このプロトコルの開発につながった従来の研究は、いくつかの市販の核酸抽出システムの比較が含まれていました。この比較では、商業的なプロトコルへの改変は、以下に説明するように、最も高いDNAおよびRNA収量と品質(Selvarajah ら 、 準備中)を得ました 。組織コアは、典型的にはFFPET抽出プロトコール11,12,14,18に使用される5-10ミクロンのミクロン切片よりも厚い- 20、及びパラフィンの複数の可変量を含有することができます。これを補償するために、脱パラフィンをキシレンおよびエタノール処理を繰り返すことにより、電動式均質化工程( 図1)を導入することによって増強されました。また、プロテイナーゼK消化時間は、DNAの収量を増加させるために延長しました。全体的に、このプロトコルは、費用対効果であり、ラにおける疾患の分子的および組織病理学的特徴の間の結合の確立を可能にしますRGE、よく特徴付け集団。その全体のプロトコルは、特殊または高価な機器をほとんど必要とせハンズオン時間の3時間、を含む、2日以内に確実に行うことができます。
ステップバイステップのプロトコルは、製造業者のプロトコルの修正版として、以下である。21特定の試薬 、機器、および製造業者のためのマテリアル/機器の表を参照してください。
プロトコル
1.組織コアリング
- 顕微鏡スライドを確認し、細かい点恒久的なマーカーを使用して、関心のある領域(複数可)を概説します。顕微鏡スライド上の関心領域をカバーするのに十分な大きさのパラフィン膜の断面を切り取ります。しっかりとスライド上に膜を置き、滑りからフィルムを維持するために、エッジの上にフィルムを包みます。しかし、外の - - 地域(複数可)、ファインポイントパーマネントマーカーを使用して、アウトライン感動を保ち、全体の組織および組織内の関心領域(複数可)を概説します。
- 膜を除去し、対応する組織ブロックに転送します。向きを反転または回転させることにより、フィルム全体の組織の輪郭は、ブロック内の組織( 図1)の観測された形状と一致するように。滑りを防止するために、しっかりとブロックの表面に膜の断面を押します。
- 油性マーカーの先端を使用して、中の領域の輪郭(複数可)に沿って浅いが、目に見える(〜0.2ミリメートル)くぼみを作りますterest、その後、膜を除去。ロード別々1.5または2.0 mlマイクロチューブに漂白剤、70%エタノール、および水の1ミリリットル。
- 先端が漂白剤を含むチューブに浸漬されながら上下に数回パンチをスライドさせることによって設定0.6ミリメートルパンチからパンチ受容体(赤)を清掃してください。 70%エタノール、次いで水(重要な漂白剤が除去されることを確実にするために)で、上記のステップを繰り返します。
- 3ミリメートルの深さに関心のある領域の内側に、組織の中にパンチを押すとパンチを撤回。スタイラスでパンチからそれを押すことによって、1.5または2ミリリットルチューブを結合低にコアをリリース。 -20℃(長期)または短期の使用のために4℃でコアを保管してください。
- 1.4に進み、次の領域またはサンプルを続行するに応じてパンチを清掃してください。
2.脱パラフィンFFPE組織コア
- 組織コアに1ミリリットルのキシレンを添加し、10秒間激しくボルテックス1.5または2ミリリットルチューブ内のキャリーアウト脱パラフィン化。ょん50℃で3分間トン。
- 室温(RT)と氷上で5分間、最大速度(21130 XG)と場所の管で2分間遠心分離し(ワックス状残留物が上に固化することができます)。
- 慎重にピペットチップを用いて上清を向けたメニスカスの周りに蓄積されたパラフィンを除去し、(2.1~2.2ステップ)キシレン治療を繰り返します。
- 1mlのエタノール(100%)を加え、10秒間激しくボルテックス。 RT(最大速度)で2分間遠心し、エタノールを注意深く廃棄します。一度上記の手順を繰り返します。
脱パラフィンコアの3均質化
- 均質化の前にエタノール(100%)700μlの中のコアを再懸濁します。電動式の組織ホモジナイザーを用いて、微細な組織粒子にコアを挽く(〜中程度の設定で1分間)。キャリーオーバー汚染を最小限にするために、各試料の間にホモジナイザープローブを清掃してください。
- 漂白剤の〜10ミリリットル、RNアーゼ中和液、70%エタノールで15ミリリットルチューブを埋めます。サンプルホモ後genizationは、上記の順に洗浄溶液のそれぞれにホモジナイザープローブを洗浄します。洗浄段階中に最高速度でホモジナイザーを実行します。
- 組織を有するプローブを拭きし、プローブは次のサンプルを均質化する前に完全に乾燥させます。視覚残留組織片のためのプローブのブレードを検査します。見つかった場合は、再度プローブを清掃してください。洗浄溶液(漂白剤、エタノール、およびRNase中和溶液)を、毎日変化します。
- 均質化に続いて、多くの100%エタノール(〜300μl)を添加することによって1mlに試料容量をもたらします。 15分間最大速度で遠心分離し、慎重にRNA抽出に進む前に約15-20分間エタノールと空気の乾燥ペレットを吸引します。
プロテイナーゼK 4.消化
- ペレットを緩めるために150μlのプロテイナーゼK消化バッファーとフリックチューブにペレットを再懸濁します。温度安定性プロテイナーゼKの10μlを添加して、フリック混和(ありません)チューブをボルテックス。穏やかに撹拌しながら15分間、56℃でチューブ内のコンテンツをインキュベートします。
- チューブは3分間氷上でインキュベートすることを可能にします。完全な冷却は、次のステップで効率的な沈殿のために重要です。最大速度で15分間遠心します。
DNAから5.個別のRNA
- RNA精製のための新しい1.5 mlに、ペレットを乱すことなく、上清を慎重に移します。
- DNA精製のためのペレットを(ペレットは-20℃で1日まで2〜8℃で、またはより長い期間のために、室温で2時間保存することができます)してください。
6. RNA精製
- 15分間80℃でRNAを含む上清を(この時間を超えない)インキュベートします。次に、簡単に蓋の内側に付いた水滴を収集するためのチューブを遠心します。
- 結合条件を調整し、ピペッティングにより混合するために320μlのBuffer RLTを追加します。次に、720μlのエタノール(100%)、および渦を追加します。
- 転送62 mlのコレクションチューブに入れ、残りのコンテンツを取っておく(キットに付属)RNAスピンカラムに、形成した沈殿物を含む試料の00μlを、。 ≥8,000×gで15秒間遠心分離し、フロースルーを廃棄し、コレクションチューブを再利用します。
- チューブの蓋に蓄積されている可能性の液滴を含むカラムにサンプルを残りの転送、≥8,000×gで15秒間遠心分離し、フロースルーを捨てます。
- 、≥8,000×gで15秒間スピンカラムや遠心に350μlのBuffer FRNを追加し、フロースルーを廃棄し、コレクションチューブを再利用します。
- 静かに、70μlのBuffer RDDと10μlのDNase Iストック溶液を混ぜてスピンカラムの膜に直接追加し、室温で15分間インキュベートします。
- ≥8,000×gで15秒間、スピンカラムに遠心分離を500μlのBuffer FRNを追加し、次のステップで使用するためにフロースルーを保存します。スピンカラムを配置し、低分子RNAの回収率を高めるために、新しい2 mlコレクションチューブとフロースルー前のステップからのスピンカラムに適用します。
- ≥8,000×gで15秒間遠心分離し、フロースルーを廃棄し、次のステップでコレクションチューブを再利用します。 、≥8,000×gで15秒間スピンカラムや遠心に500μlのBuffer RPEを添加フロースルーを廃棄し、次のステップでコレクションチューブを再利用します。
- ≥8,000×gで15秒間スピンカラムや遠心に500μlのBuffer RPEを添加し、フロースルーとコレクションチューブを捨てます。
- 5分間最大速度で蓋と遠心分離機を開き、新しい2 mlコレクションチューブにスピンカラムを配置します。フロースルーとコレクションチューブを捨てます。
- 、新しい1.5 mlのコレクションでスピンカラムを置き、スピンカラム・メンブレンに直接RNaseフリー水20μlを追加し、室温で1分間チューブをインキュベートします。最高速度で1分間遠心分離し、RNAを溶出します。 -80℃で溶出したRNAサンプルを保管してください。
7。 DNA精製
- プロテイナーゼKバッファー(400 mMトリス7.5、400 mMのNaClを、3のMgCl 2、4%SDS)の45μlに段階的に添加することにより、RNA抽出の際に得られたペレットを再懸濁し、 45μlのH 2 O;そして、高い効力プロテイナーゼK400μgの
- 24時間(推奨)または一晩56℃で上記の溶液をインキュベートします。撹拌せずに2時間90℃でPerformincubationと簡単に蓋の内側からの滴を収集するためにマイクロチューブを遠心。
- サンプルを室温まで冷却した後、4μlのRNase A(100 mg / mlで)を追加することができます。 RTで2分間のサンプルをインキュベートします。
- サンプルに200μlのBuffer ALを添加し、ボルテックスで混和します。次に、100%エタノール200μlを添加し、ボルテックスで混和します。提供スピンカラム、2 mlのコレクションチューブ内の場所、および≥8,000×gで1分間遠心分離機にサンプル全体を転送します。
- とコレクションチューブを捨てますフロースルーと新しい2 mlコレクションチューブにスピンカラムを置きます。 、スピンカラムに700μlのBuffer AW1を追加≥8,000×gで15秒間遠心、フロースルーを廃棄し、コレクションチューブを再利用します。
- 、スピンカラムに700μlのBuffer AW2を追加≥8,000×gで15秒間遠心、フロースルーを廃棄し、コレクションチューブを再利用します。次に、≥8,000×gで15秒間スピンカラム、遠心分離機に100%エタノール700μlを添加し、フロースルーとコレクションチューブを捨てます。
- 5分間、フルスピードでスピンカラムの蓋、及び遠心分離機を開き、新しい2 mlコレクションチューブにスピンカラムを配置します。フロースルーとコレクションチューブを捨てます。
- 新しい1.5 mlのコレクションチューブにスピンカラムを配置し、加熱されたヌクレアーゼフリー水(50℃)の25μlを添加します。 10分間50℃で、カラム、チューブをインキュベートします。最高速度で1分間遠心分離し、カラムにヌクレアーゼフリー水(RT)の25μlを添加し、インキュベート室温で1分間。
- 最大速度(21130 XG)およびゲノムDNA(全DNAの約50μl)を含む収穫フロースルーで1分間遠心分離します。 (場合には、別の溶出が、後に必要とされる)-20℃で列を保管してください。
結果
このプロトコルは、組織切片用に設計された市販の抽出システムの変形例を用いて、組織コアからDNAとRNAを回収するための最適化された方法を表します。最適化は、組織均質化の導入、DNA抽出のためのより強力なプロテイナーゼKの使用、および組織消化時間の延長が含まれます。グラフと統計分析は、2ウェイANOVA、線形回帰と相関が含まれていました。
プロテイナーゼ消化の最適化
市販のキットは、より高いDNA収量( 図2A)、その結果、より強力なプロテイナーゼKで置換し、室温安定したプロテイナーゼK溶液が含まれていました。さらに、DNAの収量を増加させるために、消化は2から24時間に延長しました。有意差は、2つの時点の間で見られなかったが、24時間の消化は、SA間でより一貫性のある収量を提供するように見えmples。しかし、さらなるインキュベーションの48時間は、さらにDNA回収改善しなかった( 図2Bを; P = 0.74)。
FFPE前立腺癌組織サンプルからの典型的なDNAの回復
最適化されたプロトコルを使用して、RNAとDNAは3からサンプル時代の14年に及ぶ333前立腺癌FFPETサンプルから同時抽出しました。各サンプルから、3つの組織コア(0.95±0.13 mm 3での平均全組織量)を入力として使用しました。濃度を推定し、核酸分子のサイズ分布の評価を提供することができ、他のマイクロ流体ベースのゲル電気泳動の方法がありますが、そのような方法は、flourometricallyベースアッセイを行う再現性の核酸の定量化を提供していませんし、RNAとDNAとを区別することはできません。 22そして、マイクロ流体ベースのゲル電気泳動の結果は、断片化のために信頼性がないため、FFPET由来の核酸は、23核酸収量は(詳細については、試薬リストを参照してください)蛍光定量的に測定しました。平均利回りは、RNAとDNA( 図3A)の820 ngのの2270 ngのでした。本研究で分析した全てのFFPETサンプルの約90%は、RNAのDNAと≥500 ngのの≥100NGを得ました。興味深いことに、FFPETサンプルと核酸回収( 図3B)の年齢との間に有意な相関は認められませんでした。 (R 2 = 0.39; P <0.0001)全体的に、RNAとDNA収量はサンプル全体に相関したDNAより二倍よりもはるかにRNAは、各サンプル( 図3C)から回収したものの、。
パイロットと最適化作業が前立腺組織で実施したように、次のステップは、アーカイブ組織のいくつかの追加のタイプのこのプロトコルのパフォーマンスを調査することでした。であることを表す外科的に除去し、剖検FFPETサンプルで始まりますnign肝臓(1ケースから1サンプル)は、脳の癌(8 1ケースからのサンプル)、膀胱(2例から2サンプル)、および乳癌(3例から3サンプル)、プロトコルは、DNAの> 100 ngのをもたらしましたサンプルの90%からのRNA( 図3D)。核酸の収量は、手術組織におけるよりも剖検組織で低かったが、代表的な結果は、プロトコルが異なるサイトから誘導された癌全体で同様の収率をもたらすことを示しています。
RNAとDNA完全性の評価とダウンストリーム解析におけるその代表的パフォーマンス
(陽性対照として)8選択FFPET前立腺癌試料と新鮮PC-3前立腺癌細胞株試料47の遺伝子のRNA発現分析はFFPETのために最適化された商業多検体の遺伝子発現プラットフォームを用いて行きました。 PC3におけるmRNAカウントはFFPET SAからのものよりも一般的に高かったですmples( 図4A)。しかし、すべての遺伝子の相対的発現を比較する、FFPET前立腺癌試料は、RNAの両方の供給源は、RNA発現プロファイリングに適していることを示し、PC-3 RNAに類似の発現プロファイルを示しました。
このプロトコルで抽出したゲノムDNAの性能を実証するために、FFPETサンプルから重亜硫酸塩変換DNAの抽出物は、メチル化特異的PCR(MSP)により増幅した。ALU反復エレメントの24 MSP分析ヒトゲノム中の何百万ものコピーで存在、高度にメチル化された領域、 図25は、ゲノムのメチル化コントロールとして使用し、そしてサンプル間の最小の変動を示すことが予想されました。図4Bに示すように、ALU MSPのメチル化レベルの異なるサンプル間で見られない変化がほとんどなかったです。また、GSTP1、前立腺癌ではないが、良性サンプルにおいて過剰メチル化されることが知られている遺伝子、26に基づいて、MSPアッセイは、検出可能なamplifを示しませんでした良性試料からのDNAでications。予想されるように、低い定量PCRサイクル閾値は、メチル化GSTP1コピーの濃縮を示す、癌組織からのDNAにおいて検出されました。このプロトコルにより回収した核酸の有用性はさらに、良性肝臓からおよび脳(死後)から二外科的に除去乳癌試料から回収された核酸を使用して、典型的な下流アッセイで試験しました。 、両方のRT-qPCRに基づく発現およびMSPアッセイは、乳癌および肝臓FFPETでうまく行ったが、RT-PCRアッセイは、RNAが分解していたことを示唆し、死後脳の腫瘍サンプル( 図4C)から、高度に発現されたmRNAを増幅するために失敗しました。遅延組織固定する可能性が高いです。
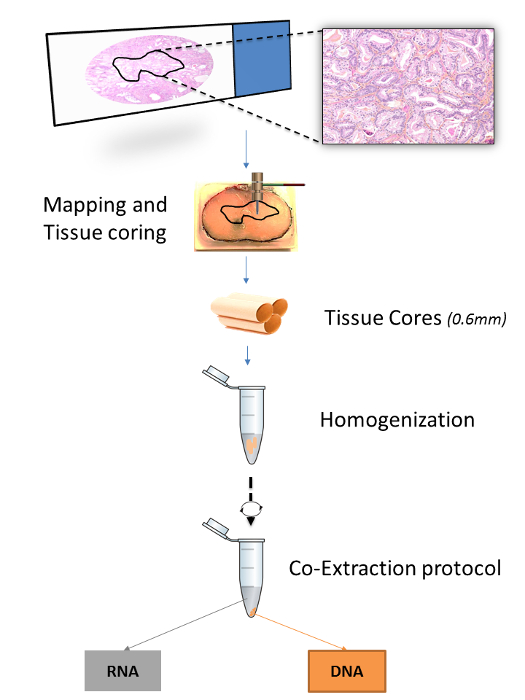
図1:FFPET サンプルのための抽出手順の概要図Aに関心のどの領域を示しています。組織ブロックは、顕微鏡スライドから組織病理学的選択に基づいてマッピングされています。三つの0.6ミリメートルの組織コアは、その後、一緒に均質化した後、RNAとDNAの両方の抽出を行い、生検パンチを使用して、各組織領域から得られる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
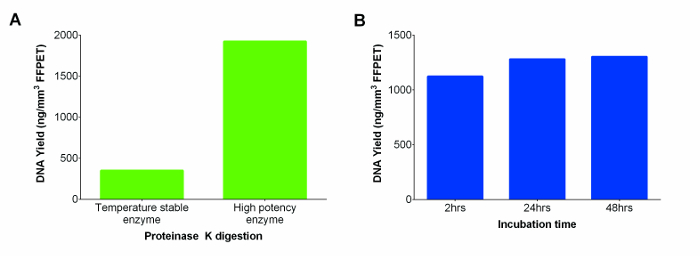
。 図2:2 プロテイナーゼK(温度安定性と高い効力酵素)、後者のためのインキュベーション時間の範囲にわたってテスト済み (A)プロテイナーゼKのパフォーマンスから ngの中の核酸(DNAとRNA)収量/ FFPETの ミリメートル 3異なるサプライヤーから。 DNA抽出は、kに供給される温度安定性酵素を用いて代表的なFFPETサンプルについて実施しましたそれ別のメーカーから、より強力な酵素対。 (B)DNAの収量を最大化するために最適なプロテイナーゼKのインキュベーション時間を決定します。高濃度のプロテイナーゼK消化の性能は、3 FFPETサンプルを使用して、3つの異なるインキュベーション時間で評価しました。エラーバーは平均の標準誤差(SEM)を表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
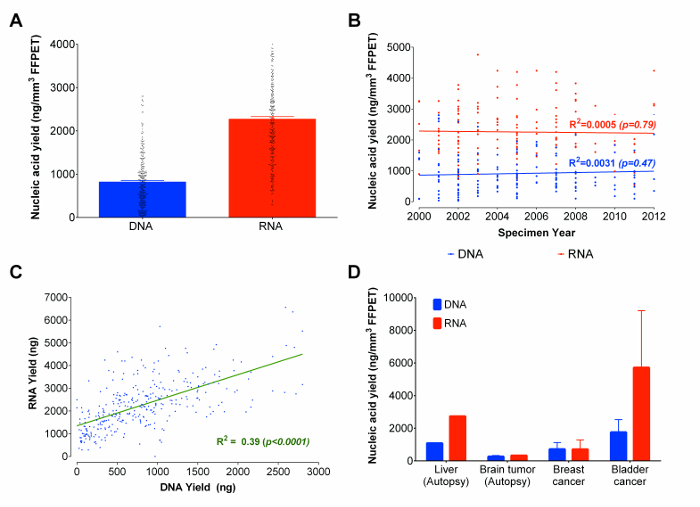
図3: サンプル年代表的な組織タイプにわたって合計FFPETの NG / mmの 3 中の核酸(DNAおよびRNA)収量 、(A)の合計は、ホルマリン固定パラフィン包埋組織から核酸を回収しました。提示された核酸の量は333 FFPETサンプルの抽出に基づいているのu最適化されたプロトコルを歌います。回収された全DNAとRNAとFFPETサンプルの年齢との間に(B)の相関プロット。使用される抽出FFPETサンプルは333の前立腺サンプルから同時に抽出されたDNA及びRNAの収量との間に2012年(C)の相関に2000年から得ました。 DNAとRNA収量との間に正の相関があります。追加のアーカイブ組織タイプを使用してプロトコルの(D)デモンストレーション。最適化されたプロトコルは、14の癌(乳癌、膀胱および脳)および正常(肝臓)試料から核酸を抽出するために使用されました。エラーバーはSEMを表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
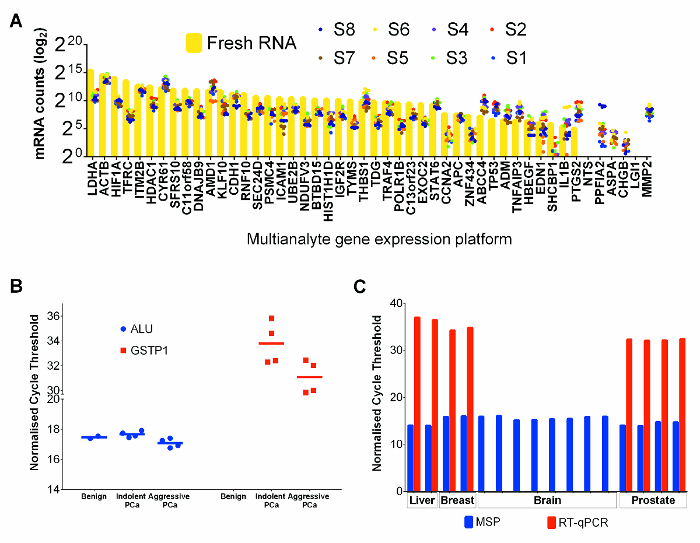
図4:RNA とDNAのパフォーマンスTISSUから共同抽出ダウンストリームアプリケーションでの電子のコア。(A)mRNAはFFPE前立腺癌組織のために、新鮮なPC-3細胞ライン制御のためにカウントされます。各点は個別に抽出された3技術的反復の平均を表します。新鮮なPC-3細胞株のRNA値は、黄色のバーで示されており、FFPET組織値は着色ドットで表現されます。 (B)FFPET前立腺癌試料のDNAのメチル化特異的PCRアッセイ。サイクル閾値は、50 ngの/重亜硫酸塩変換DNAの反応を用いて、予想されるように行わ10サンプルについて得られました。すべてFFPETサンプルからのALU MSPアッセイは、同様のサイクル閾値(P> 0.67)でした。 GSTP1のMSPアッセイは、良性前立腺よりも前立腺癌において高いメチル化(低いサイクル閾値)レベルを示しました。 (C)追加の組織型からのDNAとRNAの品質の評価。 HPRT1遺伝子発現とのAlu遺伝子メチル化アッセイは、から抽出された核酸(それぞれRNA及びDNA)で行ったもMAL肝臓(剖検)、および脳(剖検)および乳癌(すべてFFPET)。前立腺からの結果を比較のために示されています。注:同様の結果は、1つの剖検標本から失敗したmRNA増幅を除いて、各組織型から観察されました。各点またはバーはサンプルを表し、エラーバーはSEMを表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 組織コア | |||||||||||
| ティッシュ入力(立方ミリメートル) | 抽出された核酸 | 検証 | 品質チェック:DNA | 品質チェック:RNA | |||||||
| (サンプルの#) | サンプルの年齢(歳) | 総収量(NG) | フラグメントサイズ(bp)の | PCR | 総収量(NG) | フラグメントサイズ(bp)の | PCR | NanoString | |||
| Pikor ら。 | 43から129 | DNA | データなし | データなし | データなし | データなし | |||||
| Montaser-Kouhsari ら。 | 18から29.5 | RNA | 763 | 0-25 | 843 | データなし | |||||
| この紙 | 1.71 | DNAおよびRNA | > 350 | 3月12日 | 820 | 100から500 |  | 2270 | 100-500 |  | /ftp_upload/54299/check_mark.jpg "/> |
| 組織切片 | |||||||||||
| ティッシュ入力 | 抽出された核酸 | 検証 | 品質チェック:DNA | 品質チェック:RNA | |||||||
| (サンプルの#) | サンプルの年齢(歳) | 総収量(NG) | フラグメントサイズ(bp)の | PCR | 総収量(NG) | フラグメントサイズ(bp)の | PCR | NanoString | |||
| ヘイカルら。 | 5×5ミクロン | DNA | 12 | 7月22日 | 88から300 | 103から351 |  | ||||
| チャンら。 | 1×20ええと | RNA | 9 | > 5 | 16,000- 23000 | 100-200 |  | ||||
| アンティカら。 | 2×4ミクロン | RNA | 18 | データなし | 不明(621 NG /μL) | 80から202 + |  | ||||
| Ghatak ら。 | 5×5ミクロン | DNAおよびRNA | 5 | 1 | 14 256 | <1030 |  | 16 000 | 109から400 + |  | |
| ヘニヒら。 | 1×10ミクロン | DNAおよびRNA | 210 | 1月25日 | データなし | データなし |  | データなし | データなし |  | |
| レーザーキャプチャーマイクロダイセクション | |||||||||||
| ティッシュ入力(MM2) | 抽出された核酸 | 検証 | 品質チェック:DNA | 品質チェック:RNA | |||||||
| (サンプルの#) | サンプルの年齢(歳) | 総収量(NG) | フラグメントサイズ(bp)の | PCR | 総収量(NG) | フラグメントサイズ(bp)の | PCR | NanoString | |||
| 雪ら。 | 1-2 | DNA | 110 | 0-2 | 430 | データなし |  | ||||
表1: 組織コアセクションおよびレーザーキャプチャーmicrodissectionsの公表DNA及びRNA抽出プロトコールの比較も含まれるPCRとNanostringアッセイを使用して、これらの方法のいくつかの分子のエンドポイントの評価です。
ディスカッション
関心の組織領域からのDNAやRNAの抽出成功のために、正確なコアリングは重要です。このプロトコルは、直径0.6mmのコアを分離するために、組織パンチの使用を記載し、顕微鏡からの表記を転送するためのプロセスがFFPETブロックに対応するスライド概説します。製造業者のプロトコルへの変更を効率的に約プロトコルが意図されたミクロトームセクションよりも50倍厚いコアから核酸を抽出する必要がありました。コアは組織切片に対してよりパラフィンワックスの相対を含むことができるので、繰り返しキシレンおよびエタノール処理工程を経て、コアの有効な脱パラフィンが必要でした。ポスト脱パラフィン手順の成功は、適切な機械の組織コアの均質化と効率的なプロテイナーゼK消化に依存していました。プロテイナーゼK消化のさらなる最適化を行うことができます。
これは、このメソッド同定することを言及する価値があります組織病理スライドを対応で識別されるブロックの表面上の目的の外資企業の地域、。 3または4ミリメートルの深さであり、コアの収穫組織としては、このプロトコルのユーザーは、細胞または組織は、ブロック表面の下に敷くものを心配することがあります。これが有効な関心事ですが、(参照27に概説されている)複数の研究では、重複または三重コアが関心のある領域からサ ンプリングされている場合は特に、組織コアを忠実に組織学的および病理学的組織ブロックの分子的特徴を表すことを明らかにしました。
このプロトコルで採用されている修正された市販の抽出キットが同じ組織からのDNAとRNAの両方の同時抽出を可能にするように、プロトコルは、貴重な生物学的材料を節約し、同じサンプルから得られた二つの核酸の間の直接比較を可能にします。 RNAとDNAの同時抽出は半分に労働力と組織の枯渇をダウンカット、および遺伝子exprの正確な統合解析を可能にしますession、ならびにDNAで見つかったエピジェネティックな遺伝的特徴。これらの代表的な組織コアからRNAとDNAの両方の収率は、典型的には、それぞれ600および300 ngのを超えて、最も電流PCR次世代配列決定アプリケーションは、典型的には10〜100 ngのを必要とするので、このプロトコルによって精製サンプルのほとんどは、適切提供するべきであるのでいくつかの下流のアッセイのための材料。このプロトコルは、(Selvarajah ら 、 準備に)独立した研究室の両端の再現性であることが示されています。このプロトコルのRNAは、RT-PCRまたは人気の多検体のプラットフォームのいずれかを用いた遺伝子発現解析のために十分な品質のものであり、DNAは、メチル化特異的PCRアッセイでよく行います。次世代シーケンシングで回収された核酸の有用性を評価することを目的とした今後の研究が保証されています。
このように、いくつかの変更は、それに適したFOをレンダリング、薄いFFPETセクション用に設計された市販のプロトコルに行われました0.6ミリメートルのFFPETコアからのRNAとDNAのrの同時抽出。プロトコルは、前立腺癌サンプルの大規模コホートで乳房、脳及び膀胱の癌からのサンプルの限られたセットに一貫して高い収量を示しました。全体的に、プロトコルは、大規模な、よく注釈付き組織コレクションの標的遺伝子ベースの分析を実行するために、ユーザーを有効にする必要があります。重要なのは、プロトコルがFFPET中の関心領域を効率的に集束されたサンプリング、比較的少ないハンズオンタイム、および最下流のアプリケーションに十分に高い歩留まりを可能にします。
開示事項
The authors declare no competing financial interests.
謝辞
This research was supported by a team grant from Movember/Prostate Cancer Canada to JMSB, DMB, PCP, and JL, and by the Ontario Institute of Cancer Research (JMSB, DMB, and PCP) and Motorcycle Ride for Dad Kingston/University Hospitals Kingston Foundation/Kingston General Hospital (DMB, PCP).
資料
| Name | Company | Catalog Number | Comments |
| Plastic paraffin film, "Parafilm 'M'" | Bemis | RK-06720-40 | Any generic paraffin film will work as a substitute |
| Sodium Hypochlorite, "Ultra Bleach" | Likewise | 53-2879-2 | Any generic bleach will work as a substitute. Hazardous material that can cause burns on contact. |
| Molecular biology grade absolute ethanol | Fisher BioReagents | BP2818-500 | Sigma-Aldrich E7023 suffices as a substitute |
| Molecular Grade H2O | G-Biosciences | 786-293 | Sigma W4502 suffices, as well as any other brand of molecular grade H2O |
| 0.6 mm Punch Set for Beecher Instruments | Estigen | MPO6[Yellow] | Make sure to use the red receiver punch from the set |
| Fine point permanent marker | Sharpie | 10365796S | Using the marker on FFPE tissues causes it to dry out quickly, so several may be required |
| FFPE tissue block | |||
| Stained tissue slide corresponding to FFPE block | |||
| 1.5 ml Micro-Centrifuge Tubes | Fisher BioReagents | 05-408-137 | |
| 2.0 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431048 | |
| 1.5 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431021 | |
| Histology Xylene | VWR | CA 95057-822 | Fisher Scientific X5-500 suffices as a substitute |
| Molecular Biology Grade 2-Propanol | Sigma | I9516 | |
| AllPrep FFPE DNA/RNA Kit | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Buffers: RLT, FRN, RPE, ATL, AL, AW1, AW2, DNaseI solution | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Temperature stable proteinase K | Qiagen | 80234 | |
| High potency proteinase K | Invitrogen | 25530-049 | Invitrogen 25530-015 suffices as a substitute |
| RNAse neutralizing solution (Rnase AWAY) | Molecular BioProducts | 7003 | |
| RNaseA 100 mg/ml | Qiagen | 19101 | |
| BD Integra Syringe 3 ml 21G x 1/2 | BD | 305274 | |
| Motorized tissue homogenizer (TissueRuptor) | Qiagen | 9001271 | Fisher Scientific 14-261-29 suffices as a substitute |
| -20 °C and -80 °C Laboratory Freezer | |||
| Micro-Centrifuge with rotor for 2 ml tubes | |||
| Digital Vortex Mixer | |||
| Pipettes and filter tips | |||
| Heating blocks or water baths | |||
| Tris Hydrochloride | Amresco | 0234 | |
| Sodium Chloride | Amresco | 0241 | |
| Anhydrous Magnesium Chloride | Sigma | M8266 | |
| Sodium Dodecyl Sulfate | Sigma | L4509 | |
| Acrodisc 25 mm syring filters with 0.45 µm Supor membrane | Pall | PN 4614 | |
| Syringe with retracting BD PrecisionGlide needle 3 ml | BD Integra | 305274 | |
| Hydrochloric Acid | BDH | 3026 | |
| Multianalyte gene expression platfrom (nCounter ® CAE codeset and Nanostring nCounter platform) | Nanostring nCounter platform, Nanostring | ||
| Fluorometric nucleic acid quantification (Qubit dsDNA HS Assay Kit and Qubit® RNA BR Assay Kit) | Invitrogen |
参考文献
- Kern, S. E. Why your new cancer biomarker may never work: recurrent patterns and remarkable diversity in biomarker failures. Cancer Res. 72 (23), 6097-6101 (2012).
- Klopfleisch, R., Weiss, A. T. A., Gruber, A. D. Excavation of a buried treasure--DNA, mRNA, miRNA and protein analysis in formalin fixed, paraffin embedded tissues. Histol. Histopathol. 26 (6), 797-810 (2011).
- Beltran, H., et al. Targeted Next-generation Sequencing of Advanced Prostate Cancer Identifies Potential Therapeutic Targets and Disease Heterogeneity. Eur. Urol. 63 (5), 920-926 (2013).
- Hoppin, J. A., Tolbert, P. E., Taylor, J. A., Schroeder, J. C., Holly, E. A. Potential for selection bias with tumor tissue retrieval in molecular epidemiology studies. Ann. Epidemiol. 12 (1), 1-6 (2002).
- von Ahlfen, S., Missel, A., Bendrat, K., Schlumpberger, M. Determinants of RNA quality from FFPE samples. PLOS ONE. 2 (12), e1261 (2007).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Pikor, L. A., Enfield, K. S. S., Cameron, H., Lam, W. L. DNA extraction from paraffin embedded material for genetic and epigenetic analyses. J. Vis. Exp. (49), (2011).
- Turashvili, G., et al. Nucleic acid quantity and quality from paraffin blocks: defining optimal fixation, processing and DNA/RNA extraction techniques. Exp. Mol. Pathol. 92 (1), 33-43 (2012).
- Espina, V., et al. Laser-capture microdissection. Nat. Protoc. 1 (2), 586-603 (2006).
- Hackler, L., Masuda, T., Oliver, V. F., Merbs, S. L., Zack, D. J. Use of laser capture microdissection for analysis of retinal mRNA/miRNA expression and DNA methylation. Methods Mol. Biol. 884, 289-304 (2012).
- Bonin, S., Stanta, G. Nucleic acid extraction methods from fixed and paraffin-embedded tissues in cancer diagnostics. Expert Rev. Mol. Diagn. 13 (3), 271-282 (2013).
- Bonin, S., et al. Multicentre validation study of nucleic acids extraction from FFPE tissues. Virchows Archiv. 457 (3), 309-317 (2010).
- Montaser-Kouhsari, L., et al. Image-guided Coring for Large-scale Studies in Molecular Pathology. Appl. Immunohistochem. Mol. Morphol. , (2015).
- van Eijk, R., Stevens, L., Morreau, H., van Wezel, T. Assessment of a fully automated high-throughput DNA extraction method from formalin-fixed, paraffin-embedded tissue for KRAS, and BRAF somatic mutation analysis. Exp. Mol. Pathol. 94 (1), 121-125 (2013).
- Ghatak, S., Sanga, Z., Pautu, J. L., Kumar, N. S. Coextraction and PCR Based Analysis of Nucleic Acids From Formalin-Fixed Paraffin-Embedded Specimens. J. Clin. Lab. Anal. , (2014).
- Hennig, G., et al. Automated extraction of DNA and RNA from a single formalin-fixed paraffin-embedded tissue section for analysis of both single-nucleotide polymorphisms and mRNA expression. Clin. Chem. 56 (12), 1845-1853 (2010).
- Snow, A. N., Stence, A. A., Pruessner, J. A., Bossler, A. D., Ma, D. A simple and cost-effective method of DNA extraction from small formalin-fixed paraffin-embedded tissue for molecular oncologic testing. BMC Clin. Pathol. 14 (1), 30 (2014).
- Torrente, M. C., et al. DNA extraction from formalin-fixed laryngeal biopsies: Comparison of techniques. Acta Otolaryngol. 131 (3), 330-333 (2011).
- Okello, J. B. A., et al. Comparison of methods in the recovery of nucleic acids from archival formalin-fixed paraffin-embedded autopsy tissues. Anal. Bochem. 400 (1), 110-117 (2010).
- Abramovitz, M., et al. Optimization of RNA extraction from FFPE tissues for expression profiling in the DASL assay. BioTechniques. 44 (3), 417-423 (2008).
- . . AllPrep DNA/RNA FFPE Handbook. , (2012).
- Laurent, L. C., et al. Meeting report: discussions and preliminary findings on extracellular RNA measurement methods from laboratories in the NIH Extracellular RNA Communication Consortium. Journal of Extracell. Vesicles. 4, (2015).
- . Methods of RNA Quality Assessment Available from: https://www.promega.ca/resources/pubhub/methods-of-rna-quality-assessment (2012)
- Herman, J. G., Graff, J. R., Myohanen, S., Nelkin, B. D., Baylin, S. B. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad. Sci. U.S.A. 93 (18), 9821-9826 (1996).
- Weisenberger, D. J., Campan, M., et al. Analysis of repetitive element DNA methylation by MethyLight. Nucleic acids research. 33 (21), 6823-6836 (2005).
- Yegnasubramanian, S. Hypermethylation of CpG Islands in Primary and Metastatic Human Prostate Cancer. Cancer Res. 64 (6), 1975-1986 (2004).
- Parsons, M., Grabsch, H. How to make tissue microarrays. Diagn. Histopathol. 15 (3), 142-150 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved