Method Article
Получение формалином фиксированных залитых парафином тканей Ядра как для РНК и ДНК экстракции
В этой статье
Резюме
Этот модифицированный протокол экстракции улучшает РНК и ДНК урожаи от более точно целевых областей, представляющих интерес в блоках гистологических тканей.
Аннотация
Formalin-fixed paraffin embedded tissue (FFPET) represents a valuable, well-annotated substrate for molecular investigations. The utility of FFPET in molecular analysis is complicated both by heterogeneous tissue composition and low yields when extracting nucleic acids. A literature search revealed a paucity of protocols addressing these issues, and none that showed a validated method for simultaneous extraction of RNA and DNA from regions of interest in FFPET. This method addresses both issues. Tissue specificity was achieved by mapping cancer areas of interest on microscope slides and transferring annotations onto FFPET blocks. Tissue cores were harvested from areas of interest using 0.6 mm microarray punches. Nucleic acid extraction was performed using a commercial FFPET extraction system, with modifications to homogenization, deparaffinization, and Proteinase K digestion steps to improve tissue digestion and increase nucleic acid yields. The modified protocol yields sufficient quantity and quality of nucleic acids for use in a number of downstream analyses, including a multi-analyte gene expression platform, as well as reverse transcriptase coupled real time PCR analysis of mRNA expression, and methylation-specific PCR (MSP) analysis of DNA methylation.
Введение
Геномные исследования биомаркеров стремится идентифицировать молекулярные коррелятов , которые точно и достоверно отражают состояние заболевания, и сделать это в клинически полезным образом. 1 Развитие биомаркеров зависит от ретроспективного анализа хорошо аннотированных образцов ткани. Пораженные и нормальные образцы ткани хранятся либо в виде свежезамороженной ткани в специализированных биобанках или в виде фиксированных формалином парафин ткани (FFPET) блоков в клинических архивах. Свежезамороженной ткани позволяет для извлечения высококачественных нуклеиновых кислот и широко используется в геномных исследованиях биомаркеров. 2,3 Однако меньшее количество образцов ткани доступны в биобанках и изучение такой ткани вводит уклон в сторону больших образцов, необычных категорий болезни, и пациенты видели в специализированных центрах с большими способностями к банковской ткани. 4 FFPET, напротив, является способ хранения по умолчанию для пораженных тканей человека и животных. В то время как FFPET блоки поддержания клеточного мorphology, процесс фиксации сшивает других клеточных составляющих нуклеиновых кислот. Сшитый РНК и ДНК могут быть возмещены, но только в деградированных, сильно фрагментированных форм. 5,6 Тем не менее, эти ДНК и РНК - фрагменты могут быть подвергнуты анализу с помощью расширяющегося множества анализов, в том числе экспрессию мРНК, гиперметилировании ДНК и целевой последовательности. 7,8 Чтобы воспользоваться этой возможностью , в большом количестве и разнообразии FFPET доступных для исследования, существует необходимость эффективного и надежного протокола экстракции.
Большая часть исследований биомаркеров в тканях фокусируется на рак. Как и другие виды патологической ткани, ткани рака часто показывает значительную региональную неоднородность в сохранении клеток и типа клеток. Так как биомаркер исследования опираются на возможности коррелировать составляющие пораженной ткани с молекулярными особенностями, важным шагом этого процесса является точная заготовка ткани, которая хорошо сохраняется и обогащается за дisease в стадии изучения. В FFPET два метода обогащения часто используются: лазерный захват микродиссекции (LCM), и микротом секционирования. LCM позволяет узкоспециализированные сбор тканей и могут быть использованы для выделения конкретных, хорошо сохранившиеся типы клеток в гетерогенных тканях. 9,10 Тем не менее, LCM требует дорогостоящего оборудования и запредельно отнимает много времени у большого количества образцов. Микротомных секционирования является более широко используется процесс , в котором тонкие секции вырезают из FFPET блоков. 11,12 микротомных нарезанные участки часто включают в себя ткань, которая неоднородна по сохранению клеток (например, некротический против хорошо сохранившееся) и состав (например, рак по сравнению с доброкачественными паренхимы), и, следовательно, может привести к усреднению молекулярных особенностей наиболее изученным отдельно. Таким образом, существует потребность в высокой пропускной способности метода, обогащающий для клеток, представляющих интерес. Третий способ, выделение нуклеиновых кислот из FFPET ядер, обеспечивает это обогащение, подходит для высокой через вhput протоколы, и был использован другими для выделения РНК или ДНК из отдельных сердечников ткани. 7,13,14
Ряд опубликованных протоколов указать способы извлечения нуклеиновых кислот из FFPET (таблица 1). Тем не менее, протоколы , где РНК и ДНК , извлеченные из той же ткани были оптимизированы для секций микротомных ткани, но не для сердечников ткани. 15,16 Аналогичным образом , опубликованные протоколы , которые обеспечивают повышенную тканевую специфичность, либо через сердечники ткани или слайд microdissections, определяют процедуры для экстракции ДНК, но не РНК. 7,17 Здесь, оптимизированный протокол для двойной экстракции ДНК и РНК из того же ядра ткани демонстрируется. Тканевые сердечники собирают путем вставки ткани микрочипов (TMA) пуансоны в регионах, представляющих интерес, отображенных на FFPET блоков. Отображение выполняется аннотирования предметного стекла микроскопа с маркером и передачи аннотацию к поверхности соответствующего FFPET блок (Рисунок 1).
До работы, что привело к разработке этого протокола включал сравнение нескольких коммерчески доступных систем нуклеиновых кислот экстракции. В этом сравнении, модификации коммерческих протоколов, как описано ниже , при условии , что самые высокие ДНК и РНК урожайность и качество (Selvarajah и др., В стадии подготовки). Тканевые сердечники толще секций микронных 5-10 мкм , обычно используемых при экстракции протоколов FFPET 11,12,14,18 - 20, и может содержать более переменные количества парафина. Чтобы компенсировать это, Депарафинирование был усилен повторением ксилола и этанола и лечения путем введения моторизованный стадии гомогенизации (рисунок 1). Кроме того, протеиназы K раз пищеварением были удлинены, чтобы увеличить выход ДНК. В целом, этот протокол является экономически эффективным и позволяет установить связи между молекулярными и гистологических признаков заболевания в Лос-АнджелесеRGE, хорошо охарактеризованных популяции. Протокол в целом может быть осуществлено надежно в течение 2-х дней, в том числе 3 ч от практического времени, с особой необходимости в специализированной или дорогостоящего оборудования.
Протокол шаг за шагом, в дальнейшем в качестве модифицированной версии протокола производителя. 21 Пожалуйста , смотрите таблицу материалов / оборудования для конкретных реагентов, оборудования и производителей.
протокол
1. Ткань Coring
- Просмотрите стекло микроскопа и очертить области (ы) интересов с помощью тонкой точки постоянный маркер. Вырежьте секцию парафиновой пленки, достаточно большой, чтобы покрыть область интереса на предметном стекле микроскопа. Поместите пленку плотно на слайде и оберточную пленку по краям, чтобы сохранить пленку от скольжения. Использование тонкой точки постоянный маркер, очертить всю ткань и область (ы) интересов в ткани, сохраняя контурной прикосновений - но за пределами - региона (ов).
- Снимите пленку и перенести его к блоку соответствующей ткани. Сориентируйте фильм листать или повернув его так, чтобы контур всей ткани соответствует наблюдаемой формы ткани в блоке (рисунок 1). Нажмите участок пленки прочно к поверхности блока, чтобы предотвратить соскальзывание.
- Используя кончик перманентным маркером, сделайте неглубокие, но видимые (~ 0,2 мм) углублений вдоль контура региона (ов) вterest, затем снимите пленку. Нагрузка 1 мл хлорной извести, 70% этанола и воды в отдельные 1,5 или 2,0 мл микропробирок.
- Очистите рецептор (красный) удар от 0,6 мм штампа, установленного сдвинув удар вверх и вниз несколько раз, пока кончик погружен в пробирку, содержащую отбеливателя. Повторить операцию с 70% -ным этанолом, а затем водой (решающее значение для обеспечения того, чтобы отбеливатель удаляется).
- Нажмите удар в ткань, внутри области, представляющей интерес на глубину 3 мм и вывести удар. Освободить ядро в низкое св зывание 1,5 или 2 мл трубки, вставив его из штампа с помощью стилуса. Храните ядра при -20 ° С (на длительный период) или 4 ° С для кратковременного использования.
- Очистите удар согласно пункту 1.4 и продолжить с соседними регионами или образца.
2. Deparaffinize ткани Сердечники FFPE
- Выходной сигнал переноса Депарафинирование в 1,5 или 2 мл пробирки путем добавления 1 мл ксилола в сердцевине ткани и встряхиванием энергично в течение 10 сек. Heaт в течение 3 мин при 50 ° С.
- Центрифуга в течение 2 мин при комнатной температуре (RT) и максимальной скорости (21130 Xg) и поместите пробирку на льду в течение 5 мин (позволяет восковой остаток затвердеть на верхней части).
- Осторожно удалите парафин, накопленный вокруг мениска с супернатанта с помощью пипетки и повторить лечение ксилола (шаги 2.1-2.2).
- Добавить 1 мл этанола (100%) и на вортексе в течение 10 сек. Центрифуга в течение 2 мин при комнатной температуре (максимальная скорость), и осторожно выбросьте этанол. Повторите описанную выше процедуру один раз.
3. гомогенизация депарафинировали сердечников
- Ресуспендируют ядер в 700 мкл этанола (100%) перед гомогенизацией. С помощью гомогенизатора моторизованный ткани, измельчить ядра на частицы тонких тканей (~ 1 мин на среднем уровне). Очистите гомогенизатора зонд между каждого образца, чтобы свести к минимуму перенос средств загрязнения.
- Заполните 15 мл пробирки с ~ 10 мл отбеливающего раствора, нейтрализующего РНКазы и 70% этанола. После того, как образец гомоgenization, моют гомогенизатора зонд в каждой из моющих растворов в порядке, установленном выше. Запуск гомогенизатора на самой высокой скорости в течение стадии промывки.
- Протрите зонд с тканью и позволяют зонд полностью высохнуть перед гомогенизацией следующего образца. Осмотреть ножи зонда для деталей остаточной ткани. Если будет установлено, очистите зонд снова. Изменить чистящие растворы (хлорная известь, этанол и РНКазы нейтрализующим раствором) ежедневно.
- После гомогенизации, довести объем пробы до 1 мл добавлением более 100% этанола (~ 300 мкл). Центрифуга на максимальной скорости в течение 15 мин, тщательно аспирата этанола и воздуха сухой осадок в течение приблизительно 15-20 мин, прежде чем приступить к экстракции РНК.
4. Пищевое расщепление с помощью протеиназы К
- Ресуспендируют осадок в 150 мкл протеиназы К переваривания буфера и выкидной трубки, чтобы ослабить осадок. Добавляют 10 мкл теплоустойчивая протеиназы К и смешивать Смахивающее (невихревой трубки). Выдержите содержание в трубке при 56 ° С в течение 15 мин при осторожном перемешивании.
- Разрешить трубки для инкубирования на льду в течение 3 мин. Полное охлаждение имеет важное значение для эффективного осаждения на следующей стадии. Центрифуга в течение 15 мин при максимальной скорости.
5. Отдельные РНК из ДНК
- Тщательно передачи супернатант, не нарушая гранул, к новому 1,5 мл для очистки РНК.
- Хранить гранулы для очистки ДНК (осадок может храниться в течение 2 ч при комнатной температуре, в течение 1 дня при температуре 2-8 ° С, или в течение более длительных периодов при температуре от -20 & deg; C).
6. РНК Очистка
- Выдержите РНК-содержащий супернатант при 80 ° С в течение 15 мин (не превышают этот раз). Далее кратко отцентрифугировать пробирку для сбора капель с внутренней стороны крышки.
- Добавьте 320 мкл буфера RLT скорректировать обязательные условия, и перемешать с помощью пипетки. Затем добавляют 720 мкл этанола (100%), и вихрь.
- Передача 600 мкл образца, в том числе любого осадка, который может быть сформирован, чтобы спина РНК колонке (поставляется в комплекте), помещенного в пробирку для сбора 2 мл и отложить в сторону остального контента. Центрифуга в течение 15 сек при ≥8,000 XG, отбросить проточные и повторно использовать пробирку для сбора.
- Передача оставшегося образца на колонку, в том числе капель, которые могут накапливаться в крышке трубки, центрифуги в течение 15 сек при ≥8,000 XG, и отбросить проточные.
- Добавьте 350 мкл буфера FRN в колонке спина и центрифуги в течение 15 сек при ≥8,000 XG, отбросить проточные и повторно использовать пробирку для сбора.
- Аккуратно смешайте 10 мкл ДНКазы I маточного раствора с 70 мкл буфера RDD, добавляют непосредственно к мембране ротационную колонку, и инкубируют при комнатной температуре в течение 15 мин.
- Добавить 500 мкл буфера для FRN в ротационную колонку, центрифугу в течение 15 сек при ≥8,000 XG и сохранить проточные для использования на следующей стадии. Для повышения коэффициента извлечения малых РНК, поместите столбец спина вНовая коллекция трубки и 2 мл применяют проточные из предыдущего шага в ротационную колонку.
- Центрифуга в течение 15 сек при ≥8,000 XG, отбросить проточные и повторное использование сбора трубки в следующей стадии. Добавить 500 мкл буфера RPE к колонке спина и центрифуги в течение 15 сек при ≥8,000 XG, отбросить проточные и повторное использование сбора трубки на следующем шаге.
- Добавить 500 мкл буфера RPE к колонке спина и центрифуги в течение 15 сек при ≥8,000 XG и выбросить пробирку для сбора с проточные.
- Поместите колонку отжиму в новой коллекторной трубки 2 мл, откройте крышку и центрифуге при максимальной скорости в течение 5 мин. Откажитесь отборная труба с проточные.
- Поместите колонку спина в новой коллекции 1,5 мл, добавляют 20 мкл РНКазы воды непосредственно на мембрану спиновой колонки и инкубировать трубку в течение 1 мин при комнатной температуре. Центрифуга на максимальной скорости в течение 1 мин для элюции РНК. Хранить элюированный образец РНК при температуре -80 ° С.
7. ДНК Очистка
- Ресуспендируют осадок , полученный при экстракции РНК путем ступенчатого добавлением 45 мкл протеиназы К буфера (400 мМ Трис - 7,5, 400 мМ NaCl, 3 мМ MgCl 2, 4% SDS); 45 мкл H 2 O; и 400 мкг высокой потенции протеиназы К.
- Выдержите вышеуказанного раствора при 56 ° С в течение 24 ч (предпочтительно) или в течение ночи. Performincubation при 90 ° С в течение 2 ч без перемешивания и кратко центрифуге микроцентрифужных трубки для сбора капель с внутренней стороны крышки.
- Дайте образец остыть до комнатной температуры и затем добавляют 4 мкл РНКазы А (100 мг / мл). Инкубируйте образца в течение 2 мин при комнатной температуре.
- Добавить 200 мкл буфера для искусственного интеллекта к образцу, и тщательно перемешать встряхиванием. Затем добавляют 200 мкл 100% этанола, и тщательно перемешать встряхиванием. Перенесите весь образец предоставленному ротационную колонку, место в пробирку для сбора 2 мл, и центрифугировать в течение 1 мин при ≥8,000 х г.
- Откажитесь отборная труба спроточный и поместите колонку спина в новой коллекции трубки 2 мл. Добавить 700 мкл буфера AW1 в ротационную колонку, центрифуги в течение 15 сек при ≥8,000 XG, отбросить проточные и повторно использовать пробирку для сбора.
- Добавить 700 мкл буфера aw2 в ротационную колонку, центрифуги в течение 15 сек при ≥8,000 XG, отбросить проточные и повторно использовать пробирку для сбора. Затем добавьте 700 мкл 100% этанола в ротационную колонку, центрифуге в течение 15 секунд при ≥8,000 XG и выбросить пробирку для сбора с проточные.
- Поместите колонку спина в новой коллекции трубки 2 мл, откройте крышку спиновой колонки и центрифугу на полной скорости в течение 5 мин. Откажитесь отборная труба с проточные.
- Поместите колонку отжима в новой 1,5 мл пробирку для сбора и добавить 25 мкл нагретого нуклеазы без воды (50 ° C). Инкубируйте колонку и трубку при 50 ° С в течение 10 мин. Центрифуга в течение 1 мин при максимальной скорости, добавить 25 мкл нуклеазы без воды (RT) в колонну и инкубировать1 мин при комнатной температуре.
- Центрифуга в течение 1 мин при максимальной скорости (21130 XG) и сбора урожая проточных, содержащей геномную ДНК (примерно 50 мкл ДНК в общей сложности). Хранить колонку при -20 ° C (в случае, если требуется другая элюирование позже).
Результаты
Этот протокол представляет собой оптимизированный способ извлечения ДНК и РНК из ядер тканей, с использованием модификаций коммерческой системы, предназначенной для извлечения срезов тканей. Оптимизация включали введение гомогенизацией ткани, использование более мощного протеиназы К для экстракции ДНК, а также продление срока ткани пищеварения. Графики и статистические анализы включали 2-дисперсионный анализ, линейная регрессия и корреляция.
Оптимизации протеиназы пищеварении
Коммерческий набор включал при комнатной температуре раствор стабилен протеиназы К , который был заменен более сильным протеиназы К, что приводит к более высокому выходу ДНК (фиг.2А). Для дальнейшего повышения урожайности ДНК, переваривание была продлена от 2 до 24 часов. Никаких существенных различий не наблюдалось между двумя временными точками, но 24 часа пищеварение появился, чтобы обеспечить более последовательные урожаи через саmples. Однако дальнейшее инкубирование до 48 ч не приводит к дальнейшему улучшению восстановления ДНК (рис 2В; р = 0,74).
Типичный Восстановление ДНК из FFPE рака простаты образцов тканей
С помощью оптимизированного протокола, РНК и ДНК были совместно извлеченный из 333 простаты образцов рака FFPET в пределах от 3 до 14 лет, в возрасте образца. Из каждого образца, 3 сердечников ткани ( в среднем общий объем ткани 0,95 ± 0,13 мм 3) были использованы в качестве входных данных. Хотя существуют и другие методы, основанные на гель-электрофорез микрофлюидальные, которые могут оценивать концентрацию и обеспечивают оценку распределения размеров нуклеиновых молекул кислоты, такие способы не обеспечивают воспроизводимости нуклеиновых кислот квантификации, и не может различить РНК и ДНК, как анализы flourometrically основе делают. 22 И, поскольку микрофлюидальные на основе результатов гель-электрофорез не являются надежными для фрагментированнуклеиновые кислоты , полученные из FFPET, 23 выходы нуклеиновых кислот были измерены флуорометрически (см список реагентов для более подробной информации). Средний выход составил 2270 нг РНК и 820 нг ДНК (рис 3А). Примерно 90% всех образцов FFPET анализируемых в данном исследовании, дали ≥100 нг ДНК и ≥ 500 нг РНК. Интересно отметить , что не было никакой существенной корреляции между возрастом образца FFPET и восстановления нуклеиновой кислоты (рис 3б). В целом, доходность РНК и ДНК были соотнесены через образцы (R 2 = 0,39; р <0,0001), хотя и более чем в два раза больше , чем РНК ДНК выделяли из каждого образца (рис 3C).
Как пилот и оптимизация работы были выполнены на ткани простаты, следующим шагом было изучение эффективности этого протокола на несколько дополнительных типов архивных ткани. Начиная с удалены хирургическим путем и аутопсии образцы FFPET представляющие бытьnign печени (1 проба из 1 случай), рак головного мозга (8 образцов от 1 случая), мочевого пузыря (2 пробы из 2-х случаях) и груди (3 образца из 3 случаев), протокол дали> 100 нг ДНК и РНК из 90% образцов (рис 3D). В то время как урожайность нуклеиновых кислот были ниже в тканях аутопсии, чем в хирургических тканей, репрезентативные результаты указывают на то, что протокол приводит к таким же урожаи через раков, полученных из различных участков.
Оценка РНК и ДНК Целостность и их представитель Производительность в Downstream Анализ
экспрессии РНК анализ 47 генов в 8 отобранных FFPET образцов рака простаты и свежий PC-3 образца клеток рака простаты линии (в качестве положительного контроля) проводили с использованием коммерческой экспрессии гена платформы multianalyte, которая оптимизирована для FFPET. Отсчеты мРНК в PC3 были, как правило, выше, чем те, из FFPET саmples (фиг.4А). Однако, сравнивая относительную экспрессию всех генов, FFPET образцов рака простаты показали сходные профили экспрессии для PC-3 РНК, что свидетельствует о том, что оба источника РНК пригодны для экспрессии РНК профилирования.
Для того, чтобы продемонстрировать эффективность геномной ДНК , извлеченной с этим протоколом, бисульфит-преобразованное экстракты ДНК из образцов FFPET амплифицировали с помощью метилирования специфической ПЦР (ПНС). 24 MSP анализ ALU повторяющихся элементов, сильно метилированных областей , присутствующих в миллионах копий в геноме человека, 25 использовали в качестве контроля геномного метилирования, и , как ожидается, показывают минимальные вариации между образцами. Как показано на фиг.4В, не было практически никакого изменения наблюдаются между различными образцами уровней метилирования АЛУ MSP. Кроме того, MSP Анализы , основанные на GSTP1, в известный ген гиперметилированы при раке простаты , но не в доброкачественных образцах, 26 не показало заметных amplifications в ДНК из доброкачественных образцов. Как и следовало ожидать, более низкие пороговые значения КПЦР цикла были обнаружены в ДНК раковых тканей, что указывает на обогащение метилированных GSTP1 копий. Полезность нуклеиновых кислот, извлеченных из этого протокола был дополнительно протестирован в типичных последующих анализах с использованием нуклеиновых кислот, извлеченных из доброкачественного печени и от мозга (посмертного) и из двух удаленных хирургическим путем образцов рака молочной железы. Оба на основе экспрессии и MSP анализы RT-КПЦР хорошо зарекомендовал себя на рак молочной железы и FFPET печени, но анализ RT-PCR не удалось амплификации с высоким уровнем экспрессии мРНК из образца опухоли мозга посмертного (рис 4в), предполагая , что РНК деградировали, вероятно, из-за фиксации отсроченной ткани.
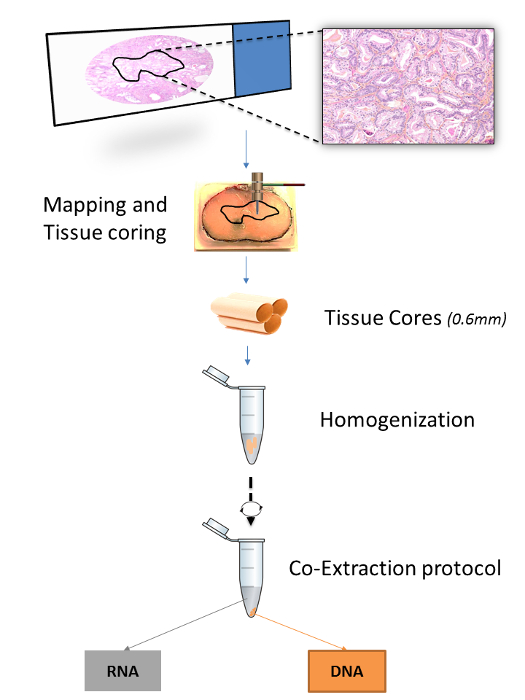
Рисунок 1:. Обзор процедуры экстракции для FFPET образцов На рисунке показано , как область интереса вблок ткани отображается на основе гистологического выбора из предметного стекла микроскопа. Три ядра ткани 0,6 мм затем получают из каждой области ткани с помощью биопсии пунши, гомогенизируют вместе и затем подвергают экстракции как ДНК и РНК. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
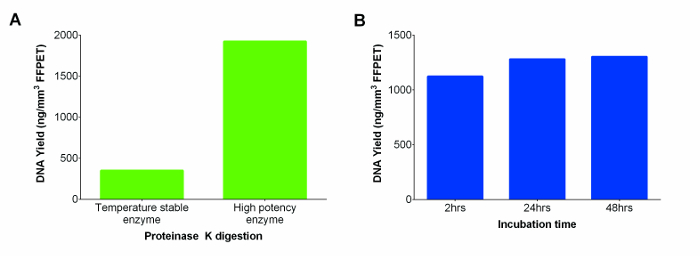
Рисунок 2: нуклеиновые кислоты (ДНК и РНК) дает в нг / мм 3 из FFPET из двух протеиназы К (температура Стабильная и высокоэффективная Ферменты) и испытано через диапазон Инкубационный времена для последнего (А) Производительность протеиназы К. от разных поставщиков. экстракция ДНК проводились на репрезентативной выборке с использованием FFPET температуры стабильный фермент, поставляемый вместе с кона по сравнению с более мощным фермента от другого производителя. (B) Определение оптимального протеиназы К времени инкубации , чтобы максимально увеличить выход ДНК. Производительность высокой концентрации протеиназы К пищеварения оценивали при трех различных периодов инкубации с использованием 3 образцов FFPET. Усы представляют собой стандартную ошибку среднего (SEM). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
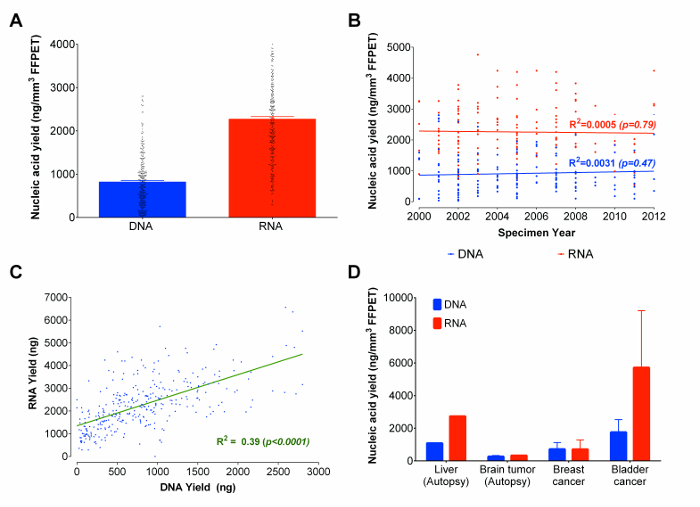
Рис . 3: нуклеиновые кислоты (ДНК и РНК) дает в нг / мм 3 из FFPET в общем, через эталонных лет и представительных типов тканей (A) Всего выздоровел нуклеиновых кислот из фиксированных формалином парафин ткани. Нуклеиновые кислоты, представленные величины основаны на извлечений 333 образцов FFPET Uпеть оптимизированный протокол. (В) Корреляция участок между извлеченной общей ДНК и РНК , а также возраст образцов FFPET. Извлеченные образцы FFPET , используемые были получены от 2000 года до 2012 года (C) Соотношение между выходами из параллельно извлеченной ДНК и РНК из 333 образцов простаты. Существует положительная корреляция между выходами ДНК и РНК. (D) Демонстрация с использованием протокола дополнительных типов архивных тканей. Оптимизированный протокол был использован для извлечения нуклеиновых кислот из 14 рака (молочной железы, мочевого пузыря и головного мозга) и нормальных (печень) образцов. Усы представляют собой SEM. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
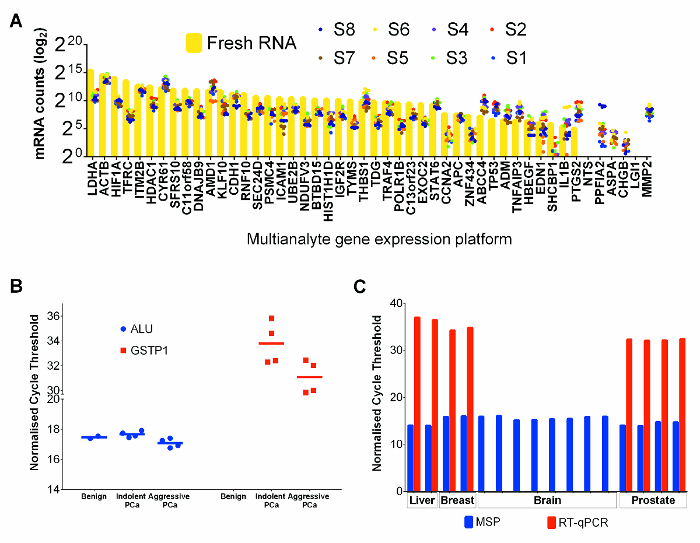
Рисунок 4: Производительность РНК и ДНК Co-извлеченный из Tissuе Ядра в нижнем течении приложений. (А) мРНК подсчитывает для раковых тканей FFPE простаты и для свежего PC-3 контроля клеточной линии. Каждая точка представляет собой среднее из 3 технических повторах добытых отдельно. Значения РНК Fresh PC-3 клеточной линии показаны желтыми барами и значениями ткани FFPET представлены цветными точками. (B) метилирования специфические ПЦР - анализ на ДНК FFPET образцов рака простаты. пороговые значения цикла были получены для 10 образцов, выполненных, как и ожидалось, используя 50 нг / реакцию бисульфита преобразованной ДНК. ALU MSP анализы из всех образцов FFPET имели сходные пороговые значения цикла (р> 0,67). GSTP1 анализы показали MSP более высокую метилирование (нижний пороговый цикл) уровней при раке простаты, чем в доброкачественной простаты. (C) Оценка ДНК и РНК качества из дополнительных типов тканей. экспрессии генов и генных HPRT1 Alu метилирования анализы проводили на нуклеиновых кислот (РНК и ДНК, соответственно), извлекаемые ниMAL печени (вскрытие трупа), и мозг (Вскрытие) и рак молочной железы (все FFPET). Результаты простаты показаны для сравнения. Примечание: Сходные результаты были получены от каждого типа ткани, для амплификации мРНК неудачной из одного образца аутопсии за исключением того. Каждая точка или бар представляет собой образец, и Столбики ошибок обозначают SEM. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Тканевые Сердечники | |||||||||||
| Ткань ввода (мм3) | Извлеченные нуклеиновые кислоты | Проверка | Контроль качества: ДНК | Контроль качества: РНК | |||||||
| (# Образцов) | Возраст образца (лет) | Общий выход (нг) | Размер фрагмента (п.о.) | ПЦР | Общий выход (нг) | Размер фрагмента (п.о.) | ПЦР | NanoString | |||
| Пикор и др. | 43 - 129 | ДНК | Нет данных | Нет данных | Нет данных | Нет данных | |||||
| Монтасер-Kouhsari и др. | 18 - 29,5 | РНК | 763 | 0-25 | 843 | Нет данных | |||||
| Эта бумага | 1,71 | ДНК и РНК | > 350 | 3-12 | 820 | 100 - 500 |  | 2270 | 100-500 |  | /ftp_upload/54299/check_mark.jpg "/> |
| Тканевые Разделы | |||||||||||
| Ткань Входной | Извлеченные нуклеиновые кислоты | Проверка | Контроль качества: ДНК | Контроль качества: РНК | |||||||
| (# Образцов) | Возраст образца (лет) | Общий выход (нг) | Размер фрагмента (п.о.) | ПЦР | Общий выход (нг) | Размер фрагмента (п.о.) | ПЦР | NanoString | |||
| Хейкал и др. | 5 х 5 мкм | ДНК | 12 | 7-22 | 88-300 | 103-351 |  | ||||
| Chung и др. | 1 х 20 мкм | РНК | 9 | > 5 | 16,000- 23000 | 100-200 |  | ||||
| Antica и др. | 2 х 4 мкм | РНК | 18 | Нет данных | Неизвестный (621 нг / мкл) | 80-202 + |  | ||||
| Ghatak и др. | 5 х 5 мкм | ДНК и РНК | 5 | 1 | 14 256 | <1030 |  | 16 000 | 109-400 + |  | |
| Хенниг и др. | 1 × 10 мкм | ДНК и РНК | 210 | 1-25 | Нет данных | Нет данных |  | Нет данных | Нет данных |  | |
| Лазерная Захват микродиссекция | |||||||||||
| Ткань ввода (мм2) | Извлеченные нуклеиновые кислоты | Проверка | Контроль качества: ДНК | Контроль качества: РНК | |||||||
| (# Образцов) | Возраст образца (лет) | Общий выход (нг) | Размер фрагмента (п.о.) | ПЦР | Общий выход (нг) | Размер фрагмента (п.о.) | ПЦР | NanoString | |||
| Снег и др. | 1-2 | ДНК | 110 | 0-2 | 430 | Нет данных |  | ||||
Таблица 1:. Сравнение опубликованных ДНК и экстракции РНК протоколов для сердечников тканей, секций и лазерного захвата microdissections Также включены несколько оценки молекулярных конечных точек этих методов с использованием ПЦР и Nanostring анализов.
Обсуждение
Для успешного извлечения ДНК и РНК из тканей областей, представляющих интерес, точный отбор керна имеет решающее значение. Этот протокол описывает использование штампа ткани для изоляции стержней диаметром 0,6 мм и описывается процесс переноса нотации из стекла микроскопа в соответствующие FFPET блоки. Изменения в протоколе изготовителя были необходимы для эффективного извлечения нуклеиновых кислот из ядер, которые примерно в 50 раз толще, чем микротомных секций, для которых протокол был предназначен. Поскольку ядра могут содержать больше парафина относительно срезов тканей, эффективной депарафинизации ядер посредством повторных этапов ксилола и обработки этанола требуется. Успех шагов после депарафинизации зависит от правильной механической сердечников ткани гомогенизации и эффективность протеиназы К пищеварения. Дальнейшая оптимизация протеиназы К пищеварения может быть выполнена.
Стоит отметить, что этот метод идентифицируетFies области, представляющие интерес на поверхности блока, как они определены в соответствующих гистопатологией слайдов. В качестве основных урожаями ткани, которая может быть 3 или 4 мм, пользователи этого протокола могут быть обеспокоены тем, что клетки или ткани лежат под поверхностью блока. Хотя это действительный интерес, многочисленные исследования (обзор в ссылке 27) показали , что ядра ткани точно представляют гистологические и молекулярные особенности блоков патологических тканей, особенно при двух или трех повторностях ядер отбираются из зоны интереса.
По мере того как модифицированный коммерческий набор для выделения принятой в данном протоколе обеспечивает одновременное извлечение ДНК и РНК из той же ткани, протокол сохраняет драгоценное биологический материал и позволяет проводить прямое сравнение между двумя результирующими нуклеиновых кислот из того же образца. Параллельное извлечение РНК и ДНК сокращает истощение труда и ткани в два раза, и позволяет точно комплексный анализ гена выражession, а также эпигенетические и генетические особенности, найденные в ДНК. Поскольку урожайность как РНК и ДНК из этих ядер представительных тканей, как правило, превышает 600 и 300 нг, соответственно, и так как большинство современных ПЦР и секвенирования следующего поколения приложений, как правило, требуют 10-100 нг, большинство образцов очищенных этим протоколом должны обеспечивать адекватное материал для нескольких последующих анализов. Этот протокол был показано, воспроизводимые через независимые лаборатории (Selvarajah и др., В стадии подготовки.). РНК из этого протокола было достаточного качества для анализа экспрессии генов с использованием либо RT-PCR или популярную платформу multianalyte, и ДНК хорошо зарекомендовал себя в метилирования конкретных ПЦР-анализов. Будущие исследования, направленные на оценку полезности добываемых нуклеиновых кислот в следующей последовательности поколения являются оправданными.
Таким образом, несколько модификаций были сделаны к коммерчески доступным протокол, предназначенный для тонких срезов FFPET, что делает его подходящим FOг совместное извлечение РНК и ДНК из ядер FFPET 0,6 мм. Протокол продемонстрировал стабильно высокие урожаи в большой группе образцов рака простаты и в ограниченном наборе образцов из рака молочной железы, головного мозга и мочевого пузыря. В целом, протокол должен позволить пользователям осуществлять целевые анализы генов на основе крупных хорошо аннотированных коллекций тканей. Важно отметить, что протокол позволяет эффективно осуществлять целенаправленную выборку областей, представляющих интерес в FFPET, относительно мало практического времени, и достаточно высокие урожаи для большинства последующих применений.
Раскрытие информации
The authors declare no competing financial interests.
Благодарности
This research was supported by a team grant from Movember/Prostate Cancer Canada to JMSB, DMB, PCP, and JL, and by the Ontario Institute of Cancer Research (JMSB, DMB, and PCP) and Motorcycle Ride for Dad Kingston/University Hospitals Kingston Foundation/Kingston General Hospital (DMB, PCP).
Материалы
| Name | Company | Catalog Number | Comments |
| Plastic paraffin film, "Parafilm 'M'" | Bemis | RK-06720-40 | Any generic paraffin film will work as a substitute |
| Sodium Hypochlorite, "Ultra Bleach" | Likewise | 53-2879-2 | Any generic bleach will work as a substitute. Hazardous material that can cause burns on contact. |
| Molecular biology grade absolute ethanol | Fisher BioReagents | BP2818-500 | Sigma-Aldrich E7023 suffices as a substitute |
| Molecular Grade H2O | G-Biosciences | 786-293 | Sigma W4502 suffices, as well as any other brand of molecular grade H2O |
| 0.6 mm Punch Set for Beecher Instruments | Estigen | MPO6[Yellow] | Make sure to use the red receiver punch from the set |
| Fine point permanent marker | Sharpie | 10365796S | Using the marker on FFPE tissues causes it to dry out quickly, so several may be required |
| FFPE tissue block | |||
| Stained tissue slide corresponding to FFPE block | |||
| 1.5 ml Micro-Centrifuge Tubes | Fisher BioReagents | 05-408-137 | |
| 2.0 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431048 | |
| 1.5 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431021 | |
| Histology Xylene | VWR | CA 95057-822 | Fisher Scientific X5-500 suffices as a substitute |
| Molecular Biology Grade 2-Propanol | Sigma | I9516 | |
| AllPrep FFPE DNA/RNA Kit | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Buffers: RLT, FRN, RPE, ATL, AL, AW1, AW2, DNaseI solution | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Temperature stable proteinase K | Qiagen | 80234 | |
| High potency proteinase K | Invitrogen | 25530-049 | Invitrogen 25530-015 suffices as a substitute |
| RNAse neutralizing solution (Rnase AWAY) | Molecular BioProducts | 7003 | |
| RNaseA 100 mg/ml | Qiagen | 19101 | |
| BD Integra Syringe 3 ml 21G x 1/2 | BD | 305274 | |
| Motorized tissue homogenizer (TissueRuptor) | Qiagen | 9001271 | Fisher Scientific 14-261-29 suffices as a substitute |
| -20 °C and -80 °C Laboratory Freezer | |||
| Micro-Centrifuge with rotor for 2 ml tubes | |||
| Digital Vortex Mixer | |||
| Pipettes and filter tips | |||
| Heating blocks or water baths | |||
| Tris Hydrochloride | Amresco | 0234 | |
| Sodium Chloride | Amresco | 0241 | |
| Anhydrous Magnesium Chloride | Sigma | M8266 | |
| Sodium Dodecyl Sulfate | Sigma | L4509 | |
| Acrodisc 25 mm syring filters with 0.45 µm Supor membrane | Pall | PN 4614 | |
| Syringe with retracting BD PrecisionGlide needle 3 ml | BD Integra | 305274 | |
| Hydrochloric Acid | BDH | 3026 | |
| Multianalyte gene expression platfrom (nCounter ® CAE codeset and Nanostring nCounter platform) | Nanostring nCounter platform, Nanostring | ||
| Fluorometric nucleic acid quantification (Qubit dsDNA HS Assay Kit and Qubit® RNA BR Assay Kit) | Invitrogen |
Ссылки
- Kern, S. E. Why your new cancer biomarker may never work: recurrent patterns and remarkable diversity in biomarker failures. Cancer Res. 72 (23), 6097-6101 (2012).
- Klopfleisch, R., Weiss, A. T. A., Gruber, A. D. Excavation of a buried treasure--DNA, mRNA, miRNA and protein analysis in formalin fixed, paraffin embedded tissues. Histol. Histopathol. 26 (6), 797-810 (2011).
- Beltran, H., et al. Targeted Next-generation Sequencing of Advanced Prostate Cancer Identifies Potential Therapeutic Targets and Disease Heterogeneity. Eur. Urol. 63 (5), 920-926 (2013).
- Hoppin, J. A., Tolbert, P. E., Taylor, J. A., Schroeder, J. C., Holly, E. A. Potential for selection bias with tumor tissue retrieval in molecular epidemiology studies. Ann. Epidemiol. 12 (1), 1-6 (2002).
- von Ahlfen, S., Missel, A., Bendrat, K., Schlumpberger, M. Determinants of RNA quality from FFPE samples. PLOS ONE. 2 (12), e1261 (2007).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Pikor, L. A., Enfield, K. S. S., Cameron, H., Lam, W. L. DNA extraction from paraffin embedded material for genetic and epigenetic analyses. J. Vis. Exp. (49), (2011).
- Turashvili, G., et al. Nucleic acid quantity and quality from paraffin blocks: defining optimal fixation, processing and DNA/RNA extraction techniques. Exp. Mol. Pathol. 92 (1), 33-43 (2012).
- Espina, V., et al. Laser-capture microdissection. Nat. Protoc. 1 (2), 586-603 (2006).
- Hackler, L., Masuda, T., Oliver, V. F., Merbs, S. L., Zack, D. J. Use of laser capture microdissection for analysis of retinal mRNA/miRNA expression and DNA methylation. Methods Mol. Biol. 884, 289-304 (2012).
- Bonin, S., Stanta, G. Nucleic acid extraction methods from fixed and paraffin-embedded tissues in cancer diagnostics. Expert Rev. Mol. Diagn. 13 (3), 271-282 (2013).
- Bonin, S., et al. Multicentre validation study of nucleic acids extraction from FFPE tissues. Virchows Archiv. 457 (3), 309-317 (2010).
- Montaser-Kouhsari, L., et al. Image-guided Coring for Large-scale Studies in Molecular Pathology. Appl. Immunohistochem. Mol. Morphol. , (2015).
- van Eijk, R., Stevens, L., Morreau, H., van Wezel, T. Assessment of a fully automated high-throughput DNA extraction method from formalin-fixed, paraffin-embedded tissue for KRAS, and BRAF somatic mutation analysis. Exp. Mol. Pathol. 94 (1), 121-125 (2013).
- Ghatak, S., Sanga, Z., Pautu, J. L., Kumar, N. S. Coextraction and PCR Based Analysis of Nucleic Acids From Formalin-Fixed Paraffin-Embedded Specimens. J. Clin. Lab. Anal. , (2014).
- Hennig, G., et al. Automated extraction of DNA and RNA from a single formalin-fixed paraffin-embedded tissue section for analysis of both single-nucleotide polymorphisms and mRNA expression. Clin. Chem. 56 (12), 1845-1853 (2010).
- Snow, A. N., Stence, A. A., Pruessner, J. A., Bossler, A. D., Ma, D. A simple and cost-effective method of DNA extraction from small formalin-fixed paraffin-embedded tissue for molecular oncologic testing. BMC Clin. Pathol. 14 (1), 30 (2014).
- Torrente, M. C., et al. DNA extraction from formalin-fixed laryngeal biopsies: Comparison of techniques. Acta Otolaryngol. 131 (3), 330-333 (2011).
- Okello, J. B. A., et al. Comparison of methods in the recovery of nucleic acids from archival formalin-fixed paraffin-embedded autopsy tissues. Anal. Bochem. 400 (1), 110-117 (2010).
- Abramovitz, M., et al. Optimization of RNA extraction from FFPE tissues for expression profiling in the DASL assay. BioTechniques. 44 (3), 417-423 (2008).
- . . AllPrep DNA/RNA FFPE Handbook. , (2012).
- Laurent, L. C., et al. Meeting report: discussions and preliminary findings on extracellular RNA measurement methods from laboratories in the NIH Extracellular RNA Communication Consortium. Journal of Extracell. Vesicles. 4, (2015).
- . Methods of RNA Quality Assessment Available from: https://www.promega.ca/resources/pubhub/methods-of-rna-quality-assessment (2012)
- Herman, J. G., Graff, J. R., Myohanen, S., Nelkin, B. D., Baylin, S. B. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad. Sci. U.S.A. 93 (18), 9821-9826 (1996).
- Weisenberger, D. J., Campan, M., et al. Analysis of repetitive element DNA methylation by MethyLight. Nucleic acids research. 33 (21), 6823-6836 (2005).
- Yegnasubramanian, S. Hypermethylation of CpG Islands in Primary and Metastatic Human Prostate Cancer. Cancer Res. 64 (6), 1975-1986 (2004).
- Parsons, M., Grabsch, H. How to make tissue microarrays. Diagn. Histopathol. 15 (3), 142-150 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены