Method Article
RNA 및 DNA 추출 모두 포르말린 고정 파라핀 - 임베디드 조직 코어의 제조
요약
이 수정 추출 프로토콜은 조직 병리학 적 조직 블록에 대한 관심이 더 정확하게 대상 지역의 RNA 및 DNA 수율을 향상시킨다.
초록
Formalin-fixed paraffin embedded tissue (FFPET) represents a valuable, well-annotated substrate for molecular investigations. The utility of FFPET in molecular analysis is complicated both by heterogeneous tissue composition and low yields when extracting nucleic acids. A literature search revealed a paucity of protocols addressing these issues, and none that showed a validated method for simultaneous extraction of RNA and DNA from regions of interest in FFPET. This method addresses both issues. Tissue specificity was achieved by mapping cancer areas of interest on microscope slides and transferring annotations onto FFPET blocks. Tissue cores were harvested from areas of interest using 0.6 mm microarray punches. Nucleic acid extraction was performed using a commercial FFPET extraction system, with modifications to homogenization, deparaffinization, and Proteinase K digestion steps to improve tissue digestion and increase nucleic acid yields. The modified protocol yields sufficient quantity and quality of nucleic acids for use in a number of downstream analyses, including a multi-analyte gene expression platform, as well as reverse transcriptase coupled real time PCR analysis of mRNA expression, and methylation-specific PCR (MSP) analysis of DNA methylation.
서문
유전체 바이오 마커 연구는 정확하고 신뢰성 질병 상태를 반영하고, 임상 적으로 유용한 방식으로 그렇게. 한 바이오 마커의 개발은 잘 주석 조직 샘플의 후 향적 분석에 의존 분자 상관 관계를 파악하고자한다. 질병과 정상 조직 샘플은 신선한 냉동 조직 전문 바이오 뱅크 또는 임상 아카이브에서 포르말린 고정 파라핀 조직 (FFPET) 블록으로 하나 저장됩니다. 신선한 냉동 조직 고품질 핵산의 추출을 허용 널리 게놈 바이오 마커 발견 연구에 사용되었다. 2,3- 다소 적은 조직 샘플은 바이오 뱅크에 사용할 수 있으며, 이러한 조직을 연구하는 것은 큰 샘플 특이 카테고리 향해 바이어스를 소개 뱅크 조직에 큰 능력을 가진 전문 센터에서 보이는 질환의 환자. 4 FFPET 대조적 질환 인간 및 동물 조직의 기본 저장 방법이다. FFPET 블록 셀룰러 m을 유지하면서orphology, 정착 프로세스 가교 핵산이 다른 세포 성분. 가교 RNA 및 DNA 복구 할 수 있습니다,하지만 성능 저하, 높은 조각난 형태. 5,6 그러나, 이러한 DNA 및 RNA 조각은 mRNA 발현, DNA 메틸화 및 타겟 시퀀싱을 포함하여 분석의 확장 배열에 의해 분석 의무가 있습니다. 7,8-가 다량 연구 가능한 FFPET의 다양한 기회를 이용하기 위해 효율적이고 신뢰성있는 추출 프로토콜에 대한 필요성이 존재한다.
조직에서 바이오 마커 연구의 큰 비율은 암에 초점을 맞추고 있습니다. 병에 걸린 조직의 다른 유형과 마찬가지로, 암 조직은 종종 세포의 보존과 세포 유형에서 중요한 지역 이질성을 보여줍니다. 바이오 마커 연구 분자 기능 환부 조직의 구성 요소의 상관 관계를 할 수있는 능력에 의존하기 때문에,이 프로세스의 중요한 단계는 잘 보존 D 및 충실 조직의 정확한 수확이다연구 대상 isease. FFPET에서,이 농축 기술이 자주 이용된다 : 레이저 캡처 미세 절제 (LCM) 및 마이크로톰 절편. LCM은 높은 조직 채취 집중 가능 이종 조직에서 특이 잘 보존 된 세포 유형을 분리 할 수있다. 9,10 그러나 LCM 샘플 다수 위해 소모 엄청나게 시간 고가의 장비를 필요로하고있다. 마이크로톰 단면이 얇은 섹션 FFPET 블록에서 절단보다 널리 사용되는 방법이다. (11, 12) 마이크로톰 컷 부분은 종종 세포의 보존에 이기종입니다 조직을 포함한다 (예를 들어, 괴사 대 잘 보존)와 구성 (예를 들어, 암 대 따라서 양성 실질)과는 별도로 조사 최선의 분자 기능의 균질화가 발생할 수 있습니다. 따라서, 관심있는 세포가 풍부 고 처리량 방법이 요구된다. 세 번째 방법, FFPET 코어로부터 핵산의 분리는이 농축을 제공 높은 통해 서 적합프로토콜 hput, 분리 조직 코어로부터 RNA 또는 DNA를 분리하는 다른 사람에 의해 이용되고있다. 7,13,14
게시 된 프로토콜의 숫자는 FFPET (표 1)에서 핵산을 추출하는 방법을 지정합니다. 그러나, RNA 및 DNA가 같은 조직으로부터 추출 된 프로토콜이 아닌 조직 코어를 들면, 마이크로톰 조직 섹션에 최적화되어있다. 조직 특이성을 증가 제공 (15, 16) 마찬가지로, 출판 프로토콜을 하나의 조직 코어 또는 슬라이드 microdissections를 통해 절차를 지정 DNA의 추출,하지만 여기되지 RNA. 7,17, 같은 조직 코어에서 모두 DNA와 RNA의 이중 추출을위한 최적화 된 프로토콜에 대한 설명된다. 조직 코어는 FFPET 블록에 매핑 관심의 영역으로 조직 마이크로 어레이 (TMA) 펀치를 삽입하여 수확. 매핑은 마커 펜 현미경 슬라이드에 주석 및 대응 FFPE의 표면에 주석을 전사함으로써 수행T 블록 (그림 1).
이 프로토콜의 개발을 주도 이전 작업은 몇몇 시판의 핵산 추출 시스템의 비교를 포함. 이 비교에서, 상업적 프로토콜 변형은 후술하는 바와 같이 높은 DNA 및 RNA 수율 및 품질 (Selvarajah 외., 준비하여) 제공 하였다. 조직 코어는 전형적 FFPET 추출 11,12,14,18 프로토콜에서 사용되는 5-10 μm의 미크론 부보다 두꺼운 - 20 파라핀보다 다양한 양을 함유 할 수있다. 이를 보상하기 위해, 탈 파라핀 크실렌, 에탄올 치료를 반복하여 동력 균질화 공정 (도 1)을 도입함으로써 확장되었다. 또한, 단백질 분해 효소 K 분해 시간은 DNA 수율을 높이기 위해 연장되었다. 전반적으로,이 프로토콜은 비용 효과적이고 라 질병의 분자 병리 조직 학적 기능 사이의 결합의 설립을 가능하게RGE 잘 특성화 인구. 전체의 프로토콜은 전문 또는 고가의 장비에 대한 약간의 필요에 손에 시간이 3 시간을 포함하여 2 일 이내에 안정적으로 수행 할 수있다.
단계별 프로토콜은 제조 업체의 프로토콜의 수정 된 버전으로 이하이다. (21)는 특정 시약, 장비 및 제조 업체에 대한 자재 / 장비의 표를 참조하십시오.
프로토콜
1. 조직 코어 링
- 현미경 슬라이드를 검토하고 미세 포인트 영구 마커를 사용하여 관심 영역 (들)을 설명합니다. 현미경 슬라이드에 관심 영역을 커버하기에 충분히 큰 파라핀 필름의 단면을 잘라. 단단히 슬라이드 필름을 놓고 미끄러지는 필름을 유지하기 위해 가장자리를 통해 영화를 포장. 하지만 외부 - - 지역 (들) 좋은 점 영구 마커를 사용하여 개요 접촉을 유지, 전체 조직과 조직 내에서 관심 영역 (들)을 설명합니다.
- 필름을 제거하고 해당 조직 블록으로 전달. (도 1)을 내리고 또는 전체 조직의 윤곽이 블록의 조직 관찰 형상과 일치하도록 그 회전에 의해 필름의 방향. 단단히 미끄러짐을 방지하기 위해 블록의 표면에 필름의 단면을 누른다.
- 영구 마커의 팁을 사용하여 영역 (들)의 윤곽에 따라 (~ 0.2 mm) 얕은하지만 눈에 보이는 톱니을의 terest, 다음 필름을 제거합니다. 로드 별도 1.5 또는 2.0 ml의 마이크로 원심 튜브에 표백제, 70 % 에탄올 1 mL 및 물.
- 끝이 튜브 함유 표백제로 침수 상태에서 위아래로 여러 번 펀치를 밀어 설정 한 0.6 mm 펀치의 수용체 (적색) 펀치를 청소합니다. 70 % 에탄올 및 물로 상기 단계를 반복 (즉 표백을 위해 중요 제거한다).
- 3mm의 깊이로 관심의 영역 내부 조직에 펀치를 누르고 펀치를 철회. 스타일러스와 펀치 밖으로 밀어 1.5 2 ML 튜브를 결합 낮은에 코어를 놓습니다. -20 ° C (장기) 또는 단기 사용을위한 4 ° C에서 코어를 저장합니다.
- 1.4 단계로 다음 지역 또는 샘플을 계속 따라 펀치를 청소합니다.
2. FFPE 조직 코어를 Deparaffinize
- 티슈 코어에 1 ㎖의 크실렌을 첨가하고, 10 초 동안 격렬하게 볼 텍싱하여 1.5 ml의이 튜브 Carryout의 탈 파라핀. 난방50 ℃에서 3 분 동안 t.
- 실온 (RT)과 5 분 동안 얼음에 최대 속도 (21,130 XG)과 장소 관에서 2 분 동안 원심 분리기 (밀랍 잔류 상단에 응고 할 수 있습니다).
- 조심스럽게 크실렌 치료를 피펫 팁을 사용하여 상층 액과 반월 상 연골 주위에 축적 된 파라핀을 제거하고 반복 (2.1-2.2 단계).
- 10 초 동안 적극적으로 에탄올 (100 %)와 소용돌이의 1 ML을 추가합니다. RT (최대 속도)에서 2 분 동안 원심 분리기 조심스럽게 에탄올을 버린다. 일단 위의 단계를 반복합니다.
탈 파라핀 코어의 3 균질화
- 균질화 전에 에탄올 (100 %) 700 μL에 재현 탁 코어. 전동 조직 균질를 사용하여 미세 조직 입자에 코어를 갈기 (~ 중간 설정 1 분). 이월 오염을 최소화하기 위해 각 샘플 사이의 균질 프로브를 청소합니다.
- ~ 표백제의 RNase 중화 용액과 70 % 에탄올 10 ㎖를 15 ㎖의 튜브를 입력합니다. 샘플 호모 후genization는 위에서 설명한 순서로 세척 용액의 각각에 균질 프로브를 세척한다. 세척 단계에서 최고 속도의 균질화를 실행합니다.
- 조직과 프로브를 닦고 프로브가 다음 샘플을 균질화하기 전에 완전히 건조 할 수 있습니다. 시각적으로 잔여 조직 조각 용 프로브 블레이드를 검사합니다. 발견하는 경우, 다시 프로브를 청소합니다. 일일 세정액 (표백제, 에탄올의 RNase 중화 용액)을 변경한다.
- 균질화 후, 더욱 100 % 에탄올 (~ 300 μL)을 첨가하여 용액으로 한 샘플 볼륨을 가져온다. 15 분 동안 최대 속도로 원심 분리기 조심스럽게 RNA 추출을 진행하기 전에 약 15 ~ 20 분 동안 에탄올과 공기 건조 펠렛을 대기음.
테 K 4. 소화
- 펠렛을 느슨하게하는 150 ㎕의 테 K 소화 버퍼의 펠릿과 영화 튜브를 재현 탁. 온도 안정 테 K의 10 μl를 추가하고 쓸어 넘겨 혼합 (안) 튜브를 소용돌이. 온화한 교반과 함께 15 분 동안 56 ° C에서 튜브의 콘텐츠를 부화.
- 튜브는 3 분 동안 얼음에 품어 할 수 있습니다. 전체 냉각은 다음 공정에서 효율적으로 침전 중요하다. 최대 속도에서 15 분 동안 원심 분리기.
DNA 5. 분리 된 RNA
- 조심 RNA 정제하는 새로운 1.5 ml의 펠렛을 방해하지 않고, 상등액을 옮긴다.
- DNA 정제 용 펠렛을 (펠릿을 -20 ℃에서 1 일까지 2-8 ℃에서, 또는 더 긴 기간에 대해, 실온에서 2 시간 동안 저장 될 수있다) 것.
6. RNA 정제
- 15 분 동안 80 ℃에서의 RNA 함유 상등액을 인큐베이션 (이 시간을 초과하지 않도록). 다음에, 잠시 뚜껑 내부로부터 방울을 수집 튜브를 원심 분리기.
- 결합 조건을 조정하고, 피펫 팅하여 혼합 320 μL 버퍼 RLT을 추가합니다. 다음, 720 ㎕의 에탄올 (100 %), 그리고 소용돌이를 추가합니다.
- 이전 62 ml의 수집 튜브에 넣고 (키트에 제공됨) RNA 스핀 컬럼에 형성되고, 나머지 콘텐츠를 별도로 설정했을 수있는 침전물을 포함한 시료 00 μL. ≥8,000 XG에 15 초 동안 원심 분리기의 흐름을 통해 내용을 무시하고 포집 관을 다시 사용합니다.
- 전송 ≥8,000 × g으로 15 초 동안 튜브의 뚜껑에 축적 된 방울 원심 포함 컬럼에 잔류 시료 및 관류를 버린다.
- , ≥8,000 XG에 15 초 동안 스핀 컬럼 및 원심 분리기 350 μL 버퍼 FRN을 추가 흐름을 통해 폐기 및 수집 튜브를 다시 사용합니다.
- 조심스럽게 70 μL 버퍼 RDD 10 μL의 DNase I 원액을 혼합 스핀 컬럼 막에 직접 추가 15 분 동안 RT에서 배양한다.
- ≥8,000 × g으로 15 초 동안 스핀 컬럼을 원심 500 μL FRN 버퍼를 첨가하고 다음 단계에 사용하기 위해 관류 저장한다. A의 스핀 열을 배치, 작은 RNA를 복구를 향상시키기 위해새로운 2 ml의 수집 튜브 및 스핀 컬럼으로 이전 단계의 관류를 적용한다.
- ≥8,000 × g으로 15 초간 원심 분리기, 플로우 스루를 무시하고 다음 단계에서 포집 관을 재사용. , ≥8,000 × g으로 15 초 동안 스핀 컬럼 원심 분리기로 500 ㎕의 완충액 RPE를 추가 관류를 폐기하고, 다음 단계에서 포집 관을 재사용.
- ≥8,000 XG에 15 초 동안 스핀 컬럼 및 원심 분리기 500 μL 버퍼 RPE를 추가하고 흐름을 통해 함께 수집 튜브를 폐기합니다.
- 새로운 2 ㎖의 포집 관에서 스핀 컬럼을 놓고 5 분 동안 최대 속도로 뚜껑과 원심 분리기를 엽니 다. 플로우 스루와 포집 관을 폐기하십시오.
- 새로운 1.5 ㎖의 컬렉션에 스핀 컬럼을 배치 스핀 컬럼 막 상으로 직접의 RNase가없는 물 20 μL를 추가하고, 실온에서 1 분 동안 튜브를 배양한다. 1 분 동안 최대 속도로 원심 분리기는 RNA를 용출한다. -80 ° C에서 용출 RNA 샘플을 저장합니다.
(7)에게. DNA 정제
- 프로 테이나 제 K 버퍼 45 ㎕를 단계적으로 첨가하여 RNA를 추출하는 동안 얻어진 펠릿 재현 탁 (400 mM 트리스 7.5, 400 mM의 염화나트륨을, 3 밀리미터의 MgCl 2, 4 % SDS); 45 μL의 H 2 O; 높은 효능 테 K. 400 μg의
- 24 시간 동안 56 ℃에서 상기 용액을 품어 (권장) 또는 밤새. 간단히 2 교반없이 시간과 90 ° C에서 Performincubation 뚜껑의 내부에서 방울을 수집하는 microcentrifuge 관을 원심 분리기.
- 샘플을 실온으로 냉각 한 다음 4 μL의 RNase A (100 ㎎ / ㎖)을 추가 할 수있다. 실온에서 2 분 동안 샘플을 품어.
- 시료 200 μL 버퍼 AL을 추가하고 텍싱에 의해 철저하게 섞는다. 다음에, 100 % 에탄올 200 μL를 추가하고, 볼 텍싱하여 완전히 혼합한다. ≥8,000 × g으로 1 분 동안 제공된 스핀 열, 장소 2 ml의 포집 관에서, 원심 분리기에 전체 샘플을 전송합니다.
- 와 포집 관을 폐기-을 통해 흐름과 새로운 2 ㎖의 포집 관에 스핀 열을 배치합니다. , ≥8,000 XG에 15 초 동안 스핀 컬럼에 원심 분리기 700 μL 버퍼 AW1을 추가 흐름을 통해 내용을 무시하고 포집 관을 다시 사용합니다.
- , ≥8,000 XG에 15 초 동안 스핀 컬럼에 원심 분리기 700 μL 버퍼 AW2를 추가 흐름을 통해 내용을 무시하고 포집 관을 다시 사용합니다. 다음 ≥8,000 × g으로 15 초 동안 스핀 칼럼, 원심 분리기로 100 % 에탄올 700 μL를 추가하고 관류와 포집 관을 폐기.
- 새로운 2 ㎖의 포집 관에서 스핀 컬럼을 놓고 5 분 동안 전체 속도로 스핀 컬럼의 뚜껑, 원심 분리를 엽니 다. 플로우 스루와 포집 관을 폐기하십시오.
- 새로운 1.5 ml의 포집 관에서 스핀 컬럼을 놓고 가열 클레아없는 물 (50 °에 C)의 25 μl를 추가합니다. 10 분 동안 50 ° C에서 칼럼 튜브 부화. 최대 속도에서 1 분 동안 원심 분리기, 열을 클레아없는 물 (RT)의 25 μl를 추가하고 부화실온에서 1 분.
- 최대 속도 (21,130 XG)와 게놈 DNA (총 DNA의 약 50 μl를) 포함 수확 흐름을 통해에서 1 분 동안 원심 분리기. -20 ° C에서 열을 저장 (경우에 다른 용출 나중에 필요합니다).
결과
이 프로토콜은, 조직 코어에서 DNA와 RNA를 회수 조직 절편 설계된 상업 추출 시스템의 변형을 사용하는 최적화 된 방법을 나타낸다. 최적화는 조직의 균질화 도입 DNA 추출을위한 더 강력한 테 K의 활용, 조직 분해 시간의 연장을 포함했다. 그래프 및 통계 분석은 2 웨이 ANOVA, 선형 회귀 및 상관 관계를 포함.
테 소화의 최적화
상업 키트는 높은 DNA 수율 (그림 2A)의 결과로, 더 강력한 단백질 분해 효소 K로 치환 된 실내 온도 안정 테의 K 솔루션을 포함. 또한 DNA 수율을 높이기 위해, 소화 2에서 24 시간으로 확대했다. 큰 차이는 두 시점 사이 보지되었지만, 24 시간 소화 SA 걸쳐 일관성 수율을 제공하는 것으로 나타mples. 그러나 더 배양 48 시간 추가 DNA 복구 개선되지 않았다 (그림 2B를; P = 0.74).
FFPE 전립선 암 조직 샘플에서 일반적인 DNA 복구
최적의 프로토콜을 사용하여 RNA 및 DNA 공동 추출 세 내지 14 세 연령에서 샘플까지 333 전립선 암 FFPET 샘플에서 있었다. 각 시료로부터 3 조직 코어 (± 0.13 mm (3) 0.95의 평균 전체 조직 부피)의 입력으로 사용 하였다. 핵산 분자의 크기 분포의 평가 농도를 추정하고 제공 할 수있는 다른 마이크로 유체 기반 겔 전기 영동 방법이 있지만, 이러한 방법은 재생 가능한 핵산의 정량 분석을 제공하지 않으며, 같은 flourometrically 기반 분석 할 RNA 및 DNA를 구분할 수 없다. 22, 미세 유체 기반 겔 전기 영동 결과 조각에 대한 신뢰할 수 없기 때문에FFPET에서 파생 된 핵산은 23 핵산 수율은 (자세한 내용은 시약의 목록 참조) fluorometrically 측정 하였다. 평균 수율은 RNA의 2270 NG와 DNA (그림 3A)의 820 NG였다. 본 연구에서 분석 된 모든 FFPET 샘플의 약 90 %는 DNA의 ≥100 NG와 RNA의 ≥ 500 NG를 얻었다. 흥미롭게도, FFPET 샘플 및 핵산 복구 (그림 3B)의 나이 사이에 유의 한 상관 관계가 없었다. (R 2 = 0.39; p <0.0001) 전반적으로, RNA 및 DNA 수율은 샘플에서 상관 관계가 있었다 DNA보다 두 배 이상 많은 RNA는 각 샘플 (그림 3C)에서 발견되었지만,.
파일럿 및 최적화 작업이 전립선 조직에서 수행 된 바와 같이, 다음 단계는 보관 조직의 몇 가지 추가 타입의이 프로토콜의 성능을 조사 하였다. 로 시작하는 수술로 제거하고 부검 FFPET 샘플 수를 나타내는nign 간 (1 샘플의 경우 1), 뇌 (1 케이스에서 8 샘플), 방광 (이 경우와 2 샘플), 유방 (3 경우와 3 샘플)의 암, 프로토콜은 DNA의> 100 ng의 열매를 산출 및 RNA 90 %에서 샘플 (그림 3D). 핵산 수율 수술 조직에서보다 부검 조직에서 낮은 동안, 대표적인 결과는 프로토콜이 다른 사이트에서 파생 된 암에서 비슷한 수익률을 생산하고 있음을 나타냅니다.
RNA의 평가 및 DNA 무결성 및 다운 스트림 분석에서의 대표 성과
47 8 선택된 FFPET 전립선 암 샘플 유전자 (양성 대조군)을 새로운 PC-3 전립선 암 세포주 시료의 RNA 발현 분석 FFPET 최적화 된 상업적 다중 동시 유전자 발현 플랫폼을 이용하여 수행 하였다. PC3의 mRNA의 수는 FFPET 사에서보다 일반적으로 더 높았다mples (그림 4A). 그러나, 모든 유전자의 상대적인 발현을 비교 FFPET 전립선 암 샘플 RNA 모두 소스 RNA 발현 프로파일 링에 적합한 것을 나타내는, PC-3과 유사한 RNA 발현 양상을 보였다.
이 프로토콜로 추출한 게놈 DNA의 성능을 보여주기 위해 FFPET 샘플에서 중아 변환 된 DNA 추출물이 메틸화에 의해 증폭 된 특정 PCR (MSP). (24) 인간 게놈의 복사본 수백만에 존재하는 ALU 반복적 인 요소, 높은 메틸화 지역의 MSP 분석, 도 25는 유전자 메틸화 대조군으로 사용하고, 샘플들 사이에 최소한의 변화를 표시하는 것으로 하였다. 도 4b에 도시 된 바와 같이, ALU MSP 메틸화 수준에서 상이한 샘플 사이 본 변형없이 거의 있었다. 또한, GSTP1 전립선 암이 아닌 양성 샘플에서 메틸화 것으로 알려진 유전자에 기초하여 MSP 세이 26은 검출 충전 앰프 없었다양성 샘플에서 DNA의 ications. 예상 한 바와 같이, 하부 qPCR의 사이클 임계 값은 메틸화 GSTP1 복사본 농축을 나타내는 암 조직으로부터 DNA에서 발견되었다. 이 프로토콜에 의해 복구 된 핵산의 유틸리티는 또한 핵산 뇌 (사후) 양성 간에서와에서 회복 산 두 수술로 제거 유방암 샘플에서를 사용하여, 일반적인 다운 스트림 분석에서 시험 하였다. 모두 RT-qPCR에 기반 표현과 MSP 분석은 유방암과 간 FFPET 잘 수행하지만, RT-PCR 분석은 RNA가 분해했다고 제안의 사후 뇌 종양 샘플에서 높은 표현의 mRNA (그림 4C)을 증폭하는 데 실패 때문에 지연 조직 고정에 가능성이 높습니다.
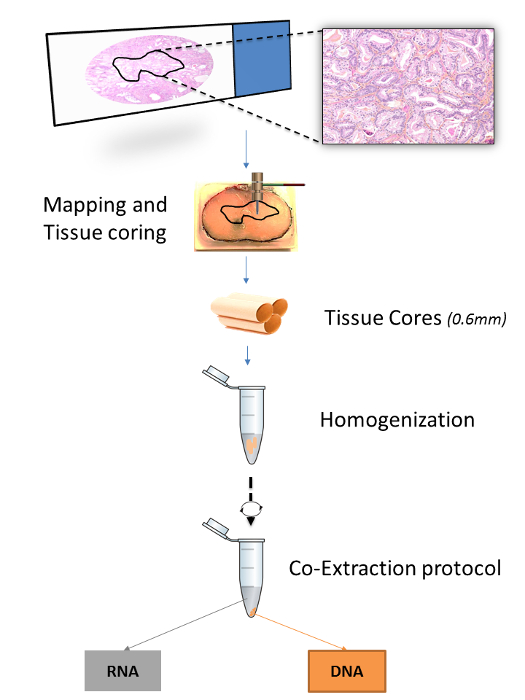
그림 1 :. FFPET 샘플의 추출 절차의 개요는 그림은 관심의 방법 영역을 보여줍니다조직 블록은 현미경 슬라이드의 병리학 적 선택에 기초하여 매핑된다. 세 개의 0.6 mm 조직 코어는 함께 균질화 한 후 RNA 및 DNA 모두의 추출을 실시, 생검 펀치를 사용하여 각 조직 영역에서 얻을 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
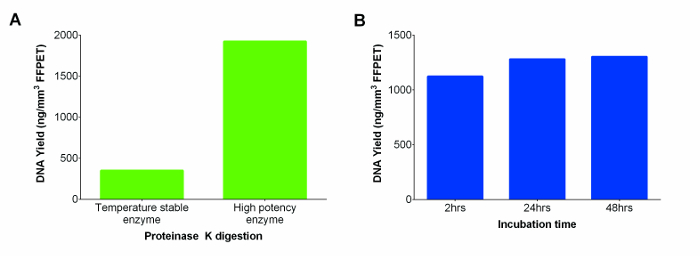
. 그림 2 : 두 개의 테 K (온도 안정 및 하이 포 텐시 효소), 그리고 후기에 대한 배양 시간의 범위에 걸쳐 테스트 (A) 테 K의 성능에서 NG에 핵산 (DNA 및 RNA) 수율 / FFPET의 mm 3 다른 공급 업체. DNA의 추출은 K가 공급 온도 안정성 효소를 사용하는 대표적인 FFPET 샘플에서 수행 하였다그것은 다른 제조사의 더 강력한 효소 대. DNA의 수율을 최대화하기 위해 최적의 프로 테이나 제 K 배양 시간을 결정 (B). 고농도 테 K 소화 성능은 3 FFPET 샘플을 사용하여 세 가지 배양 기간에서 평가 하였다. 오차 막대는 평균 (SEM)의 표준 오류를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
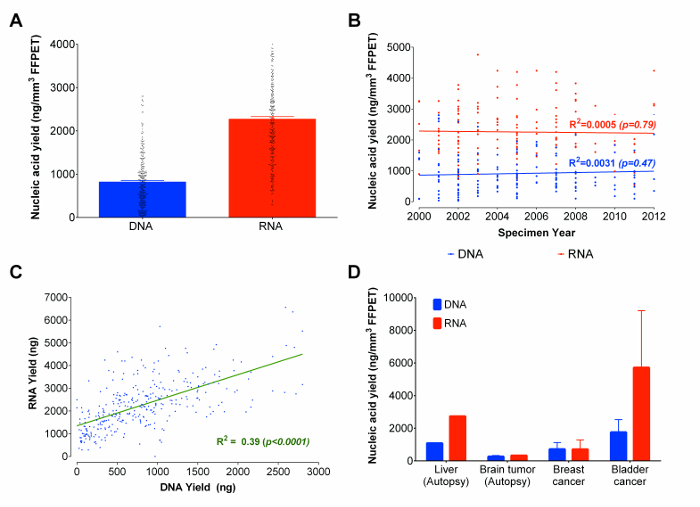
그림 3 :. 핵산 (DNA 및 RNA) 샘플 년과 대표 조직 유형에 걸쳐 총에 FFPET의 / mm 3 ng를의 금리는 (A) 총 포르말린 고정 파라핀 조직에서 핵산을 회복했다. 제시된 핵산 량은 333 FFPET 샘플의 추출을 기반으로 U최적화 된 프로토콜을 노래. 회수 된 총 DNA 및 RNA와 FFPET 샘플 세 사이의 (B) 상관 관계 플롯. 사용 FFPET 추출 샘플 333 전립선 샘플들로부터 동시에 추출 된 DNA와 RNA의 수율 사이 2012 (C) 상관으로 2000 년 얻었다. DNA 및 RNA 수율 사이의 양의 상관 관계가있다. 추가 보관 조직 유형을 사용하는 프로토콜의 (D) 데모. 최적화 된 프로토콜은 (14) 암 (유방, 방광과 뇌) 정상 (간) 샘플로부터 핵산을 추출하는 데 사용되었다. 오차 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
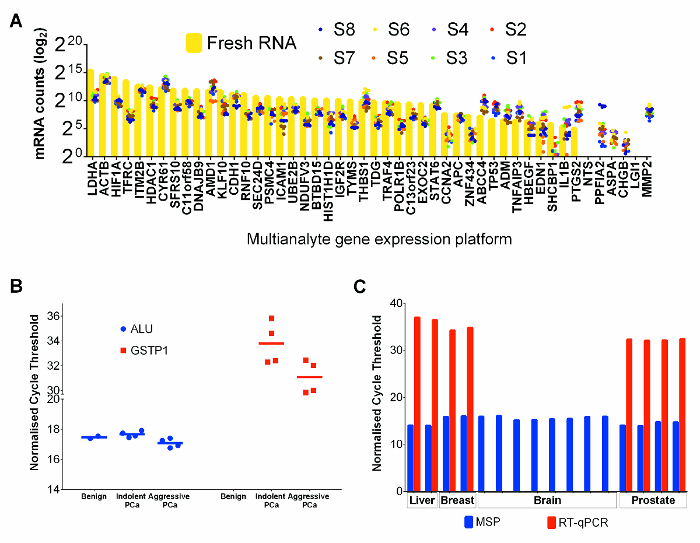
그림 4 : RNA 및 DNA의 성능 Tissu에서 공동 추출다운 스트림 응용 프로그램에서 전자 코어는. (A)의 mRNA는 FFPE 전립선 암 조직과 신선한 PC-3 세포주 제어를위한 계산합니다. 각 점은 개별적으로 추출 (3) 기술 복제의 평균을 나타냅니다. 신선한 PC-3 세포주 RNA 값은 황색 바와 FFPET 조직 값으로 도시되어 착색 점으로 표시된다. FFPET 전립선 암 샘플 DNA에 (B) 메틸화 특이 PCR 분석법. 사이클 임계 값은 50 NG / 중아 변환 DNA의 반응을 이용하여 예상대로 수행 10 샘플을 얻었다. 모든 FFPET 샘플에서 ALU의 MSP의 분석은 유사한 사이클 임계 값 (p> 0.67)을했다. GSTP1 MSP 분석 높은 메틸화 (낮은 사이클 임계 값) 양성 전립선에 비해 전립선 암의 수준을 보여 주었다. (C) 추가적인 조직 유형에서 DNA와 RNA의 품질 평가. HPRT1 유전자 발현 및 알루 유전자의 메틸화 분석은 추출 된 핵산 (RNA 및 DNA 각각)에서 수행 하였다 아니다말의 간 (부검), 뇌 (부검)과 유방암 (모든 FFPET). 전립선의 결과는 비교를 위해 표시됩니다. 주의 : 유사한 결과 부검 한 시료에서 mRNA를 증폭 실패를 제외한 각각의 조직 유형에서 관찰되었다. 각 지점이나 바는 샘플을 나타내고, 오차 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 조직 코어 | |||||||||||
| 티슈 입력 (MM3) | 추출 된 핵산 | 확인 | 품질 검사 : DNA | 품질 검사 : RNA | |||||||
| (샘플 #) | 샘플의 나이 (10 세) | 총 수율 (NG) | 조각의 크기 (BP) | PCR | 총 수율 (NG) | 조각의 크기 (BP) | PCR | NanoString | |||
| Pikor 등은. | 43-129 | DNA | 데이터가 없습니다 | 데이터가 없습니다 | 데이터가 없습니다 | 데이터가 없습니다 | |||||
| Montaser-Kouhsari 등. | 18-29.5 | RNA | 763 | 0-25 | 843 | 데이터가 없습니다 | |||||
| 이 종이 | 1.71 | DNA 및 RNA | > (350) | 3-12 | (820) | 100-500 |  | 2,270 | 100 ~ 500 |  | /ftp_upload/54299/check_mark.jpg "/> |
| 조직 섹션 | |||||||||||
| 조직 입력 | 추출 된 핵산 | 확인 | 품질 검사 : DNA | 품질 검사 : RNA | |||||||
| (샘플 #) | 샘플의 나이 (10 세) | 총 수율 (NG) | 조각의 크기 (BP) | PCR | 총 수율 (NG) | 조각의 크기 (BP) | PCR | NanoString | |||
| Heikal 등은. | 5 × 5 μm의 | DNA | (12) | 7-22 | 88-300 | 103-351 |  | ||||
| 정 등. | 1 × 20 음 | RNA | 9 | > 5 | 16,000- 23,000 | 100-200 |  | ||||
| 안티 카 등. | 2 × 4 μm의 | RNA | (18) | 데이터가 없습니다 | 알 수없는 (621 NG / μL) | 80-202 + |  | ||||
| Ghatak 등은. | 5 × 5 μm의 | DNA 및 RNA | (5) | 1 | (14) 256 | <1030 |  | (16) 000 | 109-400 + |  | |
| 헤니는 등. | 1 × 10 μm의 | DNA 및 RNA | (210) | 1-25 | 데이터가 없습니다 | 데이터가 없습니다 |  | 데이터가 없습니다 | 데이터가 없습니다 |  | |
| 레이저 캡처 이외에 Microdissection | |||||||||||
| 티슈 입력 (MM2) | 추출 된 핵산 | 확인 | 품질 검사 : DNA | 품질 검사 : RNA | |||||||
| (샘플 #) | 샘플의 나이 (10 세) | 총 수율 (NG) | 조각의 크기 (BP) | PCR | 총 수율 (NG) | 조각의 크기 (BP) | PCR | NanoString | |||
| 눈이 등. | 1-2 | DNA | (110) | 0-2 | (430) | 데이터가 없습니다 |  | ||||
표 1 :. 조직 코어, 섹션 및 레이저 캡처 microdissections에 대해 게시 된 DNA와 RNA 추출 프로토콜의 비교 또한 포함 된 PCR 및 Nanostring 분석을 사용하여 이러한 방법 중 몇 가지 분자 엔드 포인트 평가입니다.
토론
관심의 조직 영역에서 DNA 및 RNA를 성공적으로 추출, 정확한 코어 링이 중요합니다. 이 프로토콜은 0.6 mm 직경의 코어를 분리하는 조직 펀치의 사용을 설명하고 현미경 표기를 전송하는 과정 FFPET 블록에 대응하는 슬라이드를 설명. 제조 업체의 프로토콜에 대한 수정을 효율적으로 약 프로토콜이 의도 된 마이크로톰 섹션보다 50 배 두꺼운 코어에서 핵산을 추출해야했습니다. 코어가 조직 섹션에 더 파라핀 왁스의 상대, 반복 자일 렌, 에탄올 처리 단계를 통해 코어의 효과적인 탈 파라핀을 포함 할 수 있기 때문에 필요했다. 탈 파라핀 후의 단계의 성공은 적절한 기계적 조직 코어 균질화 효율적인 테 K 소화에 의존. 프로 테이나 제 K 소화의 추가 최적화가 수행 될 수있다.
그것은 언급 할 가치가 그이 방법의 식별자병리 조직 슬라이드를 대응에 식별 된 블록의 표면에 관심 아 보라 영역. 3 4mm 깊이 될 수있는 핵심 수확 조직으로,이 프로토콜의 사용자는 세포 또는 조직이 블록의 표면 아래에 누워 무엇에 대해 우려 할 수있다. 이것이 유효한 문제이지만, (참고 27에서 검토) 여러 연구 조직 코어 충실히 중복 또는 삼중 코어가 관심의 영역으로부터 샘플링 특히, 병리 조직 블록의 조직 학적 및 분자 특성을 나타낸다는 것을 증명 하였다.
이 프로토콜에 채용 개질 상용 추출 키트는 동일한 조직에서 모두 DNA 및 RNA의 동시 추출을 가능하게 된 바와 같이, 프로토콜은 귀중한 생체 물질을 저장하고, 동일한 샘플에서 두 얻어진 핵산 사이의 직접적인 비교를 허용한다. RNA 및 DNA의 동시 추출은 반으로 노동과 조직 파괴를 줄인다, 유전자 EXPR의 정확한 통합 분석이 가능ession뿐만 아니라 DNA에서 발견 후생 유전 학적 및 유전 적 특징. 이러한 대표적인 조직 코어에서 모두 RNA와 DNA의 수율을하기 때문에 일반적으로 각각 600, 300 NG를 초과하고, 가장 최근의 PCR 차세대 시퀀싱 애플리케이션은 일반적으로 10-100 NG가 필요하기 때문에,이 프로토콜에 의해 정제 된 샘플의 대부분은 충분히 제공해야 여러 개의 다운 스트림 분석에 대한 자료. 이 프로토콜은 독립적 인 실험실에 걸쳐 재현 가능한 것으로 밝혀졌다 (Selvarajah 외., 준비한다.). 이 프로토콜에서 RNA를 RT-PCR 또는 인기 다중 동시 플랫폼을 사용하는 유전자 발현 분석을위한 충분한 품질이고, DNA 메틸화는 특정 PCR 분석에서 잘 수행 하였다. 차세대 시퀀싱에 복구 된 핵산의 유용성을 평가하기위한 미래 연구가 보증됩니다.
따라서, 여러 변형이 FO 적합한를 렌더링 얇은 FFPET 부 설계된 시판 프로토콜을 만들었다0.6 mm의 FFPET 코어에서 RNA 및 DNA의 연구 공동 추출. 프로토콜은 전립선 암 샘플의 큰 집단 및 유방, 뇌 및 방광의 암에서 샘플의 제한된 세트에 지속적으로 높은 수율을 보였다. 전반적으로, 프로토콜은 큰 잘 주석이 조직 컬렉션의 대상으로 유전자 기반의 분석을 수행 할 수 있도록해야합니다. 중요한 것은, 프로토콜은 대부분의 다운 스트림 응용 프로그램에 대한 FFPET에 대한 관심의 영역을 효율적으로 집중 샘플링, 상대적으로 작은 손에 시간, 충분히 높은 수율을 가능하게한다.
공개
The authors declare no competing financial interests.
감사의 말
This research was supported by a team grant from Movember/Prostate Cancer Canada to JMSB, DMB, PCP, and JL, and by the Ontario Institute of Cancer Research (JMSB, DMB, and PCP) and Motorcycle Ride for Dad Kingston/University Hospitals Kingston Foundation/Kingston General Hospital (DMB, PCP).
자료
| Name | Company | Catalog Number | Comments |
| Plastic paraffin film, "Parafilm 'M'" | Bemis | RK-06720-40 | Any generic paraffin film will work as a substitute |
| Sodium Hypochlorite, "Ultra Bleach" | Likewise | 53-2879-2 | Any generic bleach will work as a substitute. Hazardous material that can cause burns on contact. |
| Molecular biology grade absolute ethanol | Fisher BioReagents | BP2818-500 | Sigma-Aldrich E7023 suffices as a substitute |
| Molecular Grade H2O | G-Biosciences | 786-293 | Sigma W4502 suffices, as well as any other brand of molecular grade H2O |
| 0.6 mm Punch Set for Beecher Instruments | Estigen | MPO6[Yellow] | Make sure to use the red receiver punch from the set |
| Fine point permanent marker | Sharpie | 10365796S | Using the marker on FFPE tissues causes it to dry out quickly, so several may be required |
| FFPE tissue block | |||
| Stained tissue slide corresponding to FFPE block | |||
| 1.5 ml Micro-Centrifuge Tubes | Fisher BioReagents | 05-408-137 | |
| 2.0 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431048 | |
| 1.5 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431021 | |
| Histology Xylene | VWR | CA 95057-822 | Fisher Scientific X5-500 suffices as a substitute |
| Molecular Biology Grade 2-Propanol | Sigma | I9516 | |
| AllPrep FFPE DNA/RNA Kit | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Buffers: RLT, FRN, RPE, ATL, AL, AW1, AW2, DNaseI solution | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Temperature stable proteinase K | Qiagen | 80234 | |
| High potency proteinase K | Invitrogen | 25530-049 | Invitrogen 25530-015 suffices as a substitute |
| RNAse neutralizing solution (Rnase AWAY) | Molecular BioProducts | 7003 | |
| RNaseA 100 mg/ml | Qiagen | 19101 | |
| BD Integra Syringe 3 ml 21G x 1/2 | BD | 305274 | |
| Motorized tissue homogenizer (TissueRuptor) | Qiagen | 9001271 | Fisher Scientific 14-261-29 suffices as a substitute |
| -20 °C and -80 °C Laboratory Freezer | |||
| Micro-Centrifuge with rotor for 2 ml tubes | |||
| Digital Vortex Mixer | |||
| Pipettes and filter tips | |||
| Heating blocks or water baths | |||
| Tris Hydrochloride | Amresco | 0234 | |
| Sodium Chloride | Amresco | 0241 | |
| Anhydrous Magnesium Chloride | Sigma | M8266 | |
| Sodium Dodecyl Sulfate | Sigma | L4509 | |
| Acrodisc 25 mm syring filters with 0.45 µm Supor membrane | Pall | PN 4614 | |
| Syringe with retracting BD PrecisionGlide needle 3 ml | BD Integra | 305274 | |
| Hydrochloric Acid | BDH | 3026 | |
| Multianalyte gene expression platfrom (nCounter ® CAE codeset and Nanostring nCounter platform) | Nanostring nCounter platform, Nanostring | ||
| Fluorometric nucleic acid quantification (Qubit dsDNA HS Assay Kit and Qubit® RNA BR Assay Kit) | Invitrogen |
참고문헌
- Kern, S. E. Why your new cancer biomarker may never work: recurrent patterns and remarkable diversity in biomarker failures. Cancer Res. 72 (23), 6097-6101 (2012).
- Klopfleisch, R., Weiss, A. T. A., Gruber, A. D. Excavation of a buried treasure--DNA, mRNA, miRNA and protein analysis in formalin fixed, paraffin embedded tissues. Histol. Histopathol. 26 (6), 797-810 (2011).
- Beltran, H., et al. Targeted Next-generation Sequencing of Advanced Prostate Cancer Identifies Potential Therapeutic Targets and Disease Heterogeneity. Eur. Urol. 63 (5), 920-926 (2013).
- Hoppin, J. A., Tolbert, P. E., Taylor, J. A., Schroeder, J. C., Holly, E. A. Potential for selection bias with tumor tissue retrieval in molecular epidemiology studies. Ann. Epidemiol. 12 (1), 1-6 (2002).
- von Ahlfen, S., Missel, A., Bendrat, K., Schlumpberger, M. Determinants of RNA quality from FFPE samples. PLOS ONE. 2 (12), e1261 (2007).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Pikor, L. A., Enfield, K. S. S., Cameron, H., Lam, W. L. DNA extraction from paraffin embedded material for genetic and epigenetic analyses. J. Vis. Exp. (49), (2011).
- Turashvili, G., et al. Nucleic acid quantity and quality from paraffin blocks: defining optimal fixation, processing and DNA/RNA extraction techniques. Exp. Mol. Pathol. 92 (1), 33-43 (2012).
- Espina, V., et al. Laser-capture microdissection. Nat. Protoc. 1 (2), 586-603 (2006).
- Hackler, L., Masuda, T., Oliver, V. F., Merbs, S. L., Zack, D. J. Use of laser capture microdissection for analysis of retinal mRNA/miRNA expression and DNA methylation. Methods Mol. Biol. 884, 289-304 (2012).
- Bonin, S., Stanta, G. Nucleic acid extraction methods from fixed and paraffin-embedded tissues in cancer diagnostics. Expert Rev. Mol. Diagn. 13 (3), 271-282 (2013).
- Bonin, S., et al. Multicentre validation study of nucleic acids extraction from FFPE tissues. Virchows Archiv. 457 (3), 309-317 (2010).
- Montaser-Kouhsari, L., et al. Image-guided Coring for Large-scale Studies in Molecular Pathology. Appl. Immunohistochem. Mol. Morphol. , (2015).
- van Eijk, R., Stevens, L., Morreau, H., van Wezel, T. Assessment of a fully automated high-throughput DNA extraction method from formalin-fixed, paraffin-embedded tissue for KRAS, and BRAF somatic mutation analysis. Exp. Mol. Pathol. 94 (1), 121-125 (2013).
- Ghatak, S., Sanga, Z., Pautu, J. L., Kumar, N. S. Coextraction and PCR Based Analysis of Nucleic Acids From Formalin-Fixed Paraffin-Embedded Specimens. J. Clin. Lab. Anal. , (2014).
- Hennig, G., et al. Automated extraction of DNA and RNA from a single formalin-fixed paraffin-embedded tissue section for analysis of both single-nucleotide polymorphisms and mRNA expression. Clin. Chem. 56 (12), 1845-1853 (2010).
- Snow, A. N., Stence, A. A., Pruessner, J. A., Bossler, A. D., Ma, D. A simple and cost-effective method of DNA extraction from small formalin-fixed paraffin-embedded tissue for molecular oncologic testing. BMC Clin. Pathol. 14 (1), 30 (2014).
- Torrente, M. C., et al. DNA extraction from formalin-fixed laryngeal biopsies: Comparison of techniques. Acta Otolaryngol. 131 (3), 330-333 (2011).
- Okello, J. B. A., et al. Comparison of methods in the recovery of nucleic acids from archival formalin-fixed paraffin-embedded autopsy tissues. Anal. Bochem. 400 (1), 110-117 (2010).
- Abramovitz, M., et al. Optimization of RNA extraction from FFPE tissues for expression profiling in the DASL assay. BioTechniques. 44 (3), 417-423 (2008).
- . . AllPrep DNA/RNA FFPE Handbook. , (2012).
- Laurent, L. C., et al. Meeting report: discussions and preliminary findings on extracellular RNA measurement methods from laboratories in the NIH Extracellular RNA Communication Consortium. Journal of Extracell. Vesicles. 4, (2015).
- . Methods of RNA Quality Assessment Available from: https://www.promega.ca/resources/pubhub/methods-of-rna-quality-assessment (2012)
- Herman, J. G., Graff, J. R., Myohanen, S., Nelkin, B. D., Baylin, S. B. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad. Sci. U.S.A. 93 (18), 9821-9826 (1996).
- Weisenberger, D. J., Campan, M., et al. Analysis of repetitive element DNA methylation by MethyLight. Nucleic acids research. 33 (21), 6823-6836 (2005).
- Yegnasubramanian, S. Hypermethylation of CpG Islands in Primary and Metastatic Human Prostate Cancer. Cancer Res. 64 (6), 1975-1986 (2004).
- Parsons, M., Grabsch, H. How to make tissue microarrays. Diagn. Histopathol. 15 (3), 142-150 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유