Method Article
蛍光ベースのノイラミニダーゼ阻害アッセイ抗ウイルスのノイラミニダーゼ阻害剤クラスにインフルエンザウイルスの感受性を評価します
要約
我々は、抗ウイルスのノイラミニダーゼ阻害剤クラスにインフルエンザAおよびBウイルスの感受性を評価するために表現型の蛍光ベースのノイラミニダーゼ阻害アッセイの使用を記載しています。
要約
ノイラミニダーゼ(NA)阻害剤は、現在、循環株に対して有効であるインフルエンザの治療および予防のために承認された抗ウイルスの唯一のクラスです。季節性インフルエンザの治療におけるそれらの使用に加えて、NA阻害剤は、パンデミックのイベントで使用するための多くの国で備蓄されています。抗ウイルス薬のこのクラスにインフルエンザウイルスの循環の感受性を監視することが重要です。そこNA阻害剤に対するインフルエンザウイルスの感受性を評価するために使用できるアッセイの異なるタイプがあるが、蛍光基質又は化学発光基質のいずれかを使用して、酵素阻害アッセイは、最も広く使用され、推奨されています。このプロトコルはNA阻害剤にインフルエンザウイルスの感受性を評価するための蛍光ベースのアッセイの使用を記載しています。 (4-メチル)-α-D- N -acetylneuraminic酸(MUNANA -アッセイは、2 '切断NA酵素に基づいています)蛍光生成物、4-メチルウンベリフェロン(4-MU)を放出する基板。したがって、インフルエンザウイルスNA上のNA阻害剤の阻害効果をIC 50値として与えられたNA活性の50%を減少させるために必要とされるNA阻害剤の濃度に基づいて決定されます。
概要
赤血球凝集素(HA)およびノイラミニダーゼ(NA)はインフルエンザA及びBウイルスの二つの主要な表面糖タンパク質です。 NAは細胞表面1上にガラクトースからシアル酸を切断することによってウイルスを放出しながら、HAは、細胞表面糖タンパク質または糖脂質のシアル酸-ガラクトースに結合します。 NA阻害剤は、合理的にすることにより、ウイルス子孫の放出と拡散を防止すること、NAの酵素活性部位にしっかりと結合するように設計されたインフルエンザウイルス薬のクラスです。オセルタミビルおよびザナミビルはインフルエンザの治療および予防のために、世界中の多くの国で承認された2つのNA阻害剤です。近年では、二つの追加NA阻害剤、ペラミビルとラニナミビルは、国の限られた数での使用が承認されています。 NA阻害剤に対する感受性と耐性を付与する変異を同定するためのインフルエンザウイルスのスクリーニングはeffectivを決定し、監視に重要です抗ウイルス薬のこのクラスのeness。
最後の16年間で、蛍光ベースのNA阻害アッセイは、インフルエンザウイルスの循環の中で、抗ウイルス感受性の変化傾向を監視するために参考とインフルエンザ研究のためのWHO協力センター、メルボルン(メルボルンWHOCCRRI)で、日常的に行われています。毎年、2,000人以上のインフルエンザウイルスは、抗ウイルス感受性について試験されています。 2007-2008北半球のインフルエンザシーズンの間、前者季節性A(H1N1)ウイルスの数の急増があったが、ほとんどのインフルエンザシーズンでは、ウイルスの> 98%が、4つのすべてのNA阻害剤2、3、4に感受性でありますそれは、オセルタミビル5に対する感受性を減少させました。 NAのアミノ酸置換H275Yを含んこのグループのウイルスは、オセルタミビルinappropriを作り、2008年末までに世界の残りの部分に広がりますこのウイルスの治療のために世界的に食べました。広大な現在のインフルエンザB循環の大部分、インフルエンザA(H3N2)、インフルエンザA(H1N1)pdm09株はオセルタミビルに感受性である、縮小オセルタミビルを与えるNAのアミノ酸置換H275Yを含むA(H1N1)pdm09変異体のもののコミュニティクラスタとペラミビルの感受性は、世界6、7のさまざまな部分で報告されています。
そのため、十分に高いウイルス力価の必要性、(動物の鼻洗浄を含む)の臨床検体は、前の抗ウイルス感受性試験に細胞培養や発育鶏卵のいずれかで継代しなければなりません。この資料に記載NA阻害アッセイは、3つのセクションに分けることができます。
特定の蛍光光度計で蛍光生成物の4-メチルウンベリフェロン(4-MU)のための直線範囲を決定します
蛍光光度計の間の固有の差異に、トン彼蛍光最終生成物、4-MU、相対蛍光単位(RFU)のための線形範囲は、確立される必要があります。 4-MUのための線形範囲が確立されると、最適な目標信号が選択され、インフルエンザウイルスの濃度はNA活性アッセイで調整されます。特定の蛍光光度計のために完了したら、これを繰り返すことする必要はありません。
ウイルスのNA活性を測定します
(4-メチル)-α-D- N -acetylneuraminic酸(MUNANA)基板連続希釈するウイルス- NA活性アッセイは、2 'の添加を伴う単純なアッセイです。 NAによってMUNANAの切断から発生する蛍光最終生成物4-MUの量は、蛍光光度計を用いて測定されます。 NA阻害アッセイで使用するための適切なウイルス希釈は、ウイルスの希釈に対して蛍光単位をプロットすることによって選択されます。生成シグモイド曲線から、直線部の中間点は、に対応しなければなりません蛍光の4-MUの線形範囲は、セクション1で決定され、セクション3で使用されるウイルスの適切な濃度を通知します。
NA阻害アッセイを使用してNA阻害剤に対するウイルスの感受性を評価します
特定のNA阻害剤に対するウイルスの感受性を評価するために、セクション2で決定された希釈でウイルスは、NA阻害剤濃度の範囲と共にインキュベートします。 MUNANAとのその後のインキュベーションの後、阻害されていないウイルスによって生成された4-MUの蛍光によってRFUにおいて測定されます。ウイルスのNA酵素活性に対するNA阻害剤の阻害効果をIC 50値として与えられたNA活性を50%減少させるのに必要なNA阻害剤濃度、に従って計算されます。
プロトコル
1.蛍光光度計で蛍光生成物4-MUの直線範囲の決定
- 無水エタノール5mLに4-MUの11.3ミリグラムを溶解することにより6.4 mMの4-MUのストック溶液10mLを調製します。 (w / v)のストック溶液を10mLのを作るために、0.9%のNaClを5mLを加えます。 9 mLの1Xのアッセイ緩衝液(33.3 mMの2-(N-モルホリノ)エタンスルホン酸(MES)及び4 mMのCaCl 2を、pHが6.5)に6.4 mMの4-MUを1mLに希釈した溶液を作動640μMを準備します。
注:MES 13gの蒸留水8mLの1MのCaCl 2の992ミリリットルを添加することにより、2×アッセイ緩衝液を調製します。 NaOHを10 Mを用いてpHを6.5に調整します。孔径が0.2μmの滅菌酢酸セルロースフィルターを用いて、バッファをフィルタリングします。あぶない!水酸化ナトリウムは苛性であり、皮膚や目に化学火傷を引き起こす可能性があります。完全な個人用保護具を着用していることを確認してください。 - 4-MUの濃度( すなわち、5μM、10μM、20μM、40μM、80μM、160#の範囲を5ml調製181; M、および1×アッセイ緩衝液を使用して、640μM4-MUの2倍連続希釈を介して320μM)。
- 4-MU( すなわち 、5μM、10μM、20μM、40μM、80μM、160μM、320μMおよび640μM)(希釈あたり2つのウェル)明らかに、96の各連続希釈の50μLを分注ウェル平底プレートと(バックグラウンド信号を測定するためのブランクとして働く)残りのウェルに1×アッセイ緩衝液50μL。
注:反応容量(50μL4-MU + 50μL300μMMUNANA)4-MUの最終濃度は160μMおよび320μM、2.5μM、5μM、10μM、20μM、40μM、80μMであります。 - 蒸留水20mLにMUNANA 25mgを再構成することにより2.5mMのMUNANAストック溶液を調製します。 300μMMUNANAワーキング溶液(一方のプレートのために十分な量)を得るために、1×アッセイ緩衝液の5.28 mlの2.5 ム・マナナの0.72ミリリットルを混合します。 300μMのMUNANAのワーキンを含むチューブをカバーグラムのアルミ箔を用いて溶液、すぐに使用しない限り、氷の上に保管してください。残った材料を捨てます。
注:2.5 mMのMUNANA原液を1ヶ月間-20℃で保存することができ、1回の凍結/融解サイクル内で使用する必要があります。 4-MUとMUNANA溶液は感光性であり、長時間の光曝露から保護されなければなりません。 - 穏やかに混合するためにタップし、各ウェルに300μMのMUNANAの50μLを追加し、37℃で30分間インキュベートします。蒸発を防ぐために、プレートシーラーでプレートをカバーしています。
注:この手順は、NA阻害アッセイにおけるバックグラウンド蛍光を考慮するためです。 - 0.824 M NaOHを(一方のプレートのために十分な量)の2.225 mLの無水エタノール11ミリリットルを混合することにより、停止溶液を調製します。
- 反応を停止し、穏やかに混合するためにタップし、各ウェルに停止液100μLを加えます。
- PEのように、355 nmの励起波長設定および460 nmの発光波長設定で蛍光光度計を用いてプレートを読み取りますメーカーの指示rを。
- 何4-MUを含まない全てのウェルからの蛍光シグナルを使用して平均バックグラウンド信号を計算します。 4-MUを含むウェルのそれぞれからこの平均背景信号を減算し、各4-MUの濃度の平均シグナル(RFU)を計算します。 図1aに示すように、4-MUの濃度(μM)に対するRFUの標準曲線をプロットします。曲線のクローズアップリニア部は図1bに示されています。
- 線形範囲及び最適目標信号を決定するために、4-MUの濃度(μM)に対するRFUのプロットを視覚化します。線形範囲はここでプロット上の4-MUの濃度の増加に比例して蛍光シグナルが増加すると、最適な目標信号が線形範囲内の任意の4-MUの濃度です。
注:線形範囲と最適なターゲット信号は、蛍光光度計固有のものです。例えば、メルボルンWHOCCRRIにおける蛍光は2の線形範囲を有します0.5から40μM4-MUと〜1500 RFUに対応〜30μMの4-MUの最適目標信号。
2.ウイルスのNA活性測定
注:インフルエンザウイルスはマディン-Darbyイヌ腎臓(MDCK)細胞または発育鶏卵8で十分な力価に培養されます。
- 96ウェルU底プレートの残りの11列に0.1%NP-40を含有する1×アッセイ緩衝液のカラム1および60μLに希釈せずに培養したインフルエンザウイルスのウェル当たり120μLを分注します。
- 直列プレート全体のウイルスの2倍希釈を行う( すなわち、カラム2に列1から60μLを移すなど、列11まで)のみ1Xアッセイバッファーを含むブランクとしてカラム12を残して、マルチチャンネルピペットを使用して。
- 透明な、96ウェル、平底プレートにウェル(希釈ウイルスおよびブランク)のそれぞれから50μLを移します。
注:これは、Cする必要はありません材料がカラム1に通ってカラム12から転送された場合ハンゲピペットチップ。 - ウェルあたり300μMMUNANA(ステップ1.4に従って調製した)の50μLを加え、穏やかに混合するためにプレートをタップ。 1時間37℃でプレートをインキュベートします。蒸発を防ぐために、プレートシーラーでプレートをカバーしています。
- 反応を停止し、穏やかに混合するためにプレートをタップするウェル当たり停止溶液の100μL(ステップ1.6に従って調製)を加えます。
- 蛍光光度計を用いてプレートを読みます。
- 355 nmおよび460 nmの発光波長設定の励起波長設定を使用します。
- カラム12中の蛍光読み取り値に基づいて平均バックグラウンド信号を決定し、各ウェルから平均バックグラウンド信号を差し引きます。ウイルス希釈液に対するRFUのグラフをプロットします。
注:WHOCCRRIメルボルンの100μMのMUNANAのバックグラウンド値は50と120 RFUの間、典型的に、これらは蛍光のBEIによって異なります使用NG。 - 各ウイルスについての曲線( 図2)の直線部の中間点を決定するために、ウイルス希釈物に対するRFUのプロットを表示します。基準点として(ステップ1で決定された)最適目標信号を用います。
注:これは、セクション1で決定した蛍光の4-MUの線形範囲に対応するべきであり、セクション3で使用されるウイルスの適切な濃度を提供するであろう。
3. NA阻害アッセイを使用してNA阻害剤に対するウイルスの感受性を評価します
- 300μMの濃度で、NA阻害剤のマスターストックを準備します。
- 2×アッセイ緩衝液(66.6ミリモルのMESおよび8 mMのCaCl 2を、pHが6.5)50mLにザナミビルの5.0ミリグラムを溶解し、300μMザナミビル(分子量、MW = 332.32グラム/モル)を準備。
- 2×アッセイ緩衝液50mLに5.8ミリグラムを溶解することによって、300μMオセルタミビルカルボキシレート(MW = 386.44グラム/モルのD-酒石酸塩)を調製。
- 作ります2×アッセイ緩衝液50mLに5.7 mgの溶解により300μMペラミビル三水和物(MW = 382.45グラム/モル)。
- 2×アッセイ緩衝液50mLに5.2ミリグラムを溶解し、300μMラニナミビル(MW = 346.34グラム/モル)を準備。
注:NA阻害剤マスター株式は12ヶ月間-20℃で保存することができます。正しい重みとボリュームを再構築に使用されていることを確認するためにNA阻害剤のMWを確認してください。オセルタミビルカルボン酸塩は、プロドラッグのリン酸オセルタミビルの活性化合物です。したがって、唯一のオセルタミビルカルボン酸塩は、NA阻害アッセイで使用されるべきです。
- マスターストックから、0.03 nMで、0.3 nMの、3nMの、30nMで、300nMの、3,000 nMの、および2Xアッセイ30,000 nMでの濃度で50mL遠心チューブにNA阻害剤の10倍連続希釈のワーキングストックを調製バッファ(66.6ミリモルのMESおよび8ミリモルのCaCl 2、pHは6.5)。これは、複数のアッセイの間で使用するためのものです。
注:反応volumにおけるNA阻害剤の最終濃度E(ウイルス希釈液+50μLのNAの阻害剤300μMMUNANAの+ 50μLの50μL)は0.01 nMで、0.1 nMの、1 nMの、それぞれ10nMで、100nMで、1000nmで、10,000 nMです。最終濃度は、停止溶液100μLを含んでいません。 2〜8℃ですべてのNA阻害剤の希釈液を保管してください。有効期限は、マスター株のものと同じです。 - 96ディープウェルブロック中の0.1%NP-40界面活性剤を含有する1×アッセイ緩衝液中のウイルス希釈液を調製します。 4つのNA阻害剤を試験するためにウイルス当たり2mLの総容積を使用部2に由来するNA活性アッセイの結果に基づいて、ウイルス希釈物を使用しています。
注:96ディープウェルブロック中のウイルスにつき2つのウェル(ウェル当たり1 ml)を調製します。ウイルス1、2、および3のウイルス希釈液の例は、 表1に示します。 - 8ディープウェルリザーバにNA阻害剤(ステップ3.2に従って調製)の必要量を分注します。そこから、範囲の希釈で50μLNA阻害剤の分配0 nMの(2×アッセイBからufferのみ)透明な、96ウェル、平底プレートにHに列A 30,000 nMです。
注:プレートレイアウトは、 図3に示されています。 - 穏やかに混合し、室温で45分間インキュベートし、プレートをタップのみカラム12にカラム1-11と1Xアッセイバッファーウェルあたり50μLをウェルごとに希釈した試験ウイルスの50μLを加えます。蒸発を防ぐために、プレートシーラーでプレートをカバーしています。
- ウェルあたり300μMMUNANA(ステップ1.4に従って調製した)の50μLを加え、穏やかに混合するためにプレートをタップ。 1時間37℃でプレートをインキュベートします。蒸発を防ぐために、プレートシーラーでプレートをカバーしています。
- 各ウェルに停止溶液の100μL(ステップ1.6に従って調製)を加え、穏やかに混合するためにプレートをタップ。
- 蛍光光度計を用いてプレートを読みます。
- 前述のように、355 nmの励起波長および460 nmの発光波長を使用します。
4.計算IC 50値
注:JASPRのV1.2は、IC 50値の計算を可能にカーブフィッティングソフトウェアです。ソフトウェアは、CDC、アトランタ、米国でのインフルエンザ部門によって開発されました。ソフトウェアは、式を使用:= V max を ×(1 - 私は (+ [I] /(K [I])))V V maxは代謝の最大速度であり、[I]は阻害剤濃度であり、Vは応答が阻害される、及びK i は 、阻害曲線のIC 50です。
- コピーとセルA1から始まる、12列プレートフォーマット(96ウェル)にスプレッドシートに蛍光光度計により出力された生データを貼り付けます。
注:後続の各プレートからの生データは、1つの空行によって互い違いにされなければなりません。各ウイルスは、4つのNA阻害剤に対して試験された場合、(それぞれのプレートの間に空白行で)は、4つのセット内の生データを貼り付けます。 - フィッティングソフトウェアおよびCLを開きます。「実験」タブのICK。 「オルタナティブ2-薬フロロ11個のサンプルを。」を選択します
- 「オプション」タブをクリックし、チェックを入れ、「グラフを生成します。」
- 再び「オプション」をクリックし、「新規キー」タブをクリックします。生データのスプレッドシートファイルと同じフォルダに「inhibition_key」.csvファイルを保存します。
- inhibition_keyファイルでは、IDの下にあるすべてのサンプル名を一覧表示します。各サンプル名は一意である必要があります。
- 4つのNA阻害剤を試験した場合には、オセルタミビルの下の2つの追加行のためにスペースを挿入し、「ペラミビル」と入力し、「ラニナミビルを。」 inhibition_keyファイルに加えた変更を保存します。
- 「jasprのV 1.2 - 阻害曲線フィッティング」ウィンドウに戻り、として「実験ファイル」とinhibition_keyなどの生データファイルを選択し、「キーファイルを。」解析を実行します。 .CSVおよび.PDF形式で結果を保存します。
注:ソフトウェアが自動的に阻害曲線をプロットします(RFU agaiNST NA阻害剤濃度)、 図4に示すように。プログラムはまた、個々のNA阻害剤( 図4)に対する各ウイルスについてIC 50値を算出します。また、JASPRはIC 50値とスプレッドシート形式の信号対バックグラウンド(S / B)比を示します。バックグラウンド値を使用し、蛍光光度計に応じて、研究室に研究室から異なる場合があります。メルボルンWHOCCRRI、50〜120 RFUから100μMのMUNANA範囲のバックグラウンド値で。 10未満の比は、特に非常に低いNA活性を有する変異体ウイルスを、依然として許容可能であるが信頼性の高いIC 50値を、≥10のS / B比が、好ましいです。 - IC 50値およびソフトウェアによって生成された曲線形状を検査します。すべてのデータポイントは、上に落ちるか、曲線に近いはずです。そうでない場合は、NA阻害アッセイを繰り返します。
注:非常に高いIC 50値を示し、ウイルスのために、アッセイは、繰り返しする必要がありますedは、結果を確認します。
結果
インフルエンザ抗ウイルス感受性9のサーベイランスに関するWHOワーキンググループからの標準化された報告ガイドラインを使用して、NA阻害剤へのインフルエンザウイルスの感受性が条件通常の阻害(NI)、減少阻害(RI)、および高度に減少抑制を使用して報告している(HRI) 。 NIウイルスは(B型インフルエンザウイルスまたは5未満倍)インフルエンザAウイルスのIC 50中央値基準と比較してIC 50の値未満の10倍を有するものです。 RIウイルスは10-およびインフルエンザAウイルス(または5-およびインフルエンザBの50倍)のIC 50メジアン参照上述100倍の間のIC 50値を有するものです。 HRIウイルスはICインフルエンザAウイルスのIC 50メジアン参照上述100倍の50の値(又はB型インフルエンザウイルスの50倍を超える)を有するものです。 表2を参照してください。
IC 50(H1N1)pdm09、A(H3N2)に対する値、およびB山形/ BビクトリアウイルスはのIC 50値の軽微な変更を反映するためにメルボルンWHOCCRRIで毎年計算され、更新されメディアン参照NA阻害剤( 表3)にインフルエンザ株を循環させます。メジアンIC 50の値は、インフルエンザのA(H1N1)pdm09ウイルスは、4つのNA阻害剤横切ってほぼ同じであるが、(H3N2)ウイルスに対するメジアンザナミビルおよびラニナミビルIC 50の値は、オセルタミビルと比較して2〜4倍高いであり、ペラミビルIC 50の値( 表3)。 B型インフルエンザウイルスのための平均オセルタミビルIC 50値は、一般的に5にザナミビル、ペラミビル、及びラニナミビルIC 50値( 表3)よりも10倍です。
NA阻害アッセイは、遺伝的変化のassociに関する情報を提供していない表現型アッセイでありますRIまたはHRIとated。したがって、遺伝子分析は、RI又はHRI有するウイルスの同定後に実施されることが重要です。メルボルンWHOCCRRIでは、変異体のNA遺伝子は、サンガー配列決定とパイロシーケンシングを用いて分析されます。 RIおよびHRI変異体を有するウイルスのNA遺伝子中に見出すことができるアミノ酸置換の代表的なリストは、表4に示されています。 NAI感受性を変化させることができるアミノ酸置換のより広範なリストはまた、WHOのウェブサイト10上で利用可能です。
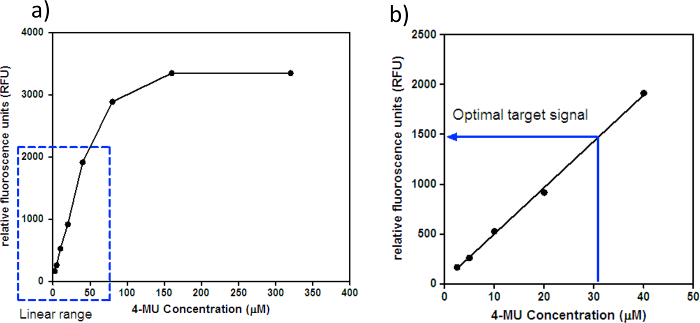
図1:4-MU の濃度に対するRFU。 4-MUの濃度(μM)に対するRFUの(a)の標準曲線。点線のボックスは、蛍光光度計用の4-MUの直線範囲を示しています。線形範囲を超える蛍光シグナルは飽和し、したがって、任意のことができます蛍光のモールの変化は、蛍光光度計によって検出されない場合があります。 (B)の同定のために、図1aの標準曲線のクローズアップ直線部「最適目標信号。」メルボルンWHOCCRRIにおける蛍光は、2.5から40μM4-MUと〜1500 RFUに対応〜30μMの4-MUの最適なターゲット信号の線形範囲を有します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
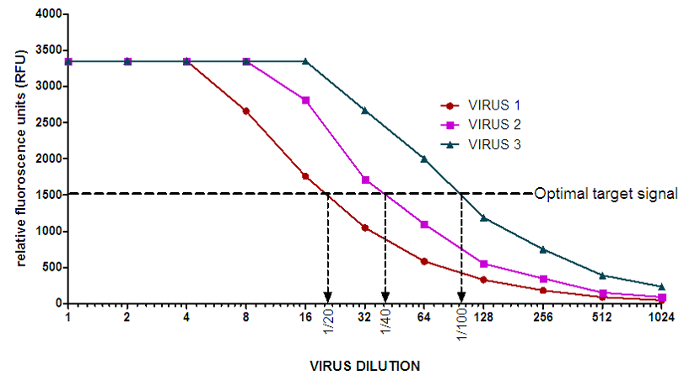
図2: インフルエンザウイルスのNA活性曲線の例。 50.61 RFUの平均バックグラウンド値は、NAの活性曲線上の各希釈ポイントから減算されてきました。矢印は各ウイルスのためのNA阻害アッセイで使用するための適切なウイルス希釈を示しています。簡単に準備のためのウイルス希釈液のaration、1の代わりに1/96希釈のVIRUS 3のための1/100希釈を実行することもできます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
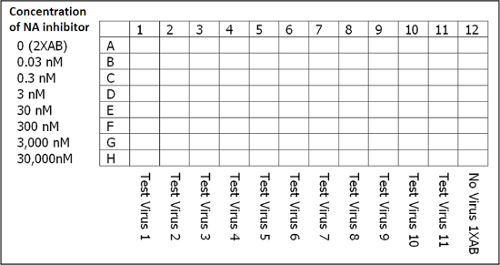
図3:NA 阻害アッセイのセットアップのためのプレートレイアウト。各プレートには、ウイルスのみの1xアッセイ緩衝液(AB)、NA阻害剤、MUNANAを含まない陰性対照として作用する最後の列を含み、そしてこの溶液を止めます。注:JASPRはIC 50値の計算に使用される平均ブランク信号を決定するために、各プレートのカラム12からの測定値を使用します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
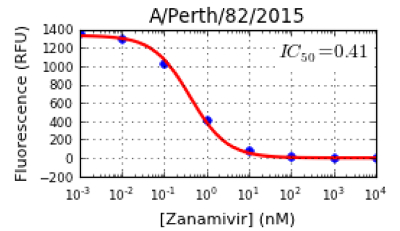
図4:A(H1N1)pdm09 ウイルス、A /パース/ 2015分の82の 阻害曲線およびIC 50 値 の例 。 JASPRソフトウェアは、曲線内のすべての点のフィット感で、NA阻害剤の濃度の増加(NM)に対する蛍光(RFU)として阻害曲線を示しています。阻害曲線に基づいて、IC 50値は、ウイルスNA活性の50%を減少させるためにNA阻害剤の濃度として決定されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| ウイルス | ウイルス希釈が必要 | 1×アッセイ緩衝容量(μL) | 界面活性剤アンペア-NP-40(10%)(ML) | ウイルスの体積(mL)を |
| 1 | 1/20 | 940 | 10 | 50 |
| 2 | 1/40 | 965 | 10 | 25 |
| 3 | 1/100 | 890 | 10 | 10 |
表1:NA阻害アッセイにおいてウイルス1、2についてのウイルス希釈液の調製、及び3。
| ウイルスのタイプ/サブタイプ/系譜 | 通常の阻害 | 減少抑制 | 高減少抑制 |
| (NI) | (RI) | (HRI) | |
| (H1N1)pdm09 | <10倍 | 10〜100倍 | > 100倍 |
| (H3N2) | &#60; 10倍 | 10〜100倍 | > 100倍 |
| B山形とBビクトリア | <5倍 | 5-50倍 | > 50倍 |
表2:WHO抗ウイルスワーキンググループは、NA阻害剤へのインフルエンザウイルスの感受性の分類のためのガイドラインをお勧めします。
| ウイルスのタイプ/サブタイプ/系譜 | N | ザナミビル | オセルタミビル | ペラミビル | ラニナミビル |
| 中央値(範囲)のIC 50 nMの | 中央値(範囲)のIC 50 nMの | 中央値(範囲)のIC 50 nMの | 中央値(範囲)のIC 50 nMの | ||
| (H1N1)pdm09 | 1326 | 0.42(0.1から3.43) | 0.36(0.01から3.48) | 0.19(0.07から1.60) | 0.55(0.05から2.29) |
| (H3N2) | 1,654 | 0.9(0.11から4.0) | 0.38(0.01から3.65) | 0.33(0.12から3.06) | 1.38(0.01から9.38) |
| B山形とBビクトリア | 1,115 | 2.2(1.24から10.72) | 15.12(2.39から70.75) | 1.36(0.57から6.67) | 2.89(1.62から9.15) |
表3: 正常阻害の 平均IC 50 とIC 50 の範囲は2015から(NI)ウイルスは、WHO CCRRI、メルボルンに由来します。
| アミノ酸置換 | タイプ/サブタイプ/系譜 | IC 50倍数変化コ中央IC 50値を参照するためにmpared。 | |||
| ザナミビル | オセルタミビル | ペラミビル | ラニナミビル | ||
| H275Y | (H1N1)pdm09 | 1 | 557(HRI) | 123(HRI) | 2 |
| E119V | (H3N2) | 1 | 63(RI) | 1 | 1 |
| H134Y | Bビクトリア | 1 | 4 | 76(HRI) | 2 |
| N151T | Bビクトリア | 4 | 4 | 42(HRI) | 1 |
| G104E | Bビクトリア | 1220(HRI) | 87(HRI) | 17724(HRI) | 701(HRI) |
| E105K | Bビクトリア | 3 | 5(RI) | 59(HRI) | 2 |
| I222T | Bビクトリア | 2 | 7(RI) | 8(RI) | 3 |
| H273Y | B山形 | 1 | 230(HRI) | 377(HRI) | 2 |
| D197N | B山形 | 4 | 7(RI) | 32(RI) | 3 |
表4:縮小阻害(RI)またはNA阻害剤に高度に低減阻害(HRI)に連結されたアミノ酸置換の代表的なリスト。
| 問題 | 考えられる理由(複数可) | 溶液(S) |
| なし、または低いNAの活動 | いいえウイルスは、ウイルス収量存在または低ありませんでした。 | 臨床検体は、細胞株( すなわちマディンダービーイヌ腎臓細胞)または発育鶏卵で培養しなければなりませんNA阻害アッセイで使用するための高いウイルス負荷へ。 |
| いくつかの変異体ウイルスは、高いウイルス負荷時にもかかわらず、非常に低いNA活性を有します。 | テストのためにきちんとしたウイルス濃度を使用してください。低いpHアッセイ緩衝液( 例えば、pH 5.3)を用いてもよいです。データを比較するときただし、注意が必要です。 | |
| ノーまたはNA阻害アッセイにおける低NA活動 | いいえウイルスを添加しませんでした。 | ウイルスを再希釈します。ウイルスが直接1×アッセイ緩衝液に添加したことを確認します。 |
| 間違ったウイルス希釈液を用いました。 | NA活性アッセイを繰り返します。 | |
| 不十分なインキュベーション時間。 | インキュベーション時間が続いていることを確認します。 | |
| データ点は、IC 50曲線の範囲外 | 高濃度のNA阻害剤の交差汚染。 | ヒントはNA inhibiと接触していないことを確認してくださいTOR 96ウェルプレートに希釈したウイルスを分配します。 |
| 8ディープウェルリザーバが使用された場合は、新鮮な8ディープウェルリザーバにNA阻害剤濃度を、破棄し、再分配。 | ||
| NAの量阻害剤またはMUNANA又は希釈ウイルスを各ウェルに等しく加えませんでした。 | 較正されたマルチチャンネルピペットを用いてアッセイを繰り返します。各試薬の等量を各ウェルに分配されていることを確認します。 | |
| 異常に高いIC 50値 | ウイルスの濃度が高すぎるが追加されました。 | NA活性アッセイおよびNA阻害アッセイを繰り返します。 |
| 試験サンプルは、インフルエンザAおよびインフルエンザBの混合物を含有していました | ウイルス混合物の存在を同定するために、リアルタイムPCRを行います。 | |
| サンプル中の細菌汚染 | 抗生物質の存在下で無菌状態で培養ウイルス。 | |
| 高いバックグラウンド蛍光シグナル | MUNANA基板は、時間の経過とともに低下することがあります。 | MUNANAのsubtrateの新しいバッチを使用してください。 |
| 隣接するウェルからの蛍光の検出。 | 黒色96ウェル平底プレートを使用 |
表5:NA阻害アッセイにおける潜在的な問題のトラブルシューティング。
ディスカッション
NA阻害剤に対するインフルエンザウイルス感受性のグローバルなモニタリングは、現在、蛍光または化学発光NA阻害アッセイ11、12のいずれかを使用して実験室の数で行われています。蛍光アッセイ、化学発光アッセイよりも一般的に使用されます。両方のアッセイは、堅牢かつ再現性であるが、蛍光ベースのアッセイから得られたIC 50値は、13難しい2つのアッセイからのデータの直接比較を行う、しばしば化学発光ベースのアッセイよりも高いです。同じプロトコルを使用して、ある研究室から生成されたデータは、他の異なっていてもよいです。そのための研究室との間にこれらの変動により、インフルエンザ抗ウイルス感受性のサーベイランスに関するWHO作業部会は、研究室間の比較を支援するためのガイドラインを作成しました。むしろ、本ガイドラインの使用絶対IC 50値を比較するよりも中央値は、それぞれの特定の実験室で試験NIインフルエンザウイルスのIC 50のIC 50倍の差に基づいて、SA比較。 5つの協力センターからのデータを比較する能力は、グローバルインフルエンザウイルス感受性データ2、3、4年間出版物をもたらしました。パブリックドメインのインフルエンザ感受性大量のデータの可用性は、研究者が自分の研究室で生成されたもので、これらの研究からIC 50のデータを比較することができます。
同様の概念を採用し、他のNA阻害アッセイはまた、市販されています。すぐに使用できる試薬を含むこれらの市販のキットは、(NA阻害剤が含まれていない)も同様に再現可能です。試薬の大半は中に社内で行うことができるので、しかし、社内のNA阻害アッセイは、市販のキットよりも大幅に安いですより多くの量と以前にアッセイの主要なコストを占めたMUNANA基板は、現在、競争力のある価格で様々な供給源から購入することができます。薬剤ごとに1つのインフルエンザ分離株をテストするためのコストは約$ -1(USD)です。メルボルンWHOCCRRIでは、改善がアッセイの液体取扱い部品用ロボットプラットフォームの取り込み後に、社内のNA阻害アッセイに行われました。離れたウイルス希釈液の手動準備から、手順の大部分は、液体処理ロボットを用いて行われます。これは、マニュアルの取り扱いを最小限に抑えるが、それはまた、日中に実行できるアッセイの数を増加させないだけでなく。
NA阻害アッセイは非常に堅牢ですが、追加の注意を払って完了する必要がある重要なステップの数があります。まず、阻害曲線およびIC 50値をシフトすることができるNA阻害剤濃度における任意の不規則。そのため、細心の注意をする必要がありますNA阻害剤濃度を準備する際に支払いました。第二に、正確なピペットと正確インキュベーション期間はアッセイ間で一貫した結果を維持するために重要です。これは、キャリブレーションピペットとタイマーを使用することによって達成することができます。すべてのアッセイにおける対照ウイルスを含めることは、アッセイからアッセイへと長期間にわたってアッセイ性能の監視を可能にします。季節性インフルエンザウイルスのNA酵素活性はpH6.5で最適であるため、第三の、アッセイ緩衝液の正確なpHは重要です。いくつかの報告は、より低いpH条件の使用は、R292K変異14、15を含むA(H7N9)変形例として、インフルエンザ変異体の同定を改善できることを見出しました。しかしながら、アッセイ緩衝液のpHに変更はIC 50値をシフトし、これは実験室内と研究所との間でデータの比較を複雑にすることができます。他の修正と、pすることができ、トラブルシューティングerformedは、表5に列挙されています。
NA阻害剤は、現在、インフルエンザウイルスの循環に対して有効である承認された抗ウイルス薬の唯一のクラスです。他の抗ウイルスクラスは臨床使用のために利用可能になるまでは、インフルエンザウイルスの循環の抗ウイルス感受性サーベイランスだけではNA阻害剤を中心に説明します。そのため、結果の単純さと再現性、NA阻害剤へのインフルエンザウイルスの感受性を評価するためのNA阻害アッセイの使用が継続されます。
開示事項
著者は、開示することは何もありません。
謝辞
インフルエンザの参考と研究協力センターメルボルンWHOは健康のオーストラリア政府部門によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Influenza A and B viruses | Cultured in MDCK cells or 9 day old embryonated specific pathogen free (SPF) eggs | ||
| Madin-Darby Canine Kidney (MDCK) cells | ATCC | PTA-6500 | |
| 2-(4-methylumbelliferyl)-a-D-N-acetylneuraminic acid (MUNANA) | Biosynth AG | M-5507 | |
| 2-(4-methylumbelliferyl)-a-D-N-acetylneuraminic acid (MUNANA) | Sigma | M8639 | |
| 4-Methylumbelliferone (4-MU) | Sigma | M1381-25G | |
| 2-[N-morpholino]ethanesulphonic acid (MES hydrate) (free acid) | Sigma | M8250-250G | |
| Calcium Chloride (Ca Cl2) | APS AJAX Finechem | 127-500G | |
| Surfactant-Amps-NP-40 (10% solution) | Thermo Fisher Scientific | PIE28324 | |
| Sodium Hydroxide (NaOH) | APS AJAX Finechem | 482-2.5KG | |
| Absolute Ethanol | APS AJAX Finechem | 214-2.5L GL | |
| 96-well clear flat-bottom plates | NUNC | 456537 | |
| 96-well U-bottom plates | Greiner Bio-one | 4650101 | |
| 8 channel deep well block | Pacific Laboratory Products | RES-MW8-HP | |
| 96-well deep plates, 2.0 mL square wells | Pacific Laboratory Products | P-2ML-SQ-C | |
| Plate sealers | Thermo Fisher Scientific | 236366 | |
| Bottle-top vacuum filter system (cellulose membrane (nitrate), pore size 0.2 μm, membrane area 33.2 cm2, filter capacity 500 mL) | Sigma-Aldrich | CLS430758-12EA | |
| Single-channel pipettes (1 µL - 1,000 µL) | Variety of suppliers (eg. Eppendorf, Sartorius) | ||
| Multi-channel pipettes | Variety of suppliers (eg. Eppendorf, Sartorius) | 8 or 12 channel electronic and manual pipette (5 - 1250 µL volume) | |
| Pipette tips (1 µL - 1,250 µL) | Variety of suppliers (eg. Eppendorf, Sartorius) | ||
| Disposable pipettes (10 mL and 25 mL) | Greiner Bio-one | P7740-200EA and P7865-200EA | |
| Pipette controller | Eppendorf | 4430000018 | |
| Centrifuge tubes 50 mL | BD Bioscience | 352070 | |
| Racked tubes | Scientific Specialties, Inc. | 1750-00 | |
| Fluorometer with excitation wavelength setting of 355 nm and an emission wavelength setting of 460 nm | TermoFisher Scientific | ASCENT FL 374 | |
| Ascent software | TermoFisher Scientific | 5185410CD | |
| Incubator set at 37 °C | Lab Supply | Biocell 1000 | |
| Zanamivir | GlaxoSmithKline | Request directly from the company | |
| Oseltamivir carboxylate | Roche | ||
| Peramivir (BCX-1812) | BioCryst | ||
| Laninamivir (R-125489) | Daiichi-Sankyo | ||
| JASPR v1.2 | Influenza Division at the CDC Atlanta, USA | freely available upon request (fluantiviral@cdc.gov) |
参考文献
- Moscona, A. Neuraminidase inhibitors for influenza. N.Engl.J.Med. 353 (13), 1363-1373 (2005).
- Hurt, A. C., et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors. Antiviral Res. 132, 178-185 (2016).
- Meijer, A., et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors. Antiviral Res. 110, 31-41 (2014).
- Takashita, E., et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors. Antiviral Res. 117, 27-38 (2015).
- Lackenby, A., et al. Emergence of resistance to oseltamivir among influenza A(H1N1) viruses in Europe. Euro Surveill. 13 (5), (2008).
- Hurt, A. C., et al. Community transmission of oseltamivir-resistant A(H1N1)pdm09 influenza. N Engl J Med. 365 (26), 2541-2542 (2011).
- Takashita, E., et al. Characterization of a large cluster of influenza A(H1N1)pdm09 viruses cross-resistant to oseltamivir and peramivir during the 2013-2014 influenza season in Japan. Antimicrob Agents Chemother. 59 (5), 2607-2617 (2015).
- Eisfeld, A. J., Neumann, G., Kawaoka, Y. Influenza A virus isolation, culture and identification. Nat Protoc. 9 (11), 2663-2681 (2014).
- . Meetings of the WHO working group on surveillance of influenza antiviral susceptibility - Geneva, November 2011 and June 2012. Wkly Epidemiol Rec. 87 (39), 369-374 (2012).
- Okomo-Adhiambo, M., Hurt, A. C., Gubareva, L. V. The chemiluminescent neuraminidase inhibition assay: a functional method for detection of influenza virus resistance to the neuraminidase inhibitors. Methods Mol Biol. 865, 95-113 (2012).
- Hurt, A. C., Okomo-Adhiambo, M., Gubareva, L. V. The fluorescence neuraminidase inhibition assay: a functional method for detection of influenza virus resistance to the neuraminidase inhibitors. Methods Mol Biol. 865, 115-125 (2012).
- Analysis of IC50 data. isirv Antiviral Group (isirv-AVG) Available from: https://isirv.org/site/index.php/methodology/analysis-of-ic50-data (2016)
- Sleeman, K., et al. R292K substitution and drug susceptibility of influenza A(H7N9) viruses. Emerg Infect Dis. 19 (9), 1521-1524 (2013).
- Gubareva, L. V., Robinson, M. J., Bethell, R. C., Webster, R. G. Catalytic and framework mutations in the neuraminidase active site of influenza viruses that are resistant to 4-guanidino-Neu5Ac2en. J Virol. 71 (5), 3385-3390 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved