Method Article
Fluoreszenz-basierte Neuraminidase-Inhibitionsassay die Empfänglichkeit der Influenza-Viren an die Neuraminidase-Inhibitor-Klasse von Anti-Virus zu beurteilen
In diesem Artikel
Zusammenfassung
Wir beschreiben die Verwendung eines phänotypischen fluoreszenzbasierten Neuraminidase-Hemmt die Anfälligkeit von Influenza A und B Viren in die Neuraminidase-Hemmer Klasse von antiviralen Medikamenten zu beurteilen.
Zusammenfassung
Die Neuraminidase (NA) Inhibitoren sind die einzige Klasse von antiviralen Arzneimitteln zur Behandlung und Prophylaxe von Influenza zugelassen, die gegen derzeit zirkulierende Stämme wirksam sind. Zusätzlich zu ihrer Verwendung in der saisonale Grippe zu behandeln, haben die NA-Inhibitoren durch eine Reihe von Ländern für die Verwendung im Fall einer Pandemie bevorratet worden. Es ist daher wichtig, um die Anfälligkeit von zirkulierenden Influenzaviren zu dieser Klasse von antiviralen Medikamenten zu überwachen. Es gibt verschiedene Arten von Tests, die verwendet werden können, um die Anfälligkeit von Influenza-Viren in den NA-Inhibitoren zu bewerten, aber die Enzymhemmung Assays entweder ein fluoreszierendes Substrat oder einen Chemilumineszenzsubstrats sind die am weitesten verbreiteten und empfohlen werden. Dieses Protokoll beschreibt die Verwendung eines fluoreszenzbasierten Assays Influenzavirus Anfälligkeit für NA-Inhibitoren zu bewerten. Der Test basiert auf der Spaltung des Enzyms NA 2 '- (4-Methylumbelliferyl) -α-D - N - Acetylneuraminsäure (Munana) -Substrat den fluoreszierenden Produkt 4-Methylumbelliferon (4-MU) freizugeben. Daher wird die inhibitorische Wirkung eines Inhibitors NA auf dem Influenza - Virus - NA auf der Basis der Konzentration des Inhibitors NA bestimmt , die 50% der NA - Aktivität erforderlich ist, als ein IC 50 -Wert angegeben zu reduzieren.
Einleitung
Hämagglutinin (HA) und Neuraminidase (NA) sind die beiden wichtigsten Oberflächen-Glycoproteine von Influenza A und B Viren. HA bindet an die Sialinsäure-Galactose von Zelloberflächen - Glykoproteinen oder Glykolipiden, während die NA - Virus veröffentlicht durch auf der Zelloberfläche 1 , die die Sialinsäure aus der Galactose spaltet. Die NA-Inhibitoren sind eine Klasse von Influenza-Virostatika, die rational entworfen wurden fest an die NA enzymatisch aktive Stelle zu binden, wodurch die Freisetzung und Ausbreitung von Virusnachkommen zu verhindern. Oseltamivir und Zanamivir sind zwei NA-Inhibitoren, die in vielen Ländern der Welt zur Behandlung und Prophylaxe von Influenza zugelassen sind. In den letzten Jahren wurden zwei weitere NA-Inhibitoren, peramivir und laninamivir, wurden für die Verwendung in einer begrenzten Anzahl von Ländern zugelassen. Screening von Influenza-Viren für die Anfälligkeit für NA-Inhibitoren und die Identifizierung von Mutationen, die Resistenz verleihen, sind wichtig bei der Bestimmung und Überwachung der effectivENESS dieser Klasse von antiviralen Medikamenten.
In den letzten 16 Jahren hat sich die fluoreszenzbasierte NA Hemmtest routinemäßig bei der WHO Collaborating Center für Referenz und Forschung auf Influenza, Melbourne (Melbourne WHOCCRRI) zu überwachen, um die Trendwende von antivirale Anfälligkeit unter zirkulierenden Influenzaviren durchgeführt worden ist. Jährlich werden mehr als 2.000 Influenza-Viren für die antivirale Anfälligkeit getestet. In den meisten Influenza Jahreszeit,> 98% der Viren sind anfällig für alle vier NA - Inhibitoren 2, 3, 4, obwohl während der 2007-2008 nördlichen Hemisphäre Saison Grippe, ein Anstieg in der Zahl des ehemaligen saisonalen A (H1N1) -Viren gibt es das hatte 5 Empfindlichkeit gegenüber Oseltamivir reduziert. Diese Gruppe von Viren, die die NA Aminosäuresubstitution H275Y enthalten ist, breitete sich auf den Rest der Welt bis zum Ende des Jahres 2008, so dass Oseltamivir inappropriaß global für die Behandlung dieses Virus. Die überwiegende Mehrheit der derzeit Influenza B zirkulierenden, Influenza A (H3N2) und Influenza A (H1N1) pdm09 Stämme sind anfällig für Oseltamivir, obwohl Gemeinschafts Clustern von A (H1N1) pdm09 Varianten enthalten die Aminosäure NA Substitution H275Y, die Oseltamivir reduziert verleihen und peramivir Anfälligkeit, wurden in verschiedenen Teilen der Welt 6, 7 berichtet.
Wegen der Notwendigkeit, für einen ausreichend hohen Virustiter, klinische Proben (einschließlich Tiere nasaler Waschungen) müssen entweder in Zellkultur oder bebrüteten Hühnerei vor der antiviralen Empfindlichkeitsprüfung agiert werden. Der NA-Inhibitionstest in diesem Artikel beschrieben wird, kann in drei Abschnitte unterteilt werden:
Bestimmung des linearen Bereichs für das fluoreszierende Produkt 4-Methylumbelliferon (4-MU) zu einem bestimmten Fluorometer
Aufgrund der inhärenten Unterschiede zwischen Fluorometer, ter linearer Bereich für das Leuchtstoff Endprodukt, 4-MU und die relativen Fluoreszenzeinheit (RFU), muß festgelegt werden. Sobald der lineare Bereich für 4-MU hergestellt ist, wird das optimale Zielsignal ausgewählt wird, zu der die Konzentration der Influenza-Viren ist in dem NA-Aktivitätstest eingestellt. Sobald für eine bestimmte Fluorometer abgeschlossen, sollte dies nicht wiederholt werden muß.
Die Ermittlung der NA-Aktivität der Viren
Die NA - Aktivitäts - Assay ist ein einfacher Test, der die Zugabe der 2 'beinhaltet - (4-Methylumbelliferyl) -α-D - N - Acetylneuraminsäure (Munana) Substrat Viren seriell verdünnt. Die Menge an fluoreszierendem Endprodukts 4-MU aus der Spaltung von Munana durch die NA erzeugt wird unter Verwendung eines Fluorometers gemessen. Die geeignete Virusverdünnung in dem NA-Inhibitionstest zu verwenden, wird durch Auftragen Fluoreszenzeinheiten gegen Virusverdünnung ausgewählt. Von der S-förmigen Kurve erzeugt, sollte der Mittelpunkt des linearen Abschnitts entsprichtDer 4-MU lineare Bereich des Fluorometers in Abschnitt 1 bestimmt und die geeignete Konzentration von Viren informiert in Abschnitt 3 verwendet werden.
Beurteilung der Virusanfälligkeit NA Inhibitoren der NA-Hemmtest unter Verwendung von
Um die Anfälligkeit von Viren zu einem bestimmten NA-Inhibitor, Viren bei der Verdünnung zu bewerten in Abschnitt 2 bestimmt sind mit einer Reihe von NA Inhibitorkonzentrationen inkubiert. Nach einer anschließenden Inkubation mit Munana der 4-MU durch ungehemmte Viren erzeugt wird, in RFU durch das Fluorometer gemessen. Die Hemmwirkung des Inhibitors NA NA auf der Enzymaktivität eines Virus wird berechnet nach der Inhibitorkonzentration NA erforderlichen 50% der NA - Aktivität zu verringern, als ein IC 50 -Wert angegeben.
Protokoll
1. Ermittlung der lineare Bereich von Fluorescent Produkt 4-MU auf einem Fluorometer
- Herstellung von 10 ml von 6,4 mM 4-MU-Stammlösung durch Lösen von 11,3 mg von 4-MU in 5 ml absolutem Ethanol. In 5 ml 0,9% NaCl (w / v) an die Stammlösung auf 10 ml zu machen. Bereiten Sie einen 640 & mgr; M Arbeitslösung durch Verdünnen von 1 ml 6,4 mM 4-MU in 9 ml 1x Assay - Puffer (33,3 mM 2- (N-Morpholino) ethansulfonsäure (MES) und 4 mM CaCl 2, pH 6,5).
HINWEIS: Vorbereiten der Puffer 2x Assay durch 13 g MES Zugabe und 8 ml 1 M CaCl 2 bis 992 ml destilliertem Wasser. Den pH-Wert auf 6,5 unter Verwendung von 10 M NaOH. Filtern der Puffer eines sterilen Celluloseacetat-Filter mit einer Porengröße von 0,2 & mgr; m verwendet. Vorsicht! Natriumhydroxid ist ätzend und kann Verätzungen an Haut und Augen verursachen. Stellen Sie sicher, dass die vollständige persönliche Schutzausrüstung getragen wird. - Bereiten 5 ml eines Bereich von 4-MU - Konzentrationen (dh 5 uM, 10 uM, 20 uM, 40 uM, 80 uM, 160 & #181; M und 320 & mgr; M) durch eine zweifache serielle Verdünnung von 640 & mgr; M 4-MU 1x Assay-Puffer verwendet wird.
- Geben Sie 50 & mgr; l jede Reihenverdünnung von 4-MU (dh 5 uM, 10 uM, 20 uM, 40 uM, 80 uM, 160 uM, 320 uM und 640 uM) (zwei Vertiefungen pro Verdünnung) in eine klaren, 96- Well-Flachbodenplatte und 50 ul 1x Assay-Puffer in die verbleibenden Vertiefungen (die als Rohlinge dienen Hintergrundsignale zu messen).
HINWEIS: Die Endkonzentrationen von 4-MU in dem Reaktionsvolumen (50 & mgr; l 4-MU + 50 & mgr; l 300 & mgr; M Munana) ist 2,5 uM, 5 uM, 10 uM, 20 uM, 40 uM, 80 uM, 160 uM und 320 uM . - Vorbereiten einer 2,5 mM Stammlösung von Munana 25 mg Munana Rekonstitution in 20 ml destilliertem Wasser. Mischte 0,72 ml einer 2,5 mM MUNANA mit 5.28 ml 1x Assay-Puffer, der ein 300 uM Munana Arbeitslösung (ausreichendes Volumen für eine Platte) zu erhalten. Bedecken des Rohres wird der 300 uM Munana workin enthaltendg Lösung mit Aluminiumfolie und hält sie auf Eis, wenn nicht sofort verwendet. Entsorgen Sie alle übrig gebliebenen Materialien.
HINWEIS: Die 2,5 mM MUNANA Stammlösung kann für 1 Monat bei -20 ° C gelagert werden und muss innerhalb eines Gefrier / Tau-Zyklus verwendet werden. Die 4-MU und Munana Lösungen sind lichtempfindlich und müssen bei längerer Belichtung geschützt werden. - Zugeben von 50 uL 300 uM Munana in jeder Vertiefung, sanft zu mischen tippen, und Inkubieren bei 37 ° C für 30 min. Bedecken der Platte mit einer Plattenversiegelung zu verhindern Verdunstung.
Anmerkung: Dieser Schritt für die Hintergrundfluoreszenz in dem NA-Inhibitionstest zu berücksichtigen ist. - Bereiten Sie die Stop-Lösung von 11 ml absolutem Ethanol Mischen mit 2,225 ml 0,824 M NaOH (ausreichend Volumen für eine Platte).
- Je 100 & mgr; l Stopplösung in jede Vertiefung die Reaktion zu stoppen und sanft zu mischen tippen.
- Lesen Sie die Platte eine Fluorometer bei einer Anregungswellenlängeneinstellung von 355 nm und einer Emissionswellenlänge von 460 nm-Einstellung verwendet wird, wie PEr den Anweisungen des Herstellers.
- Berechnen das durchschnittliche Hintergrundsignal unter Verwendung von Fluoreszenz-Signalen von allen Vertiefungen, die keinen 4-MU. Subtrahieren diese mittlere Hintergrundsignal von jeder der Vertiefungen mit 4-MU und berechnen die Mittelwertsignale (RFU) für jede 4-MU-Konzentration. Plotten eine Standardkurve von RFU gegen die 4-MU - Konzentration (uM), wie in 1a gezeigt; Eine Nahaufnahme linearer Abschnitt der Kurve ist in Abbildung 1B gezeigt.
- Visualisieren die Auftragung der RFU gegen 4-MU-Konzentration (uM), um den linearen Bereich und das optimale Zielsignal zu bestimmen; Der lineare Bereich ist, wo das Fluoreszenzsignal steigt proportional zu den steigenden Konzentrationen des 4-MU auf dem Grundstück, während das optimale Zielsignal eine beliebige 4-MU-Konzentration innerhalb des linearen Bereichs liegt.
HINWEIS: Der lineare Bereich und das optimale Zielsignal ist Fluorometer spezifisch. Zum Beispiel hat das Fluorometer im Melbourne WHOCCRRI einen linearen Bereich von 20,5 bis 40 & mgr; M 4-MU und ein optimales Zielsignal von ~ 30 & mgr; M 4-MU, der auf ~ 1500 RFU entspricht.
2. Bestimmung der NA Aktivität der Viren
HINWEIS: Influenza - Viren gezüchtet werden , um eine ausreichende Titer in Madin-Darby Canine Kidney (MDCK) -Zellen oder bebrüteten Hühnereiern 8.
- Dispense 120 ul pro Vertiefung von unverdünnten gezüchteten Influenzaviren in der Säule 1 und 60 & mgr; l 1x Assay-Puffers, der 0,1% NP-40 in die verbleibenden 11 Spalten einer 96-well, U-Bodenplatte.
- Seriell auszuführen zweifache Verdünnung der Viren über die Platte (dh Übertragung von 60 & mgr; l aus Spalte 1 bis Spalte 2 und so weiter, bis Spalte 11) , um eine Mehrkanalpipette, Spalte 12 als Rohling so dass nur 1x Assay - Puffer enthält.
- Übertragung von 50 ul aus jeder der Vertiefungen (verdünnte Viren und Rohlinge) in eine klare, 96-Well-Flachboden-Platte.
HINWEIS: Es ist nicht notwendig, change Pipettenspitzen, wenn Materialien aus Spalte 12 bis zur Spalte 1 übertragen werden. - Zugeben von 50 uL 300 uM Munana (hergestellt gemäß Schritt 1.4) pro Mulde und sanft die Platte tippen zu mischen. Inkubiere die Platte bei 37 ° C für 1 h. Bedecken der Platte mit einer Plattenversiegelung zu verhindern Verdunstung.
- Füge 100 & mgr; l Stopplösung (hergestellt wie in Schritt 1.6) pro Napf die Reaktion zu beenden und die Platte sanft tippen zu mischen.
- Lesen Sie die Platte unter Verwendung eines Fluorometers.
- Verwenden einer Anregungswellenlänge Einstellung von 355 nm und einer Emissionswellenlänge von 460 nm Einstellung.
- Bestimmen Sie das mittlere Hintergrundsignal auf den Basis der Fluoreszenzmesswerte in Spalte 12 und subtrahiert das mittlere Hintergrundsignal von jedem Well. Eine Grafik mit RFU gegen Virusverdünnungen.
HINWEIS: Die Hintergrundwerte für 100 & mgr; M Munana am WHOCCRRI Melbourne sind in der Regel zwischen 50 und 120 RFU, aber diese unterscheiden sich auf dem Fluorometer bei jeng verwendet. - Sehen Sie das Diagramm der RFU gegen Virusverdünnungen den Mittelpunkt des linearen Abschnitts der Kurve für jedes Virus (Abbildung 2) zu bestimmen. Verwenden des optimalen Zielsignal (bestimmt in Schritt 1) als Bezugspunkt.
Hinweis: dieser mit dem 4-MU linearen Bereich des Fluorometers in Abschnitt bestimmt entspricht 1 und wird die geeignete Konzentration von Viren bereitzustellen, bis 3 in Abschnitt verwendet werden.
3. Bewertung Virus Empfänglichkeit für NA-Inhibitoren Verwendung des NA-Inhibitionstest
- Bereiten Master Bestände von NA - Inhibitoren bei Konzentrationen von 300 uM.
- Bereiten 300 uM Zanamivir (Molekulargewicht MW = 332,32 g / mol) von 5,0 mg Zanamivir in 50 ml 2 × Assaypuffer aufgelöst (66,6 mM MES und 8 mM CaCl 2, pH 6,5).
- Bereiten 300 uM Oseltamivircarboxylat (D-Tartrat; MW = 386,44 g / mol) von 5,8 mg in 50 ml 2 × Assaypuffer gelöst wird.
- Bereiten300 uM peramivir Trihydrat (MW = 382,45 g / mol) von 5,7 mg in 50 ml 2 × Assaypuffer gelöst wird.
- Bereiten 300 uM laninamivir (MW = 346.34 g / mol) von 5,2 mg in 50 ml 2 × Assaypuffer gelöst wird.
HINWEIS: Die NA-Inhibitor Master Aktien können für 12 Monate bei -20 ° C gelagert werden. Überprüfen Sie die MW der NA-Inhibitoren die richtigen Gewichte und Volumen, um sicherzustellen, sind in der Rekonstitution verwendet. Die Oseltamivircarboxylat ist der Wirkstoff des Prodrugs Oseltamivirphosphat. Daher sollten nur die Oseltamivircarboxylat in dem NA-Hemmtest verwendet werden.
- Von den Master-Beständen, bereite Bestände von zehnfache seriellen Verdünnungen der NA-Inhibitoren in 50 ml-Zentrifugenröhrchen in Konzentrationen von 0,03 nM arbeiten, 0,3 nM, 3 nM, 30 nM, 300 nM, 3000 nM, und 30.000 nM in 2 x Assay Puffer (66,6 mM MES und 8 mM CaCl 2, pH 6,5); Dies ist für den Einsatz in mehreren Tests.
HINWEIS: Die Endkonzentrationen von NA-Inhibitoren bei der Reaktion volume (50 & mgr; l Virusverdünnung + 50 ul Inhibitor NA + 50 & mgr; l von 300 & mgr; M Munana) ist 0,01 nM, 0,1 nM, 1 nM, 10 nM, 100 nM, 1000 nM und 10.000 nM. Die endgültige Konzentration enthält nicht die 100 & mgr; l Stopplösung. Speichern aller NA Inhibitoren Verdünnungen bei 2-8 ° C. Das Verfallsdatum ist das gleiche wie die der Stammaktien. - Bereiten Sie die Virusverdünnungen in 1 × Assaypuffer, enthaltend 0,1% NP-40-Tensid in einer 96-Deep-Well-Block. Virusverdünnungen verwenden, basierend auf den NA-Aktivitätstest Ergebnisse von 2. Mit einem Gesamtvolumen von 2 ml pro Virus Inhibitoren testen vier NA Abschnitt abgeleitet.
HINWEIS: Bereiten Sie zwei Vertiefungen (1 ml pro Vertiefung) pro Virus in einem 96-Deep-Well-Block. Beispiele für Virusverdünnungen für VIRUS 1, 2 und 3 sind in Tabelle 1 dargestellt. - Dispense das erforderliche Volumen von NA-Inhibitoren (hergestellt wie in Schritt 3.2) in ein 8 Deep-Well-Reservoir. Von dort verzichtet werden 50 & mgr; l von NA-Inhibitoren bei Verdünnungen im Bereich von 0 nM (2x Assay bUffer nur) bis 30.000 nM in Reihen A bis H in einer klaren, 96-Well-Flachboden-Platte.
HINWEIS: Die Plattenanordnung ist in Abbildung 3 dargestellt. - Je 50 ul verdünnten Test Viren pro Vertiefung zu den Spalten 1-11 und 50 & mgr; l pro Vertiefung 1x Assay-Puffer nur bis Spalte 12 vorsichtig die Platte tippen zu mischen und 45 min bei Raumtemperatur inkubieren. Bedecken der Platte mit einer Plattenversiegelung zu verhindern Verdunstung.
- Zugeben von 50 uL 300 uM Munana (hergestellt gemäß Schritt 1.4) pro Mulde und sanft die Platte tippen zu mischen. Inkubiere die Platte bei 37 ° C für 1 h. Bedecken der Platte mit einer Plattenversiegelung zu verhindern Verdunstung.
- Füge 100 & mgr; l Stopplösung (hergestellt wie in Schritt 1.6) in jeder Vertiefung und sanft die Platte tippen zu mischen.
- Lesen Sie die Platte unter Verwendung eines Fluorometers.
- Verwenden einer Anregungswellenlänge von 355 nm und einer Emissionswellenlänge von 460 nm, wie zuvor beschrieben.
4. Berechnung vonIC50 - Werte
HINWEIS: Die JASPR v1.2 ist Kurvenanpassungssoftware, die die Berechnung der IC50 - Werte ermöglicht. Die Software wurde von der Influenza-Abteilung bei der CDC, Atlanta, USA, entwickelt. Die Software verwendet die Gleichung: V = V max · (1 - ([I] / (K i + [I]))), wobei V max die maximale Geschwindigkeit des Stoffwechsels, [I] die Inhibitorkonzentration, V ist die Reaktion gehemmt wird, und K i ist der IC 50 für die Hemmungskurve.
- Kopieren Sie die rohen durch das Fluorometer in eine Tabellenkalkulations ausgegebenen Daten in einem 12-Säulenplattenformat (96-well), beginnend mit der Zelle A1.
HINWEIS: Die Rohdaten von jeder nachfolgenden Platte muss durch eine leere Reihe versetzt angeordnet werden. Wenn jeder Virus gegen vier NA-Inhibitoren getestet wurde, fügt die Rohdaten in einem Satz von vier (mit einer leeren Zeile zwischen jeder Platte). - Öffnen Sie die Anpass-Software und click auf den „Experiment“ Registerkarte. Wählen Sie "Alternative 2-Medikament Fluoro 11 Proben."
- Klicken Sie auf die Registerkarte „Optionen“ und aktivieren Sie „Graphen generieren.“
- Klicken Sie auf „Optionen“ wieder und klicken Sie auf den „New Key“ aus. Speichern Sie die „inhibition_key“ CSV-Datei im selben Ordner wie die Rohdaten Tabellendatei.
- In der inhibition_key Datei listet alle Probennamen unter der ID. Jede Probe Name muss eindeutig sein.
- Wenn vier NA-Inhibitoren getestet wurden, legen Plätze für zwei zusätzliche Zeilen unter Oseltamivir und gibt in „Peramivir“ und „Laninamivir.“ Speichern Sie die Änderungen an der Datei inhibition_key.
- Zurück zu den „jaspr v 1.2-Hemmung Kurvenanpassung“ Fenster und wählen Sie die Rohdatendatei als „Experiment Datei“ und inhibition_key als „Schlüsseldatei.“ Führen Sie die Analyse. Speichern Sie die Ergebnisse in CSV und PDF-Formate.
HINWEIS: Die Software wird automatisch eine Hemmung Kurve plotten (RFU against NA Inhibitorkonzentrationen), wie in Abbildung 4 gezeigt. Das Programm berechnet auch IC 50 -Werte für jedes Virus gegenüber einem einzelnen NA - Inhibitor (Abbildung 4). Zusätzlich stellt JASPR Die IC 50 -Werte und das Signal-zu-Hintergrund (S / B) -Verhältnis in Tabellenformat. Die Hintergrundwerte können von Labor zu Labor unterscheiden sich je nach dem Fluorometer verwendet. Am Melbourne WHOCCRRI Werte der Hintergrund für 100 & mgr; M Munana Bereich von 50 bis 120 RFU. Für einen zuverlässigen Wert IC 50, ein S / B - Verhältnis von ≥10 ist bevorzugt, obwohl ein Verhältnis von weniger als 10 noch akzeptabel ist, insbesondere für die mutanten Viren , die sehr niedrige NA - Aktivität aufweisen. - Überprüfen Sie die IC50 - Werte und die Kurvenformen von der Software erzeugt. Alle Datenpunkte sollten fallen oder in der Nähe der Kurve; wenn sie es nicht tun, wiederholen Sie den NA-Hemmtest.
HINWEIS: Für Viren , die ungewöhnlich hohe Werte 50 ICS zeigen, sollte der Test wiederholen seined das Ergebnis zu bestätigen.
Ergebnisse
Mit standardisierten Richtlinien für die Berichterstattung von der WHO - Arbeitsgruppe für Überwachung der Influenza - Antivirale Empfänglichkeit 9 wird die Anfälligkeit von Influenza - Viren in den NA - Hemmern , die Bedingungen normale Hemmung (NI), reduzierte Inhibition (RI) verwendet wird , und stark reduzierte Hemmung (HRI) . NI - Viren sind diejenigen , mit IC 50 -Werten von weniger als das 10-fache im Vergleich zu dem Referenzmittelwert IC 50 für Influenza - A - Viren (oder weniger als 5-fach für Influenza - B - Viren). RI - Viren sind diejenigen , mit IC 50 -Werten zwischen 10- und 100-fach über dem Referenzmittelwert IC 50 für Influenza - A - Viren (oder 5- und 50-fach für Influenza - B). HRI - Viren sind diejenigen , mit IC 50 -Werten von 100-fach über dem Referenzmittelwert IC 50 für Influenza - A - Viren (oder über 50-fach für B - Viren Influenza); siehe Tabelle 2.
Das Referenzmittel IC50 - Wert für A (H1N1) pdm09, A (H3N2) und B Yamagata / B Victoria Viren berechnet und jährlich im Melbourne WHOCCRRI aktualisiert , um kleinere Änderungen in den IC50 - Werten von Influenza - Stämme zu den NA - Inhibitoren zirkulierende (Tabelle 3). Die mittleren IC 50 -Werte in Influenza A (H1N1) pdm09 Viren sind fast die gleichen in den vier NA - Inhibitoren, aber der mittlere Zanamivir und laninamivir IC 50 Werte für A (H3N2) -Viren sind 2- bis 4-fach höher im Vergleich zu Oseltamivir und peramivir IC 50 -Werte (Tabelle 3). Der Median Oseltamivir IC 50 -Wert für B - Viren Influenza sind in der Regel 5- bis 10-fach höher als die Zanamivir, peramivir, und IC 50 -Werte laninamivir (Tabelle 3).
Der NA-Hemmtest ist eine phänotypische Assay, die Informationen über die genetischen Veränderungen associ bietet keineated mit RI oder HRI. Daher ist es wichtig, dass die genetische Analyse wird nach der Identifizierung von Viren mit RI oder HRI durchgeführt. Am Melbourne WHOCCRRI werden die NA-Gene von Varianten mit Sanger-Sequenzierung und Pyro-Sequenzierung analysiert. Eine repräsentative Liste von Aminosäuresubstitutionen , die in den NA - Genen von Viren mit RI und HRI - Varianten gefunden werden können , ist in Tabelle 4 dargestellt. Eine ausführlichere Liste von Aminosäure-Substitutionen , die NAI Anfälligkeit verändern kann , ist auch auf der Internetseite der WHO 10 zur Verfügung.
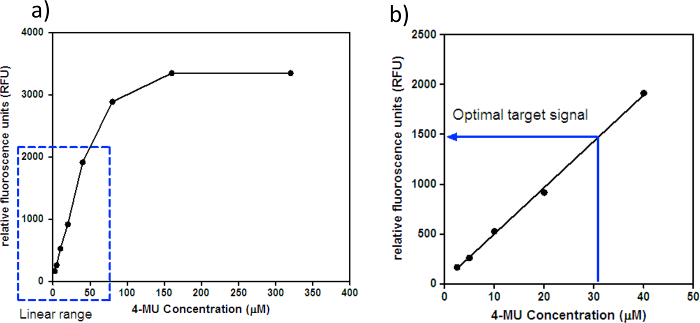
Abbildung 1: RFU gegen 4-MU - Konzentration. (A) Standardkurve von RFU gegen 4-MU - Konzentration (uM). Die gepunktete Box zeigt den linearen Bereich von 4-MU für das Fluorometer. Die Fluoreszenzsignale oberhalb des linearen Bereichs kann gesättigt werden, und daher werden alle sMall Veränderungen in der Fluoreszenz können nicht durch das Fluorometer nachgewiesen werden. (B) Nahaufnahme linearer Abschnitt der Standardkurve der Figur 1a für die Identifizierung des „optimalen Zielsignals.“ Das Fluorometer am Melbourne WHOCCRRI hat einen linearen Bereich von 2,5-40 & mgr; M 4-MU und ein optimales Zielsignal von ~ 30 & mgr; M 4-MU, der auf ~ 1500 RFU entspricht. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
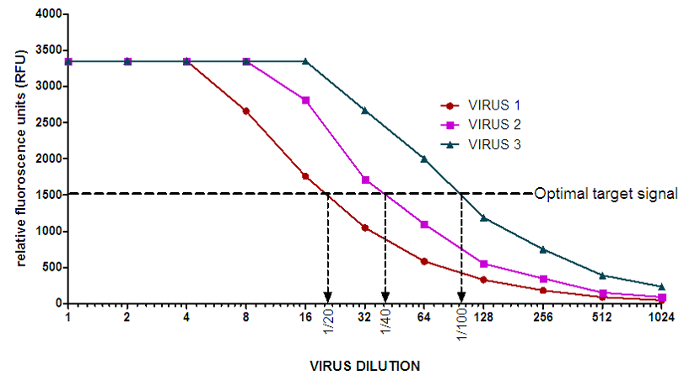
Abbildung 2: Beispiel für die Aktivitätskurven NA von Influenza - Viren. Der durchschnittliche Hintergrundwert von 50,61 RFU wird von jedem Verdünnungspunkt auf den NA Aktivitätskurven abgezogen. Die Pfeile zeigen die entsprechende Virusverdünnung für jedes Virus in dem NA-Inhibitionstest zu verwenden. Zur leichteren prepreitung von Virusverdünnungen, kann man wählen, für VIRUS 3 anstelle einer 1/96 Verdünnung einer 1/100 Verdünnung durchzuführen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
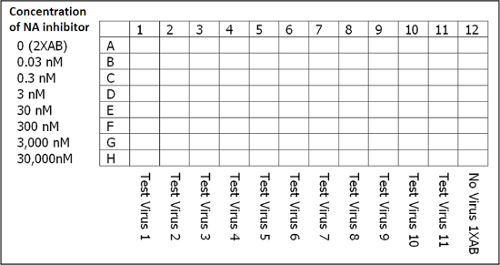
Abbildung 3: Plattenlayout für den Aufbau des NA - Hemmtest. Jede Platte enthält die letzte Spalte, die als negative Kontrolle dient, die keinen Virus enthalten, aber nur 1x Assay-Puffer (AB), Na-Inhibitor, Munana und Stopplösung. HINWEIS: JASPR verwendet Ablesungen von Spalte 12 jeder Platte , die die durchschnittliche Austastsignal in der Berechnung der IC50 - Werte verwendet , um zu bestimmen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
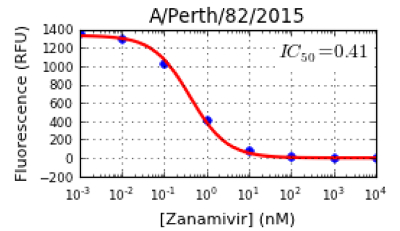
Abbildung 4: Beispiel für eine Hemmkurve und IC50 - Wert eines A (H1N1) Virus pdm09, A / Perth / 82/2015. Die Software stellt die JASPR Hemmkurve als Fluoreszenz (RFU) gegen die zunehmende Konzentration (nM) von NA-Inhibitor, mit jedem Punkt innerhalb der Kurve passen. Auf der Basis der Hemmungskurve wird die IC 50 -Wert bestimmt , als die Konzentration des Inhibitors NA 50% der Virus - NA - Aktivität zu reduzieren. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Virus | Virusverdünnung erforderlich | 1x Assay-Puffervolumen (ul) | Surfactant-Amps-NP-40 (10%) (ml) | Virus Volumen (ml) |
| 1 | 1/20 | 940 | 10 | 50 |
| 2 | 1/40 | 965 | 10 | 25 |
| 3 | 1/100 | 890 | 10 | 10 |
Tabelle 1: Herstellung von Virusverdünnungen für VIRUS 1, 2 und 3 in dem NA - Hemmtest.
| Virus-Typ / Subtyp / lineage | normale Hemmung | Reduzierte Hemmung | Stark reduzierte Hemmung |
| (NI) | (RI) | (HRI) | |
| A (H1N1) pdm09 | <10-fach | 10-100-fach | > 100-fach |
| A (H3N2) | &# 60; 10-fach | 10-100-fach | > 100-fach |
| B Yamagata und B Victoria | <5-fach | 5-50 fache | > 50-fach |
Tabelle 2: Die WHO Antivirale Arbeitsgruppe empfohlenen Richtlinien für die Klassifizierung von Influenza - Virus Anfälligkeit für NA - Inhibitoren.
| Virus-Typ / Subtyp / lineage | N | Zanamivir | Oseltamivir | peramivir | Laninamivir |
| Median (Bereich) IC 50 nM | Median (Bereich) IC 50 nM | Median (Bereich) IC 50 nM | Median (Bereich) IC 50 nM | ||
| A (H1N1) pdm09 | 1326 | 0,42 (0,1-3,43) | 0,36 (0,01-3,48) | 0,19 (0,07-1,60) | 0,55 (0,05-2,29) |
| A (H3N2) | 1654 | 0,9 (0,11-4,0) | 0,38 (0,01-3,65) | 0,33 (0,12-3,06) | 1,38 (0,01-9,38) |
| B Yamagata und B Victoria | 1115 | 2,2 (1,24-10,72) | 15,12 (2.39-70.75) | 1,36 (0,57-6,67) | 2,89 (1,62-9,15) |
Tabelle 3: Median IC 50 und IC 50 Bereich der normalen Hemmung (NI) Viren ab 2015 abgeleitet in dem WHO CCRRI, Melbourne.
| Aminosäuresubstitution | Typ / Subtyp / lineage | IC 50 fold change compared mittlere IC50 - Werte zu verweisen. | |||
| Zanamivir | Oseltamivir | peramivir | Laninamivir | ||
| H275Y | A (H1N1) pdm09 | 1 | 557 (HRI) | 123 (HRI) | 2 |
| E119V | A (H3N2) | 1 | 63 (RI) | 1 | 1 |
| H134Y | B Victoria | 1 | 4 | 76 (HRI) | 2 |
| N151T | B Victoria | 4 | 4 | 42 (HRI) | 1 |
| G104E | B Victoria | 1.220 (HRI) | 87 (HRI) | 17.724 (HRI) | 701 (HRI) |
| E105K | B Victoria | 3 | 5 (RI) | 59 (HRI) | 2 |
| I222T | B Victoria | 2 | 7 (RI) | 8 (RI) | 3 |
| H273Y | B Yamagata | 1 | 230 (HRI) | 377 (HRI) | 2 |
| D197N | B Yamagata | 4 | 7 (RI) | 32 (RI) | 3 |
Tabelle 4: Repräsentative Liste von Aminosäuresubstitutionen in Verbindung mit reduzierter Hemmung (RI) oder stark reduziert Hemmung (HRI) zu NA - Inhibitoren.
| Problem | Mögliche Gründe) | Lösung (en) |
| Keine oder geringe NA-Aktivität | Kein Virus vorhanden war oder niedrige Virusausbeute. | (Dh Madin Darby Canine Kidney-Zellen) oder in embryonierten Hühnerei klinische Proben müssen in Zellinien kultiviert werden ,auf eine höhere Virusbelastung für die Verwendung in dem NA-Hemmtest. |
| Einige mutierten Viren haben extrem niedrige NA-Aktivität trotz bei hoher Viruslast. | Anwendungskonzentration ordentlich Virus zum Testen. Niedrigere pH - Testpuffer (beispielsweise pH 5,3) verwendet werden. Vorsicht ist jedoch geboten, wenn Daten zu vergleichen. | |
| Kein oder nur geringe Aktivität in NA NA Hemmen | Kein Virus wurde hinzugefügt. | Re-Verdünnung des Virus. Sicherstellen, dass das Virus direkt in den 1x Assay-Puffer hinzugefügt. |
| Falsche Virusverdünnung verwendet. | Wiederholen Sie den NA-Aktivitätstest. | |
| Unzureichende Inkubationszeit. | Sicherstellen, dass die Inkubationszeit folgt. | |
| Die Datenpunkte fallen außerhalb der Kurve 50 IC | Eine Kreuzkontamination der NA-Inhibitor höherer Konzentration. | Stellen Sie sicher, dass die Spitzen nicht in Kontakt mit der NA inhibi sindtor, wenn Viren in die 96 Well-Platte Abgabe verdünnt. |
| Wenn ein 8 tiefen Brunnen Reservoir verwendet wurde, verwerfen und neu verteilen die NA Inhibitorkonzentrationen in ein frisches 8 tiefen Brunnen Reservoir. | ||
| Das Volumen des NA-Inhibitors oder Munana oder verdünnten Virus wurde nicht gleichmäßig in jede Vertiefung gegeben. | Wiederholen des Tests mit einer kalibrierten Mehrkanalpipette. Sicherzustellen gleichen Volumen jedes Reagenz in jedes Well dispensiert wird. | |
| Ungewöhnlich hohe Werte IC50 | Eine zu hohe Konzentration des Virus hinzugefügt. | Wiederholen Sie die NA-Aktivitätstest und NA-Hemmtest. |
| Testprobe enthalten Mischungen von Influenza A und Influenza B. | Führen Sie Echtzeit-PCR die Anwesenheit von Virus-Mischungen zu identifizieren. | |
| Eine bakterielle Kontamination in der Probe | Kultur-Virus in dem sterilen Zustand mit der Anwesenheit von Antibiotika. | |
| Hohe Hintergrund Fluoreszenzsignal | Munana Substrat kann im Laufe der Zeit verschlechtern. | Verwenden Sie eine neue Charge von Munana subtrate. |
| Der Nachweis von Fluoreszenz, die von benachbarten Vertiefungen. | Verwenden schwarze 96-Napf-Flachboden-Platten |
Tabelle 5: Fehlerbehebung für mögliche Probleme in dem NA - Hemmtest.
Diskussion
Die globale Überwachung der Influenza - Virus - Anfälligkeit für NA - Inhibitoren wird derzeit von einer Anzahl von Laboratorien durchgeführt , die entweder fluoreszierende oder chemilumineszierende NA Hemmtests 11, 12 verwendet wird . Der Fluoreszenztest wird häufiger als die chemilumineszierenden Test verwendet. Obwohl beide Assays stabil und reproduzierbar sind, sind die IC 50 Werte aus der fluoreszenzbasierten Assay erhalten oft höher ist als die Chemilumineszenz-basierte Assays, um einen direkten Vergleich der Daten aus den beiden Assays schwierig machen 13. Auch bei der Verwendung des gleichen Protokolls, von einem Labor erzeugten Daten können von anderen variieren. Wegen dieser Unterschiede zwischen den Labors, produziert der WHO-Arbeitsgruppe für Überwachung der Influenza-Antivirale Empfänglichkeit eine Leitlinie in Ringversuchen zu unterstützen. Anstatt die absoluten IC50 - Werte zu vergleichen, diese Richtlinie Anwendungsa Vergleich auf der Basis den IC 50 - facher Unterschied zum mittleren IC 50 der NI Influenza in jedem einzelnen Labor getesteten Viren. Die Fähigkeit , Daten aus den fünf Kooperationszentren zu vergleichen hat in der jährlichen Veröffentlichung der globalen Influenza antivirale Suszeptibilitätsdaten 2, 3, 4 geführt. Die Verfügbarkeit der großen Menge an Influenza Anfälligkeitsdaten im öffentlichen Bereich ermöglicht es den Forschern IC50 Daten aus diesen Studien , dass in ihren eigenen Labors erzeugt zu vergleichen.
Andere NA Hemmungstests, die ein ähnliches Konzept verabschieden sind auch im Handel erhältlich. Diese kommerziellen Kits, die enthalten ready-to-use-Reagenzien (NA-Inhibitoren nicht enthalten) sind ebenso reproduzierbar. Allerdings ist die in-house NA Hemmt wesentlich billiger als die kommerziellen Kits, weil die Mehrheit der Reagenzien kann im Hause gemacht wird ingrößere Mengen und das Munana Substrat, das zuvor die Hauptkosten des Assays aus, können nun aus verschiedenen Quellen zu wettbewerbsfähigen Preisen erworben werden. Die Kosten für die pro Medikament ein Influenza-Isolat testen, etwa von $ 1 (USD). Am Melbourne WHOCCRRI wurde auf den hauseigenen NA Hemmt nach dem Einbau einer Roboterplattform für die Liquid-Handling-Komponenten der Assays Verbesserung vorgenommen. Neben der manuellen Herstellung von Virus-Verdünnungen, die Mehrzahl der Verfahren ausgeführt, um den Liquid-Handling-Roboter. Nicht nur, dass diese minimieren manuelle Handhabung, aber es erhöht auch die Zahl der Tests, die an einem Tag ausgeführt werden kann.
Obwohl die NA-Hemmtest sehr robust sind, gibt es eine Reihe von kritischen Schritten, die mit zusätzlicher Versorgung abgeschlossen werden müssen. Zuerst wird jede Unregelmäßigkeit bei den NA Inhibitorkonzentrationen können die Hemmkurven und der IC50 - Werte verschieben; Daher sollte eine sorgfältige Aufmerksamkeitgezahlt, wenn die NA Inhibitorkonzentrationen vor. Zweitens sind präzise Pipettieren und präzise Inkubationszeiten entscheidend konsistente Ergebnisse über Tests zu halten; Dies kann durch die Verwendung kalibrierter Pipetten und Timer erreicht werden. Die Einbeziehung von Kontrollviren in jedem Test ermöglicht auch die Überwachung der Testleistung von Test zu Test und über lange Zeiträume. Drittens, da die NA-Enzymaktivität von saisonalen Influenzaviren bei pH 6,5 optimal ist, die richtige pH des Testpuffers ist wichtig. Einige Berichte haben festgestellt , dass die Verwendung von niedrigeren pH - Bedingungen können die Identifizierung von Influenzavarianten, wie beispielsweise die A (H7N9) Variante verbessert enthaltend die Mutation R292K 14, 15. Jedoch wird die Modifikation des pH des Testpuffers verschiebt den IC50 - Wert, und dies kann den Vergleich von Daten in Laboratorien und zwischen Laboratorien kompliziert. Andere Modifikationen und Fehlerbehebung, die p sein kannerformed sind in Tabelle 5 aufgeführt.
Die NA-Inhibitoren sind die einzige Klasse der zugelassenen Virostatika, die derzeit wirksam sind gegen Influenzaviren zirkulieren. Bis andere antivirale Klassen für die klinischen Einsatz zur Verfügung stehen, die antivirale Anfälligkeit Überwachung Influenzaviren zirkulierenden allein auf NA-Inhibitoren fokussiert werden. Wegen der Einfachheit und Reproduzierbarkeit der Ergebnisse, um die Verwendung der NA-Hemmtest Influenzavirus Anfälligkeit für NA-Inhibitoren beurteilen wird fortgesetzt.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Melbourne WHO-Kollaborationszentrum für Referenz und Forschung auf Influenza wird von der australischen Regierung Department of Health unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Influenza A and B viruses | Cultured in MDCK cells or 9 day old embryonated specific pathogen free (SPF) eggs | ||
| Madin-Darby Canine Kidney (MDCK) cells | ATCC | PTA-6500 | |
| 2-(4-methylumbelliferyl)-a-D-N-acetylneuraminic acid (MUNANA) | Biosynth AG | M-5507 | |
| 2-(4-methylumbelliferyl)-a-D-N-acetylneuraminic acid (MUNANA) | Sigma | M8639 | |
| 4-Methylumbelliferone (4-MU) | Sigma | M1381-25G | |
| 2-[N-morpholino]ethanesulphonic acid (MES hydrate) (free acid) | Sigma | M8250-250G | |
| Calcium Chloride (Ca Cl2) | APS AJAX Finechem | 127-500G | |
| Surfactant-Amps-NP-40 (10% solution) | Thermo Fisher Scientific | PIE28324 | |
| Sodium Hydroxide (NaOH) | APS AJAX Finechem | 482-2.5KG | |
| Absolute Ethanol | APS AJAX Finechem | 214-2.5L GL | |
| 96-well clear flat-bottom plates | NUNC | 456537 | |
| 96-well U-bottom plates | Greiner Bio-one | 4650101 | |
| 8 channel deep well block | Pacific Laboratory Products | RES-MW8-HP | |
| 96-well deep plates, 2.0 mL square wells | Pacific Laboratory Products | P-2ML-SQ-C | |
| Plate sealers | Thermo Fisher Scientific | 236366 | |
| Bottle-top vacuum filter system (cellulose membrane (nitrate), pore size 0.2 μm, membrane area 33.2 cm2, filter capacity 500 mL) | Sigma-Aldrich | CLS430758-12EA | |
| Single-channel pipettes (1 µL - 1,000 µL) | Variety of suppliers (eg. Eppendorf, Sartorius) | ||
| Multi-channel pipettes | Variety of suppliers (eg. Eppendorf, Sartorius) | 8 or 12 channel electronic and manual pipette (5 - 1250 µL volume) | |
| Pipette tips (1 µL - 1,250 µL) | Variety of suppliers (eg. Eppendorf, Sartorius) | ||
| Disposable pipettes (10 mL and 25 mL) | Greiner Bio-one | P7740-200EA and P7865-200EA | |
| Pipette controller | Eppendorf | 4430000018 | |
| Centrifuge tubes 50 mL | BD Bioscience | 352070 | |
| Racked tubes | Scientific Specialties, Inc. | 1750-00 | |
| Fluorometer with excitation wavelength setting of 355 nm and an emission wavelength setting of 460 nm | TermoFisher Scientific | ASCENT FL 374 | |
| Ascent software | TermoFisher Scientific | 5185410CD | |
| Incubator set at 37 °C | Lab Supply | Biocell 1000 | |
| Zanamivir | GlaxoSmithKline | Request directly from the company | |
| Oseltamivir carboxylate | Roche | ||
| Peramivir (BCX-1812) | BioCryst | ||
| Laninamivir (R-125489) | Daiichi-Sankyo | ||
| JASPR v1.2 | Influenza Division at the CDC Atlanta, USA | freely available upon request (fluantiviral@cdc.gov) |
Referenzen
- Moscona, A. Neuraminidase inhibitors for influenza. N.Engl.J.Med. 353 (13), 1363-1373 (2005).
- Hurt, A. C., et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors. Antiviral Res. 132, 178-185 (2016).
- Meijer, A., et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors. Antiviral Res. 110, 31-41 (2014).
- Takashita, E., et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors. Antiviral Res. 117, 27-38 (2015).
- Lackenby, A., et al. Emergence of resistance to oseltamivir among influenza A(H1N1) viruses in Europe. Euro Surveill. 13 (5), (2008).
- Hurt, A. C., et al. Community transmission of oseltamivir-resistant A(H1N1)pdm09 influenza. N Engl J Med. 365 (26), 2541-2542 (2011).
- Takashita, E., et al. Characterization of a large cluster of influenza A(H1N1)pdm09 viruses cross-resistant to oseltamivir and peramivir during the 2013-2014 influenza season in Japan. Antimicrob Agents Chemother. 59 (5), 2607-2617 (2015).
- Eisfeld, A. J., Neumann, G., Kawaoka, Y. Influenza A virus isolation, culture and identification. Nat Protoc. 9 (11), 2663-2681 (2014).
- . Meetings of the WHO working group on surveillance of influenza antiviral susceptibility - Geneva, November 2011 and June 2012. Wkly Epidemiol Rec. 87 (39), 369-374 (2012).
- Okomo-Adhiambo, M., Hurt, A. C., Gubareva, L. V. The chemiluminescent neuraminidase inhibition assay: a functional method for detection of influenza virus resistance to the neuraminidase inhibitors. Methods Mol Biol. 865, 95-113 (2012).
- Hurt, A. C., Okomo-Adhiambo, M., Gubareva, L. V. The fluorescence neuraminidase inhibition assay: a functional method for detection of influenza virus resistance to the neuraminidase inhibitors. Methods Mol Biol. 865, 115-125 (2012).
- Analysis of IC50 data. isirv Antiviral Group (isirv-AVG) Available from: https://isirv.org/site/index.php/methodology/analysis-of-ic50-data (2016)
- Sleeman, K., et al. R292K substitution and drug susceptibility of influenza A(H7N9) viruses. Emerg Infect Dis. 19 (9), 1521-1524 (2013).
- Gubareva, L. V., Robinson, M. J., Bethell, R. C., Webster, R. G. Catalytic and framework mutations in the neuraminidase active site of influenza viruses that are resistant to 4-guanidino-Neu5Ac2en. J Virol. 71 (5), 3385-3390 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten