このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
標的プラスミドDNA送達に対するメチオニン機能性生体適合性共重合体
* これらの著者は同等に貢献しました
要約
本研究では、可逆添加断片化鎖伝達(RAFT)法を介したメチオニン機能性生体適合性共重合体(mBG)の調製を提示する。得られたmBGとそのトランスフェクション効率のプラスミドDNA複合能も調べられた。RAFT法は、特殊な官能基を含むモノマーを重合するために非常に有益である。
要約
可逆的な付加断片化鎖伝達(RAFT)重合はラジカル重合および生きている重合の利点を統合する。本研究では、RAFT重合によるメチオニン機能性生体適合性共重合体の調製を提示する。まず、N,N-ビス(2-ヒドロキエチエル)メタクリラム化-b-N-(3-アミノプロピル)メタクリラム化物(BNHEMA-b-APMA,BA)を用いてRAFT重合を介して合成した4,4'-azobis(4-チアノバリン酸)(ACVA) 連鎖伝達剤として開始剤および4-シアンペンタノイン酸ジチオベンゾエート(CTP)を開始する。続いて、N、N-ビス(2-ヒドロキセチル)メタクリラム化-b-N-(3-グアニジノプロピル)メタクリラム化物(メチオニン移植BNHEMA-b-GPMA、mBG)は、メチオニンおよびグアニジンでAPMAのアミン基を修飾することによって調製した。グループ。mBG1、mBG2、およびmBG3の3種類のブロックポリマーを比較するために合成した。Ninhydrin反応は、APMA含有量を定量するために使用された。mBG1、mBG2、およびmBG3はそれぞれ21%、37%、および52%のAPMAを持っていた。ゲル透過クロマトグラフィー(GPC)の結果は、BA共重合体が16,200(BA1)、20,900(BA2)、および27,200(BA3)g/molの分子量を有することを示した。得られたブロック共重合遺伝子キャリアのプラスミドDNA(pDNA)複合能も調べた。pDNAがmBG1、mBG2、mBG3と完全に複合化した場合、電荷比(N/P)は8、16、4であった。mBG/pDNAポリプレックスのN/P比が1より高い場合、mBGのゼータ電位は陽性であった。16と32の間のN/P比では、mBG/pDNAポリプレックスの平均粒径は100〜200nmであった。全体的に、この研究は、ブロック共重合体キャリア合成のためのシンプルで便利なプロトコルを示しています。
概要
近年、あらゆる種類の疾患を治療する薬剤としての核酸の治療的送達に対する遺伝子治療が出現している1.プラスミドDNA(pDNA)および小さな干渉RNA(siRNA)を含む遺伝子薬剤の開発は、薬物送達システム(DDS)2の安定性および効率に依存する。すべてのDDSの中で、カチオン性ポリマーキャリアは、良好な安定性、低免疫原性、および顔の調製および修飾の利点を有し、これはカチオン性ポリマーキャリアに広範な応用見通し3、4を与える。生物医学の実用的な適用のために、研究者は高効率、低毒性およびよいターゲティング能力5のカチオン性ポリマーキャリアを見つける必要がある。すべてのポリマーキャリアの中で、ブロック共重合体は、最も広く使用されている薬物送達システムの1つである。ブロック共重合体は、薬物送達5においてミセル、微小球、およびナノ粒子を形成する自己組織化特性および能力について集中的に研究される。ブロック共重合体は、生体重合またはクリック化学法を介して合成することができる。
1956年、Szwarcらは生きている重合の話題を提起し、鎖破断反応なしの反応として定義した6,7.それ以来、この方法を使用してポリマーを合成するための複数の技術が開発されました。したがって、生きている重合はポリマー科学8のマイルストーンと見なされる。生きている重合は生きているアニオンの重合、生きているカチオン性重合、および可逆的な不活性化ラジカル重合(RDRP)9に分類することができる。生きているアニオン/カチオン性重合は、その厳しい反応条件10に起因する適用の限られた範囲を有する。制御/生きているラジカル重合(CRP)は、軽度の反応条件、便利な性質、および良好な収率を有し、したがって、近年11の主要な研究の焦点となっている。CRPでは、活性伝播鎖は、フリーラジカルの濃度を低下させ、連鎖ラジカルの二分子反応を回避するために休眠状態のものに可逆的に受動する。添加重合は、不活性休眠伝播鎖がチェーンラジカルに可逆的にアニメーション化された場合にのみ継続できます。生きているラジカル重合の最も有望な形態の一つとして、可逆的な加断片化鎖伝達(RAFT)重合は、制御された分子量および構造を有するブロックポリマーを得るために適用可能な方法であり、分子量が狭い配布、および機能グループ12を運ぶ。RAFT重ね合いを成功させる鍵は、非常に高い鎖転写定数を有する鎖転写剤、通常はジチオエステルの効果である。
本論文では、BNHEMA-b-APMAブロックポリマーを調製するRAFT重合法を設計し、開始剤として4,4'-アゾビス(4-シアナバレリン酸)(ACVA)を、鎖転写剤として4-シアネアタノイン酸ジチオベンゾエート(CTP)を用いた。RAFT重合は、カチオン性ポリマーキャリアにBNHEMAを導入するために2回使用した。続いて、APMA鎖中のアミン基を、メチオニンおよびグアニジニイリン化試薬1-アミドアミノピラゾール塩酸塩で修飾した。グアニジニル化試薬およびメタクリラム化ポリマー骨格構造の陽性料金を利用して、得られたブロックポリマー担体の細胞取り込み効率が向上した。
プロトコル
1. BNHEMAポリマーの合成(PBNHEMA)
- N、N-ビス(2-ヒドロキシアル)メタクリラム化(BNHEMA)の1.87gを重合ボトル中の蒸留水の1mLに溶解する。
注:重合ボトルは、ゴムストッパーと磁気攪拌機を備えた丸底フラスコです。 - 4-シアンペンタニン酸ジチオベンゾア酸(CTP)の0.03gと4,4'-アゾビス(4-シアナバレリ酸)(ACVA)の0.02gを5mLビーカーで1,4-ダイオキシンの0.5mLで溶解する。次に、ステップ1.1から重合ボトルにCTPおよびACVA溶液を添加する。
- 3つの凍結ポンプ融解サイクルを介して窒素と重合ボトル内の反応システムを換気します。
- 詳細には、凝縮トラップを用いて重合ボトル内の溶液を凍結し、重合ボトルを鉄支持体に固定し、針(#9針、内径0.65mm)で先端を通して反応混合物に窒素を真空化して注入し、外径0.9mm)。重合ボトルを密封し、室温で30分間溶融します。
- 凍結ポンプ解凍サイクルを3回繰り返します。
- 重合ボトルを70°Cのオイルバスに入れ、窒素雰囲気下で24時間反応させます。
- 重合ボトルを0°Cで冷やし、ゴムストッパーを開けて重合プロセスを終了します。
- -20 °C冷蔵庫で2時間予冷し、ステップ1.5の反応溶液と50:1(v/v)で混合します。その後、アセトンを除去し、沈殿物を収集するために10分間8,200 x gで遠心分離機。
- 合成されたPBNHEMAを精製するには、採取した沈殿物を純水の2mLで溶解し、1:50(v/v)の比率で予冷アセトンの100mLと混合します。8,200 x gで10分間溶液を遠心分離し、沈殿物を収集します。このプロセスを 3 回繰り返します。
- 50°Cの真空乾燥機を使用して、生産されたPBNHEMAを乾燥させます。乾燥したら、バランスのとれた粉末の重量を量ります。方程式 1に従って歩留まり率を計算します。
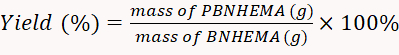 (1)
(1)
注:この実験では、得られた収率は77.2%であった。
2. BNHEMA-b-APMAポリマー(BA)の合成
- N-(3-アミノプロピル)メタクリラムド塩酸塩(APMA)の0.96gを10mLビーカーで蒸留水の5mLに0.93gPBNHEMAを溶解する。
- 1,4-ジオキサンの0.5 mLで4,4'-アゾビス(4-シアナバル酸)(ACVA)の0.01gを溶解し、パート2.1からAPMA-PBNHEMA溶液と混合します。
- 混合物を重合ボトルに移し、乾燥窒素で1時間換気します。
- 重合ボトルを70°Cのオイルバスに入れ、窒素雰囲気下で24時間反応させます。
- 重合ボトルを0°Cで冷やし、ゴムストッパーを開けて重合プロセスを終了します。
- 溶液をステップ1.6から冷やしたアセトンに移し、8,200 x gで10分間遠心分離し、BAを沈殿させる。
- BAを蒸留水の2mLで溶解し、ポリマーを冷やしたアセトンで沈殿させます。3回繰り返します。
- 50°Cの真空乾燥機で製造されたBAを乾燥させ、得られた粉末を重量を量る。方程式 2に従って歩留まり率を計算します。
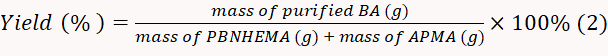
注:この実験では、歩留まりは82.0%と計算された。
3. ニンヒドリン法によるBA共重合体におけるAPMAのほくろ率を決定する
注:分光光度計は、多成分アミノ酸の内容を決定するために使用されます。原理は、吸光度がある程度13,14のアミノ酸含有量と相関するニンヒドリンおよびアミノ酸の色反応である。
- 沸騰蒸留水の125 mLにニンヒドリンの5グラムを溶解します。また、温かい蒸留水の250mLにビタミンCの5gを溶解する。250 mLのビタミンC溶液を磁気撹拌下のニンヒドリン溶液に滴下して加えます。15分間撹拌を続け、4°Cの冷蔵庫で反応液を冷やします。
- 冷蔵庫から溶液を取り出し、減らされたニンヒドリンを得るためにBuchner漏斗を使用して吸引によって濾過します。沈殿物を収集し、リンペントキシド脱水器で保存します。
- 10mLのエチレングリコールモノメチルエーテルに85mgのニンヒドリンと15mgの減らされたニンヒドリンを溶解し、ニンヒドリン着色液を調製する。
注:ニンヒドリン着色溶液は、APMAでα-アミノと反応し、前の研究15で説明したように構造を持つ紫色化合物を形成することができる。 - 0、1、10、100、1,000mg/mL APMAモノマー溶液を1mLの酢酸バッファー(2M、pH5.4)で希釈し、それぞれ1mLのニンヒドリン着色溶液を添加する。
- 沸騰したお湯で15分間加熱し、流水を使用して冷却します。溶液は5-10分間座って、60%エチルアルコールの3 mLでそれらを希釈し、完全にそれらを混合してみましょう。分光光度計を用いて570nmで吸光度を測定し、標準曲線を描きます(式3)。
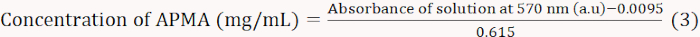
注:式3は、APMA濃度に対して570nmの吸光度の線形継着に由来した。 - 蒸留水の1 mLでBAの0.01グラムを溶解します。アセテートバッファー(2M、pH 5.4)の1mLとニンヒドリン着色溶液の1 mLを添加する。570 nmの吸光度に従ってAPMAのモル含有量を計算する。

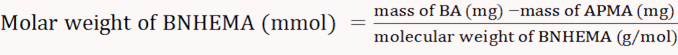 (5)
(5)
注:計算式は以下の通りです(式3-6)。
4. メチオニン移植BAポリマー(mBA)の合成
- 回復フラスコで DMSO の 5 mL で Fomc-メチオニンの 8.9 mg を溶解します。.
- 1-エチル-3-(3-ジメチルアミノプロピル)の6.92mgを回収フラスコに1-ヒドロキシベンゾトリアゾール(HOBT)の4.86mgを加え、0.5hの0°Cで反応する。
- DMSO溶液の5 mLでBAの2.59 gを溶解し、トリメチルアミンの50 μLを追加します。この溶液を回収フラスコ(ステップ4.2)にドロップして追加し、溶液を室温で0.5時間反応させます。
- 透析は、24時間2Lビーカーで透析バッグ(MWCO 10 kDa)を使用してステップ4.3でBA溶液からDMSOおよびトリメチルアミンを除去する。6時間ごとに脱イオン水を交換してください。
- 得られたmBAを凍結乾燥し、式7に従って歩留まり率を計算する重量を量る。
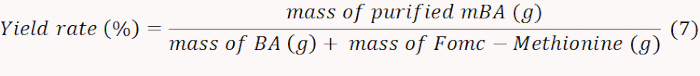
注:この場合、利回りは71%と判断されました。 - 570 nmで吸光度を測定してmBAを含むNH2を定量し、移植されたメチオニンの量を計算する。式8に従ってメチオニンのモル含有量を計算する。

5. グアニジン化・メチオニン結合BNHEMA-b-APMAポリマー(mBG)の合成
注:3つの異なるmBA1、mBA2およびmBA3共重合体を合成した。mBA3共重合体は、以下のステップで例として用いられる。
- 純水の5 mLにアミノ群60μmolを含むmBA3を溶解する。
注:アミノ基含有量は、ステップ3.5に記載されているニンヒドリン法を用いて定量した。 - 40.6mg(300μmol)のグアニジニイリン化試薬1-アミドピラゾール塩酸塩をmBA溶液中に溶解する。
- 炭酸ナトリウムの飽和溶液でpHを9.0に調整し、室温で24時間安定させます。
- mBG製品をビーカー(MWCO 10 kDa、2L)で脱イオン水で透析し、凍結乾燥粉末の形で保存します。
収率は方程式8を介して85%と計算された。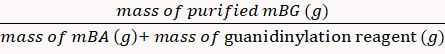 (8)
(8) - NMRチューブ中のD2OにmBG粉末を溶解し、1H核磁気共鳴分光法(1H NMR)16を用いて特徴付ける。
6. mBG/pDNAポリプレックスの調製と特性解析
- RNase/DNaseフリー水の50 μLでpDNAの50 μgを溶解します。
- MBG共重合体1mgをRNase/DNaseフリー水の1mLに溶解する。
- 異なる供給比(1:1、4:1、8:1、16:1、および32:1)に従って、異なる供給比に従ってpDNA溶液にmBG共重合体溶液を直接追加します。
注:N/P比は、pDNA中のポリマーおよびリン酸基におけるグアニジン基のモル比、すなわちポリマー中のGPMA鎖およびpDNA中の単核レオチドのモル比として定義される。N/P比は、pDNA中のmBGおよびリン酸群(P)におけるアミノ窒素(N)の分子量に従って計算される。 - ボルテックスミキサーで溶液を混合し、室温で30分間立たせます。その後、リン酸緩衝液(PBS、pH 7.4)に混合物を分散させ、得られたmBG/pDNAポリプレックスを4°Cで保存し、フォローアップ実験を行う。
注:mBGおよび複合体の平均粒子サイズおよびゼータ電位は、動的光散乱(DLS)17を用いて検出された。 - DLSおよびゼータ電位サンプル細胞中の1 mLのPBS(pH 7.4)を用いてmBG/pDNAポリプレックス溶液の10 μLを希釈する。
注:粒子サイズとゼータ電位検出を3回行い、3つの値の平均を採取した。
7. mBG/pDNAポリプレックスの電気泳動遅滞実験
注:電気泳動遅滞実験を行い、最小電荷比を決定した。
- pDNAの50 μgを含む異なるN/P比(1:1、4:1、8:1、16:1、および32:1)の5つのグループのmBG/pDNAポリプレックスを取ります。
- mBG/pDNAポリプレックスサンプルに6xのロードバッファを1xの最終濃度に追加します。
- 1.5%アガロースゲルに溶液を追加し、コントロールとしてpDNAを使用して、15分間90 mVでゲルを実行します。
- ゲルイメージャーを使用してゲルの写真を撮ります。
8. mBG/pDNAポリプレックスの細胞毒性
- 種子MCF-7細胞をウェル当たり104細胞の密度で96ウェルプレートに入れた。次いで、DMEM培地(10%FBS及び1%抗生物質)を用いて12時間の細胞を培養し、5%CO2を供給した加湿37°Cインキュベーターに入れた。
- 培養培地を、10%の胎児ウシ血清(FBS)と異なる電荷比のmBG/pDNAポリプレックス(N/P 4、8、16、および32、n=6)を含む抗生物質を含まないDMEM培養培地に置き換え、対照として同量のPBS溶液を添加した細胞を服用する。次いで、培養培地を新鮮な1640培地の150μLに置き換え、さらに24時間細胞を培養する。
- 5 mg/mL 3-(4,5-ジメチルチアゾール-2-yl)-2,5-ジフェニルテルゾルゾリュート(MTT)溶液(20 μL/ウェル)を96ウェルプレートに加え、さらに4時間細胞を培養する。
- 溶液を取り出し、各ウェルに150 μLのDMSOを加え、96ウェルプレートを30秒間振ります。
- マイクロプレートリーダーで490nmの光学密度(OD)を測定し、細胞の生存率を示します。方程式 9に従ってセルの生存率を計算します。
細胞生存率 % = (9)
= (9)
9. mBG/GFP-pDNAポリプレックスのトランスフェクション効率
- レポーター遺伝子緑蛍光タンパク質(GFP)pDNA(GFP-pDNA)を含むpDNAの50 μgをRNase/DNaseフリー水の50μLに溶解します。その後、RNase/DNaseフリー水の1 mLにmBG共重合体の1mgを溶解します。pDNAとmBG溶液を1:1、4:1、8:1、16:1、32:1の充電比(N/P)で混合し、室温で30分間インキュベートします。mBG/GFP-pDNAポリプレックス溶液を超音波(30s)を使用して分散し、フォローアップ実験のために4°Cで保存します。
注:N/P比は、pDNA中のmBGおよびリン酸基(P)におけるアミノ窒素(N)の分子量に基づき計算される。 - 種子MCF-7細胞を6ウェルプレートでウェル当たり2×105細胞の密度で培養し、加湿インキュベーターで37°Cおよび5%CO2で12時間培養した。
- 培養培地を、異なるN/P比(4、8、16、32)のmBG/GFP-pDNAポリプレックスを含む新鮮な培地に6時間置き換えます。
- 48時間の新鮮なRPMI1640培地および培養の2 mLで媒体を置き換える。
- 細胞を収集し、フローサイトメーターで緑色蛍光を検出します。
結果
BNHEMAは、表1に示す重合の客観的な程度に従って供給された。mBGの合成手順を図1に示す。まず、BNHEMAホモポリマーを水-ダイオキシザン系における可逆添加断片化鎖伝達(RAFT)法を介して調製し、鎖転写剤として4-シアンペンタニン酸ジチオベンゾエートを用いた。第二に、PBNHEMAを鎖転写剤として用いてBNHEMA-b-APMAブロックポリマーを調製した。APMAモノマ...
ディスカッション
本研究では、一連のBNHEMA-b-APMAブロックポリマーカチオン性遺伝子キャリアを導入した。これらのブロックポリマーは、リバーシブル添加断片化鎖伝達(RAFT)法を介して合成した。親水性セグメントBNHEMAは、溶解性を向上させるために導入された。メチオニンおよびグアニジン基は、標的能力およびトランスフェクション効率5を改善するために改変された。MBG共重合体におけ?...
開示事項
著者は、この記事で議論される資料に関して、いかなる金融機関との利益相反も存在しないと証明します。
謝辞
この研究は、中国国家主要研究開発プログラム(No. 2016YFC0905900)、中国国家自然科学財団(No.81801827、81872365)、江蘇省基礎研究プログラム(自然科学財団、No.BK20181086)、江蘇癌病院科学研究基金(いいえ。ZK201605)。
資料
| Name | Company | Catalog Number | Comments |
| 1-hydroxybenzotriazole | Macklin Biochemical Co., Ltd,China | H810970 | ≥97.0% |
| 1,4-dioxane | Sinopharm chemical reagent Co., Ltd, China | 10008918 | AR |
| 1-amidinopyrazole Hydrochloride | Aladdin Co., Ltd., China | A107935 | 98% |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Aladdin Co., Ltd., China | E106172 | AR |
| 4,4’-azobis(4-cyanovaleric acid) | Aladdin Co., Ltd., China | A106307 | Analytical reagent (AR) |
| 4-cyano-4-(phenylcarbonothioylthio)pentanoic Acid | Aladdin Co., Ltd., China | C132316 | >97%(HPLC) |
| Acetate | Sinopharm chemical reagent Co., Ltd, China | 81014818 | AR |
| Acetone | Sinopharm chemical reagent Co., Ltd, China | 10000418 | AR |
| Agarose | Aladdin Co., Ltd., China | A118881 | High resolution |
| Ascorbic acid | Aladdin Co., Ltd., China | A103533 | AR |
| DMSO | Aladdin Co., Ltd., China | D103272 | AR |
| Ethylene glycol | Aladdin Co., Ltd., China | E103319 | AR |
| N-(3-aminopropyl)methacrylamide hydrochloride | Aladdin Co., Ltd., China | N129096 | ≥98.0%(HPLC) |
| N,N-bis(2-hydroxyethyl)methacrylamide | ZaiQi Bio-Tech Co.,Ltd, China | CF259748 | ≥98.0%(HPLC) |
| Ninhydrin | Aladdin Co., Ltd., China | N105629 | AR |
| PBS buffer | Aladdin Co., Ltd., China | P196986 | pH 7.4 |
| Plasmid DNA | BIOGOT Co., Ltd, China | pDNA-EGFP | pDNA-EGFP |
| Plasmid DNA | BIOGOT Co., Ltd, China | Pdna | pDNA |
| Sodium carbonate decahydrate | Aladdin Co., Ltd., China | S112589 | AR |
| Trimethylamine | Aladdin Co., Ltd., China | T103285 | AR |
参考文献
- Flotte, T. R. Gene and Cell Therapy in 2018: A Look Ahead. Human Gene Therapy. 29, 1-1 (2018).
- Huang, W., et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Advanced Drug Delivery Reviews. 115, 82-97 (2017).
- Wu, Y., et al. Reversing of multidrug resistance breast cancer by co-delivery of P-gp siRNA and doxorubicin via folic acid-modified core-shell nanomicelles. Colloids & Surfaces B Biointerfaces. 138, 60-69 (2016).
- Quader, S., Kataoka, K. Nanomaterial-Enabled Cancer Therapy. Molecular Therapy. 25, 1501-1513 (2017).
- Wu, Y., et al. Multivalent methionine-functionalized biocompatible block copolymers for targeted siRNA delivery and subsequent reversal effect on adriamycin resistance in human breast cancer cell line MCF-7/ADR. Journal of Gene Medicine. 19, e2969 (2017).
- Szwarc, M. ‘Living’ Polymers. Nature. 178, 168-169 (1956).
- Szwarc, M., Rembaum, A. Polymerization of methyl methacrylate initiated by an electron transfer to the monomer. Journal of Polymer Science. 22 (100), 189-191 (1956).
- Mukhopadhyay, R. D., Ajayaghosh, A. Living supramolecular polymerization. Science. 349, 241 (2015).
- Ozkose, U. U., Altinkok, C., Yilmaz, O., Alpturk, O., Tasdelen, M. A. In-situ preparation of poly(2-ethyl-2-oxazoline)/clay nanocomposites via living cationic ring-opening polymerization. European Polymer Journal. 88, 586-593 (2017).
- Wu, W., Wang, W., Li, J. Star polymers: Advances in biomedical applications. Progress in Polymer Science. 46, 55-85 (2015).
- Boyer, C., et al. Copper-Mediated Living Radical Polymerization (Atom Transfer Radical Polymerization and Copper(0) Mediated Polymerization): From Fundamentals to Bioapplications. Chemical Reviews. 116, 1803-1949 (2016).
- Keddie, D. J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization. Chemical Society Reviews. 43, 496-505 (2014).
- Wu, Y., et al. Guanidinylated 3-gluconamidopropyl methacrylamide-s-3-aminopropyl methacrylamide copolymer as siRNA carriers for inhibiting human telomerase reverse transcriptase expression. Drug Delivery. 20, 296-305 (2013).
- Qin, Z., Liu, W., Guo, L., Li, X. Studies on Guanidinated N-3-Aminopropyl Methacrylamide-N-2-Hydroxypropyl Methacrylamide Co-polymers as Gene Delivery Carrier. Journal of Biomaterials Science, Polymer Edition. 23, 1-4 (2012).
- Friedman, M. Applications of the Ninhydrin Reaction for Analysis of Amino Acids, Peptides, and Proteins to Agricultural and Biomedical Sciences. Journal of Agricultural and Food Chemistry. 52, 385-406 (2004).
- Habuchi, S., Yamamoto, T., Tezuka, Y. Synthesis of Cyclic Polymers and Characterization of Their Diffusive Motion in the Melt State at the Single Molecule Level. Journal of Visualized Experiments. (115), 1-9 (2016).
- Rao, D. A., Nguyen, D. X., Mishra, G. P., Doddapaneni, B. S., Alani, A. W. Preparation and Characterization of Individual and Multi-drug Loaded Physically Entrapped Polymeric Micelles. Journal of Visualized Experiments. 102, 1-5 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved