Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Метионин функционально совместимые биосовместимые блок кополимеры для целевой плазмидной доставки ДНК
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта работа представляет собой подготовку метионина функционализированных биосовместимых блоков кополимеров (mBG) с помощью обратимого добавления фрагментации цепи передачи (RAFT) метод. Также были исследованы плазмидная способность ДНК-комплекса полученного mBG и их эффективность трансфекции. Метод RAFT очень полезен для полимеризации мономеров, содержащих специальные функциональные группы.
Аннотация
Реверсивная полимеризация цепочки добавленной части (РАФТ) интегрирует преимущества радикальной полимеризации и живой полимеризации. Эта работа представляет собой подготовку метионина функционализированных биосовместимых блоков кополимеров через RAFT полимеризации. Во-первых, N,N-бис(2-гидроксиэтил)метакриламид-б -N-(3-аминопропил)метакриламид (BNHEMA -b-APMA, BA) синтезировался с помощью полимеризации RAFT с использованием 4,4'-azobis (4-цианалерическая кислота) (ACVA) в качестве ивитативным агентом и 4-цианпенпентановой кислотой дитиобензоат (CTP) в качестве агента передачи цепи. Впоследствии, N,N-bis(2-гидроксиэтил)метакриламид-б -N-(3-гуанидинопропил)метакриламид (метионин привитый BNHEMA -b-GPMA, mBG) был подготовлен путем изменения групп амина в APMA с метионином и гуанидином Группы. Для сравнения были синтезированы три вида блоковых полимеров: mBG1, mBG2 и mBG3. Для количественной оценки содержания APMA была использована реакция нингидрина; mBG1, mBG2 и mBG3 имели 21%, 37% и 52% APMA, соответственно. Результаты хроматографии гель-пермяки (GPC) показали, что БА-кополимеры обладают молекулярными весами 16 200 (BA1), 20 900 (BA2) и 27 200 (BA3) г/мол. Была также исследована плазмидная ДНК (pDNA), усложняющая способность полученных носителей гена блока. Коэффициенты заряда (N/P) были 8, 16 и 4, когда pDNA был полностью осложнен mBG1, mBG2, mBG3, соответственно. Когда соотношение N/P polyplexes mBG/pDNA было выше 1, потенциал Зэты мБГ был положительным. При соотношении N/P между 16 и 32 средний размер частиц полигекса mBG/pDNA составлял от 100 до 200 нм. В целом, эта работа иллюстрирует простой и удобный протокол для синтеза комимерии блока.
Введение
В последние годы, генная терапия возникла для терапевтической доставки нуклеиновые кислоты в качестве лекарств для лечения всех видов заболеваний1. Развитие генных препаратов, включая плазмидную ДНК (pDNA) и малаюдическую интерферирующую РНК (siRNA), зависит от стабильности и эффективности системы доставки лекарств (DDS)2. Среди всех DDS, катионные полимерные носители имеют преимущества хорошей стабильности, низкой иммуногенности, и легкой подготовки и модификации, которые дают катионные полимерные носители широкие перспективы применения3,4. Для практического применения в биомедицине, исследователи должны найти катионный полимер перевозчика с высокой эффективностью, низкой токсичности, и хорошая способность ориентации5. Среди всех носителей полимеров блок кополимеры являются одной из наиболее широко используемых систем доставки лекарств. Блок кополимеров интенсивно изучаются на их свойство самосборки и способности формировать мицеллы, микросферы и наночастицы при доставке лекарств5. Блок кополимеров можно синтезировать с помощью живой полимеризации или нажмите методы химии.
В 1956 году Szwarc et al. подняли тему живой полимеризации,определив ее как реакцию без цепных реакций 6,7. С тех пор было разработано несколько методов синтеза полимеров с помощью этого метода; таким образом, живая полимеризация рассматривается как веха полимерной науки8. Димеризация жизни может быть классифицирована в живую анионическую полимеризацию, живую катионную полимеризацию и обратимую деактивацию радикальной полимеризации (РДРП)9. Живые анионические/катионные полимеризации имеют ограниченный объем применения из-за их строгих условий реакции10. Контролируемая/живая радикальная полимеризация (CRP) имеет мягкие условия реакции, удобное расположение, и хорошую урожайность и таким образом была главным фокусом исследования в недавних летах11. В CRP активные цепи распространения реверсивно переходят в спящие, чтобы уменьшить концентрацию свободных радикалов и избежать бимолекулярной реакции распространяющихся цепных радикалов. Крометое полимеризация может продолжаться только в том случае, если неактивные спящие цепи, распространяющиеся, обратимо анимируются на цепные радикалы. В качестве одной из наиболее перспективных форм живой радикальной полимеризации, обратимая добавка-фрагментация цепи передачи (RAFT) полимеризации является методом, применимым для выхода блок полимеров с контролируемым молекулярным весом и структурой, узкий молекулярный вес распределение и проведение функциональных групп12. Ключом к успешной полимеризации RAFT является эффект цепных переносных агентов, как правило, дитиостеров, которые обладают очень высокой константой передачи цепи.
В этой работе, метод полимеризации RAFT был разработан для подготовки BNHEMA -b-APMA блок полимера, принимая 4,4'-azobis (4-cyanovaleric кислоты) (ACVA) в качестве инициирующего агента и 4-цианоптановой кислоты дитиобензоат (CTP) в качестве агента передачи цепи. ПОЛимеризация RAFT дважды использовалась для внедрения BNHEMA в катионные полимерные носители. Впоследствии группы амина в цепи APMA были модифицированы с помощью метионина и гуанидинилового реагента 1-амидинопиразоле гидрохлорида. Благодаря использованию положительных зарядов гуанидинадинационного реагента и метакремламидного полимерного скелета структуры, была улучшена эффективность клеточного поглощения полученных блоков полимерных носителей.
протокол
1. Синтез полимера BNHEMA (PBNHEMA)
- Растворите 1,87 г N, N-бис(2-гидроксиэтил) метакриламид (БНХЕМА) в 1 мл дистиллированной воды в полимерной бутылке.
ПРИМЕЧАНИЕ: Бутылка полимеризации представляет собой кругло-нижнюю колбу с резиновой пробкой и магнитным мешалкой. - Растворите 0,03 г 4-цианопентановой кислоты дитиобензоат (CtP) и 0,02 г 4,4'-азобис (4-cyanovalericacid ) (ACVA) в 0,5 мл 1,4-диоксана в 5 мл стакана. Затем добавьте раствор CTP и ACVA в бутылку полимеризации со ступени 1.1.
- Вентивная система реакции в полимеризации бутылки с азотом через три замораживания насоса оттепели циклов.
- Подробно заморозить раствор в полимеризации бутылки с помощью конденсата ловушку, исправить полимеризации бутылку железа опоры, и пылесосить и вводить азот в реакционную смесь через канал наконечником с иглой (#9 игла, внутренний диаметр 0,65 мм, внешнего диаметра 0,9 мм). Запечатать полимеризацию бутылки и разморозить раствор при комнатной температуре в течение 30 минут.
- Повторите циклы замораживания насоса-оттепели три раза.
- Положите бутылку полимеризации в масляную ванну 70 градусов по Цельсию и дайте раствору реагировать на 24 ч под атмосферой азота.
- Охладите бутылку полимеризации при 0 градусах по Цельсию и откройте резиновую пробку, чтобы завершить процесс полимеризации.
- Precool ацетон в холодильнике -20 градусов по Цельсию в течение 2 ч, а затем смешать его с реакционным раствором шага 1.5 на 50:1 (v/v). После этого, центрифуга на 8200 х г в течение 10 минут, чтобы удалить ацетон и собирать осадок.
- Для очищения синтезированного PBNHEMA, растворить собранный осадок в 2 мл чистой воды, а затем смешать его с 100 мл предварительно охлажденного ацетона, в соотношении 1:50 (v/v). Centrifuge раствор на 8200 х г в течение 10 минут и собирать осадок. Повторите этот процесс три раза.
- Высушите произведенный PBNHEMA с помощью вакуумной сушилки на 50 градусов Цельсия. После высыхать, взвесить порошок с балансом. Рассчитайте норму урожайности в соответствии с уравнением 1.
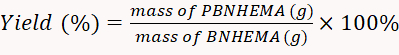 (1)
(1)
ПРИМЕЧАНИЕ: В этом эксперименте полученная доходность составила 77,2%.
2. Синтез полимера BNHEMA-b-APMA (BA)
- Растворите 0,96 г N-(3-аминопропил)метакриламид гидрохлорид (APMA) и 0,93 г PBNHEMA в 5 мл дистиллированной воды в стакане 10 мл.
- Растворите 0,01 г 4,4'-азобис (4-цианалера(ACVA) в 0,5 мл 1,4-диоксана и смешайте с раствором APMA-PBNHEMA с части 2.1.
- Перенесите смесь в полимеризацию бутылки и проветрить сухим азотом на 1 ч.
- Положите бутылку полимеризации в масляную ванну 70 градусов и дайте ей реагировать на 24 ч под атмосферой азота.
- Охладите бутылку полимеризации при 0 градусах по Цельсию и откройте резиновую пробку, чтобы завершить процесс полимеризации.
- Перенесите раствор на охлажденный ацетон со ступени 1.6, а затем центрифугите раствор при 8200 х г в течение 10 минут, чтобы осаждать БА.
- Растворите БА в 2 мл дистиллированной воды и осажесли полимер в охлажденный ацетон. Повторите три раза.
- Высушите произведенный БА в вакуумной сушиле на 50 градусов и взвесьте полученный порошок. Рассчитайте норму урожайности в соответствии с уравнением 2.
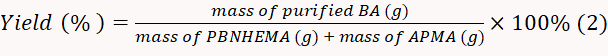
ПРИМЕЧАНИЕ: В этом эксперименте, доходность была рассчитана на 82,0%.
3. Определите процент родинки APMA в BA copolymer с помощью метода нингидрина
ПРИМЕЧАНИЕ: Спектрофотометрия используется для определения содержания многокомпонентных аминокислот. Принцип омрачить цветовую реакцию нингидрина и аминокислоты, где абсорбция коррелирует с содержанием аминокислот в определенной степени13,14.
- Растворите 5 г нингидрина в 125 мл кипящей дистиллированной воды. Кроме того, растворить 5 г витамина С в 250 мл теплой дистиллированной воды. Добавьте 250 мл раствора витамина С, капли в раствор нингидрина при магнитном перемешивании. Продолжайте перемешивать в течение 15 мин, а затем охладить раствор реакции в холодильнике 4 градусов по Цельсию.
- Возьмите раствор из холодильника и фильтр путем всасывания с помощью воронки Buchner для получения сниженного нингидрина. Соберите осадок и сохранить его в обезвоживатель фосфора пентоксида.
- Растворите 85 мг нингидрина и 15 мг пониженного нингидрина в 10 мл этилена гликолмоном монометилэфира для приготовления раствора нингидрин-окраски.
ПРИМЕЧАНИЕ: Нингидрин-окраска решение может всмяиваться с а-амино в APMA и образуют фиолетовое соединение со структурой, как описано в предыдущем исследовании15. - Разбавить 1 мл 0, 1, 10, 100, 1000 мг/мл APMA мономерные растворы с 1 мл ацетатбуфера (2 М, рН 5,4), а затем добавить 1 мл нингидрина окраски решения, соответственно.
- Нагрейте смеси в течение 15 минут на кипящей водяной бане, а затем охладите их с помощью проточной воды. Пусть растворы сидят в течение 5-10 мин и разбавить их 3 мл 60% этилового спирта и тщательно перемешать. Измерьте абсорбцию на уровне 570 нм спомощью спектрофотометра и нарисуйте стандартную кривую (Equation 3).
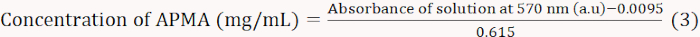
ПРИМЕЧАНИЕ: Уравнение 3 было получено из линейной установки абсорбции на уровне 570 нм по сравнению с концентрацией APMA. - Растворите 0,01 г БА в 1 мл дистиллированной воды; добавьте 1 мл ацетатного буфера (2 M, pH 5.4) и 1 мл раствора нингидрин-окраски. Рассчитайте содержание моляров APMA в соответствии с абсорбцией на 570 нм.

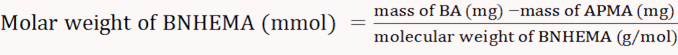 (5)
(5)
ПРИМЕЧАНИЕ: Формулы расчета следующие(Уравнения 3-6).
4. Синтез метилонина привитых BA полимер (mBA)
- Растворите 8,9 мг фомк-метионина в 5 мл ДМСО в леродительную колбу.
- Добавьте 6,92 мг 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорида (EDCl) и 4,86 мг 1-гидроксибензотриазота (HOBT) в лечебную колбу и реагируйте при 0 КК на 0,5 ч.
- Растворите 2,59 г БА в 5 мл раствора DMSO, а затем добавьте 50 л триметиламина; добавить это решение dropwise к восстановлению колбу (шаг 4.2) и пусть раствор реагирует на 0,5 ч при комнатной температуре.
- Диализ для удаления DMSO и триметиламина из раствора BA в шаге 4.3 с помощью диализа мешок (MWCO 10 kDa) в 2 L стакан для 24 ч; заменить деионизированную воду каждые 6 ч.
- Заморозить-сухой полученный mBA и взвешивать, чтобы рассчитать норму урожайности в соответствии с уравнением 7.
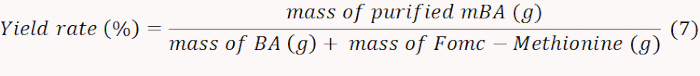
ПРИМЕЧАНИЕ: В этом случае, доходность была определена в 71%. - Количественно NH2, содержащий mBA, путем измерения абсорбции на 570 нм, чтобы вычислить количество привитого метионина. Рассчитайте содержание моляров в метионине в соответствии с уравнением 8.

5. Синтез гуанидинатизированного и метионина спряженный BNHEMA -b-APMA полимер (mBG)
ПРИМЕЧАНИЕ: Были синтезированы три различных mBA1, mBA2 и mBA3 copolymer. copolymer mBA3 используется в качестве примера в следующих шагах.
- Растворите mBA3, содержащий 60 змоль группы аминокислот в 5 мл чистой воды.
ПРИМЕЧАНИЕ: Содержание группы Amino было количественно с использованием метода нингидрина, как описано в шаге 3.5. - Растворите 40,6 мг (300 мкмоль) гуанидинадинационного реагента 1-амидинопиразоле гидрохлорид в растворах mBA.
- Отрегулируйте рН до 9.0 с насыщенным раствором карбоната натрия и дайте ему стабилизироваться в течение 24 ч при комнатной температуре.
- Диализ ный продукт с деионизированной водой с помощью диализа мешок в стакане (MWCO 10 kDa, 2 L) и сохранить его в виде лиофилизированного порошка.
Процент доходности был рассчитан на 85% через Equation 8.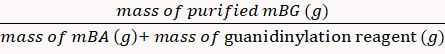 (8)
(8) - Растворите порошок mBG в D2O в трубках ЯМР и охарактеризуют его с помощью 1H ядерной магнитно-резонансной спектроскопии (1H NMr)16.
6. Подготовка и характеристика полиппексов мБГ/pDNA
- Растворите 50 мкг pDNA в 50 Л без RNase/DNase воды.
- Растворите 1 мг copolymers mBG в 1 мл безрычании RNase/DNase.
- Добавьте раствор copolymers mBG непосредственно в раствор pDNA в соответствии с различными соотношениями кормления, то есть различными соотношениями N/P (1:1, 4:1, 8:1, 16:1 и 32:1).
ПРИМЕЧАНИЕ: Соотношение N/P определяется как соотношение моляров группы гуанидин овполий и фосфатной группы в pDNA, а именно соотношение моляров цепи GPMA в полимере и мононуклеотида в pDNA. Соотношение N/P рассчитывается в соответствии с молекулярными весами аминоазота (N) в mBG и фосфатной группе (P) в pDNA. - Смешайте растворы с вихревой смеситель и дайте им постоять 30 минут при комнатной температуре. После этого рассеять смесь в фосфатном буферном растворе (PBS, pH 7.4) и сохранить полученные полиптексы mBG/pDNA при 4 градусах По Цельсия для последующих экспериментов.
ПРИМЕЧАНИЕ: Средний размер частиц и потенциал Зета mBG и комплексы были обнаружены с помощью динамического рассеяния света (DLS)17. - Разбавить 10 л из растворов полиппека mBG/pDNA с 1 мл PBS (pH 7.4) в потенциальных образцовых клетках DLS и Зета.
ПРИМЕЧАНИЕ: Размер частиц и потенциальное обнаружение Зеты выполнялись три раза, и в среднем было принято три значения.
7. Эксперимент по электрофоретической отсталости полиппексов mBG/pDNA
ПРИМЕЧАНИЕ: Для определения минимального коэффициента заряда был проведен эксперимент по электрофоретической отсталости.
- Возьмем пять групп полиптексов mBG/pDNA с различными соотношениями N/P (1:1, 4:1, 8:1, 16:1 и 32:1), содержащих 50 мкг pDNA .
- Добавьте 6x буфер загрузки к пробам polyplex mBG/pDNA к окончательной концентрации 1x.
- Добавьте растворы в 1,5% гели агарозы и запустите гель на 90 мВ в течение 15 мин, используя pDNA в качестве контроля.
- Сфотографируйте гели с помощью геля изображения.
8. Цитотоксичность полиппексов mBG/pDNA
- Семена MCF-7 в 96-колодцы пластин при плотности 104 клеток на скважину. Затем, культуры клеток для 12 ч с использованием DMEM среды (10% FBS и 1% антибиотик) в увлажненный 37 КС инкубатор поставляется с 5% CO2.
- Замените среду культуры с антибиотиками-свободно средствами культуры DMEM содержа 10% фетальной сыворотки крупного рогатого скота (FBS) и polyplexes mBG/pDNA по-разному коэффициентов обязанности (N/P 4, 8, 16, и 32, n'6) для 6 h, принимая клетки добавленные с равными томами разрешения PBS как управление. Затем замените культурную среду 150 qL свежих 1640 средних и далее культуры клеток для 24 ч.
- Добавьте 5 мг/мЛ 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилдетразолий бромид (МТТ) раствор (20 л/колодец) к 96-колодским пластинам и далее культуре клеток в течение 4 ч.
- Снимите раствор и добавьте 150 л DMSO к каждой скважине и встряхните 96-колодские пластины 30 сек.
- Измерьте оптическую плотность (OD) на уровне 490 нм с помощью микроплитного считывателя, чтобы показать жизнеспособность клетки. Рассчитайте процент жизнеспособности клеток в соответствии с уравнением 9.
Жизнеспособность клеток % (9)
% (9)
9. Эффективность трансфекции полиппексов mBG/GFP-pDNA
- Растворите 50 мкг pDNA, содержащего репортёрский ген зеленого флуоресцентного белка (GFP) pDNA (GFP-pDNA) в 50 Л воды без RNase/DNase. Затем растворите 1 мг мг мг мг copolymers mBG в 1 мл воды без RNase/DNase. Смешайте раствор pDNA и mBG при соотношении заряда (N/P) 1:1, 4:1, 8:1, 16:1 и 32:1 и инкубируйте в течение 30 мин при комнатной температуре. Разогнать раствор полипрексm mBG/GFP-pDNA с помощью ультразвуковых волн (30 с) и хранить при 4 градусах Цельсия для последующих экспериментов.
ПРИМЕЧАНИЕ: Соотношение N/P рассчитывается в соответствии с молекулярными весами аминоазота (N) в mBG и фосфатной группе (P) в pDNA. - Семена MCF-7 клеток при плотности 2 и 105 клеток на хорошо в 6-хорошо пластины и культуры их на 37 градусов по Цельсию и 5% CO2 в увлажненный инкубатор для 12 ч.
- Замените культурную среду на свежую культурную среду, содержащую полиппексы mBG/GFP-pDNA различных соотношений N/P (4, 8, 16 и 32) на 6 ч.
- Замените среду на 2 мл свежей среды RPMI1640 и культуры на 48 ч.
- Соберите клетки и обнаружить зеленую флуоресценцию с цитометром потока.
Результаты
БНЕХЕМА кормили в соответствии с объективной степенью полимеризации, показанной в таблице1; процедура синтеза mBG показана на рисунке 1. Во-первых, гомополимер BNHEMA был подготовлен с помощью обратимого добавления фрагментации цепи передачи (RAFT) метод в системе во?...
Обсуждение
Это исследование представило серию BNHEMA-b-APMA блок полимерных катионных носителей генов. Эти блок-полимеры были синтезированы с помощью метода реверсивной передачи цепочек добавления (RAFT). Гидрофильный сегмент BNHEMA был введен для улучшения растворимости. Метилонин и гуанидин группы были ...
Раскрытие информации
Авторы удостоверяем, что нет никакого конфликта интересов с какой-либо финансовой организацией в отношении материала, обсуждаемого в этой статье.
Благодарности
Это исследование было поддержано Национальной программой ключевых исследований и разработок Китая (No 2016YFC0905900), Национальным фондом естественных наук Китая (No 81801827, 81872365), Программой фундаментальных исследований провинции Цзянсу (Фонд естественных наук, No. BK20181086), и Цзянсу онкологический госпиталь Научно-исследовательский фонд (Нет. К201605).
Материалы
| Name | Company | Catalog Number | Comments |
| 1-hydroxybenzotriazole | Macklin Biochemical Co., Ltd,China | H810970 | ≥97.0% |
| 1,4-dioxane | Sinopharm chemical reagent Co., Ltd, China | 10008918 | AR |
| 1-amidinopyrazole Hydrochloride | Aladdin Co., Ltd., China | A107935 | 98% |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride | Aladdin Co., Ltd., China | E106172 | AR |
| 4,4’-azobis(4-cyanovaleric acid) | Aladdin Co., Ltd., China | A106307 | Analytical reagent (AR) |
| 4-cyano-4-(phenylcarbonothioylthio)pentanoic Acid | Aladdin Co., Ltd., China | C132316 | >97%(HPLC) |
| Acetate | Sinopharm chemical reagent Co., Ltd, China | 81014818 | AR |
| Acetone | Sinopharm chemical reagent Co., Ltd, China | 10000418 | AR |
| Agarose | Aladdin Co., Ltd., China | A118881 | High resolution |
| Ascorbic acid | Aladdin Co., Ltd., China | A103533 | AR |
| DMSO | Aladdin Co., Ltd., China | D103272 | AR |
| Ethylene glycol | Aladdin Co., Ltd., China | E103319 | AR |
| N-(3-aminopropyl)methacrylamide hydrochloride | Aladdin Co., Ltd., China | N129096 | ≥98.0%(HPLC) |
| N,N-bis(2-hydroxyethyl)methacrylamide | ZaiQi Bio-Tech Co.,Ltd, China | CF259748 | ≥98.0%(HPLC) |
| Ninhydrin | Aladdin Co., Ltd., China | N105629 | AR |
| PBS buffer | Aladdin Co., Ltd., China | P196986 | pH 7.4 |
| Plasmid DNA | BIOGOT Co., Ltd, China | pDNA-EGFP | pDNA-EGFP |
| Plasmid DNA | BIOGOT Co., Ltd, China | Pdna | pDNA |
| Sodium carbonate decahydrate | Aladdin Co., Ltd., China | S112589 | AR |
| Trimethylamine | Aladdin Co., Ltd., China | T103285 | AR |
Ссылки
- Flotte, T. R. Gene and Cell Therapy in 2018: A Look Ahead. Human Gene Therapy. 29, 1-1 (2018).
- Huang, W., et al. Nanomedicine-based combination anticancer therapy between nucleic acids and small-molecular drugs. Advanced Drug Delivery Reviews. 115, 82-97 (2017).
- Wu, Y., et al. Reversing of multidrug resistance breast cancer by co-delivery of P-gp siRNA and doxorubicin via folic acid-modified core-shell nanomicelles. Colloids & Surfaces B Biointerfaces. 138, 60-69 (2016).
- Quader, S., Kataoka, K. Nanomaterial-Enabled Cancer Therapy. Molecular Therapy. 25, 1501-1513 (2017).
- Wu, Y., et al. Multivalent methionine-functionalized biocompatible block copolymers for targeted siRNA delivery and subsequent reversal effect on adriamycin resistance in human breast cancer cell line MCF-7/ADR. Journal of Gene Medicine. 19, e2969 (2017).
- Szwarc, M. ‘Living’ Polymers. Nature. 178, 168-169 (1956).
- Szwarc, M., Rembaum, A. Polymerization of methyl methacrylate initiated by an electron transfer to the monomer. Journal of Polymer Science. 22 (100), 189-191 (1956).
- Mukhopadhyay, R. D., Ajayaghosh, A. Living supramolecular polymerization. Science. 349, 241 (2015).
- Ozkose, U. U., Altinkok, C., Yilmaz, O., Alpturk, O., Tasdelen, M. A. In-situ preparation of poly(2-ethyl-2-oxazoline)/clay nanocomposites via living cationic ring-opening polymerization. European Polymer Journal. 88, 586-593 (2017).
- Wu, W., Wang, W., Li, J. Star polymers: Advances in biomedical applications. Progress in Polymer Science. 46, 55-85 (2015).
- Boyer, C., et al. Copper-Mediated Living Radical Polymerization (Atom Transfer Radical Polymerization and Copper(0) Mediated Polymerization): From Fundamentals to Bioapplications. Chemical Reviews. 116, 1803-1949 (2016).
- Keddie, D. J. A guide to the synthesis of block copolymers using reversible-addition fragmentation chain transfer (RAFT) polymerization. Chemical Society Reviews. 43, 496-505 (2014).
- Wu, Y., et al. Guanidinylated 3-gluconamidopropyl methacrylamide-s-3-aminopropyl methacrylamide copolymer as siRNA carriers for inhibiting human telomerase reverse transcriptase expression. Drug Delivery. 20, 296-305 (2013).
- Qin, Z., Liu, W., Guo, L., Li, X. Studies on Guanidinated N-3-Aminopropyl Methacrylamide-N-2-Hydroxypropyl Methacrylamide Co-polymers as Gene Delivery Carrier. Journal of Biomaterials Science, Polymer Edition. 23, 1-4 (2012).
- Friedman, M. Applications of the Ninhydrin Reaction for Analysis of Amino Acids, Peptides, and Proteins to Agricultural and Biomedical Sciences. Journal of Agricultural and Food Chemistry. 52, 385-406 (2004).
- Habuchi, S., Yamamoto, T., Tezuka, Y. Synthesis of Cyclic Polymers and Characterization of Their Diffusive Motion in the Melt State at the Single Molecule Level. Journal of Visualized Experiments. (115), 1-9 (2016).
- Rao, D. A., Nguyen, D. X., Mishra, G. P., Doddapaneni, B. S., Alani, A. W. Preparation and Characterization of Individual and Multi-drug Loaded Physically Entrapped Polymeric Micelles. Journal of Visualized Experiments. 102, 1-5 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены